基于蛋白质组学探讨慢性血瘀证大鼠的发病机理❋
2023-01-07杨会珍张国瑗孙明谦
胡 广,李 瑛,杨会珍,张国瑗,盛 雪,苗 兰,孙明谦△,林 力△
(1.中国中医科学院西苑医院,北京 100091;2.通辽市市场检验检测中心,内蒙古 通辽 028000)
血瘀证是中医临床常见证候,多见于慢性疾病发展过程中。气滞血瘀是血瘀证的主要类型之一,其形成多是一个“久病成瘀”的过程,具有慢性血瘀证的特点[1]。中医理论认为,气滞血瘀发病机理在于气机郁滞而血行瘀阻[2],肝主藏血而又主疏泄,肝气失于畅达会导致气机郁滞进而引起血行不畅。临床研究表明,慢性血瘀证特别是气滞血瘀证患者常伴有肝功能异常,慢性血瘀证的发病机制可能与肝的生理功能密切相关[3-6],但目前对于肝脏在慢性血瘀证中的作用机制研究较少,其科学内涵还有待于进一步的阐释。
蛋白质组学是鉴定和量化细胞、组织或生物体中总蛋白质含量的研究技术,能够阐明生物体蛋白质的特性,并认识特定蛋白质的结构和功能[7]。同时蛋白质组学具有特异性、整体性、动态性、阶段性等特点[8],这与中医认识疾病的整体观、辨证观有一定的趋同性,利用其理论与方法探索中医学证候本质[9,10],揭示中医证候的科学内涵,能为中医辨证的客观化提供依据和方法[11]。本研究采用小剂量连续皮下注射肾上腺素的方法,模拟临床上气滞血瘀的发病机理,从而构建慢性血瘀证模型[12,13],进一步通过蛋白质组学技术定量肝脏组织中蛋白质,筛选得到差异蛋白,并通过蛋白相互作用网络找出慢性血瘀证的关键蛋白及相关生物途径,以期明确慢性血瘀证的发生机制。本研究通过中国中医科学院西苑医院动物伦理委员会批准(批号2021XLC011-2)。
1 材料
1.1 动物
SPF级雄性SD大鼠18只,体质量150~180 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号SCXK(京)2016-0006。实验动物饲养于中国中医科学院西苑医院动物实验中心屏障环境设施中,标准颗粒饲料及洁净饮用水喂养,饲养环境为昼夜各半交替,温度 18~22 ℃,通风良好,湿度恒定。
1.2 主要试剂及仪器
尿素(美国Affymetrix公司,货号 57-13-6);测序级胰蛋白酶(美国Promega公司,货号 V511A);甲酸、二硫苏糖醇(dithiothreitol, DTT)、乙腈(acetonitrile, ACN)(美国Thermo Fisher公司,货号分别为 212454、3483-12-3、214241);碘乙酰胺(iodoacetamide,IAA)(美国Sigma公司,货号 I1149);碳酸氢铵(美国Amresco公司,货号 1066-33-7);盐酸肾上腺素注射液(1 mL,1 mg/支)(天津金耀药业有限公司,货号2002031)。
Easy nLC1000纳升级液相色谱仪,美国Thermo Fisher公司;Q Exactive Plus四级杆-静电场轨道阱质谱仪, 美国Thermo Fisher公司;LBY-N6C全自动清洗血流变仪,北京普利生仪器有限公司;Synergy UV型超纯水机,美国Millipore公司。
2 方法
2.1 分组与造模
18只大鼠随机分为正常组和模型组每组各9只。正常组不予任何操作,模型组大鼠背部皮下注射盐酸肾上腺素溶液0.6 mg/kg,每日注射1次,连续注射1周。
2.2 样本采集
取材前1天所有大鼠均禁食12 h。造模第7天记录大鼠体质量及体征变化,模型组大鼠末次注射肾上腺素1 h后,3.5%水合氯醛麻醉,腹主动脉取血,抗凝后分别用于全血黏度(低切5 s-1,中切60 s-1,高切150 s-1)和血生化肝功能指标的测定,剩余肝素化抗凝血浆置于-80 ℃冻存,取大鼠同一位置肝脏组织50 g,于液氮中速干后置于-80 ℃冻存。
2.3 蛋白质组学样品制备
2.3.1 蛋白提取 取肝脏组织加入Ripa匀浆(1∶100),冻融超声3次,离心后取上清液,BCA定量。每3个样本混在一起,每组混成3个样本,加1 mL预冷丙酮,-20 ℃放置沉淀4 h,离心吸出上层丙酮;再加少量丙酮,-20 ℃放置沉淀,离心挥干上层丙酮,底层沉淀为蛋白。
2.3.2 样本制备 将上述蛋白用尿素溶解,转移到10K超滤管内超滤离心,浓缩完成后将溶剂置换成8 mol·L-1尿素,先加DTT至终浓度20 mmol·L-1,37 ℃还原30 min,然后用8 mol·L-1尿素洗涤3次,浓缩到50 μL,加入终浓度40 mmol·L-1的IAA,于黑暗处37 ℃放置30 min。然后8 mol·L-1尿素洗涤3次,随后采用50 mmol·L-1的碳酸氢铵溶液洗涤3次,浓缩到50 μL。以1∶25的质量比例(胰蛋白酶:蛋白)加入胰蛋白酶,37 ℃恒温水浴16 h,加入0.1%(v/v)甲酸水溶液终止酶切,更换接收管离心,离心液用于质谱分析。
2.4 样品检测
采用Easy nLC 1000 纳升级液相色谱仪对处理后的样品进行检测。流动相A:0.1%甲酸-水,流动相B:0.1%甲酸-乙腈。洗脱梯度0~25 min,5%~9%B; 25~65 mim,9%~23%B; 65~75 min,23%~32%B; 75~76 min,32%~95%B; 76~90 min,95%~95%B。流动相流速为 420 nL·min-1。质谱分析在Q Exactive Plus 质谱仪上采集完成,模式为数据依赖型(data dependent acquisition,DDA)。一级质谱的分辨率为70 000 FWHM,扫描范围m/z 400~1600,自动增益控制值为3×106,注入时间50 ms。二级质谱的分辨率设为17500,自动增益控制值1×105,注入时间45 ms,碰撞能量27 NCE。二级采集的标准设为前20个最强离子作为母离子,再进行Orbitrap 检测,每个样品平行测定3次。
2.5 蛋白质鉴定及定量分析
蛋白质鉴定通过Proteome Discoverer 软件进行,将质谱所得到的原始数据RAW文件导入软件,在UniProt(http://www.uniprot.org/)蛋白质数据库中搜索。参数条件设定为肽段置信度设置为高,最多蛋白漏切位点数2个,肽段的长度范围 6~144 个氨基酸,母离子质量偏差为 ± 10,碎片离子质量偏差 0.02,固定修饰选择半胱氨酸碘乙酰胺化,可变修饰选择甲硫氨酸氧化和N-乙酰化,肽段搜库假阳性率(false positive rate,FDR)设置为1%,定量分析通过 Maxquant 软件进行。参数设定最多漏切位点 2 个,固定修饰为半胱氨酸碘乙酰胺化,可变修饰为甲硫氨酸氧化和 N-乙酰化,先驱离子质量偏差为 ± 20,碎片离子质量偏差为0.02 ppm,可检测到的肽段最小值为 7 个氨基酸,肽段搜库假阳性率FDA为1%。
2.6 生物信息学分析
将Fold change(差异倍数)>1.50和P<0.05的蛋白作为差异蛋白,基于GO(http://www.geneontology.org/)进行蛋白本体分析,基于KEGG(http://www.genome.jp/kegg/pathway.html)进行蛋白生物功能富集。运用STRING(https ://string-db.org/)分析蛋白质之间的相互作用。
3 结果
3.1 一般状态比较
表1示,正常组大鼠皮毛白净有光泽,饮食排便正常,好动且反应灵敏。模型组大鼠懒言少动,皮毛疏松发黄,进食量减少,大便溏烂,反应迟缓,与正常组比较体质量明显下降(P<0.01)。
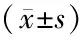
表1 大鼠造模前后体质量比较
3.2 血液流变学结果
表2示,与正常组比较,模型组大鼠的全血黏度在不同切变率下均显著升高(P<0.01),表明造模后大鼠血液黏滞,凝血功能活跃,慢性血瘀证大鼠造模成功。
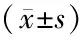
表2 大鼠不同切变率下全血黏度比较
3.3 肝功能指标结果
表3示,与正常组比较,模型组大鼠的谷丙转氨酶、谷草转氨酶水平显著升高(P<0.01),白蛋白水平显著降低(P<0.01),表明造模后大鼠肝功能出现异常。
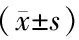
表3 大鼠肝功能指标比较
3.4 蛋白质组学结果
3.4.1 定量蛋白质组学分析 图1示,蛋白质组学分析示,2组肝脏样本中有2532个非冗余蛋白,在这些蛋白质中,2组共有1857个蛋白质,占鉴定的总蛋白质的73.3%。样本之间的皮尔逊相关性结果表明,同组样本相关性较大,而2组之间的相关系数较低。各组内皮尔逊相关系数的显著差异表明,2组间的样本相对独立。
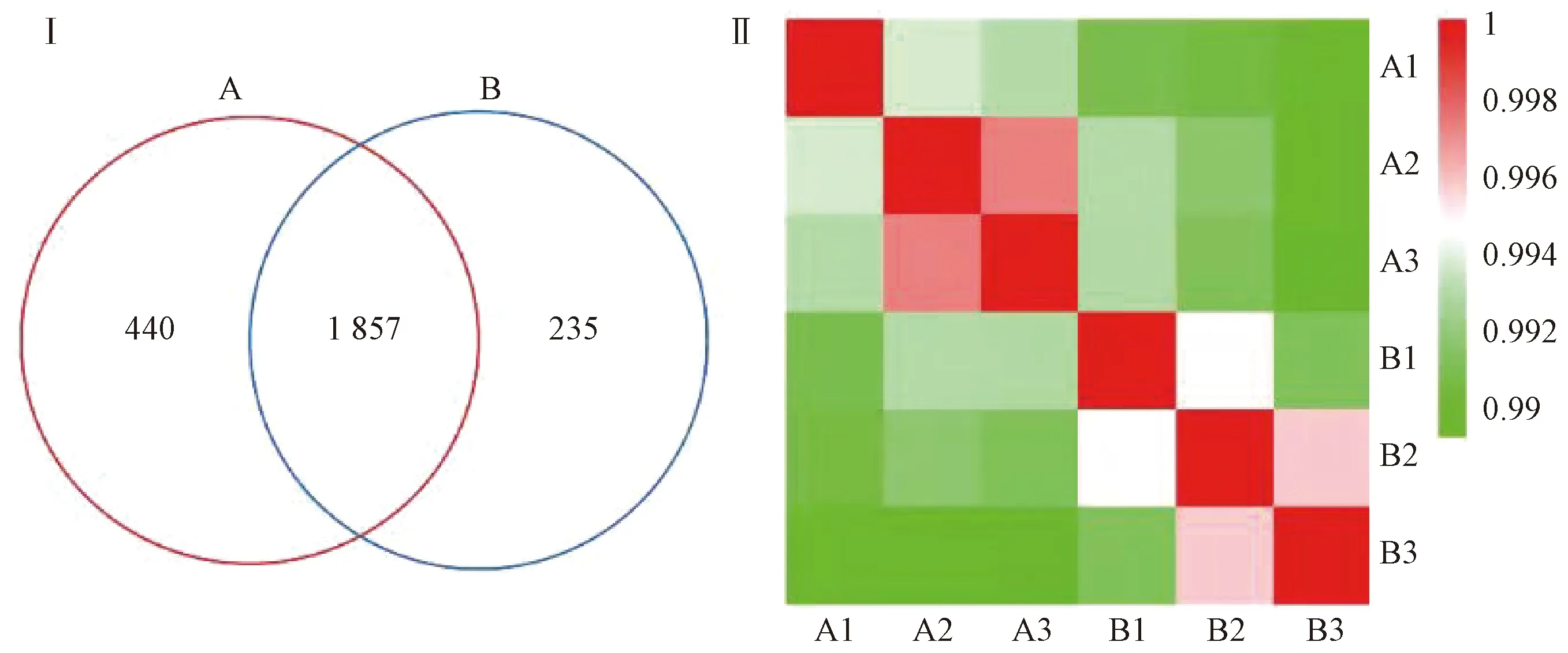
图1 慢性血瘀证大鼠肝脏样本蛋白质组学质控分析(Ⅰ:Venn图;Ⅱ:皮尔逊相关性分析;A:正常组;B:模型组)
3.4.2 差异蛋白的筛选和分析 为进一步探索肾上腺素构建慢性血瘀证模型的作用机制,使用P<0.05和Fold Change > 1.5 作为分析标准。与正常组比较,在模型组中共鉴定出56个差异表达蛋白,其中22个上调蛋白,34个下调蛋白。根据显著性水平和倍数变化值进一步绘制火山图。在图2中,红点代表上调的蛋白质,蓝点代表下调的蛋白质,灰点代表非差异表达的基因。聚类分析热图显示,肾上腺素构建慢性血瘀证模型后,这些差异蛋白在2组中的含量存在明显差异,呈现明显聚类现象。
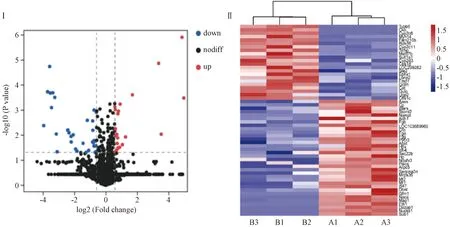
图2 慢性血瘀证大鼠肝脏样本差异蛋白分析(Ⅰ:差异蛋白火山图;Ⅱ:差异蛋白热图分析;A:正常组;B:模型组)
3.4.3 生物功能分析 GO分析使用OmicShare工具(https://www.omic share.com/tools)进行。GO涵盖生物过程、分子功能和细胞成分3个领域。细胞成分富集项表明,大部分差异表达蛋白位于细胞质、细胞外空间、细胞内膜结合细胞器、内质网膜和线粒体。图3示,GO分析发现,差异表达蛋白的分子功能主要包括相同蛋白结合、花生四烯酸14,15-环氧合酶活性、血红素结合、细胞黏附分子结合、氧化还原酶活性。生物学过程主要涉及有机酸代谢过程、凝血和纤维蛋白凝块过程、花生四烯酸代谢过程、血小板聚集、凝血的负调节等。

图3 慢性血瘀证大鼠肝脏样本差异蛋白GO分析结果
3.4.4 差异蛋白的聚类分析 使用DAVID分类系统(https://david.ncifcrf.gov/summary.jsp)和KEGG数据库进行途径富集分析。图4示,选取前20个相关通路作图,坐标标尺上包含圆圈外的基因数;第2个圆圈是背景基因的数量和P值,基因越多说明条形越长,颜色越红p值越小;第3圈是每个分类的基因总数;第4个圆圈代表每个类别的丰富因子。差异蛋白与各种生物学途径相关,包括补体和凝血级联反应(ko04610)、血小板活化(ko04611)、5-羟色胺能突触(ko04726)、乙醛酸和二羧酸代谢(ko00630)、色氨酸代谢(ko00380)、花生四烯酸代谢(ko00590)。
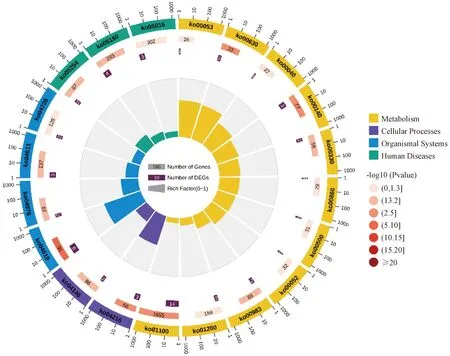
图4 慢性血瘀证大鼠肝脏样本差异蛋白KEGG分析结果
3.4.5 PPI蛋白互作分析 在生物体中,蛋白功能通常发生相互作用,从而共同完成一系列的生物过程。本研究采用STRING 数据库对通路中富集的所有蛋白相互作用进行预测,并绘制蛋白相互作用网络图,结合KEGG分析以及GO分析数据构建蛋白互作网络。图5示,细胞色素P450 2C11(cytochrome p450 2c11,CYP 2C11)、环氧化物水解酶(epoxide hydrolase,EPHX)1、补体因子(complement factor,Cf)b、激肽原(kininogen,KNG)1、纤维蛋白原γ(fibrinogen gamma chain,FGG)、纤维蛋白原α(fibrinogen alpha chain,FGA)和纤维蛋白原β(fibrinogen beta chain,FGB)位于该网络的中心,在与其他蛋白质相互作用时起到中枢作用。这些蛋白质参与多种生物过程,包括花生四烯酸代谢、补体与凝血级联反应、血小板活化与聚集等通路。
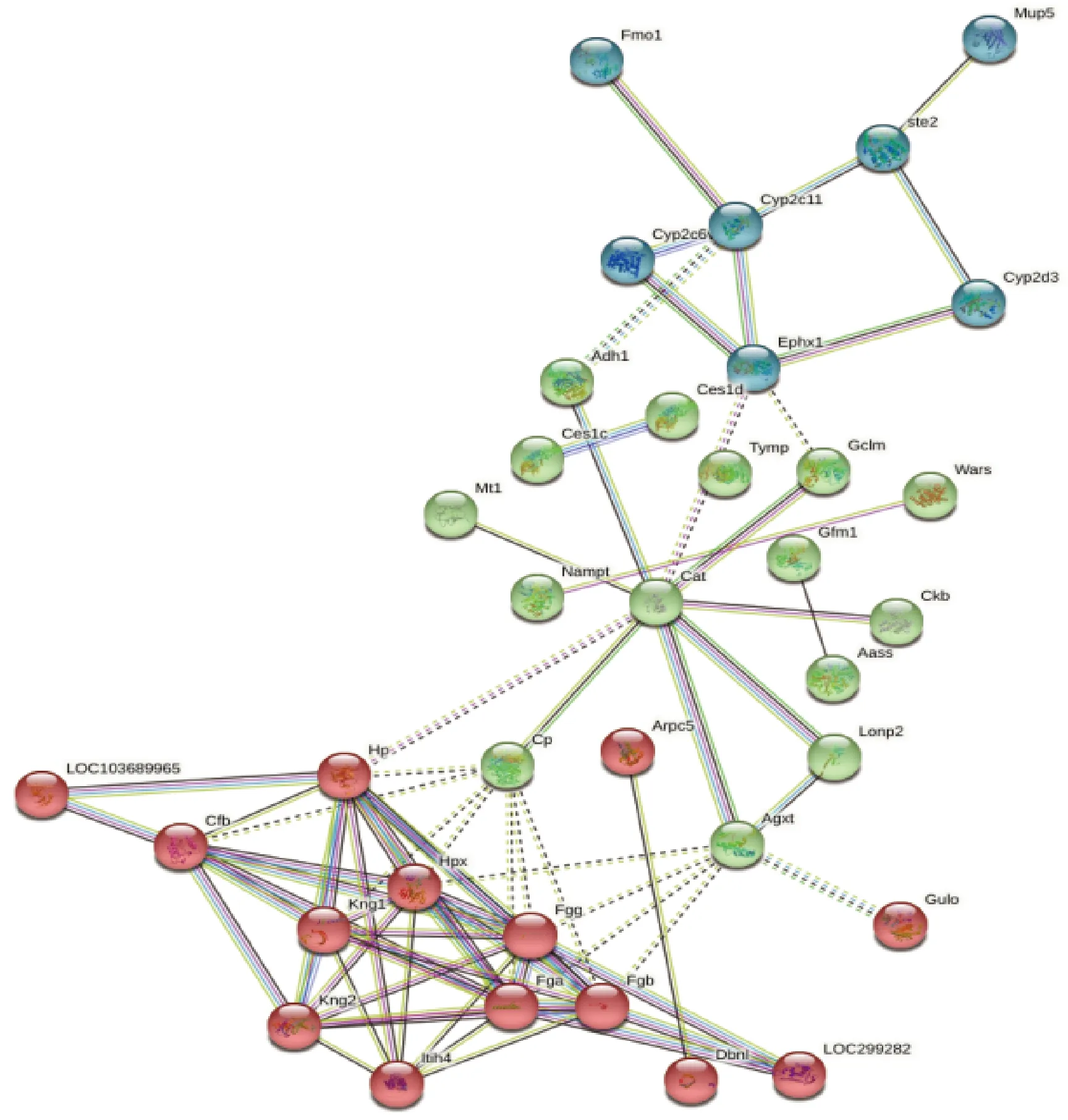
图5 慢性血瘀证大鼠肝脏样本差异蛋白PPI网络图
4 讨论
实验采用皮下长时间小剂量注射肾上腺素的方法构建慢性血瘀证大鼠模型,并通过观察其一般体征、血流变、血生化等指标进行模型判断。结果显示,模型组大鼠体质量明显下降,懒言少动,毛发枯燥,食欲下降,相关检测指标中,血流变数据在低、中、高切中均有显著性变化,说明模型组大鼠血液流动性下降。血生化中肝功能指标检测结果显示,模型组大鼠肝功能出现异常。通过蛋白质组学技术发现,慢性血瘀证的发病机制主要集中在以下通路和蛋白。
花生四烯酸是血小板的常见诱导剂,能够诱导血小板表面各种受体的激活,引起血小板的活化与聚集。当花生四烯酸作用于血小板时,先由细胞色素c氧化酶(cytochrome c oxidase,COX)作用转化为前列腺素(prostaglandin,PG)G2和PGH2,在环氧化酶(cytochrome c oxidase subunit,COX)-1作用下合成血栓素(thromboxane,TX)A2[14],而TXA2会进一步激活血小板上的受体,引起血小板活化从而导致血小板聚集。Cyp2C11是一种参与类固醇激素和脂肪酸代谢的细胞色素P450单加氧酶,能够催化碳氢键的羟基化[15],在体内能一定程度上催化花生四烯酸的羟基化[16],从而影响花生四烯酸的代谢,使得血小板的活化与聚集受到影响。EPHX1是一种高度丰富的α/β水解酶,已知其具有环氧化物水解酶活性,能够将体内的内源性大麻素2-花生四烯酸甘油(2-arachidonoylglycerol,2-AG)代谢为游离的花生四烯酸(arachidonicacid,AA)和甘油[17],同时它还能够调节体内内源性类固醇代谢、胆汁酸转运[18],在慢性血瘀证模型的构建中起到重要调节作用。本研究中EPHX1蛋白在模型组中含量显著性上升,可能会导致更多的2-AG被代谢为花生四烯酸,从而引发血小板的聚集,说明其可以作为慢性血瘀证的潜在标志蛋白。
在血液循环中,补体和凝血级联反应形成了一个紧密而复杂的网络[19],其激活通过3条途径(凝集素、经典途径和替代途径)进行,它们汇聚形成补体(complement,C)3转化酶,将C3分解为有活性的肽段C3b和C3a,再进一步在体内代谢形成C5、C5a、C5b。C3a和C5a与各自的同源受体相互作用,能促进血小板活化和聚集[20],而血小板聚集是血瘀证的主要特征之一。Cfb是补体系统替代途径的一部分,它能够切割补体成分C3结构中的Arg-Ser键产生C3a和C3b,切割补体成分C5结构中的Arg-Xaa键产生C5a和C5b。C3a和C5a是补体和凝血级联反应中重要的调节蛋白,已有实验表明这些微粒具有促炎和促凝血的特性[21]。KNG1参与补体和凝血级联反应,可以通过选择性剪接产生2种不同的蛋白质,分别为高分子量激肽原(high molecular weight kininogen,HMWK)和低分子量激肽原(low molecular weight kininogen,LMWK),HMWK具有一定的抗凝和促纤溶特性,可以抑制血小板的聚集。其结构域3通过干扰凝血酶与血小板上糖蛋白Ib-Ⅸ-V复合物的结合阻断凝血酶依赖性血小板聚集,HMWK裂解后衍生的缓激肽能够阻断凝血酶诱导的血小板聚集,HMWK结构域2可抑制血小板钙蛋白酶的功能。有研究表明,缺乏激肽基因的大鼠可能存在血栓前表型[22]。实验结果显示,KNG1蛋白在模型组中含量降低,这会导致HMWK含量减少,从而使得机体无法有效抑制血小板的聚集,证明KNG1蛋白在慢性血瘀证中起着关键调节作用。
研究发现,血瘀证往往伴随着血小板活化现象[23],而血小板聚集和活化又与FGG、FGA和FGB密切相关[24],三者一起聚合可形成不溶性纤维蛋白基质。纤维蛋白作为血凝块的主要成分之一,在止血功能上发挥着重要作用,能够通过整合素β-3(integrin beta-3)依赖性途径增强活化血小板中P选择素(p-selectin)的表达[25,26],从而促进血小板的聚集。实验结果显示,FGG、FGA和FGB蛋白在模型组均呈下降趋势,这可能是因为模型组中大量的FGG、FGA和FGB聚合形成纤维蛋白基质,进一步导致模型组体内血小板呈聚集状态,说明FGG、FGA和FGB是慢性血瘀证中的关键调节蛋白。
综上,长期小剂量注射肾上腺素会使得大鼠肝功能异常,影响相关蛋白功能,进而引起机体血小板活化和聚集,从而导致凝血功能异常,大鼠表现出相关血瘀证特征。蛋白质组学分析表明,肾上腺素可能通过多个靶点(Cyp2c11、EPHX1、Cfb、KNG1、FGG、FGA和FGB)和途径(花生四烯酸代谢、补体与凝血级联反应、血小板活化与聚集)激活血小板的活化与聚集及调节凝血功能,从而导致慢性血瘀证的发生。本研究从蛋白组角度探讨慢性血瘀证的发病机制,找出其关键调节蛋白,为慢性血瘀证的治疗与诊断提供科学支持,但相关靶点蛋白还需进一步验证与探讨。
