宠物饲料中8种水溶性维生素同步分析方法研究
2023-01-06王继彤佳徐思远
严 华 李 兰 王继彤 贾 铮 姚 婷 刘 佳徐思远 田 静 樊 霞*
(1.中国农业科学院农业质量标准与检测技术研究所,北京100081;2.北京市兽药饲料监测中心,北京102200)
当前我国宠物饲料市场发展迅猛,据统计,仅2021年我国宠物配合饲料和宠物添加剂预混合饲料的生产总量就接近113万t,与2020年相比增长17.3%[1]。维生素对于维持动物的生长发育具有重要作用,是宠物配合饲料的重要必需营养补充成分,也是评价宠物饲料质量的重要指标。然而,在现行有效的饲料标准体系中[2-10],对水溶性维生素的检测仍以单一成分为主,缺少多种目标物同时联检的方法;同时,样品基质主要为养殖动物饲料或添加剂预混合饲料,但宠物饲料与养殖动物饲料的组成不同,因此,建立同步、准确测定宠物配合饲料中的多种水溶性维生素方法,对于进一步完善饲料标准体系、合理评价宠物饲料质量具有重要意义。
维生素B1(盐酸硫铵或硝酸硫铵,VB1)、维生素B2(核黄素,VB2)、维生素B6(吡哆醇,VB6)、烟酸(尼克酸)和烟酰胺(尼克酰胺)、D-泛酸(遍多酸)、D-生物素、叶酸(喋酰谷氨酸)、维生素B12(氰钴胺,VB12)、维生素C(L-抗坏血酸,VC)和胆碱等化合物的共同特征是都带有氨基、羟基等极性基团,易溶于水,统称为水溶性维生素。水溶性维生素分析方法主要包括分光光度法、微生物法、电化学法、毛细管电泳法、液相色谱法和液相色谱-质谱法等,其中微生物法可用于VB2、VB6的测定,分光光度法可用于VB1、VB2和生物素的测定,但微生物法耗时长、准确度低,日常检测中已较少使用;分光光度法和电化学法难以实现多种维生素的同时测定[11];毛细管电泳法的灵敏度不如液相色谱法[12];目前多以液相色谱法和液相色谱-质谱法为主。高效液相色谱(HPLC)法成本低,易于普及,可用于测定基质相对简单的添加剂预混合饲料(包括复合预混合饲料和维生素预混合饲料)中的水溶性维生素[13-15]。梁琳等[13]采用HPLC法同步测定维生素预混合饲料中5种B族维生素;张憬等[14]等采用沸水浴提取,在267和280 nm双波长条件下检测添加剂预混合饲料中6种水溶性维生素;Forghieri等[15]建立了预混合饲料中VB2、烟酰胺、D-泛酸、VB6和叶酸的同时提取方法。
配合饲料基质复杂,特别是宠物配合饲料中常常含有较多的动物源性成分,检测时基质干扰严重,难以采用紫外检测器实现多种水溶性维生素的同时测定。液相色谱-串联质谱系统在选择性、准确性和灵敏度方面优势明显,利用质谱系统对目标化合物进行选择性离子监测,可以较大程度上减少色谱共流出物的影响,实现复杂基质中多种水溶性维生素的同时测定。目前,该方法在食品领域的应用较多,如严华等[16]采用超高效液相色谱-稳定同位素稀释法检测婴幼儿配方粉中10种水溶性维生素;Porter等[17]用亲水相互作用色谱(HILIC)柱结合质谱检测器检测蔬菜中4种水溶性维生素;El-Hawiet等[18]采用超高效液相色谱-电喷雾串联四极杆质谱(UPLC-ESI-MRM/MS)法测定蜂蜜中9种水溶性维生素,但目前尚无文献报道将该方法用于配合饲料中多种维生素的测定。
因此,本文从提取试剂、水浴温度、水浴时间以及pH等方面,系统研究了宠物配合饲料中8种水溶性维生素(VB1、VB2、VB6、烟酸、烟酰胺、叶酸、D-泛酸和D-生物素)的样品前处理方法,通过超高效液相色谱-同位素稀释质谱法对8种水溶性维生素进行检测,并采用内标法定量。经方法学验证,该方法准确性高、重复性好、线性范围宽,可通过一个操作流程实现宠物配合饲料中8种水溶性维生素的同步检测,提高了实验效率,并对18个宠物配合饲料中水溶性维生素的含量进行了比较分析。
1 材料与方法
1.1 仪器与试剂
SCIEX ExionLCTM超高效液相色谱仪系统,配备AD二元泵、AD自动进样器、AC柱温箱、控制器;AB SCIEX QTRAP 6500+四级杆-线性离子阱串联质谱仪,配备电喷雾离子源(美国AB SCIEX公司);XMTD-7000电热恒温水浴锅(北京市永光明医疗仪器有限公司),3K15高速冷冻离心机(德国Sigma公司),Milli-Q纯水器(美国Millipore公司),Lab 855型酸度计(德国SI Analytics公司)。
维生素标准品:VB1(纯度>98%)、VB2(纯度>98%)、烟酸(纯度>98%)、烟酰胺(纯度>98%)、VB6(纯度>98%)、D-生物素(纯度>99%)、D-泛酸钙(纯度>94.3%)和叶酸(>91.3%)(德国Dr. Ehrenstorfer公司);内标:VB1-13C3(纯度>97%)、VB2-13C415N2(纯度>95%)、烟酸-D4(纯度>98%)、烟酰胺-D4(纯度>98%)、VB6-D3(纯度>94%)、D-泛酸-13C315N(纯度>97%)、D-生物素-D4(纯度>95%)、叶酸-D4(纯度>97%)(加拿大Toronto Research Chemical公司);甲醇、乙腈、正己烷和乙酸铵(色谱纯,美国Fisher Chemical公司);盐酸(HCl)、氨水及其他试剂均为分析纯,购自国药集团化学试剂有限公司;试验用水为经Milli-Q处理后的一级水(>18.2 MΩ)。
犬粮和猫粮样品由国家饲料质量检验检测中心(北京)提供,具有代表性。
1.2 试验方法
1.2.1 标准溶液的配制
精确称取10 mg(精确到0.01 mg)8种水溶性维生素标准品,分别置于10 mL棕色容量瓶中,烟酸、烟酰胺、VB6、D-泛酸钙和D-生物素用甲醇溶解并定容至刻度;VB1用0.01 mol/L HCl溶液溶解并定容;VB2用1 mL HCl超声溶解后,用水定容;叶酸用0.1 mol/L碳酸钠(Na2CO3)溶液溶解并定容,分别配制成标准储备液。准确吸取适量上述维生素标准储备液置于同一容量瓶中,用水稀释配制成混合标准中间液,浓度为10 μg/mL;再用水逐级稀释成浓度为5、10、20、50、100、250、500、1 000及2 000 ng/mL的混合标准工作溶液。混合工作溶液均添加一定体积的内标溶液,使内标最终浓度为20 ng/mL。
1.2.2 样品前处理
精密称取1.00 g宠物配合饲料,置于50 mL具盖离心管中,加入100 μL浓度为10 μg/mL混合内标溶液,再加入20 mL 1% HCl溶液,50 ℃水浴40 min,取出迅速冷却至室温,再用10%氨水溶液调节pH至5.5~6.5,用水定容至50 mL;静置,沉淀后,取上清液,过0.2 μm滤膜,上机检测。
1.2.3 液相色谱-串联质谱条件
色谱柱:Agilent ZORBAX SB-AQ C18色谱柱(3.0 mm×100 mm,1.8 μm);柱温:40 ℃;进样量:1 μL;流动相流速:250 μL/min;流动相:A为0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液,梯度洗脱程序见表1。
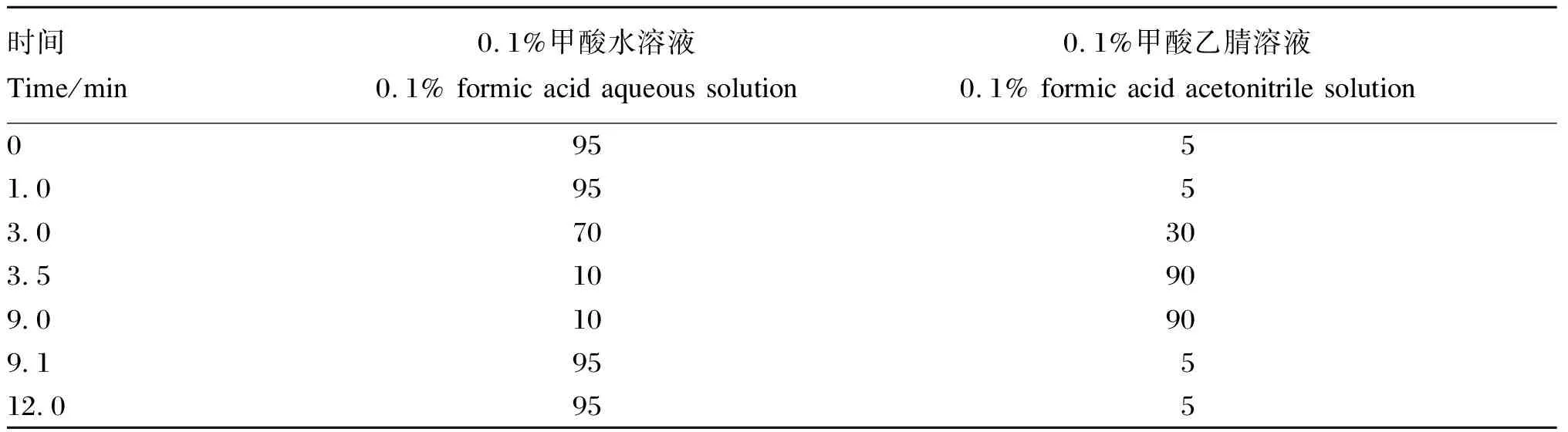
表1 流动相梯度洗脱条件
质谱采用电喷雾电离源,离子源条件为:电离模式为正离子模式(ESI+),电喷雾电压为5 500.0 V,离子源温度为500 ℃,气帘气流速为35.0 L/min,雾化气流速为50.0 L/min,辅助气流速为50.0 L/min;液质联用采用多反应监测(MRM)模式,8种水溶性维生素及内标的驻留时间均设为10 ms。
1.3 数据统计分析
试验数据统计分析及图形绘制采用SPSS 17.0进行,用Shapiro-Wilk检验探讨各变量的正态性,符合正态分布用单因素方差分析与Duncan氏多重比较分析前处理条件对测定结果的影响,P<0.05表示差异显著。
2 结果与分析
2.1 前处理条件优化
2.1.1 提取试剂对提取结果的影响
本试验的前处理过程依据的原理为采用一定的提取溶剂使水溶性维生素溶出,再用氨水溶液调节pH,使溶出的蛋白质等杂质在等电点形成沉淀。比较不同提取试剂[水、1%HCl、1%乙酸(HAc)、1%甲酸(FA)溶液]对提取结果的影响,方差分析结果表明:提取试剂对VB1、VB2和烟酸的检测结果有显著影响(VB1:F=12.288,P=0.002;VB2:F=10.658,P=0.004;烟酸:F=14.055,P=0.005),对其他5种维生素的影响不显著(烟酰胺:F=0.563,P=0.677;D-泛酸:F=0.853,P=0.503;VB6:F=0.802,P=0.527;D-生物素:F=0.580,P=0.645;叶酸:F=1.734,P=0.237)。对影响显著的3种维生素含量进行分析(图1),结果表明:VB1用1%HCl提取比用水、1%HAc和1%FA提取的测定值分别高50%、22%和27%,VB2用1%HCl提取比用水提取的测定值高19%,烟酸用水和1%HCl提取的结果高于用1%HAc和1%FA,其余维生素用4种提取溶剂的提取效果差别不大。因此,选择1%HCl作为提取剂。

图1 不同提取试剂对提取结果的影响
2.1.2 水浴温度对提取结果的影响
比较水浴温度对提取结果的影响,方差分析结果表明:水浴温度对D-泛酸和VB6检测结果有显著影响(D-泛酸:F=32.611,P<0.001;VB6:F=16.788,P<0.001),对VB1、VB2、烟酸、烟酰胺和D-生物素有一定影响(VB1:F=2.911,P=0.036;VB2:F=6.849,P=0.001;烟酸:F=6.409,P=0.001;烟酰胺:F=6.353,P=0.001;D-生物素:F=3.266,P=0.024),对叶酸的影响不显著(F=1.781,P=0.160)。对含量结果(图2)分析可见,D-泛酸和VB6在温度高于60 ℃时含量呈降低趋势,其中D-泛酸在100 ℃条件下提取后的测定值为在50 ℃条件下提取后测定值的74%;VB2和叶酸则适合高温提取,在100 ℃条件下提取后VB2和叶酸的测定值比常温提取提高了16%。综合比较,选择水浴温度为50 ℃。
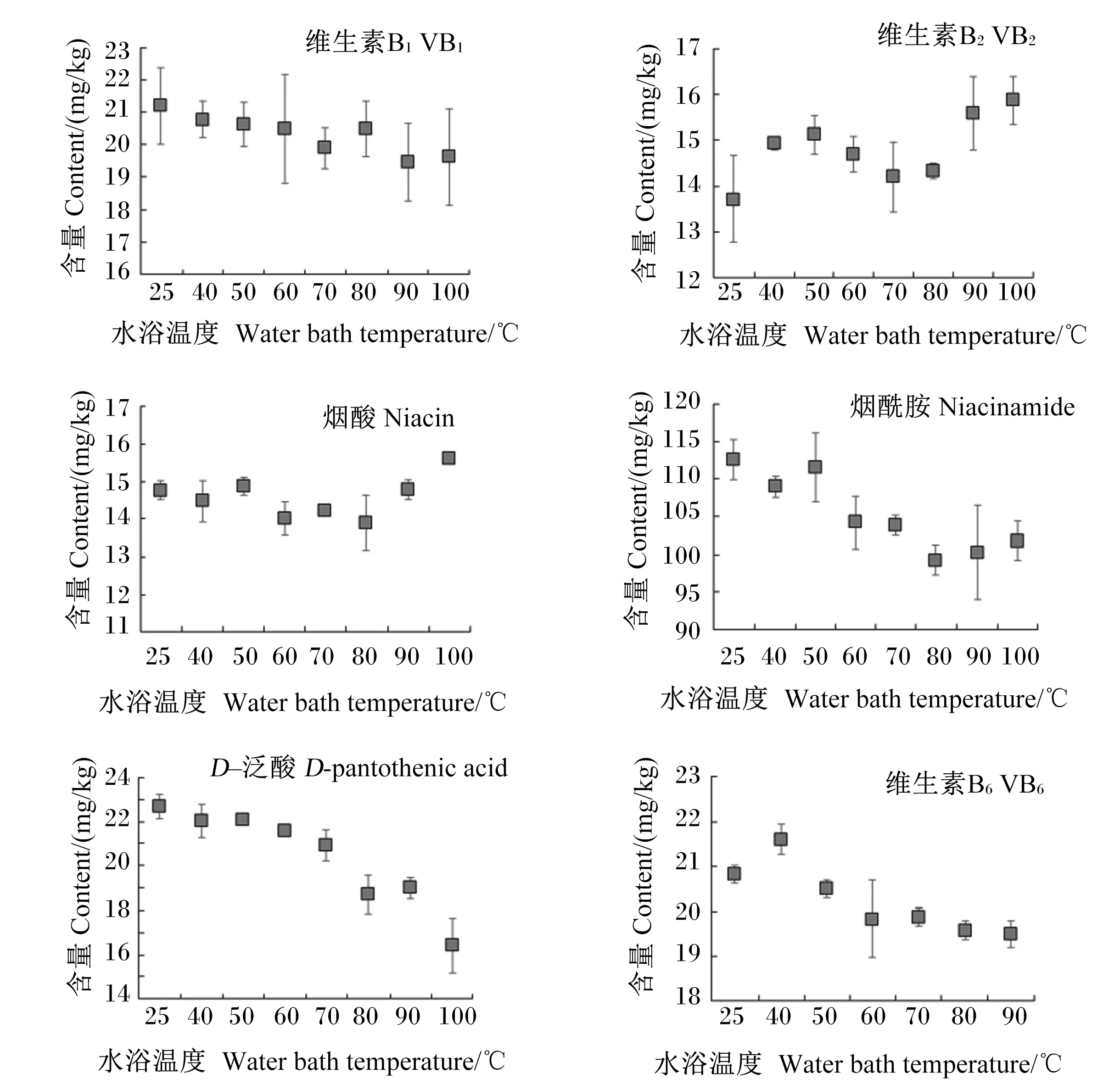
图2 水浴温度对提取结果的影响
2.1.3 水浴时间对提取结果的影响
进一步比较水浴时间的影响,方差分析结果表明:水浴时间对各维生素的影响均比较显著(VB1:F=7.702,P=0.001;VB2:F=14.677,P<0.001;烟酸:F=105.880,P<0.001;烟酰胺:F=52.924,P<0.001;D-泛酸:F=121.362,P<0.001;VB6:F=16.001,P<0.001;D-生物素:F=17.948,P<0.001;叶酸:F=16.123,P<0.001)。对含量结果(图3)分析可见,VB1和D-泛酸在40 min以内,测定值比较稳定,水浴时间超过40 min后,测定值有减小趋势;烟酸和烟酰胺随时间延长有减小趋势;VB2、D-生物素和叶酸则随水浴时间延长有增长趋势,VB2从10~40 min,测定值提高了20%,随后趋于稳定。综合比较,选择水浴时间为40 min。
2.1.4 pH对提取结果的影响
比较pH从3.5~7.5对提取结果的影响,方差结果表明:pH对VB1、VB2和叶酸的检测结果有显著影响(VB1:F=3.287,P=0.023;VB2:F=3.076,P=0.030;叶酸:F=17.775,P<0.001),对其他5种维生素的影响不显著(烟酸:F=0.538,P=0.794;烟酰胺:F=0.676,P=0.690;D-泛酸:F=1.472,P=0.246;VB6:F=1.042,P=0.441;D-生物素:F=1.545,P=0.222)。对含量结果(图4)分析可见,叶酸在pH为3.5和4.0时测定值较低,当pH>5.0时,叶酸的检测结果趋于稳定;pH为5.0~7.0时,VB1和VB2的测定结果差异性不大,且在此pH范围内,试样溶液沉淀速度快,因此选择pH 6.0为最佳条件。

图3 水浴时间对结果的影响

图4 pH对提取结果的影响
2.2 质谱条件优化
采用电喷雾离子源,在正离子电离模式下对8种水溶性维生素的母离子、子离子、碰撞能量及去簇电压等质谱条件进行优化,优化后的质谱参数见表2。

表2 8种维生素及其内标MRM质谱参数
2.3 色谱条件优化
采用Agilent ZORBAX SB-AQ C18色谱柱,以高比例水相(95%的0.1%甲酸水溶液)为初始流动相,逐渐过渡到高比例有机相(90%的0.1%甲酸乙腈水溶液),8种水溶性维生素及其同位素内标在10 min内均得到有效保留和分离(图5),8种目标化合物按出峰顺序分别是VB1[相对保留时间(RT)2.33 min]、烟酰胺(RT 3.24 min)、VB6(RT 3.24 min)、烟酸(RT 3.43 min)、D-泛酸(RT 4.95 min)、叶酸(RT 6.43 min)、VB2(RT 6.58 min)和D-生物素(RT 6.71 min)。
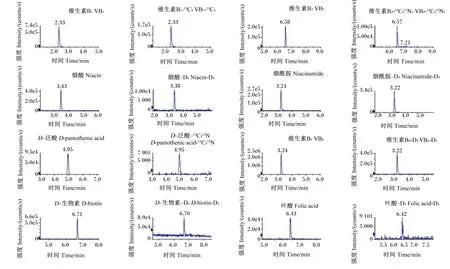
图5 8种维生素及其同位素内标的提取离子色谱图
2.4 线性范围与定量限
根据宠物配合饲料中各种水溶性维生素的添加量范围(1~200 mg/kg),确定标准曲线的范围为5.0~2 000 ng/mL,结果表明:目标化合物在此浓度范围内,线性关系良好,曲线相关系数(R2)>0.995 0;以3倍和10倍基线噪音所对应的维生素含量分别计算方法的检出限和定量限,8种水溶性维生素的线性范围、相关系数、检出限和定量限见表3。
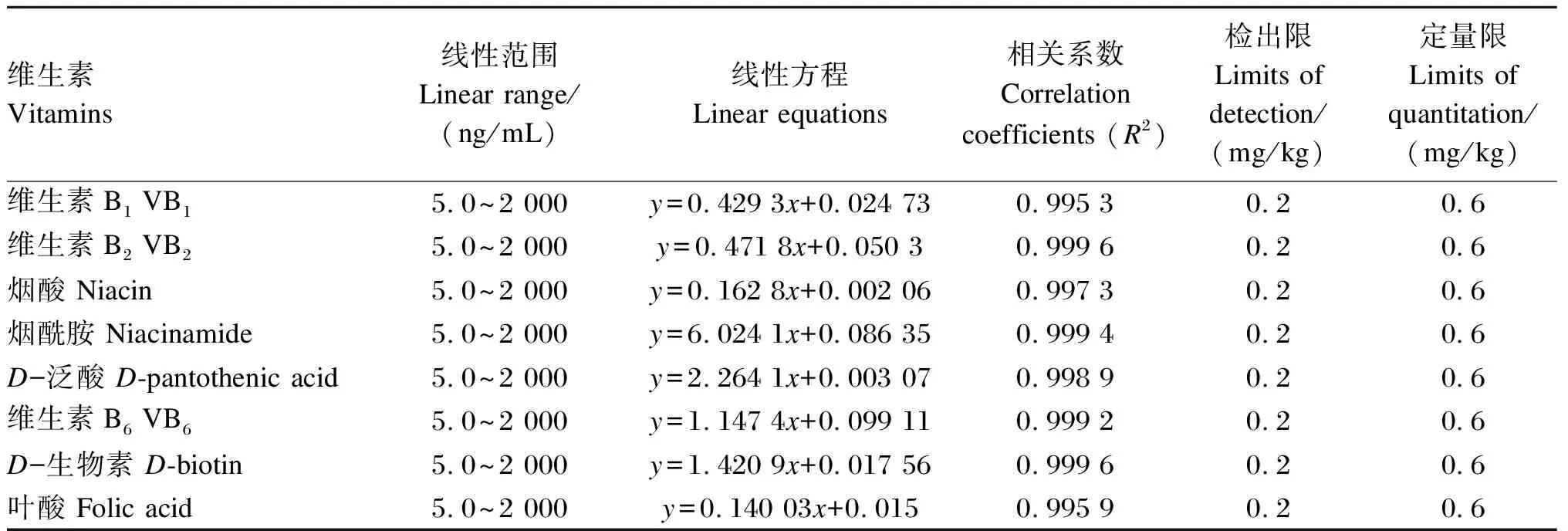
表3 8种维生素的线性方程、相关系数、检出限和定量限
2.5 方法准确性及精密度
采用配方犬粮和配方猫粮作为基质,在测定本底值的基础上,设定VB1、VB2、烟酸、烟酰胺、D-泛酸和VB6的3个添加水平分别为10、20和30 mg/kg,D-生物素、叶酸的3个添加水平分别为1.25、2.50和3.75 mg/kg,每个水平重复6次,计算添加回收率及相对标准偏差(RSD),评价方法准确性及精密度,结果见表4和表5。由表可知,配方犬粮加标回收率为80.0%~117.3%,RSD(n=6)为1.04%~5.28%;配方猫粮加标回收率为81.0%~112.2%,RSD(n=6)为1.06%~10.2%。试验结果表明,8种水溶性维生素的添加回收率高,相对偏差小,说明本方法准确度高、精密度良好。

表4 犬粮中8种维生素的回收率和精密度

表5 猫粮中8种维生素的回收率和精密度

续表5维生素Vitamins本底值Background values/(mg/kg)添加水平Supplemental levels/(mg/kg)测定值Measured values/(mg/kg)回收率Recovery/%相对标准偏差 RSD/%1023.3±1.098.5±10.14.35烟酸 Niacin13.42034.0±0.8103.0±4.22.483044.8±2.4104.7±8.15.401054.1±0.897.9±8.21.51烟酰胺 Niacinamide44.32063.2±0.794.6±3.41.063076.3±2.4106.6±8.13.201033.1±0.997.3±9.32.80D-泛酸 D-pantothenic acid23.42043.5±2.4100.4±12.15.563053.0±2.598.6±8.24.661023.8±1.295.3±12.22.11维生素B6 VB614.02032.6±1.992.9±9.63.053042.4±1.794.6±5.53.901.252.07±0.1583.8±11.87.16D-生物素 D-biotin1.022.503.20±0.2087.3±8.06.273.754.22±0.4385.4±11.510.201.251.99±0.1581.2±11.87.40叶酸 Folic acid0.982.503.23±0.2790.2±10.78.293.754.02±0.2281.0±5.85.38
2.6 实际样品的测定
采用建立的方法对18份宠物配合饲料样品进行了测定分析,结果见表6。9个猫粮样品中VB1、VB2、烟酸、烟酰胺、D-泛酸、VB6、D-生物素和叶酸含量分别为15.0~87.4 mg/kg、6.5~62.3 mg/kg、10.6~106.0 mg/kg、9.0~145.0 mg/kg、12.0~66.4 mg/kg、5.00~32.50 mg/kg、1.51~15.20 mg/kg和1.89~7.98 mg/kg;9个犬粮样品中VB1、VB2、烟酸、烟酰胺、D-泛酸、VB6、D-生物素和叶酸含量分别为6.6~129.0 mg/kg、5.1~44.6 mg/kg、2.3~49.9 mg/kg、9.0~122.0 mg/kg、15.3~50.3 mg/kg、1.64~27.90 mg/kg、1.57~13.80 mg/kg和0.46~7.96 mg/kg。

表6 实际样品中水溶性维生素测定结果

续表6项目 Items编号No.维生素B1 VB1维生素B2 VB2烟酸 Niacin烟酰胺 NiacinamideD-泛酸 D-pantothenic acid维生素B6 VB6D-生物素 D-biotin叶酸 Folic acid犬粮Dog food1105.018.715.964.836.67.772.572.77269.913.331.724.033.34.543.150.4636.614.46.19.024.41.981.820.86470.444.613.4122.050.327.9013.807.96546.513.37.422.120.33.991.930.576129.011.216.342.324.13.501.681.33722.825.249.922.636.34.532.191.2686.68.911.513.421.24.222.540.57976.65.12.39.815.31.641.571.26
3 讨 论
3.1 质谱条件的选择
8种水溶性维生素的分子结构式见图6。从分子结构上可以看出,VB1、VB2、烟酸、烟酰胺、D-泛酸和VB6均带有氨基,因此可在正离子模式下结合氢离子(H+)产生[M+H]+的母离子;而D-生物素和叶酸既有氨基,也有羧基,所以在正负离子模式下均可电离[16]。本研究采用正离子电离模式,通过一次进样实现8种水溶性维生素的检测。质谱检测器通过选择性离子监测模式,可有效排除色谱共流出物的干扰,从而大大提高方法的选择性和灵敏度。从图5可以看出,8种水溶性维生素及其同位素内标的提取离子色谱图均无干扰峰。

图6 8种水溶性维生素的分子结构式
3.2 液相色谱条件的选择
部分水溶性维生素在C18色谱柱上的保留能力较差,且难以与配合饲料中共同提取出的极性化合物分离,在紫外检测器上表现为出峰早、杂峰多。质谱检测器虽然具有较好的选择性,但仍存在共流出的干扰问题,良好的色谱分离可以提高液相色谱-质谱系统定性和定量分析的准确性。通过改变流动相组成或采用梯度洗脱的方式可增强水溶性维生素的保留,最常用的流动相为庚烷磺酸钠-乙二胺四乙酸(EDTA)-三乙胺体系[2-3,6-7],该体系通过离子对试剂对色谱固定相进行修饰,以提高离子间作用力,延长保留时间;采用磷酸盐-乙腈体系[5,19],不仅改变流动相pH,也可实现水溶性维生素的分离,但这2种分离体系均不适合质谱系统。除了改变流动相,色谱柱的类型对维生素的分离结果影响较大[16-17,20]。梁琳等[13]比较了3种不同长度的C18色谱柱,选择250 mm的长柱进行多组分分离;Chamseddin等[20]比较了传统C18固定相、极性封端C18、醚链接极性封端以及环烃键合固定相的分离效果,发现极性封端C18色谱柱最适合分离维生素。本研究采用的SB-AQ C18色谱柱,其键合相为含极性基团的C18,侧面键合异丙基增加烷基长链的空间位阻,可耐受高水相,并在不使用离子对试剂的条件下增强水溶性维生素的保留[16]。VB1、烟酰胺、烟酸和VB6这几种化合物极性大,在传统C18柱上几乎无保留,而在SB-AQ C18柱上的保留时间分别为2.33、3.24、3.43和3.24 min,样品的定性定量离子比与标准品的一致,说明无干扰离子共流出。
3.3 前处理条件的选择
参照饲料中水溶性维生素的提取方法对宠物配合饲料进行前处理,所得提取溶液出现浑浊、乳化等现象,这是由于与禽畜配合饲料比较,宠物配合饲料的组成更为复杂。禽畜配合饲料组成包括豆粕、玉米等植物源性成分和饲料添加剂,宠物配合饲料除添加燕麦、大麦、糙米、豌豆、植物油等植物源性成分以及各种矿物质和维生素添加剂外,还会添加大量鸡肉、鱼肉等动物源性成分,因此,宠物配合饲料提取液的基质更为复杂。水溶性维生素的前处理方法通常采用酸解、酶解和蛋白质沉淀等方法[21-22],本研究采用1%HCl溶液使水溶性维生素溶出,再用氨水溶液调节pH,使蛋白质等杂质在等电点形成沉淀,所得提取液澄清、杂质少,且8种水溶性维生素的回收率均在80%以上,说明该样品前处理过程既能保证维生素的提取效率,又能达到去除杂质的目的。
3.4 实际样品分析
目前,我国国家标准只对维生素A、维生素D、二甲基嘧啶醇亚硫酸甲萘醌和L-肉碱进行了最高添加量的限制性规定[23],对其他维生素的添加量没有限制性规定。参考美国饲料管理协会(AAFCO)对宠物配合饲料中维生素的推荐添加量(成猫猫粮中VB1、VB2、烟酸、D-泛酸、VB6和叶酸的最低添加量分别为5.6、4.0、60、5.75、4.0和0.8 mg/kg,成犬犬粮中VB1、VB2、烟酸、D-泛酸、VB6和叶酸的最低添加量分别为2.25、5.2、13.6、12、1.5和0.216 mg/kg),对结果进行分析,发现存在以下问题:一是不同样品中维生素的添加量差异很大,样品之间维生素最高值与最低值的比值相差数倍到数十倍不等,有的样品维生素的添加量远远高于推荐值,如犬粮6的VB1含量是推荐值的57倍;二是少量样品的维生素达不到推荐值,如犬粮9维生素B2和烟酸的含量低于AAFCO推荐值;三是检测中应关注维生素B3的2种添加形式,即烟酸和烟酰胺,食品安全国家标准GB 5009.89—2016[24]中规定了以烟酸和烟酰胺之和计算样品中维生素B3的含量,饲料相关标准则将2种化合物分别进行检测[4,6]。本试验所测样品中,若只以烟酸计,有5个猫粮的含量低于60 mg/kg,5个犬粮的含量低于13.6 mg/kg,若以烟酸和烟酰胺之和计,则除犬粮9以外,其余样品均符合要求。
4 结 论
① 以1%HCl为提取试剂,在50 ℃水浴40 min,用10%氨水调节pH至6.0使蛋白质沉淀,可有效提取宠物配合饲料中的8种水溶性维生素。
② 提取液经超高效液相色谱分离,正离子模式电离,质谱MRM模式下进行检测,同位素内标法定量,方法准确度高,犬粮和猫粮的加标回收率分别为80.0%~117.3%和81.0%~112.2%,RSD分别为1.05%~5.28%和1.06%~10.20%。
③ 本试验建立的宠物配合饲料中8种水溶性维生素含量的同步检测方法,提高了检测效率,可为宠物饲料生产企业合理使用维生素及政府监管提供技术支持。
