白术多糖通过线粒体和死亡受体途径缓解脂多糖诱导的雏鹅胸腺细胞凋亡
2023-01-06陈丽君李冰心付新亮杨保和袁明凤许丹宁田允波黄运茂李婉雁
陈丽君 李冰心 曹 楠 付新亮 杨保和 袁明凤许丹宁 田允波 黄运茂 李婉雁*
(1.仲恺农业工程学院动物科技学院,广州510225;2.广东省水禽健康养殖重点实验室,广州510225;3.云南快大多畜牧科技有限公司,玉溪653100)
鹅是一种半旱养动物,养殖过程中需要不定期下水,高温、高湿的环境使得水中的细菌增加,导致鹅体内积聚的脂多糖(LPS)增加。在鹅的育雏期,免疫器官的发育尚未完全,因此极易因LPS的积聚影响雏鹅免疫器官的生长发育,抑制雏鹅的免疫功能。胸腺是雏鹅的中枢免疫器官,是T淋巴细胞分化和发育的场所,因此胸腺对雏鹅的免疫功能有着重要作用[1]。胸腺中含有胸腺细胞、胸腺上皮细胞、T细胞等多种细胞,可以通过发生细胞凋亡来维持机体平衡,维持内环境稳定。但当器官受到不良刺激时,细胞凋亡会增加,过多的细胞凋亡会打破免疫功能平衡,这种平衡一旦被破坏,将导致雏鹅的免疫器官发育不全、免疫功能损伤等严重后果[2-3]。LPS是革兰氏阴性菌细胞壁的主要成分,具有细菌毒素作用。目前研究指出,LPS引起机体损伤的作用机制有以下2种,一是作用于免疫细胞、上皮细胞等靶细胞,使表面分子异常并增加细胞通透性,导致功能性损伤;二是通过激活免疫细胞,使其分泌大量炎性介质并引起炎症[4-6]。此外,有研究发现LPS会导致机体的氧化应激及细胞凋亡的水平增加,如LPS处理小鼠的胸腺细胞凋亡等水平增加,从而抑制机体的免疫功能。前期的研究表明,LPS作为Toll样受体4(TLR4)的配体,通过核因子-κB(NF-κB)信号通路激活炎性细胞因子的表达,引起机体发生炎症,同时机体发生氧化应激进一步加剧炎症反应,使得组织中的炎性因子失调。LPS会导致氧化应激和炎症细胞因子的增加,氧化应激和炎症细胞因子的增加也是导致细胞凋亡的关键因素,因此LPS会进一步促进细胞凋亡的发生[7-9]。
细胞凋亡是机体中常发生的细胞死亡现象之一,主要通过线粒体和死亡受体信号通路进行调控。线粒体途径起源于细胞内部应激,如DNA损伤或内质网应激,受B细胞白血病/淋巴瘤-2(Bcl-2)、B细胞白血病/淋巴瘤-2相关X蛋白(Bax)和半胱氨酸天冬氨酸特异性蛋白酶-3(Caspase-3)等基因的调控[10-12]。死亡受体途径始于对细胞的外部刺激,由细胞外特定因子的浓度达到特定阈值等原因触发,导致致死信号或依赖性受体的转导,刺激半胱氨酸天冬氨酸特异性蛋白酶-8(Caspase-8)激活,进而激活Caspase-3,诱导细胞凋亡[13-14]。线粒体和死亡受体信号通路共同作用,参与细胞凋亡的调节。
近年来,关于中药提取物对畜禽的炎症、氧化应激、细胞凋亡等方面的预防作用得到越来越多的关注。白术多糖(polysaccharide ofAtractylodesmacrocephalaKoidz,PAMK)是中药白术的有效生物活性成分,具有绿色、天然、无残留、无毒副作用等特点,被研究证实具有抗炎、抗氧化等作用,可通过调节免疫细胞的增殖和活化、炎性细胞因子分泌等来调节机体的免疫功能,以此维持免疫系统的平衡[15-17]。据报道,PAMK可以下调雏鹅脾脏和肠道中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)等促炎细胞因子的水平[18-19]。PAMK也可降低氧化应激来缓解热应激引起的鸡脾脏免疫功能障碍,增强线粒体功能,从而抑制细胞凋亡[20]。尽管已经证明PAMK对雏鹅的免疫功能具有调节作用,但是PAMK对LPS诱导的雏鹅胸腺细胞凋亡是否具有保护作用及其可能的调控机制仍需要进一步研究。因此,本研究通过在饲粮中添加PAMK,同时注射LPS以引起雏鹅胸腺细胞凋亡,观察胸腺超微结构变化,检测炎性细胞因子、氧化应激、凋亡相关基因等指标的变化,探索PAMK是否通过线粒体途径和死亡受体途径对LPS诱导的胸腺细胞凋亡具有保护作用,为进一步研究和开发PAMK作为一种新型的、绿色的饲料添加剂提供理论依据。
1 材料与方法
1.1 试验设计
选择80只1日龄马岗鹅,预饲3 d后随机分为4组,分别为对照组(CON组)、白术多糖组(PAMK组)、脂多糖组(LPS组)、脂多糖+白术多糖组(LPS+PAMK组),每组4个重复,每个重复5只,组间体重差异不显著(P>0.05)。CON组和LPS组饲喂基础饲粮,PAMK组和LPS+PAMK组在基础饲粮中添加400 mg/kg PAMK。CON组和PAMK组分别在雏鹅第24、26、28日龄腹腔注射1 mL生理盐水;LPS组和LPS+PAMK组分别在雏鹅第24、26、28日龄腹腔注射2 mg/kg LPS溶液。
1.2 饲养管理及样品采集
试验鹅购自清远金羽丰鹅业有限公司,饲养试验在仲恺农业工程学院教育基地鹅舍中开展,试验开始前1周对鹅舍进行严格清洗和消毒,试验全期采用平地散养,试验鹅自由采食、饮水。预试期3 d,正试期28 d。全程饲养、免疫程序及环境标准均按《马岗鹅肉鹅饲养管理技术规范》(DB 44/T 1595—2015)执行。
28日龄注射LPS 1 h后,雏鹅颈静脉放血处死,迅速采集雏鹅胸腺组织,分别储存在2.5%戊二醛溶液、多聚甲醛液管中,-80 ℃保存,用于后续试验。
1.3 主要试剂
LPS(L2880-100MG),购自美国Sigma Chemical公司;PAMK(CY201216),纯度为95%,购自杨凌慈缘生物技术有限公司;Trizol(1559602),购自美国Ambion公司;反转录试剂盒(Rr036A),购自日本TaKaRa公司;实时定量PCR染料2×PowerUpTMSYBRTMGreen PCR Master Mix(A25742),购自美国Thermo Fisher公司;RIPA细胞裂解液(P0013B)、蛋白酶抑制剂(ST506)和BCA蛋白浓度测定试剂盒(P0010),均购自上海碧云天生物技术研究所;化学发光试剂盒(GK10008),购自于美国GlpBio公司;活性氧(ROS)活性检测试剂盒(XY-ELA08632),购于上海心语生物科技有限公司;谷胱甘肽过氧化物酶(GPX)(A005-1)、过氧化氢酶(CAT)(A007-1-1)、超氧化物歧化酶(SOD)(A001-3-2)活性检测试剂盒,购于南京建成生物工程研究所;10%聚丙烯酰胺凝胶电泳(PAGE)快速制备试剂盒(PG112)、快速转膜缓冲液、Tris-甘氨酸-十二烷基硫酸钠(SDS)电泳缓冲液,均购自上海雅酶生物科技公司;蛋白marker(26616),购自美国Thermo Fisher公司;β-肌动蛋白(β-actin)一抗(T0022),购于美国Affinity Biosciences公司;Bcl-2(BA0412)、Bax(BA0315-2)一抗,购于美国Boster公司;Caspase-8一抗(WL03426),购于万类生物科技有限公司;山羊抗兔免疫球蛋白G(IgG)二抗(E1WP318),购于美国EnoGene公司。
1.4 试验方法
1.4.1 胸腺组织石蜡包埋及苏木精-伊红(HE)染色
使用光学显微镜观察胸腺组织形态。将4组的胸腺组织样品固定在4%缓冲多聚甲醛中并包埋在石蜡中保存。将组织切片成厚度为5 μm并进行HE染色(哈里斯苏木精2 min,1%伊红30 s),在正置显微镜(Nikon Eclipseci,日本)下观察分析。
1.4.2 胸腺组织超微结构观察
使用透射电子显微镜观察胸腺组织的超纤维结构。取约2 mm的新鲜胸腺组织,立即用2.5%戊二醛溶液固定,置于4 ℃保存,送广州金域医学检验中心制备电镜标本,在透射电子显微镜(JEM-1400,日本)下观察分析。
1.4.3 实时荧光定量PCR
采用Trizol法提取雏鹅胸腺组织中总RNA,用于反转录成cDNA。根据操作说明,SYBR mix 10 μL,焦碳酸二乙酯(DEPC)水7 μL,上、下游引物各1 μL,cDNA 1 μL,构建20 μL反应体系,反应条件为50 ℃ 2 min,95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环,在实时荧光定量PCR仪(ABI PRISM 7500,新加坡)中检测,以β-actin为内参对照,使用2-ΔΔCt法计算目的基因的mRNA相对表达水平。用于荧光定量PCR的引物序列见表1,由华大基因公司合成。

表1 引物序列信息

续表1基因Genes上游引物Forward primer (5′—3′)下游引物Reverse primer (5′—3′)半胱氨酸天冬氨酸特异性蛋白酶-8 Caspase-8GGTGTCGCAGTTCAGGTACATTGTAGTTTCAGGGCTT过氧化氢酶 CATATACAGTTCGTGACCCTCGCCAGAAGTCCCATACCAT超氧化物歧化酶 SODAAATGGGTGTACCAGCGCAGTCTTCTATTTCTACTTCTGCCACTCC谷胱甘肽过氧化物酶 GPXGCAAGGGGTACAAGCCCAACTGATGATGTACTGCGGGTTGGTC白细胞介素-1β IL-1βAAGTGAGGCTCAACATTGCGCGGTAGAAGATGAAGCGGGT白细胞介素-6 IL-6ACGATAAGGCAGATGGTGATTCCAGGTCTTATCCGACTTC白细胞介素-10 IL-10ATCATGACATGGACCCGGTAATTGCTCCATGACAGTTGCT肿瘤坏死因子-α TNF-αATGAACCCTCCTCCGTACACAGAGGCCACCACATGATAGC
1.4.4 抗氧化指标测定
剪取0.1 g的胸腺组织,按照胸腺重量(g)和磷酸盐缓冲液体积(mL)比例为1∶9置于匀浆机匀浆,3 000 r/min离心15 min,离心后取上清即为10%的组织匀浆,使用BCA蛋白浓度测定试剂盒检测蛋白浓度。按照ROS、CAT、SOD、GPX试剂盒操作说明检测各样品中抗氧化指标的活性。
1.4.5 蛋白免疫印迹分析(Western blot)
按照胸腺重量(g)和RIPA细胞裂解液体积(mL)比例为1∶9提取胸腺组织总蛋白,使用BCA蛋白浓度测定试剂盒检测蛋白浓度。样品在95 ℃变性后,用10% SDS-PAGE分离等量蛋白,恒流200 mA转移至聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭2 h,然后在4 ℃下分别用β-actin、Bax、Bcl-2、Caspase-8一抗(1∶1 000)孵育过夜。膜在磷酸盐吐温缓冲液(PBST)中清洗0.5 h后与二抗(1∶10 000)在室温下孵育1 h,清洗0.5 h后用化学发光成像系统(Tanon 5200,上海天能科技有限公司)检测蛋白表达。使用Image J软件分析蛋白质条带灰度值,使用β-actin为内参对照,蛋白相对表达量用目的蛋白条带灰度值/内参蛋白条带灰度值表示。
1.5 数据统计与处理
数据使用SPSS 18.0软件进行分析单因素方差分析,采用Turkey法进行组间多重比较检验。用Graph Prim 7.0软件进行作图。所有结果均以平均值±标准误表示,P<0.05表示差异显著。
2 结果与分析
2.1 PAMK对LPS处理的雏鹅胸腺组织病理损伤的影响
为了评估PAMK对LPS引起的胸腺组织病理损伤的潜在保护作用,进行了胸腺组织的石蜡包埋及HE染色,并进行了胸腺组织病理学观察。结果如图1所示,LPS组与CON组和PAMK组相比,红髓中出现较多的空泡和细胞碎片;但LPS+PAMK组红髓中空泡和细胞碎片较少,细胞排列较紧密。这些结果表明,PAMK可以缓解LPS引起的雏鹅胸腺组织病理损伤。

A:CON组 CON group;B:PAMK组 PAMK group;C:LPS组 LPS group;D:LPS+PAMK组 LPS+PAMK group。图片白色箭头指示为组织空泡化且有碎片。The white arrow represents for vacuoles and debris tissue.
2.2 PAMK对LPS处理雏鹅胸腺组织超显微结构的影响
雏鹅胸腺组织的透射电镜结果如图2所示,CON组胸腺细胞维持圆形或微椭圆形的细胞形态(图2-a、图2-e,白色箭头),胞质均匀,核较大,线粒体呈棒状或者球状(图2-e,蓝色箭头),并无发生染色质聚集现象;PAMK组细胞未观察到异常(图2-b、图2-f);LPS组的雏鹅胸腺组织发生明显的病理变化(图2-c、图2-g),可见大部分细胞体积变小,形态不规则,染色质浓缩,出现边缘化(图2-c,黑色箭头),部分细胞的线粒体发生肿胀、嵴断裂、空泡化等现象(图2-g,绿色箭头),可见典型的凋亡小体(图2-g,红色箭头)。LPS+PAMK组的大部分的细胞形态接近正常(图2-d、图2-h),胞质均匀,核呈现圆形,出现少量的凋亡小体,具有比LPS组更紧密的排列。这些结果表明,PAMK可以减轻LPS诱导的雏鹅胸腺细胞凋亡。

图2 PAMK对LPS处理的雏鹅胸腺组织超显微结构的影响
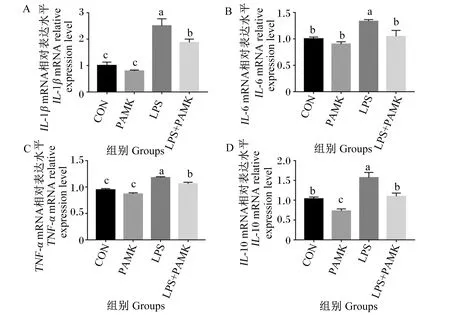
2.3 PAMK对LPS处理的雏鹅胸腺中炎性细胞因子mRNA相对表达水平的影响
IL-1β、IL-6、IL-10、TNF-α作为关键的促炎因子,与氧化应激、凋亡等细胞活动有着密切的相关性[21]。为了阐明PAMK对LPS处理的雏鹅胸腺中炎性细胞因子的影响,采用荧光定量PCR方法检测IL-1β、IL-6、TNF-α、IL-10的mRNA相对表达水平。结果如图3所示,与CON组相比,PAMK组的IL-1β、IL-6、TNF-α的mRNA相对表达水平无显著差异(P>0.05),IL-10的mRNA相对表达水平显著下降(P<0.05);而LPS组的IL-1β、IL-6、TNF-α、IL-10的mRNA相对表达水平显著升高(P<0.05)。与LPS组相比,LPS+PAMK组的IL-1β、IL-6、TNF-α、IL-10的mRNA相对表达水平显著降低(P<0.05)。这些结果表明,PAMK可缓解LPS引起的雏鹅胸腺中炎性细胞因子水平升高。
2.4 PAMK对LPS处理的雏鹅胸腺中ROS含量及CAT、GPX、SOD的mRNA相对表达水平和活性的影响
为研究PAMK对氧化应激的影响,在本研究首先检测了胸腺组织中ROS含量。结果如图4所示,与CON组相比,LPS组ROS含量增加了1.11倍(P>0.05);与LPS组相比,LPS+PAMK组ROS含量减少了0.73倍(P>0.05)。此外,PAMK组的ROS含量与CON组相比显著下降(P<0.05),说明PAMK具有下调ROS含量的作用。
此外,检测了胸腺组织中CAT、GPX、SOD的mRNA相对表达水平和活性,结果如图5所示,与CON组相比,LPS组CAT的mRNA相对表达水平显著降低(P<0.05),GPX的mRNA相对表达水平显著升高(P<0.05),SOD的mRNA相对表达水平无显著差异(P>0.05)。与LPS组相比,PAMK+LPS组CAT、SOD的mRNA相对表达水平显著升高(P<0.05),GPX的mRNA相对表达水平显著降低(P>0.05)。酶活性结果显示,LPS组的CAT(P>0.05)、GPX(P>0.05)和SOD(P<0.05)活性不同程度低于CON组和LPS+PAMK组。这些结果表明,PAMK能缓解LPS引起的雏鹅胸腺组织的氧化应激。
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。

图4 PAMK对LPS处理的雏鹅胸腺中
2.5 PAMK对LPS处理的雏鹅胸腺中凋亡相关基因mRNA相对表达水平的影响
使用荧光定量PCR技术检测Bax、Caspase-3、Bcl-2、肿瘤蛋白63(TP63)、Caspase-8等凋亡相关基因的mRNA相对表达水平来阐明PAMK对LPS处理的雏鹅胸腺组织细胞凋亡的影响。结果如图4所示,与CON组相比,PAMK组Bax、TP63的mRNA相对表达水平无显著差异(P>0.05),Caspase-3的mRNA相对表达水平显著降低(P<0.05),Bcl-2、Caspase-8的mRNA相对表达水平显著升高(P<0.05);LPS组Bax、Caspase-3的mRNA相对表达水平显著升高(P<0.05),TP63、Bcl-2的mRNA相对表达水平显著降低(P<0.05),Caspase-8的mRNA相对表达水平无显著差异(P>0.05)。与LPS组相比,LPS+PAMK组Bax、Caspase-3的mRNA相对表达水平显著降低(P<0.05),Bcl-2、Caspase-8、TP63的mRNA相对表达水平表达显著升高(P<0.05)。这些结果表明,PAMK可以缓解LPS处理的雏鹅胸腺细胞凋亡。
2.6 PAMK对LPS处理的鹅胸腺中凋亡相关蛋白相对表达水平的影响
采用了Western blot方法检测蛋白相对表达水平进一步证实PAMK对LPS引起的胸腺细胞凋亡的缓解作用。由图7可知,与CON组相比,PAMK组Bax、Caspase-8的蛋白相对表达水平无显著差异(P>0.05),Bcl-2的蛋白相对表达水平显著下降(P<0.05);LPS组Bax、Caspase-8的蛋白相对表达水平显著升高(P<0.05),Bcl-2的蛋白相对表达水平显著下降(P<0.05)。与LPS组相比,LPS+PAMK组Bax、Caspase-8的蛋白相对表达水平显著下降(P<0.05),Bcl-2的蛋白相对表达水平显著升高(P<0.05)。这些结果表明,PAMK对健康雏鹅的中的凋亡相关蛋白无显著影响,但可以缓解LPS刺激下胸腺组织中凋亡相关蛋白表达水平的上升。

图5 PAMK对LPS处理的雏鹅胸腺中CAT、GPX、SOD的mRNA相对表达水平和活性的影响

图6 PAMK对LPS处理雏鹅胸腺中凋亡相关基因mRNA相对表达水平的影响

图7 PAMK对LPS处理的雏鹅胸腺细胞凋亡相关蛋白相对表达水平的影响
3 讨 论
胸腺是雏鹅的中枢免疫器官,也是T淋巴细胞发育和分化的地方,其中胸腺组织中的胸腺细胞也对T淋巴细胞孵育具有重要作用,因此胸腺的生长发育水平及组织形态的情况,均对雏鹅的免疫功能有着重要作用[1]。细胞凋亡本质上是一种程序性细胞死亡,能有效地清除机体内衰老、畸变、损伤等细胞,在一定程度上对机体具有自我保护的作用。然而,在某些不良刺激或病理条件下,细胞凋亡的水平会增加,从而引起组织损伤。已有研究表明,细胞凋亡对不同刺激有不同的形态学特征,如细胞收缩、质膜起泡、染色质凝聚,最终细胞都碎裂成凋亡小体,这些小体被吞噬后引发炎症反应[22-23]。本试验结果显示,LPS组的胸腺组织结构完整性被破坏,凋亡小体增多,可见细胞凋亡的典型特征,与之前的研究相似,这些结果为LPS诱导雏鹅胸腺细胞凋亡模型制备成功提供了证据。有研究表明,PAMK对热应激、环磷酰胺等不同刺激导致的凋亡有明显的缓解作用[24]。本试验同样发现,在饲粮中添加400 mg/kg PAMK能减少LPS引起的凋亡小体、线粒体损伤等凋亡现象,这些结果表明PAMK可以缓解由LPS引起的凋亡,然而PAMK的抗凋亡机制尚不清楚。
氧化应激和炎症因子水平的增加是导致细胞凋亡的关键因素,因此PAMK缓解LPS诱导细胞凋亡作用可能与二者的水平相关。细胞凋亡是通过促炎介质诱导的,如发挥多功能作用的TNF-α,可以与死亡受体(TNF receptor,TNFR)结合,并可能通过激活Caspase-3和Caspase-8直接诱导细胞凋亡[25-26]。研究表明,LPS可通过增加TNF-α、IL-6和IL-10等细胞因子水平从而诱导细胞凋亡[27-29]。因此,具有抗炎作用的植物提取物也可通过下调炎性因子的水平参与缓解细胞凋亡水平,如原花青素、黄芩苷[30-31]。研究表明,PAMK可降低LPS诱导的小肠等器官中的炎性细胞因子水平。本试验结果也在前人的研究基础上得到进一步的验证,PAMK显著降低LPS处理下胸腺组织中细胞因子(IL-1β、TNF-α、IL-6、IL-10)的表达,这可能是其缓解细胞凋亡的作用方式之一。
在氧化应激水平增加且不能及时缓解的情况下,也可引发细胞凋亡。本试验检测了ROS含量及CAT、GPX、SOD等基因表达和酶活性,结果表明LPS有提高胸腺组织中ROS含量和抑制CAT、GPX和SOD活性的趋势,提示LPS诱导雏鹅胸腺发生氧化应激。透射电镜结果显示LPS组线粒体嵴断裂、染色质凝集等特征,这有理由认为是线粒体发生氧化损伤并导致促凋亡蛋白释放到细胞质中,从而导致细胞凋亡。本结果也表明,PAMK可以通过调节抗氧化酶的表达和提高机体内酶活性而提高抗氧化功能。我们试图证明PAMK通过氧化应激和细胞因子缓解免疫器官中凋亡,然而其中的串扰关系极其复杂,需要更多的研究来阐明PAMK与LPS处理的雏鹅胸腺中的细胞凋亡、炎症和氧化应激相关的机制。因此,需进一步试验分析PAMK是否通过线粒体或死亡受体凋亡途径参与缓解胸腺细胞凋亡的过程。
已知LPS可通过激活死亡受体途径与线粒体凋亡途径引起凋亡[30]。Bcl-2和Bax是细胞凋亡调控中最重要的基因,Bcl-2/Bax信号通路在细胞凋亡过程中发挥重要作用。本研究中,LPS处理显著上调了Bax、Caspase-3的表达和下调了Bcl-2的表达,与之前的研究一致。有趣的是,PAMK显著调节了LPS诱导组织中这些基因和蛋白表达水平。这表明PAMK对LPS诱导的细胞凋亡的抑制作用可能与胸腺组织中Bax/Bcl-2信号通路的调节有关。死亡受体途径可以通过激活死亡受体来诱导,如Fas,这需要与Fas配体(FasL)结合,然后通过Fas相关死亡域(FADD)激活Caspase-8[32]。在本研究中检测了死亡受体关键蛋白Caspase-8的表达,结果显示LPS处理显著上调了其mRNA表达,而PAMK显著下调了其蛋白表达,PAMK对LPS诱导的细胞凋亡的抑制作用可能与胸腺组织中死亡受体途径信号通路的调节有关。此外,本试验结果显示,LPS处理显著下调了TP63的mRNA表达,有研究表明TP63的同型异构体TAP63α既可以激活死亡受体途径又可以激活线粒体途径[33],目前较少有研究证明TP63是否是LPS激活死亡受体途径与线粒体凋亡途径发生串扰的关键,有趣的是PAMK显著上调了TP63的mRNA表达。
本研究还发现单独加PAMK对凋亡信号通路的表达不会有明显变化,能够维持信号通路的稳定性,因此可以认为PAMK作用与雏鹅胸腺组织不会引起凋亡,本试验的组织结构观察也证实了这点。本研究在分子层面初步解释了PAMK可能通过线粒体及死亡受体途径关键基因的抑制,缓解LPS诱导细胞凋亡。
4 结 论
PAMK可抑制LPS引起的氧化应激、炎性细胞因子水平上升,通过线粒体及死亡受体途径缓解雏鹅胸腺细胞凋亡,并维持胸腺组织的结构完整性。
