大豆皂苷对吉富罗非鱼肠道菌群和肠道健康的影响
2023-01-06常恩慧周梓涵王安然苗淑彦
张 鑫 常恩慧 付 裕 徐 洁 韩 蓓 周梓涵 王安然 苗淑彦
(扬州大学动物科学与技术学院,扬州225000)
近年来,由于鱼粉资源短缺和价格上涨等因素导致水产饲料成本不断上升,寻找鱼粉替代物成为水产动物营养领域的研究热点。豆粕具有市场供应稳定、氨基酸组成较为平衡等特点,被广泛应用于水产配合饲料[1],但其中包含的抗营养因子,如胰蛋白酶抑制剂、皂苷等,在一定程度上会损伤鱼类的生长性能、肠道健康和免疫力[2]。例如,Baeverfjord等[3]报道,饲料中添加高水平的豆粕会诱发大西洋鲑(SalmosalarL.)感染亚急性肠炎;当豆粕替代鱼粉的量超过50%时,花鲈(Lateolabraxjaponicus)的肠道组织形态和肠黏膜屏障功能受到损伤[4]。进一步研究发现,高水平的豆粕会引起鱼类肠道促炎细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、干扰素-γ(interferon-γ,IFN-γ)、白细胞介素-8(interleukin-8,IL-8)基因表达量显著上升,抗炎细胞因子如转化生长因子-β(transforming growth factor-β,TGF-β)和白细胞介素-10(interleukin-10,IL-10)基因表达量显著下降[5-6]。
皂苷是豆粕中的主要抗营养因子,含量为0.43%~0.67%[7],但皂苷对鱼类摄食及生长的影响在不同种类上的研究结果却不尽相同。例如,0.3%的大豆皂苷显著抑制了大鳞大麻哈鱼(Oncorhynchustshawytscha)和虹鳟(Oncorhynchusmykiss)的采食量和生长[8],但饲料中添加2%的皂苷活性物却能够显著提高南美白对虾(Litopenaeusvannamei)的增重率[9],1.5%的大豆皂苷也能够显著提高鲤鱼(CyprinuscarpioL.)的饲料利用效率[10]。此外,大豆皂苷通过破坏肠道黏膜屏障,从而改变肠道上皮细胞的通透性,并进一步诱发大西洋鲑豆粕性肠炎[11]。但也有研究发现,皂苷能够清除小鼠机体自由基,防止机体氧化反应的发生[12-13],从而增强机体的细胞和体液免疫能力等[13]。
鱼类肠道存在由多种微生物构成的复杂微生态系统,是鱼类健康和生长发育的重要因素之一。肠道微生物不但能够增强宿主的消化吸收能力,而且能够通过激活肠道免疫系统,促进杯状细胞的生长和保持肠道黏膜的完整性[14],从而调控机体的免疫防御功能。Reveco等[15]发现,摄食含20%豆粕的饲料后,大西洋鲑肠道内能够刺激肠道炎症反应的细菌,如乳球菌属(Lactococcus)的数量显著上升。Miao等[5]研究发现,饲料中皂苷含量超过70%后,乌鳢(Channaargus)肠道内Lactococcus、土芽孢杆菌属(Geobacillus)、假单胞菌属(Pseudomonas)、链球菌属(Streptococcus)、芽孢杆菌属(Bacillus)和不动杆菌属(Acinetobacter)的丰度显著下降,而鲸杆菌属(Cetobacterium)、浮霉状菌属(Planctomyces)、希瓦氏菌属(Shewanella)、热单胞菌属(Thermomonas)、红长命菌属(Rubrivivax)和肉食杆菌属(Carnobacterium)的丰度显著上升。
吉富罗非鱼(genetic improved farmed tilapia,GIFT)属于暖水性鱼类,分布于热带、亚热带,具有生长快、杂食性、免疫力强、抗应激能力强等特点,是我国重要的水产养殖品种。研究表明,罗非鱼饲料中豆粕替代鱼粉蛋白的量超过25%时,会显著抑制罗非鱼的生长和降低饲料利用效率[16]。本研究拟通过测定吉富罗非鱼的生长性能、肠道菌群结构、肠道炎症相关基因和紧密连接蛋白相关基因的表达,评估大豆皂苷对其生长性能、肠道菌群和肠道健康的影响,并进一步分析大豆皂苷、生长性能、肠道健康相关基因表达和肠道菌群间的关系,为进一步了解高含量豆粕饲料对罗非鱼生长和健康方面的不利影响提供数据支持和理论依据。
1 材料与方法
1.1 试验饲料配方及制作
参考乐贻荣等[17]的研究确定吉富罗非鱼的饲养标准及饲料营养水平。以脱脂鱼粉为主要蛋白质源,配制粗蛋白质和粗脂肪含量分别为35%和8%对照组饲料,命名为G1;分别在对照组饲料中添加0.30%和0.60%的大豆皂苷(湖北帝柏化工有限公司,纯度为60%),配制2种添加大豆皂苷饲料,分别命名为G2和G3;另外,用40%的豆粕替代27%的鱼粉(替代57.50%的鱼粉蛋白),配制1种添加豆粕饲料,命名为G4。4种试验饲料等氮等能,其组成及营养水平见表1。所有饲料原料用饲料粉碎机(HK820,广东旭朗机械有限公司)粉碎并过80目网筛。饲料原料混合均匀后分别加入油脂和蒸馏水,通过挤压机(F-26Ⅲ,华南理工大学)压制成形,55 ℃烘至恒重后,制成约2 mm×2 mm的颗粒饲料,于-20 ℃冰箱中保存。根据Ireland等[7]的报道,豆粕中大豆皂苷含量为0.43%~0.67%,估算本研究中试验饲料G4的大豆皂苷含量为0.17%~0.27%。各组饲料及饲料原料中的营养成分,包括干物质、粗蛋白质、粗脂肪和粗灰分含量,参照AOAC(1995)[18]提供的方法测定。

表1 试验饲料组成及营养水平(干物质基础)
1.2 试验用鱼及养殖管理
试验用吉富罗非鱼幼鱼购自广东农业淡水鱼苗养殖基地,为当年的同一批健康鱼苗。试验开始前,所有幼鱼在扬州大学水产温室水泥池(2 m×2 m×2 m)中暂养2周以适应环境,期间每天08:00和17:00饱食投喂对照组饲料。正式试验开始前,所有鱼停喂1 d,挑选活力较好、体表无损伤、体质量[(1.35±0.04) g]均匀的幼鱼480尾,随机分配到12个养殖桶(300 L)中,每桶放养40尾鱼,每组3桶,共4组。养殖周期为28 d。每天2次(08:00和17:00)投喂试验饲料。养殖期间,每桶每日换水约1/3,水温为26~28 ℃,溶解氧浓度在5 mg/L以上,亚硝酸态氮浓度≤0.09 mg/L,总氨氮浓度≤0.19 mg/L。
1.3 样品采集与指标测定
1.3.1 样品采集
分别于养殖试验的第14天和第28天采集试验鱼的全肠道样品,每桶采集3尾,用于测定肠道炎症相关基因和紧密连接蛋白相关基因的表达量;另从每桶中采集3尾试验鱼的全肠道样品,用于测定肠道菌群组成。样品采集前,用MS-222(20 g/m3)对试验鱼进行麻醉,以减少操作应激。每组的120条鱼逐尾称重,记录终末体重(FBW),计算增重率(WGR)和特定生长率(SGR)。肠道菌群样本的采集在无菌环境下进行,解剖前使用70%的酒精擦拭鱼体,将采集的样品放入1.5 mL的无菌离心管中。所有样品采集完立刻置入液氮冻存,再转入-80 ℃冰箱保存。
1.3.2 生长性能指标的测定
生长性能指标计算公式如下:
WGR(%)=100×(Wt-W0)/W0;SGR(%/d)=100×(lnWt-lnW0)/t。
式中:W0为初始体重(g);Wt为终末体重(g);t为试验天数(d)。
1.3.3 基因表达量的测定
采用北京全式金生物公司的EasyPure RNA Kit试剂盒提取肠道样品RNA,操作方法按照说明书进行。提取RNA后采用北京全式金生物公司的TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR试剂盒合成cDNA。使用实时荧光定量PCR法对肠道炎症相关基因——IL-1β、IL-8、IL-10、TNF-α、TGF-β、IFN-γ和紧密连接蛋白相关基因——闭合蛋白3(claudin 3,CLDN3)、闭合蛋白4(claudin 4,CLDN4)、闭锁小带蛋白-1(zonula occluden-1,ZO-1)、咬合蛋白(occludin,OCLN)的相对表达量进行测定。所用内参基因为β-肌动蛋白(β-actin)。引物设计使用NCBI在线设计程序,引物序列见表2。实时荧光定量PCR使用ABI 7500Fast Real-Time PCR系统(Applied Biosystems,美国)和ChamQ SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司)进行分析。按说明书进行操作,扩增条件:预变性,95 ℃ 30 s;扩增反应(40个循环),95 ℃ 10 s,60 ℃ 30 s。使用2-△△Ct方法[19]分析目的基因表达数据。
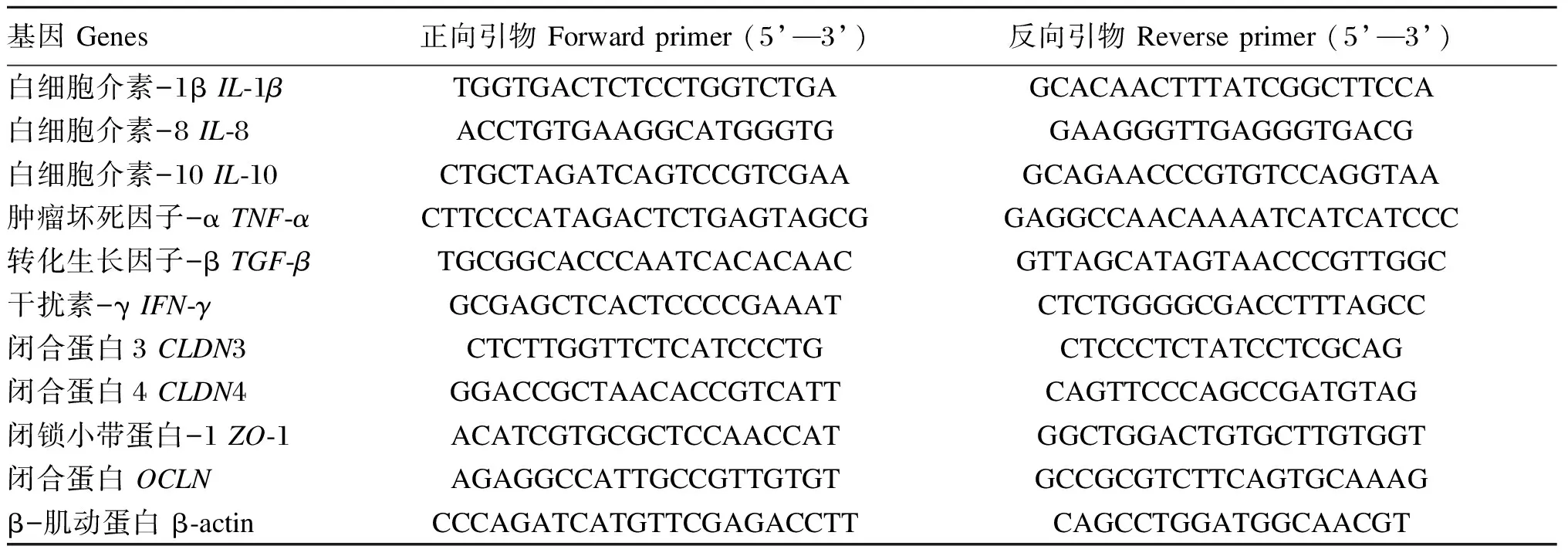
表2 实时荧光定量PCR所用引物序列
1.3.4 肠道菌群检测
采用16S rDNA法对肠道微生物组成进行测定[20]。首先,用QIAampDNA试剂盒(QIAGEN,cat#51504)提取肠道微生物DNA,并扩增16S rDNA的V3~V4区域进行微生物检测。然后,对所得数据进行处理,去除嵌合体后使用USEARCH GLOBAL软件进行生物学信息分析,根据97%的相似性生成操作分类单元(OTU)。最后,使用核糖体数据库项目(RDP)分类器(v.2.2)将每个样本中的OTU分配到不同的分类级别。
1.4 数据处理与统计
对所有数据使用SPSS 18.0软件进行单因素方差分析(one-way ANOVA),结果用平均值±标准差(mean±SD)表示,采用Tukey’s法检验比较组间差异显著性,显著性水平为P<0.05。使用Excel 2003对数据进行相关性分析。
2 结 果
2.1 不同饲料对吉富罗非鱼生长性能的影响
不同饲料对吉富罗非鱼生长性能的影响见表3。罗非鱼摄食饲料14 d后,G2、G3组的WGR和SGR显著低于G1和G4组(P<0.05),并且G1与G4组无显著差异(P>0.05)。而罗非鱼摄食饲料28 d后,G4组的WGR和SGR显著高于G1、G2和G3组(P<0.05),并且G1、G2组之间无显著差异(P>0.05)。

表3 不同饲料对吉富罗非鱼生长性能的影响
2.2 不同饲料对吉富罗非鱼肠道炎症相关基因表达的影响
不同饲料对罗非鱼肠道炎症因子基因表达的影响见图1。罗非鱼摄食饲料14 d后,不同饲料对罗非鱼肠道中IL-1β的表达没有显著影响(P>0.05);G2、G3和G4组肠道中IL-8、IL-10、IFN-γ和TNF-α的mRNA相对表达量与G1组相比均显著上升(P<0.05),且IL-10、IFN-γ和TNF-α的mRNA相对表达量在这3组间无显著差异(P>0.05);G2和G3组肠道中IL-8的mRNA相对表达量显著高于G4组(P<0.05);另外,G2、G3和G4组肠道中TGF-β的mRNA相对表达量与G1组相比显著下降(P<0.05)。罗非鱼摄食饲料28 d后,肠道中IL-1β的mRNA相对表达量各组间无显著差异(P>0.05);G4组肠道中IL-8、IL-10和IFN-γ的mRNA相对表达量显著高于其余3组(P<0.05),而TGF-β的mRNA相对表达量则显著低于其余3组(P<0.05);对肠道中TNF-α的mRNA相对表达量来说,G3组最高,其次为G2组,再其次为G4组,G1组最低,且G2、G3组显著高于G1、G4组(P<0.05),G4组也显著高于G1组(P<0.05)。
2.3 不同饲料对吉富罗非鱼肠道紧密连接蛋白相关基因表达的影响
不同饲料对吉富罗非鱼肠道紧密连接蛋白相关基因表达的影响见图2。罗非鱼摄食饲料14 d后,不同饲料对肠道中CLDN3和OCLN的表达没有显著影响(P>0.05);G2和G3组肠道中CLDN4的mRNA相对表达量显著高于G1、G4组(P<0.05),G4组也显著高于G1组(P<0.05);与G1组相比,G2、G3和G4组肠道中ZO-1的mRNA相对表达量显著降低(P<0.05),且这3组间无显著差异(P>0.05)。罗非鱼摄食饲料28 d后,肠道中OCLN的mRNA相对表达量各组间无显著差异(P>0.05);G4组肠道中CLDN4的mRNA相对表达量显著高于其余3组(P<0.05),而ZO-1的mRNA相对表达量则显著低于其余3组(P<0.05);G2和G3组的CLDN3的mRNA相对表达量显著高于其余2组(P<0.05)。
2.4 不同饲料对吉富罗非鱼肠道菌群组成的影响
罗非鱼肠道菌群属水平组成见图3,从罗非鱼肠道内共检测出12个菌门,优势菌门为梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。
罗非鱼摄食饲料14 d后,肠道菌群中35.21%~48.67%为Fusobacteria、20.04%~36.62%为Proteobacteria、3.08%~13.79%为Actinobacteria,0.01%~16.25%为Bacteroidetes,0.08%~9.53%为Firmicutes。G2和G4组Fusobacteria的相对丰度高于G1、G3组;G3组Bacteroidetes的相对丰度明显高于其余3组;G4组Proteobacteria的相对丰度最高;G1组Actinobacteria和Firmicute的相对丰度高于其余3组。

数据柱标注相同字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。图2同。

图2 不同饲料对吉富罗非鱼肠道紧密连接蛋白相关基因表达的影响
罗非鱼摄食饲料28 d后,罗非鱼肠道菌群中41.99%~95.35%为Fusobacteria,4.23%~24.29%为Proteobacteria,0.07%~17.81%为Actinobacteria,0.06%~6.47%为Bacteroidetes,0~2.01%为Firmicutes。大豆皂苷的添加使G2和G3组罗非鱼肠道菌群中Actinobacteria、Proteobacteria的相对丰度降低,而Fusobacteria的相对丰度上升。G2、G3和G4组Bacteroidetes和Firmicutes的相对丰度明显低于G1组。
另外,随着养殖时间的延长,除G1组外,其余各组罗非鱼肠道菌群中Fusobacteria的相对丰度明显上升;除G2组外,其余各组罗非鱼肠道菌群中Proteobacteria和Bacteroidetes的相对丰度明显下降。
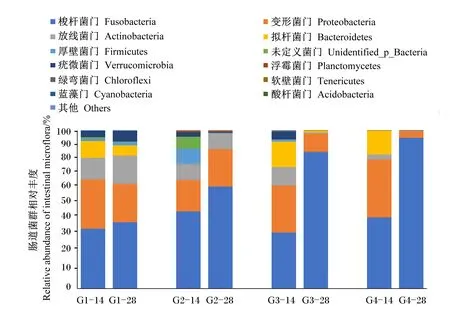
G1-14:G1组第14天;G1-28:G1组第28天;G2-14:G2组第14天;G2-28:G2组第28天;G3-14:G3组第14天;G3-28:G3组第28天;G4-14:G4组第14天;G4-28:G4组第28天。图4同。
罗非鱼肠道菌群属水平组成见图4,共从罗非鱼肠道内共检测出40个菌属,优势菌属为Cetobacterium、Aurantimicrobium、分枝杆菌属(Mycobacterium)、Reyranella和Bacillus。
罗非鱼摄食饲料14 d后,肠道菌群中29.19%~50.11%为Cetobacterium,2.64%~16.62%为Aurantimicrobium,0.12%~6.01%为Mycobacterium,0.11%~15.90%为Reyranella,0.02%~12.81%为Bacillus。G2、G3和G4组Cetobacterium的相对丰度均高于G1组,并且以G4组最高;Mycobacterium、Bacillus、Pseudorhodoplanes和Luteolibacter的相对丰度随着大豆皂苷和豆粕的添加而降低。
罗非鱼摄食饲料28 d后,肠道菌群中32.63%~85.35%为Cetobacterium,0.02%~12.5%为Aurantimicrobium,0.02%~6.70%为Mycobacterium,0.18%~9.22%为Reyranella,0~2.85%为Bacillus。大豆皂苷的添加使罗非鱼肠道菌群中Cetobacterium的相对丰度上升;G2组Reyranella和Mycobacterium的相对丰度明显高于其他3组。
另外,G1、G3和G4组罗非鱼肠道菌群中Cetobacterium的相对丰度随着养殖时间的延长而上升;G1和G2组罗非鱼肠道菌群中Aurantimicrobium的相对丰度随着养殖时间的延长而上升,G3和G4组的变化则相反;随着养殖时间的延长,G2、G3和G4组罗非鱼肠道菌群中Bacillus的相对丰度均呈下降趋势。
2.5 大豆皂苷与吉富罗非鱼肠道炎症相关基因、紧密连接蛋白相关基因以及肠道菌群的相关性分析
图5为大豆皂苷与罗非鱼肠道炎症相关基因、紧密连接蛋白相关基因以及肠道菌群之间相关性分析热图。
在第14天,大豆皂苷添加量与IL-8、IFN-γ、IL-10、CLDN4和OCLN的mRNA相对表达量呈正相关,与IL-1β、TNF-α呈较强的正相关,与TGF-β和ZO-1的mRNA相对表达量呈较强的负相关;大豆皂苷添加量与软壁菌门(Tenericutes)、醋杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)的相对丰度呈较强的正相关,与蓝藻门(Cyanobacteria)、Aurantimicrobium、Reyranella、红杆菌属(Rhodobacter)、包西氏菌属(Bosea)、乔治菌属(Georgenia)、乳杆菌属(Lactobacillus)、布赫纳氏菌属(Buchnera)、鞘脂单胞菌属(Sphingopyxis)、贪铜菌属(Cupriavidus)、产碱杆菌属(Alcaligenes)和粪杆菌属(Faecalibacterium)的相对丰度呈正相关,与Mycobacterium、Bacillus、Pseudorhodoplanes、Luteolibacter、未定义菌属(unidentified_g_Bacteria)、军团菌属(Legionella)、Phreatobacter、小梨形菌属(Pirellula)、微杆菌属(Microbacterium)、Aquicella、生丝微菌属(Hyphomicrobium)、土壤丝菌属(Nocardia)、类诺卡氏菌属(Nocardioides)和土微菌属(Pedomicrobium)的相对丰度呈负相关。

图4 不同饲料对罗非鱼肠道菌群属水平组成的影响
在第28天,大豆皂苷添加量与IL-1β、IFN-γ和CLDN4的mRNA相对表达量呈正相关,与TGF-β、TNF-α、CLDN3和ZO-1呈较强的正相关性,与IL-8和OCLN的mRNA相对表达量呈负相关;大豆皂苷添加量与Bacteroidetes、疣微菌门(Verrucomicrobia)、Firmicutes、Actinobacteria和Chloroflexi的相对丰度呈较强的负相关,与Fusobacteria、Tenericutes和邻单胞菌属(Plesiomonas)、支原体属(Mycoplasma)的相对丰度呈较强的正相关,同时与Rhodobacter、Pseudorhodoplanes、Luteolibacter、unidentified_g_Bacteria、Legionella、林杆菌属(Alsobacter)、Pirellula、Microbacterium、Aquicella、Hyphomicrobium、Pedomicrobium、Methyloversatilis的相对丰度呈较强的负相关,与Bosea、Aurantimicrobium的相对丰度呈负相关。
3 讨 论
3.1 大豆皂苷对吉富罗非鱼生长性能的影响
研究表明饲料中添加大豆皂苷对鱼类的生长性能有不利影响[8,11]。本研究中,在饲养14 d时,饲料中添加大豆皂苷显著降低了罗非鱼的WGR和SGR,生长性能受到不利影响。然而,在饲养28 d时,摄食大豆皂苷的罗非鱼生长性能高于对照组。Chen等[21]用含0.32%大豆皂苷的饲料饲养牙鲆(Paralichthysolivaceus)也发现,饲养28 d后牙鲆的摄食和生长受到显著抑制,而饲养56 d后牙鲆的生长性能及摄食率与对照组无显著差异。这说明大豆皂苷对罗非鱼生长性能的影响与养殖周期密切相关。
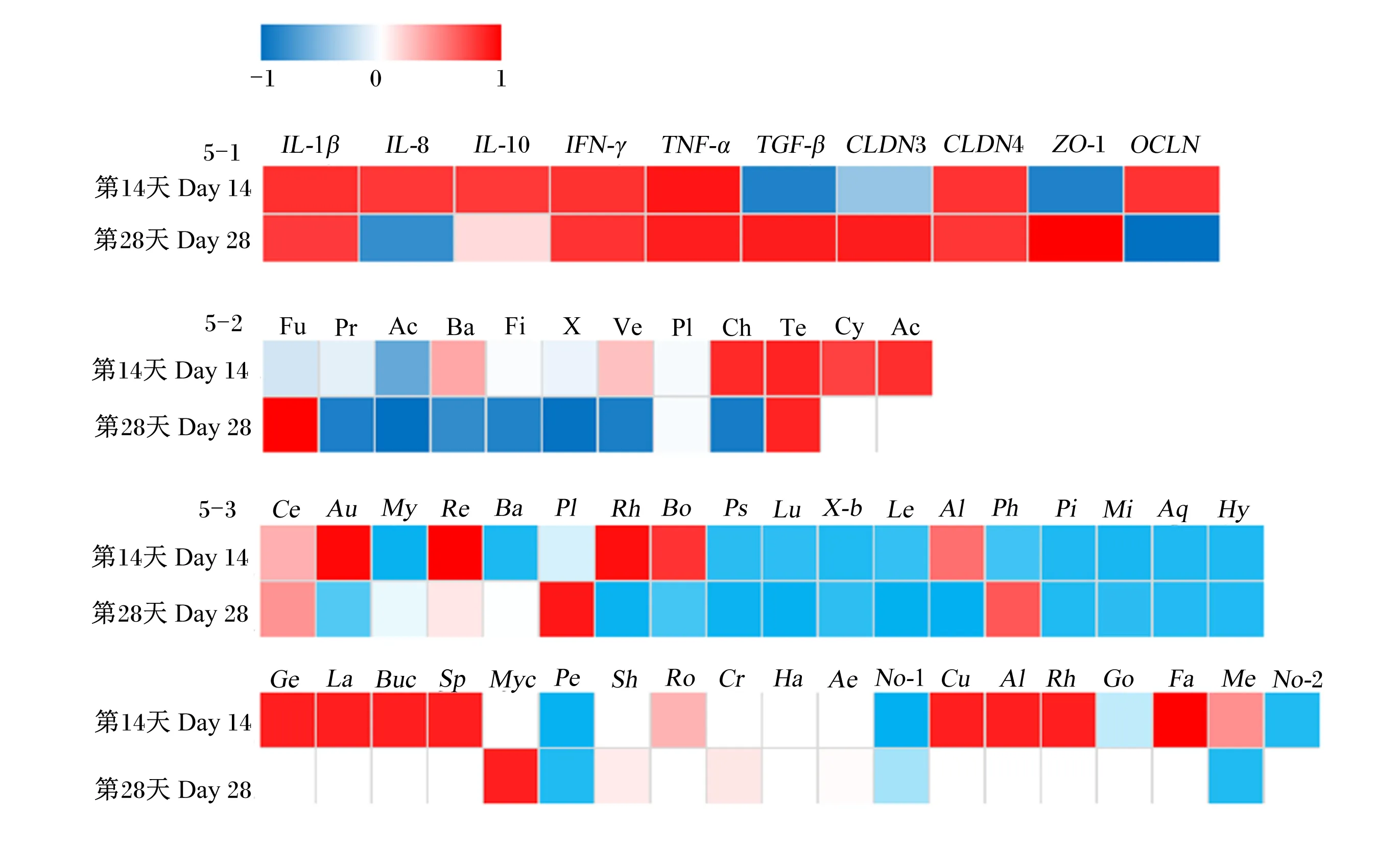
5-1:大豆皂苷与肠道炎症相关基因、紧密连接蛋白相关基因的相关性 the correlation of soyasaponins and intestinal inflammation and tight junction protein related genes;5-2:大豆皂苷与肠道菌群(门水平)的相关性 the correlation of soyasaponins and intestinal flora (phylum level);5-3:大豆皂苷与肠道菌群(属水平)的相关性 the correlation of soyasaponins and intestinal flora (genus level)。
3.2 大豆皂苷对吉富罗非鱼肠道炎症因子的影响
肠黏膜因子是鱼类黏膜免疫系统的重要组成部分,包括白细胞介素(ILs)、干扰素调节因子(IRFs)和肿瘤坏死因子(TNFs)等[22]。研究表明,TNF-α、IFN-γ和IL-8可以诱导体内粒细胞、单核细胞、树突细胞募集到炎症部位,并进一步产生更多的炎性细胞因子,促进炎症反应的发生[23]。作为抗炎因子,IL-10和TGF-β在肠道黏膜免疫反应中也发挥着关键作用[24-25]。当肠道受到炎症应激时,炎性细胞因子基因表达呈现一定程度的变化。例如,饲料中添加豆粕易诱发大西洋鲑肠道炎症,同时TGF-β的基因表达量显著降低[26]。在本试验的第14天,饲料中的大豆皂苷和豆粕均显著上调了罗非鱼肠道中促炎因子基因的表达,包括IL-8、IFN-γ和TNF-α,显著下调了抗炎因子TGF-β基因的表达,并且基因的mRNA相对表达量与大豆皂苷添加量均有较大的相关性。Gu等[27]在饲料中添加大豆皂苷后发现,大豆皂苷显著增加了大菱鲆(Scophthalmusmaximus)幼鱼肠道IL-1β和IL-8的基因表达,在一定程度上损伤了肠道的屏障功能,并进一步诱导了大菱鲆肠炎的发生。这与本研究结果一致,说明罗非鱼摄食大豆皂苷后,肠道中抗炎因子与促炎因子受到显著影响,肠道健康受到损伤,从而对罗非鱼生长产生不利影响。然而,试验第28天时,添加大豆皂苷组罗非鱼肠道IL-8、IFN-γ、ZO-1和CLDN3的mRNA相对表达量与对照组无显著差异CLDN4的mRNA相对表达量显著上升,同时IL-8、ZO-1和CLDN3的mRNA相对表达量与大豆皂苷添加量的相关性与试验第14天时相反,也说明大豆皂苷对罗非鱼肠道健康的影响与养殖周期密切相关。
3.3 大豆皂苷对吉富罗非鱼肠道紧密连接蛋白的影响
一般来说,引起炎症性肠道疾病的重要原因是紧密连接结构受到破坏[28]。肠道紧密连接结构由4种跨膜蛋白[OCLN、闭合蛋白(claudins,CLDNs)、紧密连接黏附分子(JAM)、tricellulin]和胞质分子闭合小环蛋白闭锁小带蛋白(Zos)等组成,在维持肠道上皮细胞旁转运、控制肠道通透性方面发挥重要作用[29]。在本研究中,摄食饲料的第14天,添加大豆皂苷组罗非鱼肠道内紧密连接蛋白ZO-1的mRNA相对表达量与对照组相比显著下降,与大豆皂苷添加量有呈负相关。研究发现TNF-α和IFN-γ可以分别通过MLCK转录[30]和巨噬细胞胞饮作用[31-32]诱导OCLN的内吞,因此在一定程度上加剧了由于大豆皂苷添加而导致的肠道紧密连接的损伤[11],这说明本研究中罗非鱼肠道OCLN的mRNA相对表达量与大豆皂苷添加量一直有较强的相关性。以上结果也表明,随着饲料中大豆皂苷添加量的增加,罗非鱼肠道屏障功能和肠道健康受到的损伤程度更大。
3.4 大豆皂苷对吉富罗非鱼肠道菌群的影响
健康的肠道微生物区系对于促进宿主肠道结构和健康状态至关重要[33]。本研究结果表明,罗非鱼肠道优势菌门为Fusobacteria、Proteobacteria、Actinobacteria、Bacteroidetes和Firmicutes。需要注意的是,本试验中摄食添加大豆皂苷饲料14 d后,罗非鱼肠道中Fusobacteria的相对丰度显著增加,28 d后成为罗非鱼肠道中的主要优势菌门,并且与饲料中皂苷添加量呈现极高的正相关性。据报道,人和大鼠肠道中的拟杆菌属(Bacteroides)和梭杆菌属(Fusobacterium)等能够代谢人参皂苷成分[34-35]。此外,添加大豆皂苷组罗非鱼肠道内Bacteroidetes和Firmicutes的相对丰度降低,在第28天时与大豆皂苷添加量呈现出较大的负相关性,这与在人类炎症性肠病患者肠道内发现的情况[36]相似。杜敏[37]发现,Bacteroidetes中的双歧杆菌属(Bifidobacterium)、Lactobacillus等有益菌可以改善肉鸡肠道菌群结构平衡,维持肠道健康。而Mycobacterium丰度的上升[38]和Bifidobacteria丰度的下降[39]是炎症性肠病(IBD)发生的重要因素。在本研究中,添加大豆皂苷组Mycobacterium的相对丰度显著下降,在第14天与大豆皂苷添加量有较强的负相关性,但在第28天后相关性降低,这说明罗非鱼摄食一定时间的添加大豆皂苷饲料后,其肠道菌群组成发生改变,从而影响肠道健康。Firmicutes是影响免疫的关键微生物区系[40]。Hu等[41]研究发现,饲料中分别添加大豆异黄酮和大豆皂苷后,黄鳝(Monopterusalbus)肠道内Firmicutes和Proteobacteria的丰度均降低。这与本研究结果相似,因此认为大豆皂苷影响了罗非鱼的肠道菌群结构,并可能是导致肠道炎症发生的主要原因。
3.5 豆粕对吉富罗非鱼肠道炎症因子、紧密连接蛋白以及肠道菌群的影响
本研究中添加豆粕饲料中大豆皂苷含量为1.72~2.68 g/kg DM。添加豆粕组罗非鱼肠道中IL-8、IL-10、IFN-γ、TNF-α、TGF-β等基因的表达变化趋势在第14天与添加大豆皂苷组(大豆皂苷含量分别为1.8、3.6 g/kg DM)一致,在第28天的表达变化趋势却与其他3组相反,同时肠道紧密连接蛋白基因的表达变化趋势也是如此,推测这可能是豆粕中其他抗营养因子导致的。据报道,大豆原料中固有的抗营养因子,如蛋白酶抑制因子、大豆凝集素和植酸等,能够通过改变鱼类肠道黏膜形态和通透性,显著降低饲料中蛋白质的利用率[42]。Buttle等[43]研究表明,摄食含大豆凝集素的饲料84 d后,大豆凝集素在大西洋鲑、虹鳟鱼体内能够与肠道上皮细胞结合,从而导致鱼类肠道的病理性变化。本研究表明,随着养殖时间的延长,添加豆粕组罗非鱼肠道菌群表现出相同的趋势,以Fusobacteria为主要菌门,Cetobacterium为主要菌属,同时在门和属水平上肠道菌群多样性均显著降低。本试验中添加豆粕组优势菌门和优势菌属的占比要高于添加大豆皂苷组,菌群多样性低于添加大豆皂苷组。这可能是因为豆粕中其他抗营养因子发挥着与大豆皂苷类似的作用。然而,摄食添加豆粕饲料28 d后,罗非鱼生长性能并没有受到负面影响,其WGR和SGR较对照组显著上升。由此推断,豆粕替代饲料中27%的鱼粉对罗非鱼的生长性能具有促进作用,但对其肠道健康依然有不利影响。
4 结 论
在本试验中,饲料中添加大豆皂苷和豆粕后,吉富罗非鱼肠道中促炎因子TNF-α、IFN-γ和IL-8的mRNA相对表达量显著上调,抗炎因子TGF-β的mRNA相对表达量显著下调,紧密连接蛋白ZO-1的mRNA相对表达量显著下降;罗非鱼肠道菌群中Fusobacteria的相对丰度升高,Bacteroidetes和Firmicutes的相对丰度下降;并且,肠道炎症和紧密连接蛋白相关基因的mRNA相对表达量和菌群的相对丰度都与大豆皂苷添加量有一定的相关性。但随着养殖时间的延长,吉富罗非鱼对大豆皂苷表现出一定的耐受性。豆粕替代饲料中27%的鱼粉(替代57.5%的鱼粉蛋白)对吉富罗非鱼生长性能具有促进作用,但对其肠道健康依然有不利影响。
