宁杞7号枸杞根腐病发生的微生物学机制
2023-01-05高惠惠贾晨波韩琴苏建宇徐春燕
高惠惠 贾晨波 韩琴 苏建宇 徐春燕
(宁夏大学生命科学学院 西部特色生物资源保护与利用教育部重点实验室,银川 750021)
宁夏枸杞是当地的特色支柱性经济产业,几年来栽培面积迅速扩大,传统的种植方式及栽培连作致使枸杞病虫害不断发生,其中根腐病一旦发生,尤为严重[1]。根腐病是一种真菌性土传病害,致病原因复杂多样,病原菌被认为是主要因素之一[2]。据报道,腐霉菌[3]、链格孢[4]、疫霉菌[5]和丝核菌[6]、镰刀菌[7]等均能引起作物患根腐病。病原菌侵入根部引起腐烂,叶部逐渐脱落,直至全株枯死。根腐病在全国的枸杞种植区都有发生,目前从甘肃、青海、新疆等地枸杞发现的病原菌有尖孢镰刀菌、单隔镰刀菌、同色镰刀菌、腐皮镰刀菌、黄色镰刀菌、木贼镰刀菌、疫霉菌和丝核菌[7-9],从宁夏枸杞中发现的病原菌有尖孢镰刀菌、腐皮镰刀菌、同色镰刀菌、串珠镰刀菌、木贼镰刀菌、变红镰刀菌和立枯丝核菌[10-12]。高通量测序技术为全面了解根腐病的发生机制提供了新的视角,从土壤微生物群落角度研究根腐病已被广泛地应用于多种作物中[13]。通过微生物的群落结构及多样性获取与根腐病发生相关的菌群信息将有助于深入了解根腐病的发生机制,但是,多数研究集中于作物的根际微生物上,鲜有研究关注到与根联系最紧密的根表微生物。根表微生物主要是附着在根表面的真菌和细菌[1],其中有益菌与有害菌的“博弈”对于维持健康的土壤生态系统有重要意义[14]。
本研究采集了宁夏中宁县恩和镇枸杞种植区的宁杞7 号枸杞健康株和根腐病患病株的根部样品,拟从可培养真菌和不可培养真菌两个层面研究宁杞7 号枸杞根腐病发生的机制。首先基于Illumina MiSeq 平台进行ITS1 片段扩增子的高通量测序,分析宁杞7 号枸杞健康株和根腐病患病株的根表微生物群落组成。其次采用组织分离法分离腐根上的真菌,并结合形态学与分子生物学特征确定所分离真菌的分类学地位;依据柯赫法则进行进行回接实验验证各类真菌的致病性,确定病原菌;最后本研究将从根表微生物群落结构及病原菌两个角度探究宁杞7 号枸杞罹患根腐病的微生物学机制,为枸杞根腐病的研究提供一定的参考。
1 材料与方法
1.1 材料
采样地为宁夏中宁恩和枸杞种植区(杞泰农业科技有限公司,37°29′N,105°44′E)。选取3 株有明显根腐病症状的宁杞7 号枸杞植株,剖去其根部周围土壤,将病根全部挖出分别收集、编号,用于分离腐根真菌和制备根表样品,3 株即为3 个生物学重复。在同一样地采集3 株宁杞7 号枸杞健康植株的根部,用作对照。所采集的样品及时放入低温冰袋保藏箱,带回实验室暂存于-20℃冰箱。
1.2 方法
1.2.1 根表样品的制备 将枸杞健康根与腐根用无菌剪刀剪成小段,分别置于无菌PBS 溶液中,于4℃、180 r/min 振荡20 min 后取出根组织,再置入新的无菌PBS 溶液中,相同条件下处理20 min。将两次处理后的液体合并、混匀,于10 000 r/min、4℃离心10 min,弃去上清液,沉淀即为根表样品。
1.2.2 根表样品DNA 的提取与扩增子测序 使用DNeasy Power Soil Pro Kit 试剂盒提取根表样品的真菌群落总DNA。检验合格的DNA 送至上海美吉生物医药科技有限公司进行扩增子测序。扩增片段为ITS1 区段,所使用引物为ITS1F 和ITS2R,测序平台为Illumina 公司的Miseq PE300。
1.2.3 腐根真菌的分离纯化 将腐根用无菌剪刀剪成小段(0.5 cm左右)后完全浸入75%乙醇中处理5 s,而后置于次氯酸钠溶液中处理30 s,最后用无菌水冲洗3 遍,处理后的根段用无菌滤纸吸干水分,转接在PDA 培养基中。于28℃恒温培养箱内放置,每天观察,待长出菌落后挑取尖端菌丝进行纯化,多次纯化直至获得纯培养物,所分离的菌株于4℃保存于PDA 斜面上。
1.2.4 形态学鉴定 参照《真菌鉴定手册》,根据菌落的颜色、菌丝形态、生长速率(第5 天时测量直径)、孢子形状等特征进行分类鉴定。
1.2.5 分子鉴定 采用OMEGA 试剂盒进行基因组DNA 的提取,使用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[15]扩增菌株的ITS 序列进行鉴定,使用镰刀菌属特异性引物EF1(5′-ATGGGTAAGGAAGACAAGAC-3′)和EF2(5′-GGAAGTACCAGTGATCATGTT-3′)[15]对初步鉴定为镰刀菌属的菌株(ITS 序列经BLAST 比对相似度不足100%的镰刀菌)进行TEF 序列扩增。PCR 产物均经1%琼脂糖凝胶电泳检测合格后,送至生工生物工程(上海)股份有限公司进行测序。所获取的序列使用NCBI 进行比对,下载参比序列,采用MEGA5.0 软件构建系统发育树。
1.2.6 病原菌的致病性鉴定 采用伤根法和灌根法相结合的方法对目标菌株进行致病性验证。使用灭菌混合土壤(沙土∶营养土∶椰糠=1∶1∶1)于室温移栽宁杞7 号枸杞的一年生植株至直径为30 cm的花盆中,待幼苗生长稳定后接种目标菌株。除去盆栽枸杞根部周围土壤使根部暴露,用灭菌刀片轻轻划伤根皮,将目标菌株的菌悬液浇灌于枸杞根部,每个菌种接种5 盆,接种量为100 mL/盆,用作对照的5 株枸杞采用同样的方法伤根后接入等量的PDB 培养基。保持适当的温度和湿度对其进行常规管理,观察并记录各植株的表型。待植株发病后,挖出腐根用1.2.3 所述组织分离法再次分离并纯化腐根真菌,若再次分离得到所接种的菌株,即确定该菌为宁杞7 号枸杞的病原菌。
1.2.7 数据处理 根据PE reads 之间的overlap 关系,使用FLASH 软件将成对的reads 拼接(merge)成一条序列,同时通过fastp 软件对reads 的质量和merge 的效果进行质控过滤,得到有效序列。使用UPARSE 软件根据97%的相似度对序列进行OTU 聚类,用RDP classifier 进行序列分类注释,Mothur 软件进行Alpha 多样性分析。数据分析用Excel2016 处理,SPSS17 进行显著性分析,所有分析都基于抽平后的数据。
2 结果
2.1 健康株与患病株根表真菌OTU分类及多样性分析
采用高通量测序获得根表样品的原始序列数据,经过质控后得到了6 个样品共350 292 条真菌有效序列,聚类为823 个OTUs,分属于3 门11 纲61 科125 属。对OTU 进行物种分类学注释,患病株和健康株的根表真菌分别分为371 和734 个OTU(图1),其中共有的OTU 数目为261 个,健康株根表真菌特有的OTU 数目是患病株的4.38 倍,提示健康株根表具有更多的真菌种类。

图1 健康株与患病株根表真菌的OTU 韦恩图Fig.1 Venn diagram of rhizoplane fungi in the healthy and diseased plants based on OTU analysis
Alpha 多样性分析表明(表1),所有样品的测序覆盖率均达99%以上,说明所测得的OTU 数量基本能反映样品的真实情况。与患病株相比,健康株根表真菌的Simpson 指数较低,Shannon 指数较高(Simpson 指数值越小,Shannon 指数值越大,群落多样性越高),表明患病株根表真菌群落的多样性水平低于健康株。健康株根表样品的Sobs 和ACE 指数均显著高于患病株(P<0.05),表明患病株根表真菌群落的丰富度水平也显著低于健康株。

表1 根表真菌的Alpha 多样性Table 1 Alpha diversity of rhizoplane fungi of the healthy and diseased plants
2.2 健康株与患病株根表真菌的群落组成
门水平上(图2-A),患病株与健康株根表真菌群落组成基本一致,但相对丰度差异较大。与健康株相比,患病株根表真菌中子囊菌门(Ascomycota)的相对丰度较高,占比达97.81%,而担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)的丰度则较低。
属水平上(图2-B),将两组样品中相对丰度大于1%的真菌群落剔除unclassified 后进行分析,发现患病株根表真菌群落中的5 个优势属(丰度>1%)占比高达82.83%,分别为镰刀菌属(Fusarium)、粘帚霉属(Clonostachys)、小不整球壳属(Plectosphaerella)、假裸囊菌属(Pseudogymnoascus)和被孢霉属(Mortierella);健康株根表真菌群落中的优势属(丰度>1%)也有5 个,总占比仅为31.10%,分别是被孢霉属、镰刀菌属、地丝霉属(Geomyces)、链格孢属(Alternaria)和土赤壳属(Ilyonectria)。可以看出,健康株与患病株根表真菌的群落结构差异很大,其中差异最大的是Clonostachys,在健康株根表的丰度只有0.14%,而在患病株根表的丰度却高达31.24%。差异较大的类群还有Fusarium(10.38%和38.81%)、Mortierella(14.09% 和1.86%)、Plectosphaerella(0.90% 和6.24%)、Pseudogymnoascus(0.23% 和4.11%)以及Geomyces(4.37%和0.06%)。患病株根表Fusarium、Plectosphaerella、Pseudogymnoascus的丰度分别比健康株根表高2.74 倍、5.93 倍和16.87倍,而Mortierella和Geomyces丰度分别低86.80%和98.63%。相较而言,Ilyonectria和Alternaria在两组样品中的丰度差异较小。
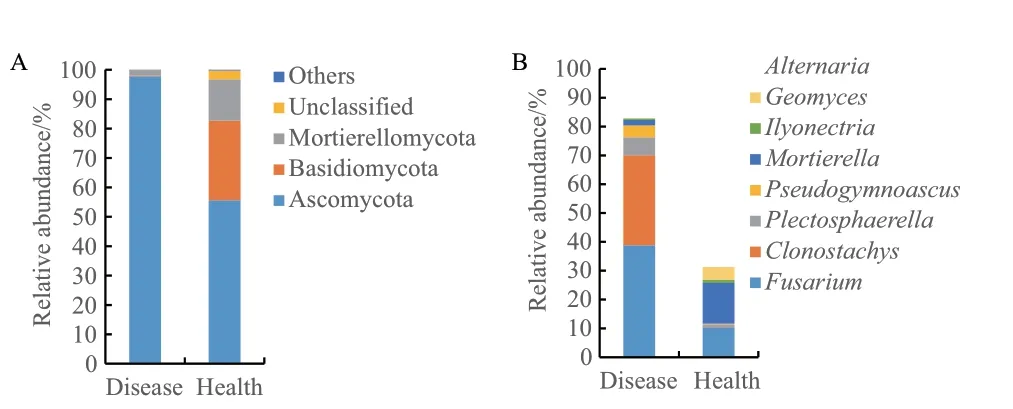
图2 健康株和患病株门水平(A)和属水平(B)上根表真菌的组成与相对丰度Fig.2 Composition and relative abundance of rhizoplane fungi at the phylum(A)and genus(B)levels of healthy and diseased plants
2.3 腐根真菌的形态学鉴定
从3 个腐根样品中共分离纯化到33 株真菌,据形态学观察初步分为四大类。第一类(QT116和QT320):菌落墨绿色,菌丝呈从状着生,梗顶端多次分枝,分生孢子圆形,初步鉴定为青霉属(Penicilliumsp.);第二类(QT201 和QT207):菌落白色厚绒花瓣状,产明黄色色素,生长缓慢,培养5 d 后直径为2.7 cm 和3.0 cm,分生孢子梗分枝较多,分生孢子梭形,未确定种属;第三类(QT209、QT311、QT312 和QT317):菌落红褐色,无大孢子,小孢子杆状或卵圆形,未确定种属;第四类:菌落和孢子形态特征与镰刀属较为一致,初步鉴定为Fusariumsp.。
对Fusariumsp.进一步形态分类鉴定发现:QT104、QT107、QT109、QT115、QT119、QT126、QT302、QT303、QT321 和QT324 菌落白里透紫,绒毛状较厚,大孢子纤细,两端较尖,小孢子卵圆形,与尖孢镰刀菌(F.oxysporum)形态一致;QT106、QT108、QT120、QT121、QT123、QT125、QT127、QT128、QT130、QT204、QT307、QT310、QT316、QT318 和QT322 菌落白色,毡状较稀疏或菌落土黄色,卷羊毛状,大孢子镰刀状,两端钝圆,小孢子椭圆形,和腐皮镰刀菌(F.solani)形态一致。各类代表性菌株的菌落形态及显微形态如图3。

图3 代表性菌株的菌落形态及显微形态Fig.3 Colony morphologies and microscopic morphologies of representative strains
2.4 基于ITS和TEF序列的系统发育分析
基于ITS 序列构建的系统发育树(图4)显示:QT201 和QT207 与粉红粘帚霉(Clonostachys rosea)聚为一支,置信度为100%;QT116 和QT320 与Penicilliumsp.聚为一类;QT209、QT311、QT312 和QT317 与红贝俄氏孔菌(Earliella scabrosa)聚为一支,亲缘关系近,置信度为99%;QT104、QT107、QT109、QT115、QT119、QT126、QT302、QT303、QT321、QT324 与Fusarium oxysporum聚为一支,置信度为100%;其余15 个菌分别与F.solani聚为一类,置信度均大于98%。

图4 基于ITS 基因序列构建的系统发育树Fig.4 Phylogenetic tree based on ITS gene sequences
基于TEF 序列构建的镰刀菌的系统发育树(图5)共分两大支,分属为F.oxysporum和F.solani,其鉴定结果与ITS 序列的鉴定结果一致。测序所得菌株序列已全部上传至GenBank,ITS 序列登录号为OL744574-OL744604 和OL744606-OL744607;TEF序列登录号为OL799141、OL799143-OL799147、OL799149-OL799159。

图5 基于TEF 基因序列构建的镰刀菌的系统发育树Fig.5 Phylogenetic tree of Fusarium based on TEF gene sequences
综上,共从宁杞7 号腐根样品中分离到33 株真菌,经分子生物学和形态学鉴定,分属于镰刀菌属、青霉属、多孔菌属和粘帚霉属4 个属,从中选择菌株F.oxysporumQT104、F.solaniQT204、Penicilliumsp.QT116 和QT320、E.scabrosaQT312、C.roseaQT201 六个代表性菌株进行回接实验,用于致病性验证。
2.5 致病性鉴定
回接实验显示,菌株QT104、QT204 和QT201接入后宁杞7 号枸杞植株出现根腐病类似症状,而菌株QT116、QT320 和QT312 接入后均未使枸杞患病。接入F.oxysporumQT104 和F.solaniQT204 25 d后,植株叶尖变黄、卷曲,随着时间推移,叶片从失绿变褐到叶片少量变枯,最后枯萎或大量叶片脱落。将全部根从盆栽中刨出后发现其根部变黑腐烂,皮层脱落,只剩木质部,侧根处有少量白色菌丝附着。接入C.roseaQT201 的植株病害程度相对较轻,但延长时间后也出现上述症状(图6)。采用组织分离法将发病植株的腐根进行再次分离纯化(图7),并进行形态学、分子生物学水平的鉴定,鉴定结果均与所接入的F.oxysporum、F.solani一致,符合柯赫法则,故将F.oxysporum、F.solani确定为宁杞7 号枸杞的根腐病病原菌。而接入C.roseaQT201 的枸杞植株,虽出现根腐病症状,但未能从腐根上再次分离出C.rosea,故尚无法完全确定C.rosea是否为宁杞7 号枸杞的根腐病病原菌。

图6 接种3 种菌株25 d 后枸杞根腐病的发病症状Fig.6 Symptoms of L.barbarum root rot 25 d after inoculation with 3 strains

图7 接种3 种菌株25 d 后发病枸杞的腐根真菌再分离Fig.7 Re-isolation of root-rot fungi from L.barbarum 25 d after inoculation with 3 strains
3 讨论
本研究从根表微生物群落结构及病原菌两个角度出发,探究宁杞7 号枸杞罹患根腐病的微生物学机制。在枸杞腐根组织中共分离出15 株F.solani、10 株F.oxysporum、4 株E.scabrosa、2 株C.rosea以及2 株Penicillium,除E.scabrosa外均属于子囊菌。子囊菌是患病株根表的绝对优势门,相对丰度为97.81%,它的营养方式为腐生、寄生和共生,含有许多有害菌属,能引起植物患病[16]。其中Fusarium是农业生产中危害最重的病害真菌类群之一,是报道次数最多的病原菌,常引起植物患根腐病[7-12]。Fusarium也是患病株根表的最优势属,相对丰度为38.81%,在可培养真菌中Fusarium的分离频率也是最高的。所有菌株经柯赫法则验证后,确定枸杞根腐病病原菌为F.solani和F.oxysporum。尖孢镰刀菌(F.oxysporum)被列为世界上第五大植物病原真菌[17],其寄主范围广泛;腐皮镰刀菌(F.solani)也是世界上最具破坏性的土传病原菌之一[18]。F.solani和F.oxysporum对枸杞的致病性在1994年王国珍[10]对根腐病病原菌的研究中已被证实,2021年陈思杰等[12]再次证实了F.oxysporum能使枸杞患根腐病但未分离到F.solani,且F.oxysporum在两个报道中均为最优势的类群(分离频率最高)。在前人的研究中,F.oxysporum对枸杞的危害甚于F.solani,而本研究发现两种病原菌中F.solani的分离频率(45.45%)远高于F.oxysporum(30.30%),与王国珍和陈思杰的研究有所不同。本研究中所选用的枸杞为宁杞7 号栽培种,该品种是2010年选育出的无性系新品种,随后被逐渐推广[19],其栽培历史较短,研究结果所呈现出的差异是否因枸杞品种不同所致,值得深入探究。Clonostachys在患病株根表的相对丰度位列第二,为31.24%,但在健康株根表中的相对丰度仅有0.14%,推测它可能是与根腐病发生相关的真菌类群。关于Clonostachys是否会引起植物患病并没有统一的认识,Haque[20]和Afshari[21]研究发现其可导致甜菜和蚕豆发生根腐病,而吴海霞、Mudassir 等[22-23]发现它是一种真菌寄生真菌,能够抑制产生真菌毒素的镰刀菌,可作为生防菌开发。本研究发现菌株C.roseaQT201 和QT207 在进行致病性验证时不符合柯赫法则,暂不能被确定为枸杞病原菌,后续的相关研究还在进行中。
在健康株根表真菌群落中发现Ascomycota 也是最优势门,比例超过50%,Fusarium的相对丰度也达10%。为什么健康株根表存在大量镰刀菌却未患病?这可能与枸杞根表的微生物群落结构有密切的关系。比较患病株与健康株的根表真菌群落Alpha多样性发现,患病株根表真菌群落多样性和丰富度水平均低于健康株,与谢玉清[16]和Tan 等[24]对作物土传病害植株根区土壤真菌群落的研究结果一致,这可能是发生根腐病的一个重要标志。另外,患病株根表富集着大量的Fusarium和Clonostachys,二者丰度和占比达70.05%,可见菌群比例严重失衡,破坏了原有健康的群落结构。相较患病株而言,健康株根表真菌群落组成更为丰富,虽然存在镰刀菌,但其益生菌Mortierella作为最优势属,与病原菌平衡对峙,使微生态环境趋于稳定。而Mortierella在患病株根表中的相对丰度只有1.06%,在生态位、资源竞争中处于劣势,被Fusarium以绝对优势压制。因此,微生物菌群比例的失衡以及多样性的改变也是引起根腐病的主要因素,平衡健康的微生物群落结构可能是其抵御病原菌的策略之一。
4 结论
宁杞7 号枸杞根腐病患病株根表的真菌群落丰富度及多样性均低于健康株,微生物群落组成已严重失衡。从患病株腐根上分离的33 株真菌归 为Fusariumsp.、Penicilliumsp.、Earliellasp.和Clonostachyssp.四个属。经柯赫法则验证后,确定了宁杞7 号枸杞根腐病的2 种病原菌F.solani和F.oxysporum。本研究从根表微生物群落结构与病原菌两个角度揭示了宁杞7 号枸杞根腐病的发生不仅与病原菌有关,也与群落结构失衡密切相关。