质谱成像新基质及其在分析生物样本方面的研究进展
2023-01-05苗玉娇朱龙佼许文涛
苗玉娇 朱龙佼 许文涛
(中国农业大学营养与健康系 食品精准营养与质量控制教育部重点实验室,北京 100193)
典型的MALDI-MSI 工作流程分为三步:制作组织切片、采集质谱数据、分析成像数据。在MSI 技术的实际应用中,质谱的扫描速度越快,相应的就要付出分辨率越低的代价,故而快速、高特异性、高空间分辨率和高灵敏度往往不能同时实现。虽然质谱扫描速率、空间分辨率和灵敏度主要由质谱硬件仪器决定,但适当的组织准备工作和高效的离子化技术也是MSI 获取高质量数据的关键。在过去的几十年中,MSI 技术不断发展创新,包括新的实验工作流程、改进的电离和采样方法、空间和质量分辨率的进步、更可靠的数据处理方式以及强大的数据分析软件的开发。本综述将重点关注MALDIMSI 中新型基质的开发,并总结一些新型MSI 技术的最新应用和进展。最后,展望了MSI 技术的发展方向——单细胞水平化、绝对定量化、仪器便携化(图1)。

图1 图文摘要Fig.1 Graphical abstract
1 MALDI 新型基质的开发推进生物样本的MSI
在MALDI-MSI 中,需要先在组织切片上沉积一层基质以在基质和样品之间形成共结晶。基质通过吸收紫外或红外激光能量被电离,同时提供羽流将分析物解吸到气相,通过将电荷或活性离子转移到分析物上而将其电离。由于可以保护分析物免受直接激光照射,基质在MALDI-MSI 中起着至关重要的作用,选择合适的基质和合适的沉积方法可以避免丢失分析物或其他耗时的组织制备步骤。目前,一些针对蛋白质、脂质、碳水化合物的2,5-二羟基苯甲 酸(2,5-dihydroxy benzoic acid,DHB)[2]、α- 氰基-4-羟基肉桂酸(α-Cyano-4-hydroxycinnamic acid,CHCA)[3]和芥子酸(sinapic acid,SA)[4]等常规小分子有机基质在目前已得到广泛应用[5]。且已经证明可以通过将吸电子基团加入到一些传统基质的核心结构中来提高其性能,如通过用氯原子取代CHCA 的羟基从而获得4-氯氰基肉桂酸(4-chloroalpha-cyanocinnamic acid,Cl-CCA),这种新型基质可以有效提高标准蛋白质胰蛋白酶消化的灵敏度[6]。
但总的来说,上述常规基质材料存在背景高、选择性弱、对小分子物质(<600 Da)的电离效果差等问题,从而促进了研究者们对新型基质的开发,包括有机小分子基质和无机纳米材料(表1)。这些新型基质一般具有共晶小、信号响应低、离子抑制低、耐盐性好等特征。

表1 近几年应用在MALDI-MSI 中的新型基质汇总Table 1 Summary of the novel matrixes used in MALDI-MSI in recent years
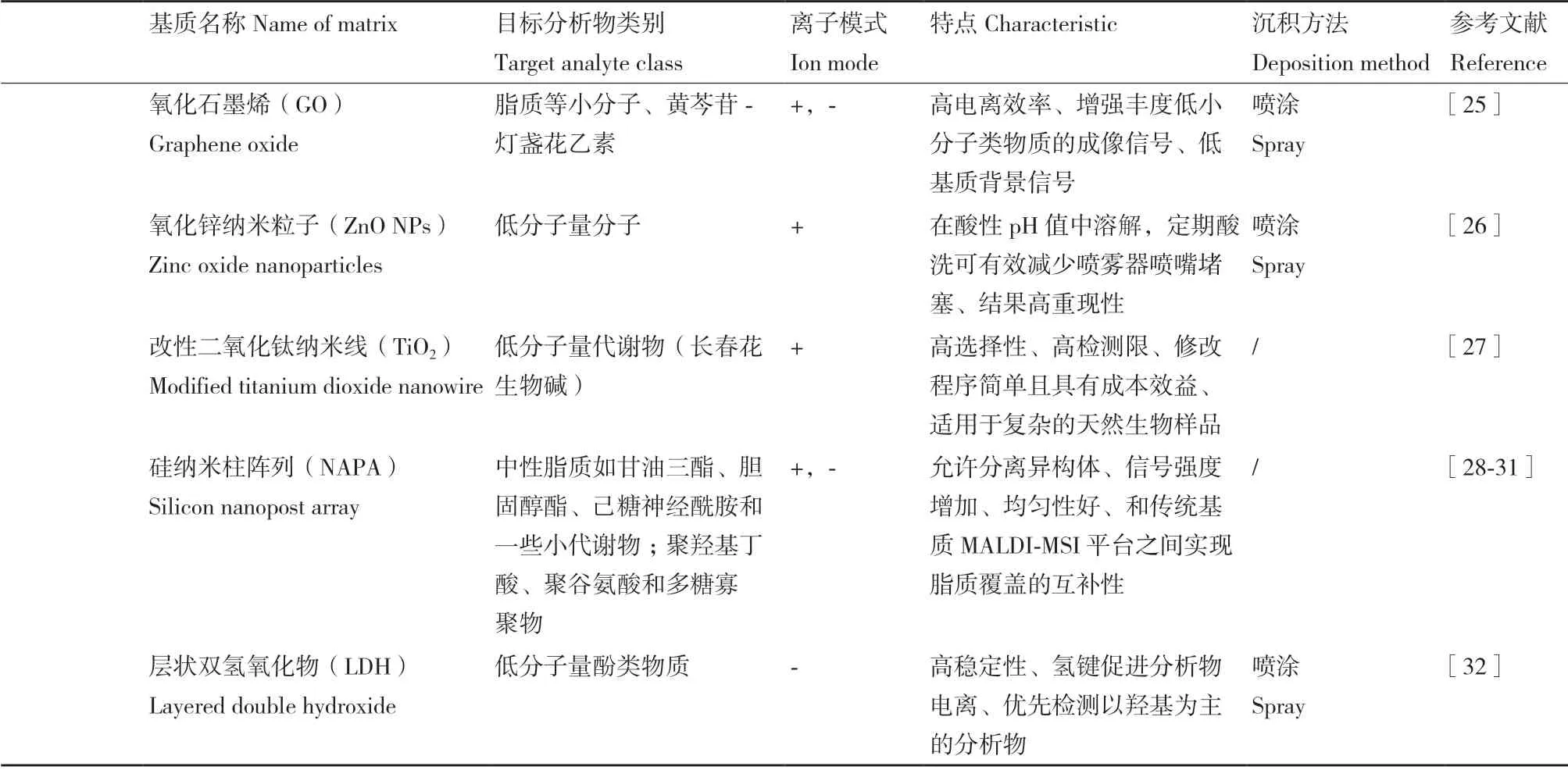
续表Continued
1.1 新型有机小分子基质
已经有相关综述[33-34]总结了一些已被开发用于 MALDI-MSI 的新型有机小分子基质,如烷基化2,5-二羟基苯甲酸、1,8-二(哌啶基)-萘和4,5-(双(二甲氨基)萘-1-基)呋喃-2,5-二酮(4-马来酸酐质子海绵)等,本文仅选择近5年来关于MALDI的新型有机小分子基质在生物组织MSI 中的最新研究成果进行综述。
Enomoto 及其研究团队[18]使用1,5-二氨基萘(1,5-diaminonaphthalene,DAN)作为MALDI-MSI 的基质在负离子模式下检测成熟草莓果实中的原花青素及其单体,实现了不同类的B 型原花青素在草莓组织中独特的空间分布的可视化,进一步阐明了类黄酮类化合物的生物学作用。此外,也有将以DAN作为基质的MALDI-MSI 和其他成像技术联用以对单个脑组织切片中的脂质分子进行多模态化学成像的报道出现[19]。
基于CHCA 和三联噻吩这两种常用基质分别用于检测不同类别分子的特性,Yerra 等[20]提出了一种“包含两者有效电离官能团的分子可以同时作为质子和电荷转移基质”的假设,并成功合成了2-氰基-3-(2-噻吩)丙烯酸(2-cyano-3-(2-thienyl)acrylic acid,CTA)基质,结果成功用于分析各类化合物如脂质、肽、蛋白质、糖类、天然产物、高分子量聚乙二醇(polyethylene glycol,PEG)和有机金属等,与其他常规基质相比,所有使用CTA 研究的分析物的质谱都显示出高信噪比和高分辨率,能将以前难以电离的较低浓度的高分子量PEG(>40 kD)阳离子化,并且CTA 还可以在MALDI-MSI 实验中提供组织表面的完整轮廓。总的来说,相对于一直以来的使用特定基质来分析特定类别的分析物,CTA 可以用作分析大多数类别化合物的通用基质。
3-氨基邻苯二甲酰肼(3-aminophthalhydrazide,3-APH,又称鲁米诺)是一种非常有效的化学发光底物。Li 等[10]根据固态紫外吸收、离子产率和种类以及双极性检测对5 种候选MALDI 新基质进行了评估,得到了3-APH 及其钠盐能够比其他几种候选物更好地检测内源性代谢物的结论,在正/负离子模式下结合了傅里叶变换离子回旋共振(fourier transform ion cyclotron resonance,FTICR)的MALDIMSI 实验中分别对159 和207 种小鼠的脑代谢物在组织上实现了无标记原位成像,从而展示了3-APH作为一种MALDI 新型基质在定位脑疾病生物标志物方面的应用前景。
在保证教学过程完整,体现素质教育教学观念和树立终身体育思想基础上,按照教学目标,创造出多种教学模式。同时,学校应改进评价内容和方法,由单一的评价内容与方法向综合考评内容与方法转变,促进学生的多方面发展。
尽管上述许多新型有机小分子基质仍未设计用于更广泛的应用,但其在许多方面均表现出优于传统基质的结果,如真空稳定性、检测灵敏度、分子覆盖度、耐盐性、基质背景信号、离子抑制和晶体形成等[35],证明了新型基质具有提高MSI 图像质量和扩展MALDI-MSI 应用领域的潜力。
1.2 无机纳米材料基质
目前,一些无机纳米材料已被开发用来作为MALDI-MSI 的新型基质,材料包括金、银、硅、碳(石墨烯、氧化石墨烯、碳纳米点等)和金属氧化物纳米材料等。
金纳米粒子(gold nanoparticles,AuNPs)已被证明可以实现肽、胆汁酸、碳水化合物、类固醇和其他脂质的原位可视化。已经发表了具有各种分析物相互作用的AuNPs 的多种应用,AuNPs 增强的组织成像现已能实现100 μm 的横向空间分辨率[36]。聚乙烯吡咯烷酮封端的银纳米粒子(silver nanoparticles,AgNPs)可以通过选择性银阳离子化来提高含有 π 键的分析物的电离效率。基于此,Guan 等[24]使用聚乙烯吡咯烷酮封端的AgNPs 作为基质的MALDI-FTICR-MS 对小鼠或大鼠的大脑动脉闭塞模型进行可视化处理,改进了对脂肪酸、甘油脂等多种类脂质以及一些小分子代谢物的综合分析,对各类脂质分子在大脑组织中的异质性分布提供了新见解。
碳材料,包括富勒烯、碳纳米管、石墨烯(graphene,G)、氧化石墨烯(graphene oxide,GO)、碳纳米点(carbon dots,CDs,又称碳点)、纳米金刚石、纳米纤维和纳米角,它们在激光波长下的强光吸收以及其他独特的物理和化学特性,可以有效地辅助MALDI 过程。与经典有机基质相比,G 和GO 可简化样品制备、消除基质背景离子的干扰并提高每次实验的重现性[37]。Wang 等[25]通过基于GO和咖啡酸(caffeic acid,CA)二元基质的MALDIMSI,对一种中药黄芩苷——灯盏花乙素及其代谢物在肾组织切片中的原位空间分布进行了可视化。这种二元基质(GO/CA)显著提高了灯盏花乙素及其代谢物的检测效率,在组织切片上具有较高的灵敏度和选择性。CDs 是一类新兴的碳材料基质,极细微粒,几乎各向同性,生物相容性好且易于后修饰[38]。Cai 等[39]探究了N、S 掺杂的碳点在鼠组织中双酚S 成像中的应用。得益于CDs 极小的粒径,该研究的成像分辨率达50 μm,且双酚S 的检出限低至pmol。
此外,硅纳米柱阵列(silicon nanopost array,NAPA)已经被证明可以增强使用传统有机基质难以检测的特定脂质类别的电离,尤其是在存在磷脂酰胆碱,例如磷脂酰乙醇胺和甘油三酯的情况下[31,40]。在最新报道的研究中,Laith 等[29]还使用基于NAPA 基质的激光解吸电离质谱成像平台(NAPA-LDI-MSI)和传统 MALDI-MSI 平台对大豆根瘤组织切片中特殊的生物聚合物聚羟基丁酸、聚谷氨酸和多糖的低聚物进行原位检测和无标记分子成像。结果显示,在NAPA-LDI-MSI 中,低聚物离子的平均信号强度比不同基质不同离子模式的几种MALDI-MSI 平台高出约7-65 倍。
虽然目前已经开发出了一系列新型无机材料基质应用于MSI 技术,但这些材料同时也存在着诸般问题。如对于无机碳材料来说,其在水或有机溶剂中的溶解性较差,难以均匀地沉积在样品上,且在真空下高浓度的碳材料可能会从目标板逸出导致仪器污染。虽然将纳米颗粒溅射到动植物组织切片上可以使生物分子成像成为可能,但同时也存在着如何溅射出具有一致尺寸的纳米粒子和必要设备的可用性的问题。并且,目前我们对纳米颗粒的电离机制尚未完全了解,这些未解决的问题和谜团亟待研究者们更进一步地深入研究。
2 不同的离子化技术助力生物组织的MSI
除了MALDI 这种被最广泛地应用于MSI 的离子化技术外,二次离子质谱技术(secondary ion mass spectroscopy,SIMS)和常压敞开式离子化技术(ambient mass spectrometry,AMS)的发展也十分迅猛,扩大了MSI 的应用范围。表2从灵敏度、分辨率等方面对MSI 中常用的几种离子化的方式进行了比较。下面简要介绍这些离子化技术的原理以及在生物组织的MSI 方向的最新应用。

表2 3 种MSI 方法的对比Table 2 Comparison of three methods of MSI
2.1 二次离子质谱技术
二次离子质谱(SIMS)的原理是在真空条件下利用高能初级离子束撞击样本表面使样品表面分子离子化为次级离子,再使用质量分析器根据不同的质荷比(mass-to-charge ratio,m/z)将其分离,随后离子到达检测器产生质谱图。使用初级离子束逐像素扫描样品表面并记录光束的位置,即可在扫描区域内构建每个离子信号强度的彩色图,从而获得可以显示离子在样品表面分布情况的离子图像[41]。此外,还可以从一系列连续的二维离子图像中进行三维重建,从而使样品表面下方的分子的分布可视化。
目前,SIMS 有两个主要平台,即飞行时间二次离子质谱(time of flight secondary ion mass spectrometry,TOF-SIMS)和纳米级SIMS(nano SIMS),它们能够分别在单细胞和细胞器水平上对不同类型的生物分子进行成像。同时,可用于SIMS 分析的生物组织样品很多,包括各类动植物器官切片以及其他仿生生物结构体系等[42]。面对检测样品的复杂化和检测要求的多样化,近年来还出现了许多具有串联、混合式质量分析器的SIMS 仪器,如Passarelli 等[43]开发出的具备TOF-Orbitrap 混合质量分析器的SIMS设备,称为3D-OrbiSIMS,它具有在保持SIMS 微米至亚微米级空间分辨的优势下兼具Orbitrap 质量分析器的强大物质鉴定能力,是目前最先进的SIMS 系统之一。
与其他质谱成像技术相比,SIMS 拥有目前质谱成像技术中最高的空间分辨率(100 nm)。但由于其初级离子束能量较高,破坏力较强,易产生碎片离子,所测的质量范围较小,当分析物的分子量超过2 000 Da 时灵敏度显著降低,因此更适用于小分子物质和样品表面元素的质谱成像分析。研究发现,通过在组织样本表面喷涂一薄层金属原子或者化学基质,形成基质增强型SIMS[44],可以有效扩大SIMS 的检测范围并提高其灵敏度,目前已成功用于脂质、多肽等生物分子的成像研究。
2.2 常压敞开式离子化技术
上述MALDI 和SIMS 是两种重要的MSI 方法,然而两者(除去大气压MALDI)都需要在真空环境中进行。为了克服这一挑战,2004年首次发表的解吸电喷雾电离质谱分析(desorption electrospray ionization mass spectroscopy,DESI MS)技术,使得样品无需预处理或仅需简单的前处理即可在常压条件下从各种载物的表面直接对固相或凝固相样品进行原位分析[45],提高了质谱分析速度以及检测通量。这一突破性技术大大简化了分析过程,从而产生了多种常压敞开式原位电离技术,加速了原位MSI 技术的发展。Javanshad 和Venter[46]还将原位电离的定义从经常被吹捧的“无样品制备”更新为通过电离和分析步骤实时进行近端样品制备加工,并提出了一种新的原位电离质谱技术分类方案。
目前,应用于MSI 的常压敞开式离子化技术主要可分为以下3 类:基于激光(laser-based)、基于等离子体(plasma-based)和基于电喷雾(spraybased)的电离技术。基于激光辅助解吸的离子化技术,包括常压基质辅助激光解吸电离(atmospheric pressure matrix-assisted laser desorption ionization,AP-MALDI)、激光刻蚀电喷雾电离(laser ablation electrospray ionization,LAESI);基于等离子体的离子化技术,包括实时直接分析(direct analysis in real time,DART),低温等离子体探针(low temperature plasma,LTP)等;基于电喷雾的离子化技术有:解吸电喷雾电离(DESI)、液体萃取电喷雾电离(liquid extraction electrospray ionization,LEESI)等。其中,在MSI 实验中最常用的是DESI 技术,这是对样品破坏性最小的环境电离质谱组织成像方法之一,已被广泛开发为用于分离各种组织病理学类别的组织区域以用于诊断应用的工具,并越来越多地被应用到揭示体内药物分布的独特模式、发现潜在可治疗的生化途径、揭示新的可药物靶点上[47]。
对于DESI-MSI,样品的离子化具体过程为施加有一定高电压的喷雾溶剂从毛细管喷出,在外侧雾化管所喷出的高速气流的作用下雾化形成带电的液滴,液滴加速作用于载体的样品表面并溅射出溶解有多种分子的次级带电液滴。次级液滴的溶剂快速蒸发,电荷转移到待测分子使其形成气态样品离子,离子再通过离子传输管进入质谱分析器而被检测。在最近的报道中,Marta 等[48]使用 DESI-MSI 对透明细胞肾细胞癌的代谢特征(游离脂肪酸、代谢物和复合脂质)进行成像和化学表征,结果证明了DESI-MSI 可以根据代谢特征的变化实现对肾细胞癌的快速诊断。而在另一项研究中,Yang 等[49]的团队在脂质组学水平上成功构建了一种将DESI-MSI 与套索回归模型(least absolute shrinkage and selection operator,LASSO)相结合的分子诊断模型,成像结果清楚地描绘了肿瘤和正常组织的空间分割,不仅能够准确区分口腔鳞状细胞癌手术不同切缘状态,还能对口腔癌手术安全切缘距离进行个性化测量。
虽然DESI-MSI 在对小分子化合物成像时具有显著的优势,但DESI 空间分辨率较低,一般100-200 μm,尽管通过优化溶剂组成及流速可以将分辨率提高至12 μm,但其与SIMS 和MALDI-MSI 相比仍有一定差距;此外,由于蛋白质大分子和非极性物质较难解离,DESI 对此类物质的灵敏度相对较低。这些不足限制了DESI 在更多领域的应用。基于此,已经开发了一系列DESI-MSI 的变体技术,如纳米DESI-MSI、气流辅助解吸电喷雾电离质谱成像(air flow-assisted desorption electrospray ionization mass spectrometry imaging,AFADESI-MSI)等以扩大DESI在生物组织成像方面的应用。
2.3 离子淌度技术与MSI联用
离子淌度谱(ionic mobility spectroscopy,IMS)是一种快速的气相分离技术,其原理是带电离子进入含有淌度气体的淌度池后,由于质荷比、分子形状和带电荷数的不同,使离子跟碰撞室内的淌度气体的碰撞截面积(collision cross section,CCS)不同而实现分离。经过淌度分离,可以得到离子的漂移时间和CCS,从而进行对离子形状的判断及定性分析。将IMS 与MS 联用,在质量分析之前对具有相同或相似质荷比的离子进行有效分离,可以获得一个新的数据维度,增强了异构体分离、扩大了分子覆盖范围、提高了信噪比以及准确观察分子空间分布和定位的能力[50]。
目前,IMS 已与上述的MALDI、DESI、LAESI等多种MSI 技术集成,并成功用于生物样本中小分子代谢物、药物分子和脂质的原位成像[50-51]。如Fu等[52]使用MALDI-IMS-MSI 方法对淡水甲壳类动物组织切片中的等压/异构脂质进行原位成像和鉴定,首次成功展示了3 种同量异位脂类在m/z为782.561处的明显分布。Towers 及其研究团队[53]利用DESI结合行波离子淌度谱(travelling wave ion mobility spectrometry,TWIMS)直接对大鼠组织切片中的蛋白质和肽进行成像,与常规DESI-MSI 相比,DESITWIMS-MSI 能够分离高度复杂的重叠信号,显著提高了信噪比和成像分辨率(150 μm)。还有研究者描述了一种通过LAESI-IMS-MS 直接分析和成像贴壁哺乳动物细胞中小分子代谢物和脂质的方案[54],通过结合IMS,可以在同一次LAESI 采集中分别提取和分离与背景、洗涤缓冲液和细胞信号相关的光谱特征。随着技术不断发展,IMS-MS 成像的前景一片光明,该技术强大的分离能力和越来越高的分辨率能够给研究人员带来关于生物样本的更详细的信息。
3 数据处理新方法助推生物组织的MSI
数据分析是MSI 的重要组成部分。然而随着MSI 技术的发展以及质量分辨率和空间分辨率的提高,每个生物组织切片可能会产生几百千兆字节的庞大原始成像数据,为后续的分析带来了困难,这也是MSI 在实际应用的主要障碍。为了满足MSI 数据处理的需要,需要开发许多特定的软件包。
一种开放数据格式imzML 的引入使免费和开源软件更加兼容[55]。目前常见的开源软件包和免费开放的MSI 平台包括 MSIReader[56]、OmniSpec[57]、BioMap 和Datacube[58]等。在最近的报道中,He 等[59]开发了一款名为MassImager 的新商业软件用于MSI数据分析,可以实现交互式可视化、原位生物标志物发现和人工智能病理诊断等功能。由Cordes 开发的M2aia[60]是第一个可扩展的开源应用程序,它支持对MSI 大型数据集进行快速、用户友好和交互式探索,实现3D 图像重建。此外,许多研究人员还结合机器学习算法开发出了新的MSI 生物信息学平台,如Kirill 等[61]引入了pyBASIS 计算平台,使用机器学习和相关模式识别改进组织样本的原位信息恢复和比较分析,使得大规模数据处理更容易,重复性更高。而Zhang 等[62]使用预训练的神经网络建立了一种深度学习方法模型,能够从MSI 数据的离子图像中提取高级特征,证明了使用神经离子图像能更好地解释离子图像之间的局部显著差异,从而在后续获得更精细的聚类结果。
4 总结
原位质谱成像技术与其他传统分子成像手段相比,可以对组织或细胞样品实现直接、快速、无损的原位分析,无需标记或特异性的探针修饰,既简化了处理,也避免了因标记引入的外源性或标记物本身的多亲和力的影响。同时MSI 灵敏度较高,检测范围高覆盖,可对目标或非目标分子同时进行成像分析,包括组织中的生物分子、药物和完整的蛋白质等。种种优势使得MSI 技术在生物医药、食品科学、植物学研究等领域越来越受到青睐,但目前从总体来看,MSI 技术还存在一些不容忽视的局限性和改进的空间,如较低的分子电离水平限制了更高的空间分辨率的实现,只能对分析物进行半定量和相对定量、除脂质外其他类代谢物如蛋白和肽目前还没有成熟的方案用于常规分析等。将MSI 技术广泛应用到生命科学基础研究中任重而道远,需要研究者们在此方面进行更加深入地研究。
5 展望
5.1 MSI单细胞水平化
未来,MSI 将会朝着更高的空间分辨率以实现单细胞或亚细胞水平分析的方向发展。最近的一些研究通过开发新的离子源、引入高能气体团簇离子束、使用专用光学装置等将各种MSI 技术的空间分辨率提高到亚微米级[63-65],在生物研究的各个方面提供了新的视角和可能性,如结合深度分析实现单细胞3D 成像[66],通过非靶向方法探索代谢途径以及脂质-蛋白质、蛋白质-蛋白质和金属-蛋白质在从亚细胞到整个生物体的复杂系统中的相互作用,以及综合利用多模态成像和高精度监测技术来提供MSI 的亚细胞横向分辨率。
5.2 MSI绝对定量化
随着各领域的更深入研究,对提供定性信息的MSI 提出了更高的要求,需要开发新方法来发展定量MSI(quantitative mass spectrometry imaging,QMSI)[67]以提供更加准确且有意义的空间和丰度信息。为了在QMSI 实验中进行准确定量,需要利用不同的策略来提高分析物分子的提取和电离效率,一方面要对基质效应进行补偿,如开发规范化策略、更好的样品制备步骤、选择合适的基质、使用基质添加剂以及组织衍生化等手段;另一方面,需要降低信号变异性,目前已有的相关研究有使用串联质谱(MS/MS)、优化激光能量和扫描速度以及改进数据分析方法等。
此外,近年来越来越多研究着眼于合成纳米核@壳颗粒(如SiO2@Au nanoshells[68]等)新型材料辅助的表面激光解吸/电离质谱,有的还结合适配体以选择性捕获并富集目标分子,辅以信号放大策略,实现对生物流体中代谢物的准确定量分析[69],但目前还没有出现将其应用到成像领域的报道。基于其优异性能,未来必然会成为MSI 领域的一大热门研究方向,助力实现QMSI,以推动MSI 技术在空间组学和精准医疗等生物医药前沿领域的应用。
5.3 MSI仪器便携化
需要不断开发新型的小型便携化MSI 仪器设备以使MSI 技术适用于更多的应用场景。同时,亟待着掌握计算机知识的复合型研究人才研发更开源、实用、强大的生物信息学工具以及数据处理新手段,助力MSI 技术实现从小分子到大分子,从亚细胞到多细胞,从器官到个体生物的更加广泛全面的应用。