新型冠状病毒核蛋白N端结构域的表达纯化以及晶体优化
2023-01-05陈铎刘永哲
陈铎 刘永哲
(1.首都医科大学附属北京朝阳医院呼吸与危重症医学科,北京 100020;2.首都医科大学附属北京朝阳医院感染和临床微生物科,北京 100020)
自2019年12月新型冠状病毒(SARS-CoV-2)爆发以来,对全球的经济社会造成了重大的影响,根据美国霍普金斯大学的统计,截至目前已经超过4.7 亿人次感染新型冠状病毒,超过600 万人死于新冠肺炎感染[1-2]。面对日益增长的新型冠状病毒感染病例,高效的检测手段和有效的抗体治疗是应对新型冠状病毒的重中之重。
SARS-CoV-2 是目前发现的基因组较大的正链RNA 病毒,基因组大小约为30 kb,其5′端的基因主要编码冠状病毒的16 个非结构蛋白[3-5]。基因组3′端编码冠状病毒的4 种结构蛋白,包括核蛋白(nucleocapsid,N)、表面刺突蛋白(spike,S)、小包膜蛋白(envelope,E)和外膜蛋白(membrane,M)[6-8]。N 蛋白是冠状病毒中含量最高的结构蛋白,位于病毒内部,具有较高的保守性。冠状病毒N 蛋白包含了N 端结构域和C 端结构域,是一种具有较高免疫原性的磷酸化蛋白,在病毒内部与病毒RNA结合形成螺旋衣壳,稳定病毒的基因组[9-13]。因此,N 蛋白是重要的冠状病毒检测靶点,同时也是关键的抗体开发靶点蛋白。
虽然新型冠状病毒的N 蛋白非常重要,但由于其蛋白中间存在柔性部分,全长蛋白并不稳定[14-15]。为了便于N 蛋白的结构生物研究和后续的抗体开发,本研究分析了N 蛋白全长的氨基酸序列,选取N 蛋白序列中的N 端结构域,约12 kD 的核酸结合序列作为靶蛋白,构建原核的表达质粒,在大肠杆菌中诱导表达新型冠状病毒N 蛋白N 端结构域重组蛋白,N2+亲和层析和分子筛凝胶层析探索N蛋白N 端结构域的纯化方式从而获得较高纯度的目的蛋白,通过Hampton 晶体试剂盒优化得到质量较高的N 蛋白N 端结构域蛋白质晶体,为后续N 蛋白N 端结构域的结构生物学研究和抗体制备提供关键研究基础。
1 材料与方法
1.1 材料
pET28b 原核表达质粒由本实验室保存;N-N 蛋白(N 蛋白N 端结构域(47N-175G))基因由北京睿博生物科技有限公司进行优化合成;大肠杆菌表达菌株BL21(DE3)和质粒扩增菌株DH5α 购自北京全式金生物技术有限公司;卡那霉素、DTT 和IPTG诱导剂购自大连美仑生物技术有限公司;酵母粉和蛋白胨购自OXOID 公司;盐酸、氯化钠和咪唑购自北京化工厂;HEPES 和六水氯化镁购自Amresco公司;DNA 胶回收试剂盒和小提质粒试剂盒购自杭州博日科技有限公司;SDS-PAGE 预制胶和Ni-NTA beads 购自南京金斯瑞生物科技有限公司;T4 连接酶和PCR mix 酶购自南京诺唯赞生物科技有限公司;限制性内切酶购自Thermo Fisher 公司;晶体筛选试剂盒购自Hampton 公司;16 孔晶体板购自天宇有机玻璃制品高分子有限公司;考马斯亮蓝R250 和G250 购自北京溪洋汇智科技有限公司;10 kD 超滤浓缩管(15 mL 和5 mL)购自Merck Millipore 公司;Superdex 75 10/30 GL 购自GE 公司。
1.2 方法
1.2.1 N-N 蛋白的序列合成和表达载体构建 通过NCBI 数据库查询新型冠状病毒N 蛋白全长氨基酸序列(GenBank:MN908947.3),本实验使用CLUSTALW 网站进行氨基酸序列对比,选取N-N 蛋白(47N-175G)129 个氨基酸相对应的基因序列为目的序列,经北京睿博生物科技有限公司进行原核系统密码子优化并人工合成,N-N 蛋白的基因序列连入通用载体Topo。我们以Topo-N-N 为模板,N-N-F和N-N-R 为引物(表1),扩增新型冠状病毒N 蛋白N 端结构域基因序列。扩增目的基因片段通过DNA胶回收试剂盒进行片段回收,之后和质粒pET28b分别通过双酶切(NdeI 和XhoI)、T4 连接酶进行片段载体连接和转化进入DH5α 感受态进行质粒扩增,培养皿挑选阳性单克隆并通过小提质粒试剂盒进行质粒提取,双酶切和测序鉴定正确的重组目的质粒命名为pET28b-N-N。

表1 引物序列Table 1 Primer sequences
1.2.2 N-N 蛋白诱导表达 将构建好的pET28b-N-N质粒转化到大肠杆菌表达菌株BL21(DE3)感受态细胞中。通过卡那霉素抗性平板筛选阳性的表达菌株,转移至包含5 mL LB 培养基的小试管中并添加50 μg/mL 卡那霉素进行37℃ 220 r/min 过夜摇晃培养。第2 天将菌株转入包含1 L LB 培养基的大瓶中并添加50 μg/mL 卡那霉素进行220 r/min 摇晃培养至菌液OD600nm为0.8 时,降低培养温度至16℃,加入终浓度为0.4 mmol/L IPTG 进行过夜诱导,之后将菌液进行4 000 r/min 离心收集大肠杆菌,然后用lysis buffer(20 mmol/L HEPES,pH 7.0,150 mmol/L NaCl,4 mmol/L MgCl2)重悬并进行高压均质破碎,12 000 r/min 离心后收集上清液进行后续的纯化。
1.2.3 N-N 蛋白表达和纯化 大量诱导表达N-N 蛋白,诱导结束后离心、收集大肠杆菌,重悬高压均质破碎,高速离心获得含有大量目的蛋白的上清液,然后进行Ni2+亲和层析纯化,上样流速为1 mL/min,上样后用wash buffer(20 mmol/L HEPES,pH 7.0,150 mmol/L NaCl,4 mmol/L MgCl2,20 mmol/L 咪唑)进行洗杂至G250 检测不变蓝,最后用Elution buffer(20 mmol/L HEPES,pH 7.0,150 mmol/L NaCl,4 mmol/L MgCl2,200 mmol/L 咪唑)洗脱目的蛋白并收集流出液。我们将流出液经过超滤浓缩管(截留蛋白分子量:10 kD)浓缩至1 mL,以1 mL/min 的流速上样,进行分子筛凝胶色谱层析(Superdex 75),收集最要的蛋白质峰,即为新型冠状病毒N-N 蛋白。通过SDS-PAGE 电泳对其进行纯度检测。
1.2.4 N-N 蛋白与RNA 相互作用的EMSA 分析 通过EMSA 试验验证N-N 蛋白与核酸的相互作用。采用体积分数为10%的Native 蛋白胶,合成序列为UCUUAGGAGAAUGAC 的RNA,按N-N 蛋白和RNA 摩尔比为1∶1.2 的比例预混蛋白和核酸,加上等比例的甘油,冰上孵育2 h 后上样,冰浴电泳(7 mA,120 min)。结束后将蛋白胶放置到含有核酸染料的染液中染色10 min,在照胶仪上观察条带。
1.2.5 N-N 蛋白晶体优化 将分子筛纯化的N-N 蛋白峰进行合并,经过超滤浓缩管(截留蛋白分子量:10 kD)浓缩至7 mg/mL 左右进行悬滴晶体生长条件筛选。晶体生长温度为16℃,试剂条件包括Hampton 公司的index1-96、PEGRx 1、PEGRx 2、Crystal Screen、Crystal Screen 2、PEG/Ion Screen 和PEG/Ion 2 Screen 等试剂盒。最终在PEG/Ion Screen的23 号条件(0.2 mol/L Ammonium formate,20%W/V Polyethlene glycol 3350)初筛获得N-N 蛋白质晶体,以此条件为基础,进行晶体生长条件优化。优化手段包括以PEG/Ion Screen 的23 号条件为基础,按4∶1 的体积比分别加入index1-96、Crystal Screen、Crystal Screen 2、PEG/Ion Screen 和PEG/Ion 2 Screen 等其他晶体筛选试剂,获得较大晶体后再进行Additive Screen 和Detergent Screen 最终优化。
2 结果
2.1 N-N蛋白的序列选取
使用CLUSTALW 网站对SARS-CoV-2(QHD 43423.2)、SARS-CoV(NP_828858.1)和MERS-CoV(YP_009047211.1)进行N 蛋白氨基酸序列对比,可以看出在N 蛋白的N 端结构域3 种病毒的差异较大,特别是MERS-CoV 与其他两种病毒的差异更大(图1),因此本研究选取了新型冠状病毒N-N 蛋白(47N-175G)129 个氨基酸序列作为目的蛋白序列,并在NCBI 查找对应的基因序列,通过生物公司进行基因合成构建原核表达重组载体,通过原核表达纯化获得性质较好特异性较高的N-N 蛋白。

图1 SARS-CoV-2、SARS-CoV 和MERS-CoV 的N 蛋白氨基酸序列对比Fig.1 Comparison of N protein amino acid sequences of SARS-CoV-2,SARS-CoV and MERS-CoV
2.2 N-N蛋白表达质粒的构建和鉴定
以Topo-N-N 为模板,生物公司合成N-N-F 和N-N-R 进行扩增,获得大小约350 bp 的目的基因片段,与预期的大小相符(图2),通过NdeI 和XhoI双酶切目的片段和载体,T4 连接酶22℃连接2 h 转化到DH5α 感受态中,通过带卡那霉素抗性的板子筛选获得阳性克隆,再通过双酶切鉴定和基因测序鉴定,获得pET28b-N-N 重组原核表达质粒。

图2 N-N 蛋白基因片段扩增结果Fig.2 PCR amplification result of N-N protein
2.3 N-N蛋白的纯化
将pET28b-N-N 质粒转化到大肠杆菌表达菌株BL21(DE3)中,按照1.2.2 中的方法培养诱导N-N 蛋白的大量表达,采用Ni2+亲和层析柱和分子筛凝胶色75 谱层析柱纯化N-N 蛋白。N-N 蛋白在Superdex 75 分子筛中的出峰位置为16.5 mL,符合Superdex 75 分子筛的出峰情况,其峰尖280 nm 的吸收值约为260 nm 的2 倍为正常的蛋白质比值(图3-A),通过12% SDS-PAGE 蛋白质胶分析N-N 的纯化情况,经过Ni2+亲和层析柱和分子筛凝胶色谱层析柱的纯化,通过Quantity One 软件对蛋白胶进行积分定量分析,N-N 蛋白的纯度达到90%以上(图3-B)。

图3 N-N 蛋白的表达纯化Fig.3 Expression and purification of N-N protein
2.4 EMSA试验验证N-N蛋白与RNA相互作用
通过EMSA 试验证明了N-N 蛋白与RNA 确实具有较强的相互作用(图4),随着N-N 蛋白浓度的提高,可以形成稳定分N-N 蛋白-RNA 复合物。进一步明确N-N 蛋白结合RNA 的能力,从侧面验证N蛋白N 端结构域结合病毒基因组,稳定病毒基因组的功能。但是EMSA 无法准确定量N-N 蛋白与RNA的结合比例以及N-N 蛋白与RNA 结合的具体方式,这些将在后续实验中通过完整的N-N 蛋白-RNA 复合物结构来进一步验证。
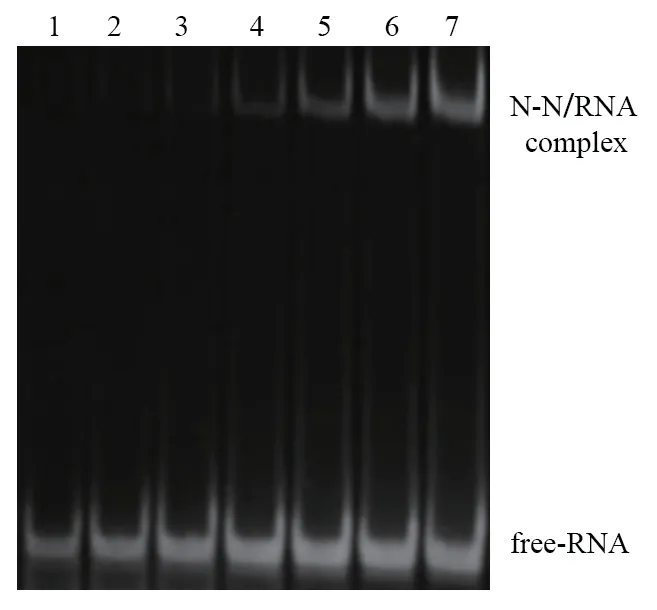
图4 N-N 蛋白与RNA 结合的EMSA 结果Fig.4 EMSA result of binding of N-N protein and RNA
2.5 N-N蛋白的晶体筛选
将分子筛纯化的N-N 蛋白浓缩至7 mg/mL,加入2 mmol/L 的DTT 还原剂后进行晶体生长筛选。在PEG/Ion Screen 的23 号(0.2 mol/L Ammonium formate,20% Polyethlene glycol 3350 W/V)池液生长条件获得初筛N-N 蛋白晶体(图5-A)。以PEG/Ion Screen 的23 号条件为基础,按照4∶1 的体积比分别加入index1-96、Crystal Screen、Crystal Screen 2、PEG/Ion Screen 和PEG/Ion 2 Screen 等其他晶体筛选试剂,在添加Crystal Screen 的45 号(0.2 mol/L Zinc acetate dihvdrate,0.1 mol/L Sodium cacodylate trihydrate pH 6.5,18% Polyethlene glycol 8000 W/V)获得较大的晶体(图5-B)。之后再进行Additive Screen 和Detergent Screen 优化,最终在添加Additive Screen 25 号(1.0 mol/L Sodium malonate pH 7.0)下获得质量较高的N-N 蛋白晶体(图5-C)。

图5 N 蛋白的晶体优化Fig.5 Optimization of N protein crystal
3 讨论
冠状病毒包含4 种结构蛋白,N 蛋白是冠状病毒最重要的结构蛋白之一[16],负责稳定病毒的基因组,协助病毒的转录复制过程。此外,N 蛋白具有较强的免疫原性[17],可以诱导人体产生较强的免疫应答[18]。N 蛋白的抗体较S 蛋白的抗体更早出现[19],而且检测率更高,维持时间更长,说明对于N 蛋白抗体检测试剂盒的开发比S 蛋白更加有优势[20-21]。由于N 蛋白全长序列中间存在柔性较大的部分,直接表达存在一定的困难[22],为了获得大量稳定的N蛋白,本研究通过构建N 蛋白N 端结构域的原核表达系统,获得了大量的可溶N-N 蛋白,为后续抗体检测试剂盒开发[23]和抗体药物[24]开发提供重要的研究基础。
本研究参考Chatzileontiadou 等[25]的蛋白纯化方法,在获得大量的可溶N-N 蛋白基础上,通过Hampton 晶体试剂盒进行晶体筛选。但与既往的研究不同,根据初筛条件还需要进一步摸索条件,如上述结果中所述,既往大部分研究将分子筛纯化的N-N 蛋白浓缩至7 mg/mL,加入2 mmol/L 的DTT 还原剂,本研究为进行多轮晶体优化,最终获得质量较高的N-N 蛋白晶体,故以PEG/Ion Screen的23 号条件为基础,按照4∶1 的体积比分别加入index1-96、Crystal Screen、Crystal Screen 2、PEG/Ion Screen 和PEG/Ion 2 Screen 等其他晶体筛选试剂,在添加Crystal Screen 的45 号获得较大的晶体,从而通过X 射线衍射试验,获得较好的衍射图像。此步骤获得的蛋白晶体,为N 蛋白N 端结构域三维结构的解析提供直接的研究基础。为后续的N 蛋白结构生物学研究,以及N 蛋白稳定核酸机制的解释提供了重要高纯度蛋白。
本研究还通过EMSA 试验定性验证了N-N 蛋白与RNA 具有明确的相互作用。随着N-N 蛋白浓度的提高,可以形成稳定分N-N 蛋白-RNA 复合物,该结果也被其他类似研究证实[26-29]。从侧面证实了N蛋白N 端结构域在稳定病毒基因组中的作用,为后续的N 蛋白功能研究提供思路和依据。
N 蛋白主要两大作用,一是结合在病毒的RNA,稳定病毒的基因组,二是可以结合转录复制形成N 蛋白的RNAP 复合物,促进基因组转录复制[30]。N 蛋白属于结构蛋白,目前开发的抗体试剂盒也是针对N 蛋白或者S 蛋白[26-27]。本研究通过N-N蛋白的表达纯化,主要是优化了后续的晶体生长条件,获得质量较高的N-N 蛋白晶体,后续将以此为基础解析N-N 蛋白晶体结构,为N 蛋白的结构生物学研究提供重要研究基础。同时,N 蛋白具有较好的机体免疫原性,本研究提供了N 蛋白N 端结构域原核表达纯化的方法,将为后续的抗体检测试剂盒开发,以及靶点N 蛋白的抗体药物研究提供关键的技术支撑。
4 结论
本研究提供了新型冠状病毒N-N 蛋白表达纯化的新方法,在大肠杆菌表达系统中高效的表达大量可溶N-N 蛋白。通过Ni2+亲和层析和分子筛凝胶色谱层析可以获得纯度超过90%的N-N 蛋白。通过晶体筛选最终获得质量较高的N-N 蛋白晶体,为后续的结构生物学研究提供重要理论基础。