Vero细胞基质流感疫苗研究进展
2023-01-05马芳芳康碧静马春英刘振斌杨迪乔自林王明明马忠仁王家敏
马芳芳 康碧静 马春英 刘振斌 杨迪 乔自林 王明明 马忠仁 王家敏
(1.西北民族大学生物医学研究中心 甘肃省动物细胞技术创新中心,兰州 730030;2.西北民族大学生物工程与技术国家民委重点实验室,兰州 730030;3.西北民族大学生命科学与工程学院,兰州 730030)
流行性感冒(简称流感)是由流感病毒感染引起的病毒性传染性呼吸道疾病。流感病毒属于正黏病毒科,单股负链RNA 病毒,分为甲(A)、乙(B)、丙(C)、丁(D)4 型,其中甲型流感病毒和乙型流感病毒主要引起人流感(图1)。甲型流感病毒(influenza A virus,IAV)感染宿主范围广,是导致季节性流感传播的主要病原体[1],给社会带来了严重的经济损失。乙型流感病毒(influenza B virus,IBV)仅仅在人与人之间传播,常引起局限性流行。由于流感病毒RNA 聚合酶校正功能缺失,变异快,曾造成4 次世界范围内的大流行,分别为西班牙H1N1 流感、亚洲 H2N2 流感、中国香港H3N2 流感及2009年在全球暴发的H1N1 流感[2]。随着病毒不断变异,H5N1、H9N2、H7N9 和H10N8 亚型的人畜共患流感病毒被确定为将来潜在的流行毒株[3],势必对人类和动物的健康造成严重威胁,同时对公共卫生及经济带来打击。
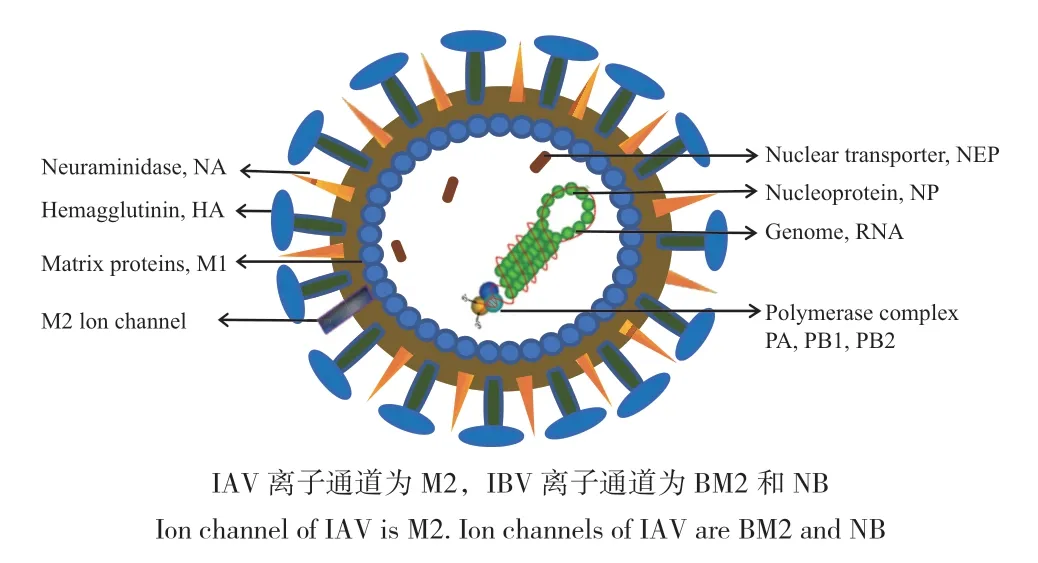
图1 流感病毒Fig.1 Influenza virus
接种流感疫苗是预防流感最常用和最有效的手段。尤其自新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)暴发以来,因其症状与流感类似,且具有高致病性和传染性,对全球公共卫生安全造成了巨大威胁,疫苗作为预防传染性疾病最有效的策略之一再度成为研究热点。值得注意的是,目前获得批准使用的流感疫苗主要是鸡胚基质流感疫苗,但是考虑到鸡胚的局限性,科研人员逐渐关注哺乳动物细胞生产流感疫苗技术,而其中Vero(Vero simian Kidney epithelial)细胞是世界卫生组织和我国生物制品规程认可的仅用于人用疫苗生产的细胞系。现就流感疫苗研究进展及关于Vero 细胞基质制备流感疫苗研究作一概述,为细胞基质流感疫苗的研发提供参考。
1 流感疫苗的研究现状
目前,我们熟知的流感疫苗有鸡胚基质流感疫苗、细胞基质流感疫苗和重组流感疫苗。图2展示了流感疫苗发展的历史进程[4]。
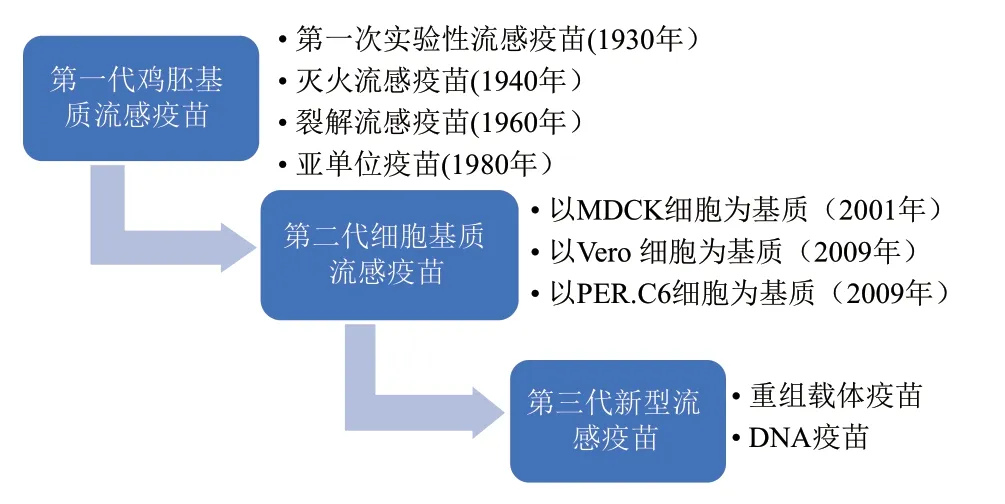
图2 流感疫苗发展的历史Fig.2 History of influenza vaccine development
鸡胚苗的生产工艺已达70 余年,主要包括灭活疫苗(通常称“流感疫苗”)和减毒(弱化)活疫苗(通常称“鼻喷雾流感疫苗”)。基于鸡胚基质流感疫苗生产技术仍在广泛应用,表1总结了美国2020-2021 季节以鸡胚为基质流感疫苗产品,主要为四价流感疫苗[5]。尽管以鸡胚为基质生产流感疫苗是最成熟的方法,但鸡胚苗存在以下缺陷[6]:第一,依赖于SPF 级鸡胚,清洁程度高,生产过程繁琐。首先,生产一剂人用流感疫苗需要1-2 个鸡胚,每只鸡胚可收获尿囊液约10 mL,因此需要大量鸡胚;此外,9-10日龄鸡胚才可用于病毒接种,耗费时间长。第二,不适于某些病增殖,如H3N2 株,高致病性禽流感株H5N1,导致病毒滴度低。第三,不可控因素较多,如下游加工过程存在无菌风险。第四,鸡胚蛋白的残留,导致潜在的过敏反应。第五,若恰逢禽流感暴发,将面临一时间内鸡胚严重供应不足等问题,将严重阻滞流感疫苗生产。
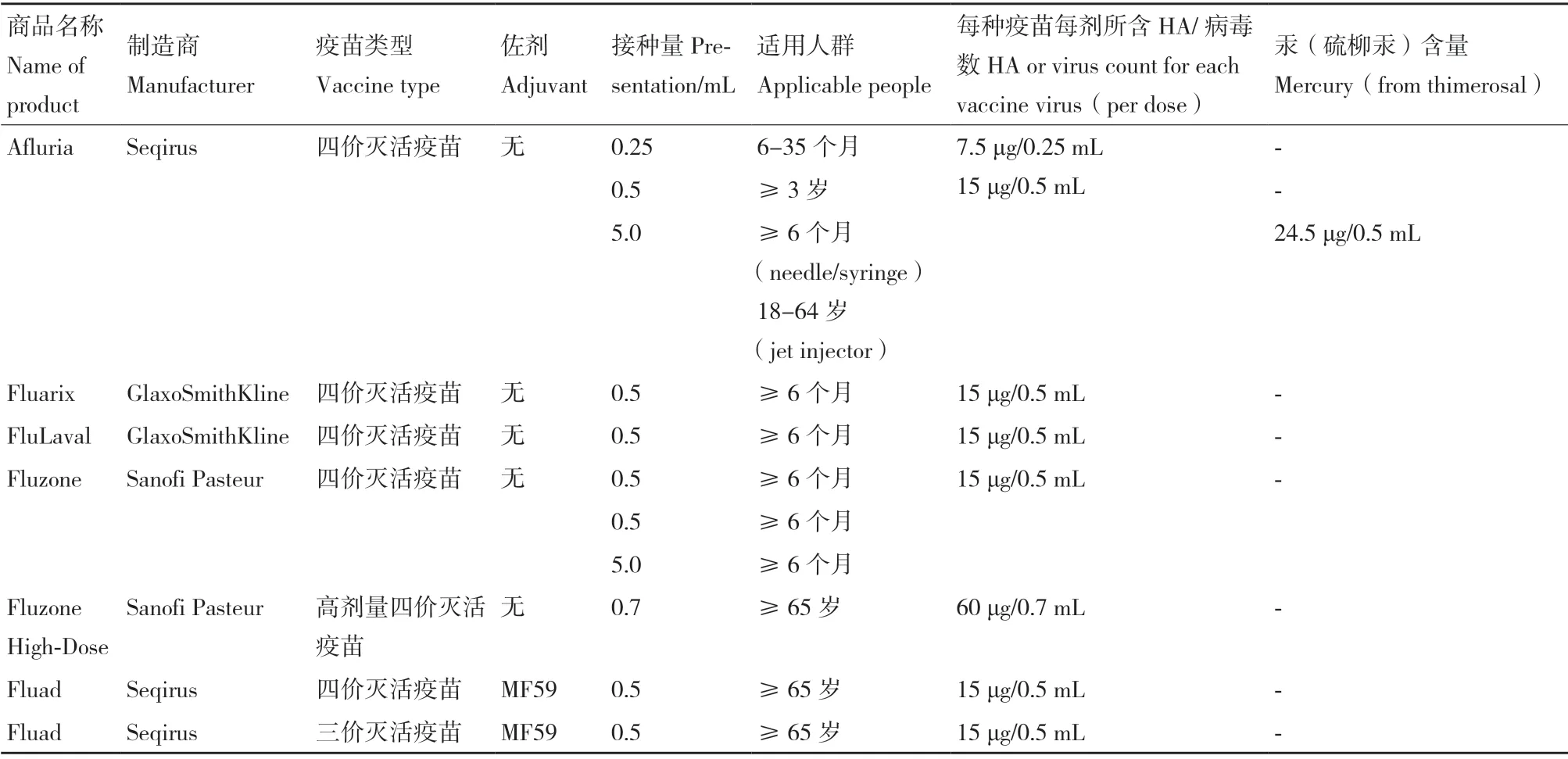
表1 2020-2021年美国FDA 批准的季节性鸡胚基质流感疫苗Table 1 2020-2021 US FDA approved seasonal chicken embryo-based influenza vaccine
为克服鸡胚生产的限制,细胞培养作为一种相对较新的技术相继发展。1995年以来,美国FDA和WHO 积极推进使用细胞苗替代鸡胚苗[7]。最初,该生产工艺使用的候选疫苗病毒是鸡胚衍生的,直到2016年,FDA 批准 Seqirus(美国唯一一家获得FDA 批准的基于细胞的流感疫苗制造商)开始使用细胞培养的候选疫苗病毒[8]。Flucelvax Quadrivalent是唯一获得FDA 许可在美国使用的细胞基质灭活流感疫苗,主要适用于6 个月及以上人群[9]。与鸡胚苗相比,细胞苗具有以下优点[10-11],(1)细胞便于储存,并且细胞培养避免了对鸡胚等原材料的依赖;(2)易于规模化生产;(3)在标准化制造过程中加强控制,细胞培养物、培养基和原材料的无菌性降低了最终产品微生物污染的风险;(4)避免对鸡胚蛋白过敏;(5)疫苗病毒株在细胞中传代突变几率低,细胞衍生的疫苗株抗原性更接近自然流行株;(6)从生产的角度来看,利用哺乳动物细胞培养技术生产流感疫苗的方法更快、更廉价、更高效,有助于人类预防包括禽流感在内的流感的大规模暴发。同时环境友好,降低废弃物排放,减轻制造商负担,特别是在大流行等紧急情况下,应用细胞基质代替鸡胚基质可有效缓解卫生压力。综上所述,细胞苗已成为流感疫苗研制的重要方向。
在培养流感病毒的细胞生产开发中,贴壁依赖性生长的MDCK 细胞、Vero 细胞和PER.C6 三个细胞系是目前最普遍的选择[12](表2)。MDCK 细胞是培养和分离流感病毒最佳的哺乳动物细胞系,但其存在潜在成瘤性,使得其应用于疫苗生产顾虑重重;PER.C6 是流感病毒的敏感适应细胞系,但它属于荷兰抗体和疫苗公司专利所有。Vero 细胞是贴壁性连续传代细胞系,由日本千叶大学的Y.Yasumura 和Y.Kawakita 从正常成年非洲绿猴的肾脏分离培养[13],与其他细胞基质相比,其安全性是Vero 细胞用于流感疫苗生产的最大优势。但与MDCK 细胞相比,Vero 细胞表面唾液酸受体相对较少,对大多数流感病毒的敏感性较低[14],故选育流感病毒Vero 细胞高产适应株,成为Vero 细胞流感疫苗研发首当其冲的首要任务。另外,建立高效的流感病毒扩增系统是基于Vero 细胞培养的流感疫苗生产的第一步,最初细胞培养工艺研究主要采用含血清培养系统[15]。近年来,由于动物源性血清具有潜在的污染风险和不断提升的质量监管要求以及微载体费用高等成本问题,采用无血清全悬浮培养成为流感病毒扩增工艺的主要趋势[16]。基于MDCK 和Vero 细胞培养的流感病毒不同工艺研究比较(表3)。
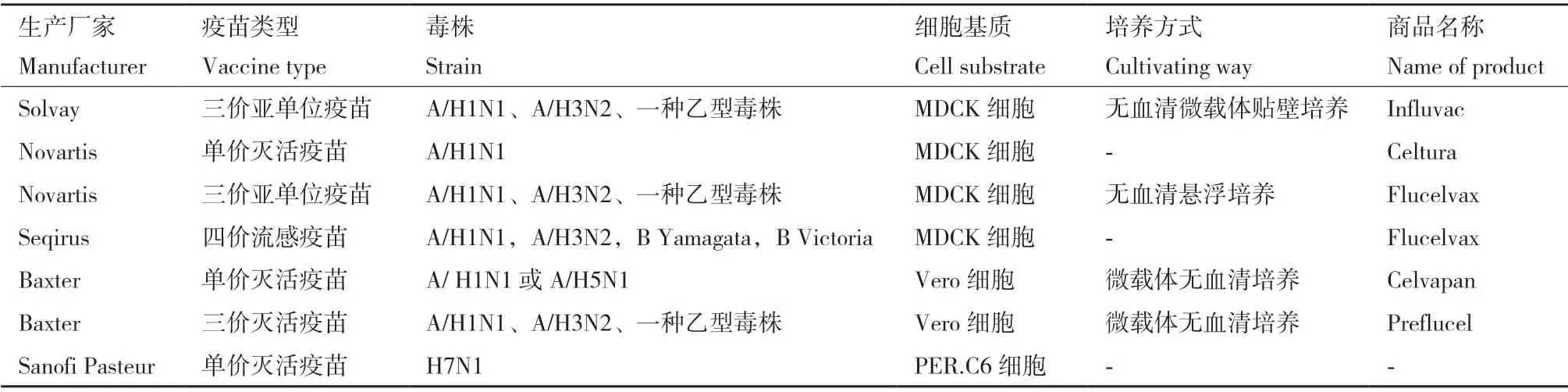
表2 细胞基质流感疫苗Table 2 Cell-based influenza vaccine
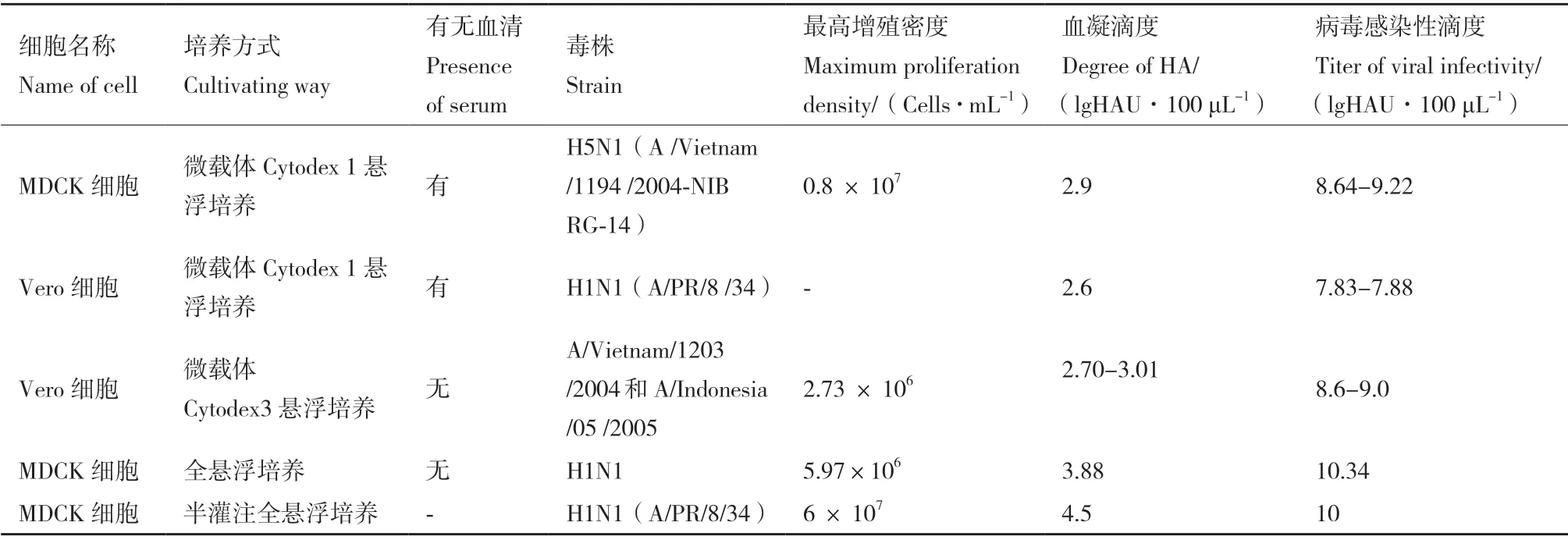
表3 MDCK 和Vero 细胞培养的流感病毒不同工艺研究比较Table 3 Comparison of different techniques of MDCK and Vero cell culture for influenza virus
2 Vero 细胞基质流感疫苗研究进展
自 20世纪 80年代以来,Vero 细胞被广泛用于脊髓灰质炎、狂犬病、乙型脑炎以及新型冠状肺炎等十多种人用病毒性疫苗的生产且被安全使用[17]。鉴于Vero 细胞是人用病毒性疫苗生产的良好细胞基质,近年来,基于 Vero 细胞培养的流感疫苗研究越来越多。图3展示了Vero 细胞基质流感疫苗工艺流程,可以看到培养大量细胞是疫苗制备的基础,而获得Vero 细胞适应性且高产的流感病毒株是制备Vero 细胞流感疫苗的关键。
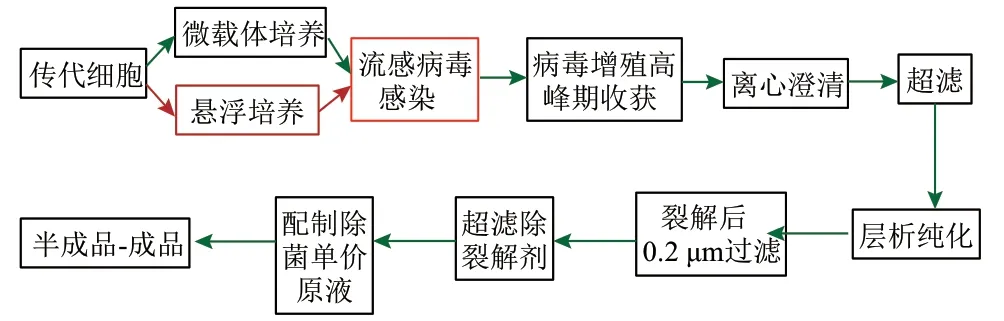
图3 Vero 细胞基质流感疫苗工艺流程Fig.3 Technological process of Vero cell-based influenza vaccine
2.1 Vero细胞高产疫苗株
据报道,在2003年Hiroichi Ozaki 等[18]通过反向遗传学技术建立了Vero 细胞高产甲型流感病毒毒株。他们通过将适应Vero 细胞的重组流感病毒株NS基因替换PR8 NS基因,获得一种改良的A/Puerto Rico/8/34(PR8)流感病毒毒株,改善了在Vero 上病毒拯救和生长特性。与在标准PR8 毒株上挽救相同组合的病毒相比,在新毒株上挽救的H1N1、H3N2、H6N1 和H9N2 血凝素和神经氨酸酶组合的病毒动力学显著增强。Legastelois 等[19]通过反向遗传学产生了流感重组RG5,在鸡胚和Vero 细胞上进行病毒种子扩增,该病毒种子可作为预防新高致病性禽流感毒株在人类传播的疫苗毒株“文库”。Shen等[20]通过基因重配法将Vero 细胞适应性流感病毒株A/Yunnan/1/2005/Va(H3N2) 和A/Anhui/1/2005(H5N1)共感染后,用抗 A/Yunnan/1/2005Va(H3N2)毒株的山羊抗体筛选重配体,获得Vero 细胞适应型H5N1 流感病毒株,且重组前后单价活疫苗血清抗体滴度无显著差异。Hu 等[21]通过连续传代法使流感病毒株A/Puerto Rico/8/1934 适应Vero 细胞,20 代后获得高增长毒株,经序列分析发现,该流感病毒适应株在NP、PB1、PA 和NS1 处均发生突变。综上所述,通过筛选或重配等方法可获得已适应Vero细胞的流感高产毒株,实现以Vero 细胞为基质生产流感疫苗指日可待。
2.2 悬浮培养型Vero细胞
为实现Vero 细胞高密度大规模工业化培养,研究者通过将悬浮培养和贴壁培养二者工艺优势巧妙结合,建立了Vero 细胞生物反应器微载体悬浮培养工艺。但微载体悬浮培养工艺也有缺陷,如微载体价格昂贵、工艺繁琐、细胞消化不完全、无法细胞计数等[22]。与之相比,全悬浮培养工艺恰好能够弥补其不足之处,开发无血清全悬浮细胞培养工艺对流感疫苗的生产具有重要意义。1992年,Litwin[23]首次报道Vero 细胞在无血清培养基中以细胞聚团样悬浮生长,而非单个细胞样悬浮生长。在此之后,未见Vero 细胞悬浮培养相关报道,直到2009年,Paillet 等[24]通过逐步增加无血清培养基的比例,经120 d 左右的驯化,终于使Vero E6 细胞适应悬浮培养,并且比较了水泡口炎病毒、单纯疱疹病毒和脊髓灰质炎病毒在贴壁型Vero 细胞和悬浮型Vero 细胞上的增殖。结果发现悬浮培养Vero 细胞上水泡口炎病毒的产率最高。单纯疱疹病毒,感染后47 h 病毒滴度可达3.2×108TCID50/mL,与贴壁培养型Vero 细胞相似。尽管该研究发现Vero 细胞成功适应单细胞悬浮生长,并且开发了生物反应器工艺,但是该系统并未进一步开发应用。10年之后,Rourou[25]和Shen[26]两个科研团队描述了Vero 细胞在无血清培养基中悬浮生长的适应性。Rourou 等研究发现Vero 细胞最初在IPT-AFM 中以单个细胞悬浮培养,平均细胞密度达(2.1±0.4)×106个/mL,分传第二代时出现中小不同程度的细胞聚团。Shen和团队成功驯化贴壁型Vero 细胞适应无血清和动物源性成分IHM03 培养基并悬浮生长,但也观察到一些聚集物,其倍增时间在40 h 和44 h 之间。Lee等[27]运用逐步适应法获得了能够在无血清培养基OptiPRO 中悬浮培养的Vero 细胞,并且腺病毒产量比贴壁培养的Vero 细胞高1.5 倍。此外,刘鹏等[28]使用自配的Vero 细胞悬浮培养基初步建立了Vero细胞的悬浮培养技术,并在悬浮Vero 细胞培养重组流感病毒H5N1 和H7N9 上获得了较高的血凝素产量,为规模化生产大流行流感病毒株疫苗做铺垫。这些结果显示,悬浮培养型Vero 细胞系用于疫苗生产具有巨大潜力,值得进一步开发探索。
综上所述,虽然已有成功悬浮培养的报道,但与流感病毒在悬浮培养型Vero 细胞上增殖的相关文献报道鲜有,因此还需要研究来弥补悬浮培养型Vero 细胞的不足。根据已有大量文献报道悬浮培养型动物细胞系的成功建立,例如悬浮培养型MDCK细胞系[29]、CHO 细胞系[30]、HEK293 细胞系[31]等,发现以上细胞系已有成熟的商品化培养基,而市面上Vero 细胞全悬浮培养基甚少。因此,尽管已有现有技术的支撑,但Vero 细胞的悬浮驯化及应用仍然极具挑战。
3 总结与展望
由于流感病毒极易变异,其有效防控依然是人类和畜禽养殖业面临的巨大挑战。传统的鸡胚苗已无法满足巨大的市场需求,故需进一步优化流感疫苗生产技术,细胞苗的研发是科研人员和医疗人员需要攻克的难题。另外,从动物细胞大规模培养的发展趋势来看,反应器悬浮培养动物细胞技术、无血清培养技术等是当前世界各大生物公司产业化生产疫苗等生物制品的首要选择和发展方向。
在过去30年里,Vero 细胞系已被广泛研究,并获得了WHO 的认可,用于人类疫苗生产。近年来,Vero 细胞基质流感疫苗研发取得了较大进展,基于Vero 细胞系生产大流行性和季节性流感疫苗的研究,显示其具有良好的耐受性和免疫原性[32]。然而相对于成熟的MDCK 细胞基质流感疫苗生产工艺,Vero细胞基质流感疫苗在全悬浮细胞培养和高产疫苗毒株等配套体系建设、病毒滴度的提高、高效生产工艺研发与优化、Vero 细胞专用悬浮培养基的开发等研究方面尚面临较多需要解决的问题,因此,Vero细胞基质流感疫苗研究工艺还需进一步深入研究。
除了加强对细胞基质流感疫苗的研发之外,还需探索新的流感疫苗研究技术,例如当前COVID-19大流行中强调的mRNA 疫苗,以解决流感疫苗生产能力的潜在不足。需值得注意的是,A(H1N1)pdm09 大流行期间一剂疫苗足以提供足够的免疫保护,但对于其他流感亚型(例如H5N1)可能需要两剂大流行疫苗才能引发足够的免疫反应,而目前70%人口不足以满足两剂的接种目标[33]。另外,由于流感病毒的进化是一个复杂过程,涉及突变和重组以及多个宿主,因此,难以预测下一次流 感大流行何时发生以及确切的毒株是什么。鉴于面临的以上困难,将来对通用型流感疫苗的研发也是及其有必要的。