无细胞蛋白合成系统中细胞提取物和模板DNA的研究进展
2023-01-05许博楠冯佳周见庭蒋建兰
许博楠 冯佳 周见庭 蒋建兰
(天津大学化工学院 天津大学系统生物工程教育部重点实验室,天津 300072)
近几十年来,微生物已经发展成为了生产蛋白质药物、酶制剂和生物能源等产品的有效底盘[1]。然而,由于活细胞的复杂性和细胞膜的屏障,目标产物的有效生物合成和释放受到了限制[2],为了解决这一问题,无细胞蛋白合成系统(cell-free protein synthesis,CFPS)被广泛应用起来。CFPS 系统与体内蛋白表达系统相比没有细胞生长和维持的限制,易于观察和操作,且设计构建速度快、产物产量高、对有毒底物或产物具有高耐受性[3]。随着合成生物学领域的快速发展,CFPS 系统在近几年来取得了巨大的进步[4-6],已经从单纯的研究性工具发展成为替代传统生物系统的有效平台。
20世纪50年代以来,无细胞系统一直被用于探索基本的生物学机制[7-8]。1958年,Zamecnik 实验室首次证明了不依赖完整的细胞结构而从细胞中提取翻译相关物质就可以调节体外蛋白质的合成[9]。1961年,Nirenberg 和Matthaei[10]利用大肠杆菌细胞提取物系统成功破译了20 种氨基酸的遗传密码子,取得了CFPS 领域的开创性进展。1962年,Nathans 等[11]利用大肠杆菌细胞提取物体外合成了第一个完整的蛋白质——噬菌体f2 的衣壳蛋白,之后许多病毒RNA 被用作信使RNA 来启动完整蛋白质的体外合成。1967年,Lederman 和Zubay[12]开发了一种耦合转录-翻译系统,可将DNA 作为模板用于蛋白质的合成,这一发现是现代无细胞转录和翻译应用的先驱。1973年,Zubay[13]开发了一种以大肠杆菌S30 提取物为基础的CFPS 系统,该系统由于较高的蛋白质产量而得到了广泛发展。1988年,Spirin 等[14]通过连续交换反应物及反应产物和副产品以延长转录和翻译,使CFPS 系统运行长达数十小时,大大提高了蛋白质的产量。2000年之后,一场关于CFPS 系统的技术复兴逐渐展开,一些限制系统发展的瓶颈问题例如较低且不可控的蛋白质产量、较高的试剂成本、反应规模小、无法正确折叠复杂的蛋白质等逐渐被攻克[15-18],使CFPS 系统在合成生物学领域的广泛应用成为可能。
CFPS 系统是一个体外蛋白质转录和翻译平台,其原理是以质粒DNA 或线性PCR 产物为模板,在RNA 聚合酶及转录因子等组分的作用下进行转录,利用体系中的核糖体、调控因子、氨基酸底物、tRNA、能源物质等进行翻译[19]。CFPS 系统可以分为两类,一类是“PURE”系统,其由转录和翻译的必要元素组成,所有添加物成分已知、浓度可控,可以减少蛋白酶与核酸酶的污染[20]。另一类是基于细胞提取物的CFPS 系统,通过裂解细胞在保留转录和翻译机制的同时去除细胞碎片和染色体DNA,它相比“PURE”系统成本更低且更通用,尤其在大规模生产中显示出更高的性价比[20],所以本文主要讨论基于细胞提取物的CFPS 系统。最近已有几篇优秀的综述总结了CFPS 系统中反应混合物的制备、优化蛋白表达量方面的研究进展[5,21],本文主要总结了CFPS 系统中另外两个关键因素——细胞提取物和模板DNA 方面的研究进展。本文将介绍细胞提取物制备方法的发展历程,重点讨论了近几年来新开发的原核细胞提取物系统的特点及应用前景。同时,详细总结了质粒DNA 模板和线性DNA 模板的研究进展,这些研究进展为构建更加高效可控的CFPS 系统奠定了基础。
1 细胞提取物的研究进展
1.1 细胞提取物的制备
在无细胞蛋白合成过程中,细胞提取物的制备是建立高效、可重复的工作流程的关键步骤。随着工业化大规模生产和对生产率的高要求,细胞提取物的制备方法也随之不断发展[22]。最初的细胞提取物制备流程为:首先使用发酵罐培养细胞至指数中期,再使用高压均质器裂解细胞,之后通过30 000×g 离心去除细胞碎片和基因组DNA,最后经过径流反应和透析等步骤获得符合标准的细胞提取物。制备好的细胞提取物再加入模板DNA、氨基酸、三磷酸腺苷(ATP)、能量分子、盐和缓冲液的混合物以启动CFPS 反应[13]。传统的细胞提取物制备流程步骤复杂且试剂成本较高,之后不同的研究团队对细胞提取物的制备工艺进行了几点改进。Kigawa等[23]报道了摇瓶发酵简化细胞生长的方法,该方法与发酵罐获得的产率相当。Liu 等[24]简化了制备过程中的几个步骤如提高均质化速度使制备时间缩短了近50%,同时通过优化径流培养使总试剂成本降低了70%。Kim 等[25]用较低的离心率(12 000×g)替代高速离心并省去了透析步骤,发现提取物仍保留完整的转录翻译活性,但总成本和处理时间分别减少了80%和60%。除此之外,为了进一步降低提取物制备的成本,研究者们也探索了能够替代高压均质器裂解细胞的方法,包括使用冻融循环[26-27]、超声[28-29]、珠涡混合[28]、溶菌酶[30]来裂解细胞。细胞提取物制备工艺的简化与优化大大节省了CFPS反应的时间和成本,有助于推动CFPS 的工业化发展及其在合成生物学领域的广泛应用。
除了对细胞提取物制备过程的简化和优化,在源细胞中删除或过表达某些基因,还可以获得更加满足需求的无细胞提取物。Michel-Reydellet 等[31]先删除了大肠杆菌菌株中编码影响氨基酸稳定性的酶的基因,再获取细胞提取物,最终使蛋白质产量大大提高。Kim 等[25]在细胞提取物制备过程中使用商业BL21(DE3)菌株过表达T7 RNA 聚合酶,从而不需要再添加独立纯化的T7 RNA 聚合酶。Jewett团队利用缺乏释放因子(release factor 1,RF1)且过表达T7 RNA 聚合酶的大肠杆菌提取物系统建立了一个高产量一锅式CFPS 平台,该平台可合成包含40 种非天然氨基酸的产品[32]。该团队还将多个提取物组合在一起,每个提取物都含有一种过表达酶,构建了一个完整的生物合成途径[33-34]。这些进展表明,提取物的制备流程可以根据最终目标进行修改。
1.2 新开发的细胞提取物系统
理论上从任何生物中都可以获取细胞提取物,提取物的选择要考虑原料的可获得性和提取物制备的便利性,还需考虑目标蛋白质的生化特性及下游应用。细胞提取物系统根据来源可分为真核系统和原核系统[35](表1)。真核系统具有翻译后修饰功能,可被用来生产具有药用价值的复杂蛋白质。目前已被开发的真核细胞提取物种类很多,包括小麦胚芽提取物(wheat germ extract)[58]、兔网织红细胞提取物(rabbit reticulocyte lysate)[59]、昆虫细胞提取物(insect cell extract)[60]、仓鼠卵巢细胞提取物(Chinese hamster ovary/CHO cells)[61]、酵母提取物(yeast extract)[62]、烟草细胞提取物(tobacco extract)[63]、人类细胞系提取物(human cell lines)[64]。基于小麦胚芽的CFPS 系统具有高效的翻译机制,合成真核蛋白范围广、产量高,但在翻译后修饰方面存在局限性[65]。基于酵母、昆虫细胞、仓鼠卵巢细胞、烟草细胞和人类细胞系的CFPS 系统含有内源性微粒体,能够实现蛋白质的共翻译易位和基于内质网的翻译后修饰,如糖基化和脂化修饰[66]。然而,真核细胞普遍培养成本较高,提取物制备过程复杂,且批量反应蛋白质产量低。与此相比,原核系统提取物制备更方便、蛋白质产量更高、下游加工要求和成本更低。目前应用最广泛的原核细胞提取物是大肠杆菌提取物(Escherichia coliextract)[67],它是CFPS 系统的首选宿主,已被广泛用于商业化生产各种蛋白质。与真核系统相比,原核细胞提取物种类偏少,以往的研究主要集中于大肠杆菌系统。为了探索更多原核细胞在CFPS 系统中的应用潜力,新的原核细胞提取物系统不断被开发出来。本文详细介绍4 种新开发的原核细胞提取物系统。
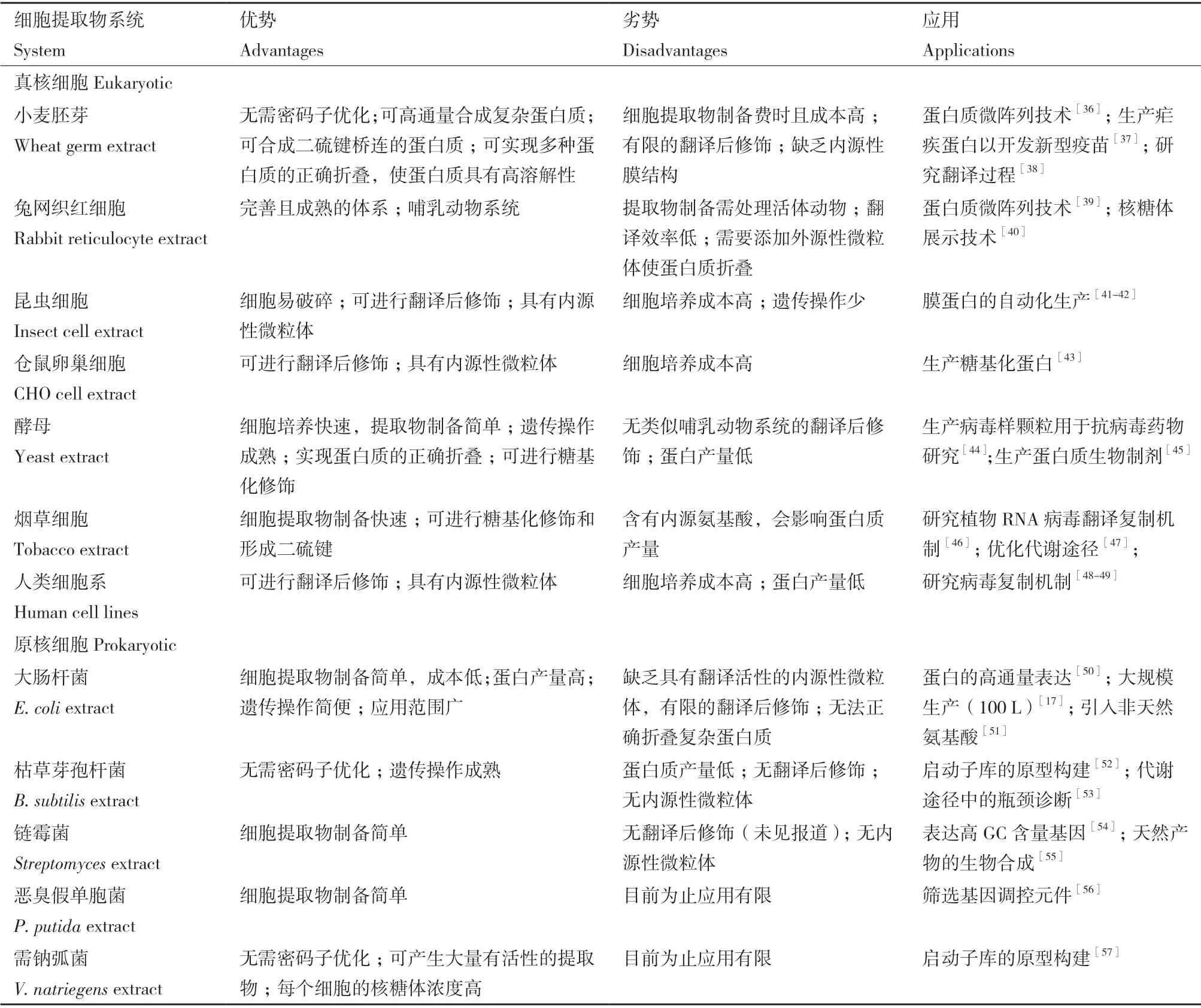
表1 不同细胞提取物系统的特点Table 1 Features of different cell extract systems
1.2.1 基于枯草芽孢杆菌(Bacillus subtilis)的CFPS系统 枯草芽孢杆菌是一种杆状的革兰氏阳性土壤细菌,作为工业模式微生物在重组蛋白的生产和化学物质的合成方面表现出很大潜力[68]。基于枯草芽孢杆菌的CFPS 系统在很早就开始了研究,但由于需要外源添加mRNA、DNAse 处理、能源系统效率低等因素限制了其发展[69-71]。近几年,研究者们努力克服这些限制开发了更加高效的枯草芽孢杆菌细胞提取物系统。Freemont 团队开发并改良了基于枯草芽孢杆菌WB800N 的CFPS 系统,该系统通过使用蛋白酶缺陷的菌株能够持续几个小时进行高效的无细胞转录-翻译反应,该系统还可以用于枯草芽孢杆菌启动子库的原型构建[52]。Tian 等[53]通过优化细胞裂解条件、添加蛋白酶抑制剂和调整缓冲液组成,构建了基于枯草芽孢杆菌的无细胞N-乙酰神经氨酸(NeuAc)生物合成体系,该系统的合成效率比体内高305 倍。由此可见,基于枯草芽孢杆菌的CFPS 系统在基因调控元件的原型构建、代谢工程的研究方面具有一定的发展前景。
1.2.2 基于链霉菌(Streptomyces)的CFPS 系统 链霉菌是一类革兰氏阳性细菌,其基因组GC 含量高(>70%),含有许多复杂的天然产物生物合成基因簇[72-73],开发基于链霉菌的CFPS 系统对于研究天然产物的生物合成具有诸多优势。最初,Li 等[74]开发了一种适用于多种变铅青链霉菌(Streptomyces lividans)和天蓝色链霉菌(Streptomyces coelicolor)的CFPS 系统,该系统以密码子优化的绿色荧光增强蛋白(enhanced green fluorescent protein,eGFP,62% GC)为报告基因,批次反应的蛋白产量大于50 μg/mL。用浓缩细胞提取物进行CFPS 反应后,eGFP的产量提高到近120 μg/mL[54]。利用该系统还成功表达了4 种链霉菌来源的高GC 含量基因,与大肠杆菌CFPS 系统相比蛋白在链霉菌CFPS 系统中的溶解度更高。虽然该系统有助于提高表达蛋白的溶解度,但该平台的蛋白质产量与大肠杆菌CFPS 系统仍有一定差距。Xu 等[75-76]为了进一步提高链霉菌CFPS 系统的生产力,在反应中添加了蛋白质翻译相关因子,获得了约400 μg/mL 的蛋白产量,这也是迄今为止报道的最高产率。与此同时,Moore等[55,77]开发了基于委内瑞拉链霉菌(Streptomyces venezuelae)的CFPS 系统,蛋白产量达266 μg/mL,该系统还揭示了通过链霉菌的土霉素合成途径合成多种酶的能力。总之,基于链霉菌的CFPS 系统将成为表达高GC 含量基因和复杂天然产物基因簇的重要工具,也为天然产物生物合成途径的获取和研究提供了新的思路。
1.2.3 基于恶臭假单胞菌(Pseudomonas putida)的CFPS 系统 恶臭假单胞菌是一种革兰阴性杆菌,已具有成熟的培养技术和遗传操作手段,被广泛用于天然产物的生物合成[78],是实验室研究和工业生产的强大功能底盘[79-80]。早在2004年,Nakashima 等[81]就开发了基于荧光假单胞菌的CFPS 系统,但该系统中细胞提取物制备方法复杂且蛋白产量低,具有很大的改进空间。直到2018年,Jewett 团队参照大肠杆菌CFPS 系统开发了基于恶臭假单胞菌的CFPS系统,通过降低反应温度、提高提取物浓度、提高质粒浓度和优化镁离子浓度成功对该系统进行了优化,优化后的sfGFP(superfolder green fluorescent protein)产量与未优化的系统相比提高了10 倍以上,可达198 μg/mL[56]。研究团队还利用该系统对15 个核糖体结合位点(ribosome binding site,RBS)序列的表达效率进行表征,证明了该平台快速评估和筛选基因调控元件的能力。2019年,Yim 和Johns[82]构建、测试和优化了10 种不同细菌来源的细胞提取物并对其转录翻译能力进行了测试,其中恶臭假单胞菌细胞提取物系统表现出了稳定持续的转录翻译能力。由此可见,基于恶臭假单胞菌的CFPS 系统不仅为体外蛋白合成提供了新的可能性,还将为基因调控元件的筛选和原型构建提供平台。
1.2.4 基于需钠弧菌(Vibrio natriegens)的CFPS 系统 需钠弧菌是迄今为止发现的增长最快的非致病性微生物,其在分子生物学、蛋白表达和代谢工程方面具有广泛的应用前景,有可能取代大肠杆菌成为实验室的常用底盘[83-85]。快速分裂的需钠弧菌细胞拥有高度活跃的蛋白质翻译机制,研究表明指数增长的需钠弧菌每细胞含有约115 000 个核糖体,显著高于大肠杆菌中观察到的每细胞约70 000 个核糖体[86],这些特性显示出了需钠弧菌可以被开发为CFPS 平台的潜力。Failmezger 等[57]利用需钠弧菌细胞提取物可以在小批量反应中成功合成高达0.4 g/L 的eGFP,并利用该系统进行了启动子库的筛选,展现了该系统作为CFPS 平台的适用性和筛选潜在遗传调控元件的能力。与此同时,研究者们也在探索需钠弧菌细胞提取物的简易制备工艺,Wiegand团队[87]设计了一种不需要专门设备和冗长纯化步骤的简化提取物制备方案,该方案在3 h 的小批量反应中可以获得>260 μg/mL 的sfGFP。Des Soye等[88]使用标准超声设备来代替昂贵的高压均质机制备了需钠弧菌细胞提取物,之后通过优化提取物制备工艺和无细胞反应条件使该系统的sfGFP 产量达(1.6±0.05)g/L。利用该系统还成功地进行了抗菌肽的合成,并证明该系统在冻干后仍可以保持生物合成能力。以上研究成果可以看出,基于需钠弧菌开发的CFPS 平台作为大肠杆菌细胞提取物系统的有力替补,具有高度的灵活性和广阔的发展空间,可能会使蛋白表达和基因元件筛选向着更快速的方向发展。
基于更多底盘生物的CFPS 平台的开发不仅给体外蛋白质生产提供了更多选择,而且有望更好地模拟宿主细胞的原型应用过程,开辟新的研究领域。以上新开发的原核细胞提取物系统与大肠杆菌CFPS系统相比有不同的特点与优势,比如枯草芽孢杆菌和需钠弧菌细胞提取物系统不需要密码子优化,且细胞提取物中细菌内毒素含量远低于大肠杆菌,可减轻生物制药行业的下游加工负担,在设计和生产未来蛋白药物方面具有更大的潜力。然而,这些CFPS 系统的蛋白合成水平仍低于大肠杆菌,一些需要更高蛋白质产量的应用如需要更强输出信号的无细胞生物传感器仍然最适用于大肠杆菌系统[89],所以还需对新开发的CFPS 系统有针对性的优化以提高系统的效率和表达水平,将在大肠杆菌CFPS系统中的应用在其他CFPS 系统中进行尝试,扩大CFPS 系统的应用范围。
2 模板DNA 的研究进展
DNA 模板的合理设计是提高CFPS 效率的关键之一,随着CFPS 系统的快速发展,模板DNA 在制备和应用方面也取得了一定的进步,如何降低制备成本、提高利用效率是研究者们重点关注的问题,本文将分别讨论质粒DNA 模板和线性DNA 模板在CFPS 系统中的研究进展。
2.1 质粒DNA模板
2.1.1 制备大量高纯度DNA 在大多数情况下,含有目的基因的超螺旋质粒DNA 由于其良好的稳定性被广泛用于无细胞系统。质粒DNA 模板是决定CFPS 系统吞吐量的重要因素,当目标是生产大量蛋白质时,质粒DNA 模板是首选。近年来,随着细胞提取物制备方法的进步以及能量底物成本的降低,大量高纯度DNA 变成了CFPS 反应中最昂贵的底物之一,为了解决这一问题,DNA 体外扩增技术被用于生产CFPS 系统中的模板DNA(图1-a)。滚环扩增(rolling circle amplification,RCA)是一种恒温核酸扩增方法,该技术以环状DNA 为模板,利用φ29 高保真DNA 聚合酶和耐外切酶的随机引物,可以方便地等温扩增表达质粒[90]。Nojima 等[91]将利用滚环扩增制备的重复DNA 序列用于无细胞转录-翻译偶联系统,反应效率高于质粒模板和PCR扩增的线性DNA。Kumar 等[92]利用φ29DNA 聚合酶多重引物RCA 从100 ng 的起始材料中扩增出了5 μg 的环状DNA,扩增出的DNA 生成的转录本在体外转录-翻译系统中具有与纯化质粒获得的转录本几乎相同的效率,可以作为蛋白质合成的高质量模板。Su’etsugu 等[93]在体外用14 种纯化的酶重构了基于oriC 的大肠杆菌基因组复制循环(图1-a),并证明了这种复制周期反应(replication-cycle reaction,RCR)可以选择性地扩增由多片段组装反应构建的环状分子。OriCiro Genomics 基于此开发了一种无细胞克隆系统,该系统通过多个重叠DNA 片段的无缝组装和RCR 扩增,在一天内可以得到与从大肠杆菌中分离的质粒DNA 相同的超螺旋DNA(表2)。

图1 质粒DNA 模板在CFPS 系统中的研究进展Fig.1 Research progress of plasmid DNA template in CFPS system
2.1.2 质粒DNA 模板的高效克隆 质粒DNA 模板制备的另一个研究进展是快速高效克隆(表2)。质粒DNA 模板制备需要设计、构建、转化与提取等步骤,这个过程往往耗时又耗力,如何缩短质粒DNA模板的制备周期以加速其在CFPS 系统中的应用逐渐成为了研究者们关注的焦点。由Invitrogen 开发的Gateway 克隆系统可以利用整合酶一步插入所需基因到载体中(图1-b),为实现高通量的基因功能分析和快速的蛋白质表达提供了平台[99]。Goshima 等[50]利用该平台高通量生产了33 275 个入门克隆(entry clone),这些克隆随后用于人类蛋白的无细胞表达,进行体外蛋白质组学研究。除此之外,GoldenGate克隆系统也被证明可以用于CFPS 中,GoldenGate克隆系统采用IIS 型限制性内切酶在识别序列外部切割DNA,可以做到高效无痕组装[100](图1-b)。Freemont 团队基于GoldenGate 克隆系统开发了一种试剂盒EcoFlex,该试剂盒包含一个简化的DNA 模块化包(启动子、RBS、终止子等),可以用于以大肠杆菌细胞为底盘的CFPS 中[94]。Dudley 等[95]也基于GoldenGate 克隆系统开发了一种适用于植物蛋白表达的DNA 组装工具包,该工具包含有用于大肠杆菌或小麦胚芽CFPS 系统的质粒受体和用于纯化、检测和提高可溶性蛋白产量的标签,研究者们利用该工具包优化了一系列植物蛋白的表达。这些基于GoldenGate 克隆系统开发的试剂盒/工具包将DNA部件的自动化组装和无细胞反应结合,显著加速了蛋白功能的表征以及组合路径的优化。

表2 质粒DNA 模板在CFPS 系统中的制备策略Table 2 Plasmid DNA template preparation strategies in CFPS system
2.1.3 质粒DNA 模板与水凝胶结合 将质粒DNA模板与水凝胶材料结合构建更高效可控的CFPS 平台是质粒DNA 模板制备的又一个新的研究进展。水凝胶是一种很有前途的生物相容性材料,近年来已被证明可以用于CFPS 系统中为蛋白质合成提供一个高通量表达、可循环使用的腔室微环境[101]。已有研究将模板DNA 与水凝胶结合使其固定在一个区域化和局部化的空间中来进行无细胞蛋白表达,Luo团队通过线性化质粒的共价连接制备了DNA 水凝胶[102-103];Thiele 等[104]制备了透明质酸水凝胶微球作为原始细胞的“细胞核”,线性化的质粒通过共价键附着在微球上。然而,由于质粒的线性化或共价连接,这些系统在转录和翻译方面效率较低,为了避免这种情况,一些不需要质粒线性化且制备简单的水凝胶系统不断被开发出来(表2)。Yang 团队开发了一种黏土水凝胶系统作为CFPS 的有效平台(图1-c)[96],该系统中黏土微凝胶的制备以及质粒与黏土微凝胶的结合都只涉及简单的静电相互作用,由于质粒集中在微凝胶内具有较高的局部浓度且黏土微凝胶保护了质粒不被裂解液中的脱氧核糖核酸酶消化[105],该系统显著提高了蛋白质生产水平。该团队在此基础上构建的基因/黏土/磁性纳米颗粒(magnetic nanoparticle,MNP)微凝胶系统也为回收再利用微凝胶、实现重复生产蛋白质提供了可能[96]。Lu 团队也利用纳米黏土的凝胶荷电特性将质粒固定在了纳米黏土表面,通过增加无细胞体系中的局部基因浓度使蛋白质产量增加1.75 倍[97]。该团队还开发了聚N-异丙基丙烯酰胺(pNIPAM)水凝胶系统来携带质粒DNA[98](图1-c),pNIPAM 随着温度升高会发生体积相变(volume phase transition,VPT),利用这一特性质粒可以固定在水凝胶表面形成聚集态。当包被质粒浓度为10-20 ng/μL 时,无细胞蛋白产量比液相体系提高了两倍,蛋白质合成的有效时间也翻了一番。将质粒DNA 模板与水凝胶结合不仅可以增加蛋白质产量和实现蛋白的重复生产,还能为研究者们提供功能或结构上的好处(例如生物相容性或黏接特性),为构建高效可控的CFPS 平台用于功能性蛋白的表达和检测提供了新的思路。
2.1.4 质粒DNA 模板的来源 除了质粒DNA 模板的制备方法会影响CFPS 系统的蛋白质生产,已有研究发现质粒的来源也会影响无细胞蛋白表达水平(图1-d)。质粒的转录受宿主背景的影响和宿主因子的调控[106],因此来自不同宿主背景的表达质粒在进行无细胞蛋白表达时会出现一定的差异(表2)。Zhang 等[89]选择了大肠杆菌常见的7 个感受态细胞来检测不同质粒来源对基于大肠杆菌、枯草芽孢杆菌、谷氨酸棒状杆菌细胞提取物系统蛋白表达水平的影响,结果显示不同感受态细胞的蛋白产量相差近两倍。Failmezger 等[57]从需钠弧菌和大肠杆菌中均纯化了质粒用于基于需钠弧菌细胞提取物系统的无细胞蛋白表达,结果表明当质粒来源于需钠弧菌时的蛋白表达量比来源于大肠杆菌要好40%,由此可以推测,两种物种之间限制修饰系统的差异会影响质粒的稳定性,进而影响转录和翻译性能,所以在进行无细胞蛋白表达时最好选择与它所应用的CFPS 系统具有相同细胞来源的表达质粒。
2.2 线性DNA模板
CFPS 系统与体内系统相比的一个独特优势是它能够直接利用线性DNA 模板来实现蛋白的表达,线性DNA 模板省去了质粒构建、验证和提取步骤,可以通过PCR 在体外数小时内高效合成,大大加快了遗传电路原型制作周期[107],也使有毒蛋白的表达和分析成为可能。然而,细胞中的内源性核酸酶会降解线性DNA 模板,使蛋白表达量大大降低。由于使用线性DNA 模板替代质粒DNA 模板具有显著的优势,许多提高线性DNA 模板在CFPS 系统中稳定性的方法已经被开发出来[108-109](表3),主要包括基因组改造、添加核酸酶抑制剂、对线性DNA 模板进行修饰和设计以及添加DNA 结合蛋白4 个方面(图2)。

表3 CFPS 系统中稳定线性DNA 模板的策略比较Table 3 Comparison of different linear DNA template protection strategies in CFPS system
2.2.1 基因组改造 早期的工作主要集中于对大肠杆菌的基因组改造上(图2-a),大肠杆菌的内源性外切酶复合物RecBCD 对线性DNA 具有很高的降解率[119-120],Michel-Reydellet 等[110]通过λ-Red 重组系统替换了大肠杆菌基因组中的recBCD基因,基于此突变菌株的提取物系统与野生型提取物相比,线性DNA 模板的蛋白质产量超过3 倍。Ahn 等[113]制备了一个RNase 缺陷的大肠杆菌菌株的细胞提取物,通过减少mRNA 的降解提高了蛋白质产量。但这些突变菌株的生长缺陷使制备提取物的周期变长,其蛋白质合成活性也明显降低[122]。
2.2.2 添加核酸酶抑制剂 与基因组改造相比,抑制提取物中的核酸酶往往更易于操作和推广(图2-b)。应用最广泛的核酸酶抑制剂为噬菌体λ 蛋白GamS,在大肠杆菌提取物中加入纯化的GamS 蛋白,可以使PCR 模板达到与质粒DNA 模板相当的蛋白质合成水平[122]。虽然此种方法效果较好,但需要重组表达和蛋白纯化步骤,开发更为简易有效的核酸酶抑制剂仍是研究者们关注的焦点。已有研究发现RecBCD 的活性可以被有机小分子所抑制[111],Shrestha 等[123]选择了两种最具抑制性的分子(CID 697851 和CID 1517823)添加到无细胞反应中,与没有RecBCD 抑制剂的反应相比,线性DNA 模板的表达提高了200%。Marshall 等[112]证明了一个包含多个Chi 位点的短dsDNA 序列可以稳定线性DNA模板,并大大提高不同蛋白质产物的生物合成,尽管线性DNA 模板的蛋白质产量仍然小于质粒模板,但生成Chi DNA 成本低廉,使用简单,可以作为标准成分纳入CFPS 反应。
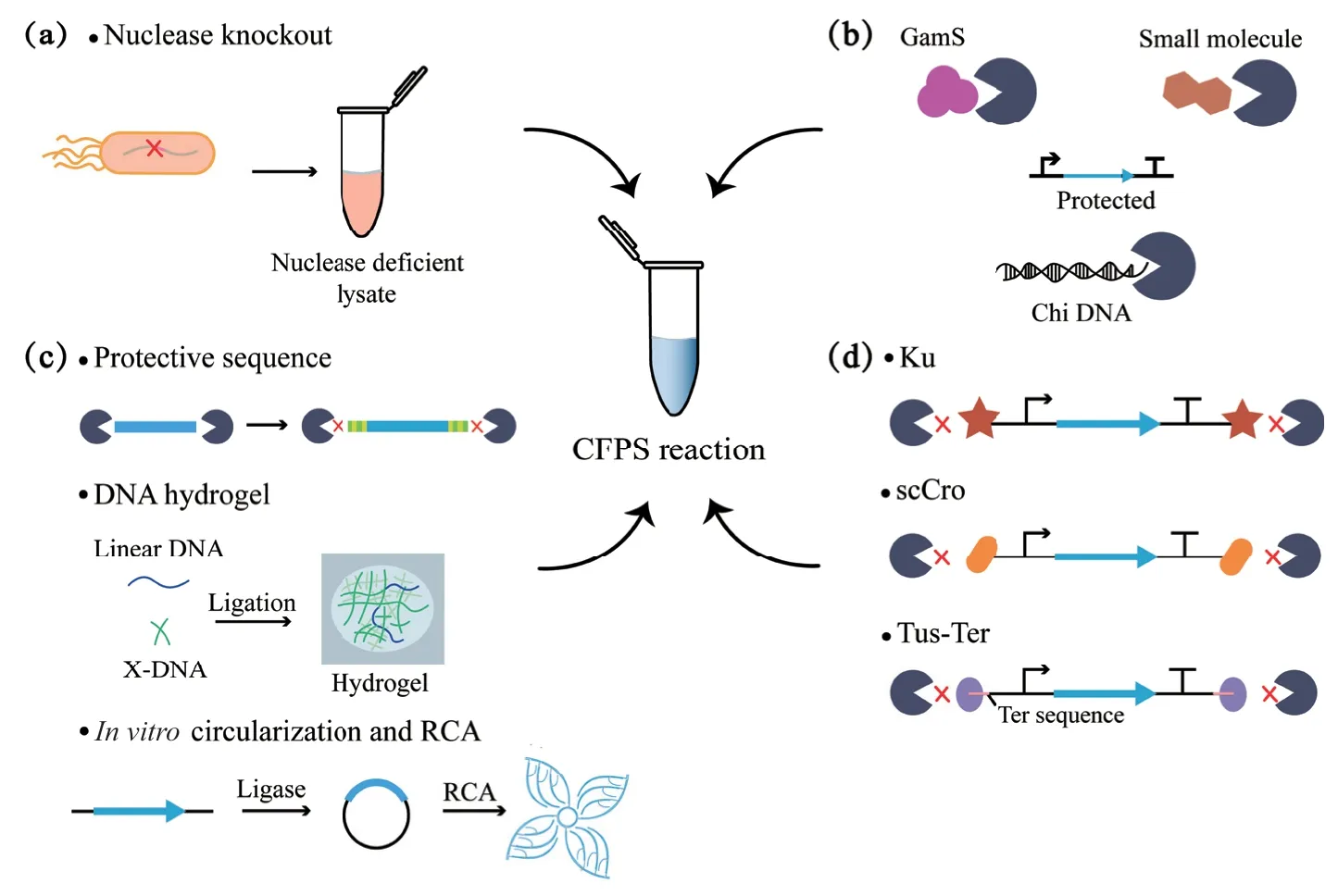
图2 CFPS 系统中保护线性DNA 模板的研究进展Fig.2 Research progress of protecting linear DNA template in CFPS system
2.2.3 对线性DNA 模板进行修饰和设计 对线性DNA 模板进行修饰和设计可以降低其对核酸酶降解的敏感性,从而提高线性DNA 模板在CFPS 反应中的稳定性(图2-c)。通过对线性DNA 模板进行合理设计可以延长mRNA 的半衰期从而提高蛋白质产量,Ahn 等[113]发现T7 终止序列和Poly(G)序列的加入可以增强mRNA 的稳定性,分别使蛋白产量提高近2 倍和3 倍。核酸酶与线性DNA 的结合位点往往位于线性DNA 的末端,因此在线性DNA 末端合理设计保护序列也是一种保护线性DNA 不受核酸酶侵害的有效方法。Chen 等[114]运用电脑模拟和实验验证相结合的方法合理设计了线性DNA 末端的保护序列,包括GC 含量、GC 排列、GC 分布和茎环结构,该序列设计策略可将线性DNA 模板的蛋白表达量提高到质粒的75%。该团队在筛选影响位点特异性非天然氨基酸嵌入效率的因素时,也利用了添加保护序列的线性DNA 作为模板[124],进一步证实了该方法的可行性和有效性。Luo团队将线性DNA与X-DNA交联成水凝胶进行无细胞蛋白表达,解决了线性DNA 模板的溶解度限制和对核酸酶降解的脆弱性,结果蛋白质产量增加了近300 倍[102],之后开发的黏土水凝胶[105]和混合水凝胶[125]也被证明可以作为批量或连续蛋白表达的可循环基因载体。除此之外,已有研究发现将线性DNA 连接成环、滚环扩增(RCA)后用于CFPS 反应中,可解决线性DNA 模板被核酸酶降解的问题,并可以在省去质粒克隆步骤的同时达到和质粒模板相当的水平[115,126]。
2.2.4 添加DNA 结合蛋白 DNA 结合蛋白通过结合在线性DNA 模板的两端,可以使其免受核酸酶的降解(图2-d)。随着新的细胞提取物系统不断被开发出来,DNA 结合蛋白对线性DNA 模板的保护不再仅局限于大肠杆菌CFPS 系统[56,87]。一种DNA结合蛋白Ku 已被证明可以保护dsDNA 末端不受分枝杆菌解旋酶/核酸酶AdnAB 的降解[127],Yim等[116]基于此发现评估了Ku 在CFPS 反应中对线性DNA 模板的保护能力,结果发现虽然Ku 在大肠杆菌CFPS 中不如GamS 和Chi DNA 有效,但其在多种细菌的CFPS 中都展现了一定程度的线性DNA保护能力,特别是在革兰氏阳性菌株枯草芽孢杆菌和谷氨酸棒状杆菌的CFPS 反应中,与不加DNA 结合蛋白的对照组相比,Ku 保护的线性DNA 模板的基因表达水平分别提高了4.43 倍和1.58 倍。Zhu等[117]鉴定了一种DNA 结合蛋白——单链Cro 蛋白(scCro),该蛋白除了在大肠杆菌CFPS 系统中展现了优秀的线性DNA 模板保护能力,在需钠弧菌CFPS 系统中也展现了很好的适用性,使sfGFP 的表达量增加了18 倍。Norouzi 等[118]基于“Tus-Ter”大肠杆菌DNA 复制终止系统开发了一种在CFPS 中保护线性DNA 的方法,通过将Ter 序列附加到线性DNA 模板的末端,并与Tus 蛋白结合,可以保护线性DNA 模板不被外切酶降解。该Tus-Ter 线性DNA模板保护策略在大肠杆菌和需钠弧菌的CFPS 中都很有效,可以达到与质粒模板相似或更高的蛋白表达。
3 总结与展望
过去的十年里,CFPS 系统取得了的巨大技术进步,逐渐向着更大规模、更短时间、更低成本的方向发展。其应用领域也不断扩大,从合成重要蛋白质、蛋白质高通量筛选以及生产蛋白类药物,到如今在人造细胞、遗传网络、生物传感、生物制造,甚至是合成生物学教育方面的应用[4],都体现出了CFPS系统替代传统生物系统的无限潜力。
CFPS 系统在取得巨大进展的同时也面临着许多挑战。为了生产更多更复杂的蛋白质、探索更丰富的生物合成路径,许多新的细胞提取物系统被开发出来,但这些新的细胞提取物系统的蛋白产量与大肠杆菌系统仍有差距,大肠杆菌作为目前唯一能够达到与活细胞蛋白产量相当的无细胞底盘,依然是蛋白表达的最优选择。目前研究者们对其他细胞提取物系统的探索还处于起步阶段,如何进一步将它们的活细胞功能重现在无细胞体系中还需要做更多的工作,比如细胞提取物制备方案要根据不同的底盘细胞进行修改、对提高蛋白产量的辅助因子进行探索等。同时,为了进一步加快CFPS 系统的反应周期和降低CFPS 系统的成本,模板DNA 的制备步骤也逐渐简便化,并且可以根据不同的细胞提取物系统进行调整。但这也意味着模板DNA 的制备不再遵循统一的原则,使得制备策略还不能标准化的纳入CFPS 反应。此外,目前CFPS 系统主要致力于研究单个基因的表达,使制备策略也局限于单个基因的模块化构建,后续可以对一些基因组DNA 和大片段DNA 的制备策略进行研究,将有助于扩大CFPS系统在噬菌体人工合成和多基因功能性表达方面的应用。
总之,CFPS 系统已经成为了体外蛋白表达的有效平台,并且正在向着更广阔的领域继续发展。合成生物学领域新技术的不断涌现使CFPS 系统的各个环节都取得了一定的技术进展,CFPS 系统的进步也将给合成生物学领域带来新的机遇。