基于网络药理学和分子对接探讨苦参碱在奶牛生产中的抗炎作用机制
2023-01-05赵梓轩杨嘉睿蒋林树童津津
赵梓轩 杨嘉睿 蒋林树 童津津
(北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京102206)
随着居民生活水平的不断提高,畜产品的安全质量问题日益受到重视,这对我国畜牧业实现绿色、健康和高质量发展提出了更高要求。在过去的很长一段时间里,兽用抗生素对动物疾病的防治、养殖效益的提高以及畜禽产品的高效供应起到了举足轻重的作用;然而,抗生素使用不当的问题也日益凸显,对畜产品的质量、公共卫生、生态环境以及动物健康造成了危害[1],阻碍了我国畜牧业大力推进绿色健康养殖发展的步伐。所以,寻找安全有效并且不产生耐药性的抗生素替代物成为当务之急。
苦参(SophoraflavescensAit.)在我国已经具有两千多年的使用历史,作为传统的中药材其作用主要有清热利尿和祛湿杀虫等。据报道,苦参的主要生物活性成分为苦参碱,其同时也是发挥抗菌、抗病毒、抗肿瘤以及抗炎等功能的最主要的活性物质[2]。研究发现,不仅是苦参,还包括苦豆、广豆根等其他豆科植物的中药材,它们的有效活性成分均为苦参碱,都能发挥杀菌消炎、抵抗病毒和肿瘤、杀虫以及调节机体免疫力等多种生理功能[3]。此外,研究表明,苦参碱对断奶仔猪腹泻[4]、牛乳头状瘤病毒[5]以及小鼠胶原诱导性关节炎[6]等疾病的治疗均有较好的效果。苦参碱在奶牛临床应用中也取得了较好的疗效。据报道,苦参碱对预防和治疗奶牛子宫内膜炎的效果显著[3],对奶牛乳腺上皮细胞(bMECs)增殖、凋亡及抗氧化能力有一定的影响[7]。卢金霞[8]研究发现,苦参碱对引起奶牛乳房炎的常见致病菌金黄色葡萄球菌具有显著的抑制作用,可通过干预其对bMECs的黏附作用,从而发挥苦参碱对乳腺的保护作用。
虽然中药在疾病预防和治疗方面发挥着举足轻重的作用,但是由于人们在其发挥疗效的作用靶点及机制方面尚未阐明,严重限制了中药的重新定位及作为新兽药的开发利用[9]。网络药理学借助计算机技术、系统生物学和多向药理学等多学科的交叉融合,形成了以网络靶标为核心的技术体系。据报道,通过网络药理学方法对药物的组成成分以及作用机制进行研究,可从生物网络稳态的角度来揭示药物与疾病之间的关系[10]。网络药理学的应用可以提高疾病的治疗效率,减少机体对相关药物的不良反应,提升中药治疗疾病的成功率,节约药品研发成本[11]。因此,本研究通过网络药理学的研究方法,探讨苦参碱在奶牛生产中发挥抗炎作用的机制,以期为苦参碱在奶牛生产中的临床应用提供参考。
1 材料与方法
1.1 苦参碱相关靶点的获取
中药系统药理学数据库与分析平台(TCMSP,https://tcmsp-e.com/tcmsp.php)是一个查找药物、靶点和疾病之间的关系的有效中药系统药理平台[12]。本文以“matrine”为关键词进行搜索,将获取的苦参碱有效化合物作用靶点信息输入UniProt数据库(https://www.uniprot.org)和PubChem(https://pubchem.ncbi.nlm.nih.gov)数据库(即有机小分子生物活性数据库,是一种化学模组的数据库[13])。然后通过PharmMapper(http://www.lilab-ecust.cn/pharmmapper/submitfile.html)预测并得到苦参碱相关的靶点。
1.2 炎症相关靶点的获取
GeneCards是一个可检索和集成的数据库,可以在大量的基因与疾病、变异与蛋白质和细胞与通路之间进行有效链接[14]。DisGeNET是一个综合和规范化各种与疾病有关的基因和有关变异的数据库,其中包含了科学文献,同时涵盖了所有的人类疾病以及正常与不正常的特点[15]。以“inflammation”为关键词,分别在上述2个数据库进行搜索,获取的交集为炎症相关靶点。
1.3 苦参碱抗炎靶点可视化分析
将上述获得的成分靶点、炎症相关靶点上传于Venny(https://bioinfogp.cnb.csic.es/tools/venny/)网络在线服务器中绘制韦恩图,获得苦参碱-炎症靶点的交集,并进行可视化处理。
1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建
登录STRING数据库上传苦参碱抗炎靶点,分析苦参碱的相关靶点并构建PPI网络。STRING数据库是现阶段信息量最丰富,研究蛋白相互作用的数据库之一,该数据库对已知和预测的蛋白质互作信息进行评估与整合,形成了覆盖大于1 100生物体的综合蛋白质网络。该数据库综合多个数据库的相关试验数据,同时也含有生物信息学等研究方法预测的相关研究结果。STRING数据库依据不同证据通道的概率计算,结合随机交互概率校正,最终综合得分为0.4时,为中等可信度;为0.7时,为高可信度;为0.9时,为最高可信度[16]。本研究选用了评分为0.4的PPI网络,即中等可信度网络。登录STRING数据库导入苦参碱发挥抗炎作用的潜在靶点并选择“Bostaurus”物种,获取靶点蛋白相互作用关系;required interaction score选择“medium confidence(0.400)”并导出tsv文件;上传tsv文件至Cytoscape 3.9.1并制作PPI网络图,选择Cytoscape 3.9.1插件CytoNCA,对PPI网络进行拓扑分析并得到关键核心靶点,通过CytoNCA插件计算节点的介数,接近中心性和子网络中心性,叠加3个指标,筛选出前10%作为关键核心靶点[17]。
1.5 基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
登录David数据库(https://david.ncifcrf.gov/)输入苦参碱抗炎靶点,选择“Bostaurus”物种,select identifier设置为official gene symbol,list type设置为gene list,进行GO功能和KEGG通路富集分析,导出txt文件。将靶点数目进行降序排列,选择生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)进行富集分析。根据微生信在线作图平台(http://www.bioinformatics.com.cn/)对相关数据进行分析并制作直方图和KEGG气泡图。
1.6 苦参碱-炎症靶点-信号通路网络构建
Cytoscape源于系统生物学,其将生物分子交互网络、高通量基因表达数据和其他的分子状态信息综合分析整合,最终将数据结合成可视化网络[18]。本研究通过Cytoscape 3.9.1软件(https://cytoscape.org/)导入苦参碱抗炎靶点以及相关通路信息,建立苦参碱-炎症靶点-信号通路网络图。
1.7 分子对接
利用TCMSP数据库(https://tcmsp-e.com/tcmsp.php)搜索苦参碱,复制苦参碱的InChIKey,登录PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/),搜索苦参碱InChIKey,下载配体苦参碱的2D结构,保存成SDF格式;利用Chem 3D软件转换为mol2格式文件,导入Autodock Tools 1.5.6软件进行加全氢、设置为配体(自动分布电荷)、检测配体的Torsion tree中的扭转键、选择扭转键等处理,保存文件为pdbqt。登录UniProt数据库(https://www.uniprot.org)复制核心靶点的,选择条件应满足“已验证,物种人”。再登录RCSB PDB数据库(https://www.rcsb.org/),粘贴对应靶点Entry Name,选择蛋白质晶体分辨率介于2.0~3.0,下载核心靶点,即受体白蛋白(ALB)、肿瘤坏死因子(TNF)、MYC原癌基因碱性螺旋-环-螺旋转录因子(MYC)、半胱氨酸-天冬氨酸蛋白酶3(CASP3)、周期蛋白D1(CCND1)、CD44和白细胞介素-6(IL-6)的PDB格式文件。同时在AutodockTools 1.5.6软件中对核心靶点蛋白采用除去水、加入氢等处理方法。首先在AutodockTools 1.5.6软件中设置Grid,选择对应的配体文件和受体文件,选择半柔性对接,设置GridBox,包裹住全部受体,保存为GPF格式文件,运行RUN AutoGrid,设置对接参数及运算方法,保存为DPF格式文件;然后设置Dock,依次选择配体文件、受体文件等,运行Run Autodock,保存为DPF格式文件;最终对运算结果进行分析并选用自由结合能最低的结合构象作为最佳构象。利用PyMOL 2.5.2软件进行可视化处理。
1.8 细胞分组
采用DMEM-F12、10%胎牛血清(FBS)和1%青-链霉素培养基,在温度为37 ℃的5% CO2细胞培养箱中培养bMECs。未经处理正常培养的bMECs为对照组(CON组);将无乳链球菌与bMECs按感染复数(MOI)50∶1、共孵育6 h为奶牛乳腺炎症模型组(TRT组)[19-20];参照已发表的文献[21],利用50 μg/mL的苦参碱添加无乳链球菌与bMECs炎症模型共孵育6 h,为苦参碱组(MAT组)。每组3个重复。
1.9 Western blot
参照本团队前期报道Western blot的研究方法[22-23],检测CASP3和CCND1蛋白表达量的变化。抗体CASP3(#9662)和CCND1(#55506)均购自于Cell Signaling公司。使用Image J 软件进行灰度值分析。
1.10 数据统计分析
试验数据最初使用Excel 2019进行整理,应用软件SPSS 20.0进行单因素方差分析(one-way ANOVA),试验结果用“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 苦参碱炎症靶点获取结果
本研究发现,苦参碱在TCMSP数据库中共有10个靶点,通过PharmMapper数据库获得276个靶点,两者取并集共获得282个苦参碱靶点。通过GeneCards数据库获得10 898个炎症靶点,通过DisGeNET数据库获得467个靶点,两者取并集共获得10 900个炎症靶点。
2.2 苦参碱炎症靶点可视化分析
通过生物信息在线作图平台,分别输入苦参碱靶点和炎症靶点通过韦恩图对苦参碱和炎症靶点进行可视化(图1)。
2.3 苦参碱炎症靶点网络构建及关键靶点的筛选
将获得的苦参碱炎症靶点共71个输入STRING数据库,限制物种为“Bostaurus”,获取蛋白互作PPI网络(图2)。结果表明,节点数为71,边数为180,预期的边数为91,平均节点度值为5.07,平均局部聚类系数为0.47,PPI富集P值为2.22×10-16,保存为tsv文件。将文件导入Cytoscape 3.9.1软件,根据其度值(degree)选择排名前30绘制柱状图(图3),由图可见degree排名前5的靶点主要包括ALB、TNF、MYC、CASP3及CCND1。CytoNCA插件计算节点中心性,筛选核心靶点。CytoNCA包含8种中心性,分别为介数、接近中心性、自由度、特征向量中心性、平均最短路径长度、网络中心性、子网络中心性和信息中心性。本研究选取介数、接近中心性和子网络中心性的前10%的节点,并将3个中心性重叠,从而获得具有关键靶点的子网络。由表1和图4可知,苦参碱抗炎核心靶点为ALB、TNF、MYC、CASP3、CCND1、CD44和IL-6。

图1 苦参碱炎症靶点韦恩图
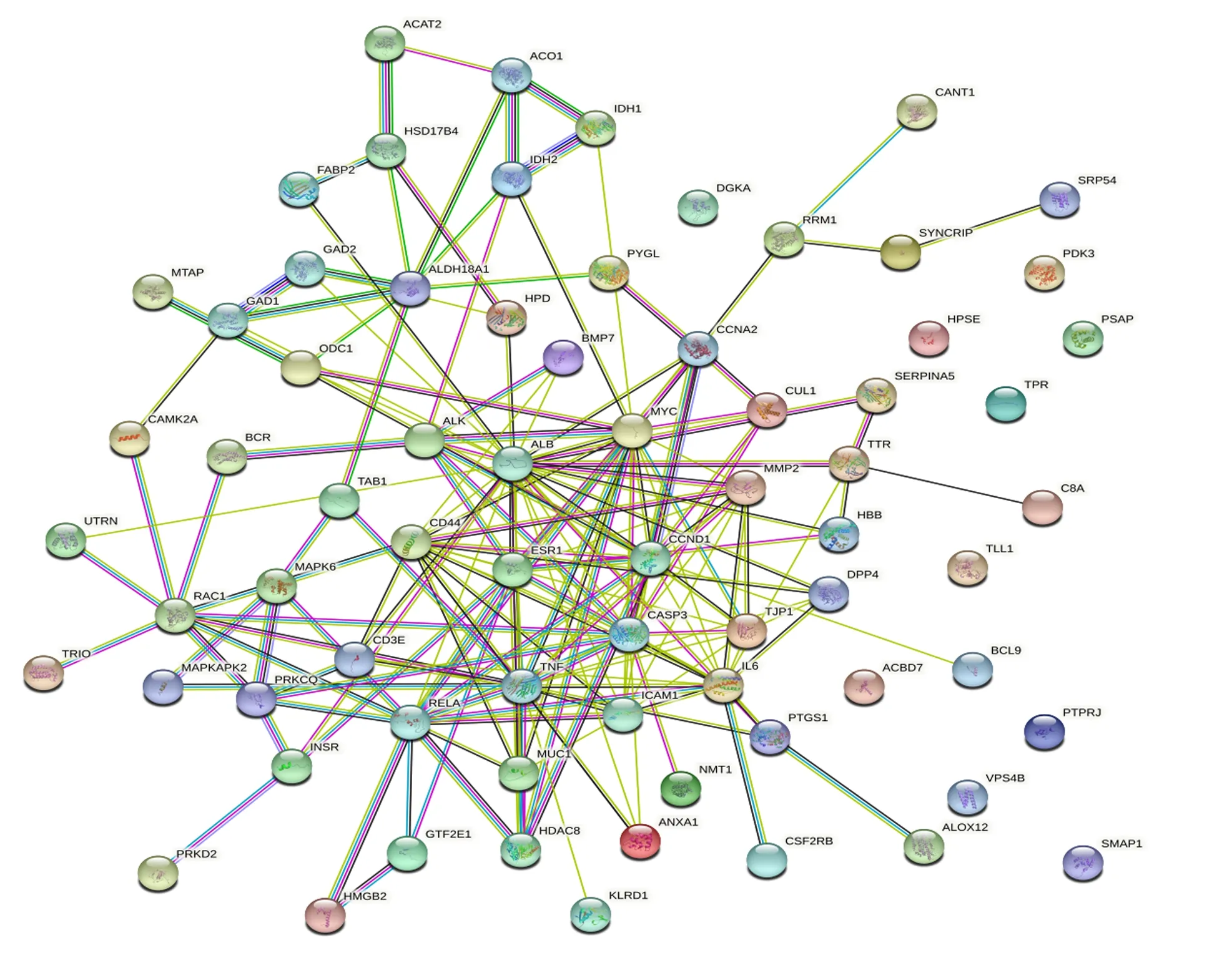
ACAT2:乙酰辅酶A乙酰转移酶2 acetyl-CoA acetyltransferase 2;ACO1:顺乌头酸酶1 aconitase 1;IDH:异柠檬酸脱氢酶 isocitrate dehydrogenase;HSD17B4:17β-羟基类固醇4型脱氢酶 hydroxysteroid 17-beta dehydrogenase 4;FABP2:脂肪酸结合蛋白2 fatty acid-binding protein 2;MTAP:S-甲基-5′-硫代腺苷磷酸化酶 S-methyl-5′-thioadenosine phosphorylase;GAD:谷氨酸脱羧酶 glutamate decarboxylase;ALDH18A1:乙醛脱氢酶18家族成员A1 aldehyde dehydrogenase 18 family member A1;ODC1:鸟氨酸脱羧酶1 ornithine decarboxylase 1;HPD:4-羟基苯丙酮酸双加氧酶 4-hydroxyphenylpyruvate dioxygenase;PYGL:肝糖原磷酸化酶 glycogen phosphorylase, liver form;DGKA:二酰基甘油激酶α diacylglycerol kinase alpha;CANT1:钙激活核苷酸酶1 calcium activated nucleotidase 1;PRM1:鱼精蛋白1 protamine 1;SYNCRIP:突触结合蛋白结合细胞质RNA相互作用蛋白 synaptotagmin binding cytoplasmic RNA interacting protein;SPR54:信号识别颗粒54 signal recognition particle 54;PDK3:丙酮酸脱氢酶激酶同工酶3 pyruvate dehydrogenase kinase 3;HPSE:乙酰肝素酶 heparanase;PSAP:鞘脂激活蛋白原 prosaposin;BMP7:骨形成蛋白7 bone morphogenetic protein 7;CCNA2 周期蛋白A2 cyclin A2;CAMK2A:钙/钙调蛋白依赖性蛋白激酶激酶2α calcium/calmodulin dependent protein kinase 2 alpha;BCR:断裂点簇集群区 breakpoint cluster region;ALK:间变性淋巴瘤激酶 anaplastic lymphoma kinase;ALB:白蛋白 albumin;MYC:MYC原癌基因碱性螺旋-环-螺旋转录因子 MYC proto-oncogene, basic helix-loop-helix transcription factor;CUL1:滞蛋白1 Cullin 1;SERPINA5:丝氨酸蛋白酶抑制剂家族A成员5 Serpin family A member 5;TPR:核蛋白易位启动子区域 nucleoprotein translocation promoter region;UTRN:肌营养相关蛋白 Utrophin;TAB1:转化生长因子β活化激酶结合蛋白1 transforming growth factor-β-activated kinase-binding protein 1;MMP2:基质金属蛋白酶2 matrix metalloproteinase 2;TTR:转甲状腺素蛋白 transthyretin;RAC1:Ras相关的C3肉毒杆菌毒素底物1 Ras-related C3 botulinum toxin substrate 1;MAPK6:丝裂原活化蛋白激酶6 mitogen-activated protein kinase 6;ESR1 雌激素受体1 estrogen receptor 1;CCND1:周期蛋白D1 cyclin D1;HBB:血红蛋白β亚基 hemoglobin subunit beta;C8A:补体C8α链 complement C8 alpha chain;MAPKAPK2:丝裂原激活蛋白激酶激活蛋白激酶2 mitogen-activated protein kinase activated protein kinase 2;PRKCQ:蛋白激酶Cθ protein kinase C theta;CD3E:T细胞受体复合物CD3ε亚基 CD3 epsilon subunit of T-cell receptor complex;RELA:转录因子p65 transcription factor p65;TNF:肿瘤坏死因子 tumor necrosis factor;CASP3:半胱氨酸-天冬氨酸蛋白酶3 Caspase-3;TJP1:紧密连接蛋白1 tight junction protein 1;DPP4:二肽基肽酶-4 dipeptidyl peptidase-4;TLL1:类Tolloid蛋白1 Tolloid like 1;INSR:胰岛素受体 insulin receptor;MUC1:黏蛋白1 mucin 1;ICAM1:细胞间黏附分子1 intercellular adhesion molecule 1;IL-6:白细胞介素-6 interleukin-6;ACBD7:乙酰辅酶A结合域包含7 acyl-CoA binding domain containing 7;BCL9:B细胞淋巴瘤9 B-cell lymphoma 9;PRKD2:丝氨酸/苏氨酸蛋白激酶D2 Serine/threonine protein kinase D2;HMGB2:高迁移率族蛋白B2 high mobility group box 2;GTF2E1:通用转录因子2E亚基1 general transcription factor 2E subunit 1;HDAC8:组蛋白脱乙酰基酶8 histone deacetylase 8;ANXA1:膜联蛋白A1 annexin A1;NMT1:N-十四烷酰转移酶1 N-myristoyltransferase 1;PTGS1:前列腺素内过氧化物合酶1 prostaglandin-endoperoxide synthase 1;PTPRJ:蛋白酪氨酸磷酸酶受体J protein tyrosine phosphatase receptor J;VPS4B:液泡蛋白分选蛋白4B vacuolar protein sorting 4 homolog B;KLRD1:杀伤细胞凝集素样受体D1 killer cell lectin like receptor D1;CSF2RB:集落刺激因子2受体β亚基 colony stimulating factor 2 receptor subunit beta;ALOX12:花生四烯酸12-脂氧合酶 arachidonate 12-lipoxygenase;SMAP1:基质膜相关蛋白1 stromal membrane-associated protein 1。图3、图4和图7同 the same as Fig.3, Fig.4 and Fig.7。
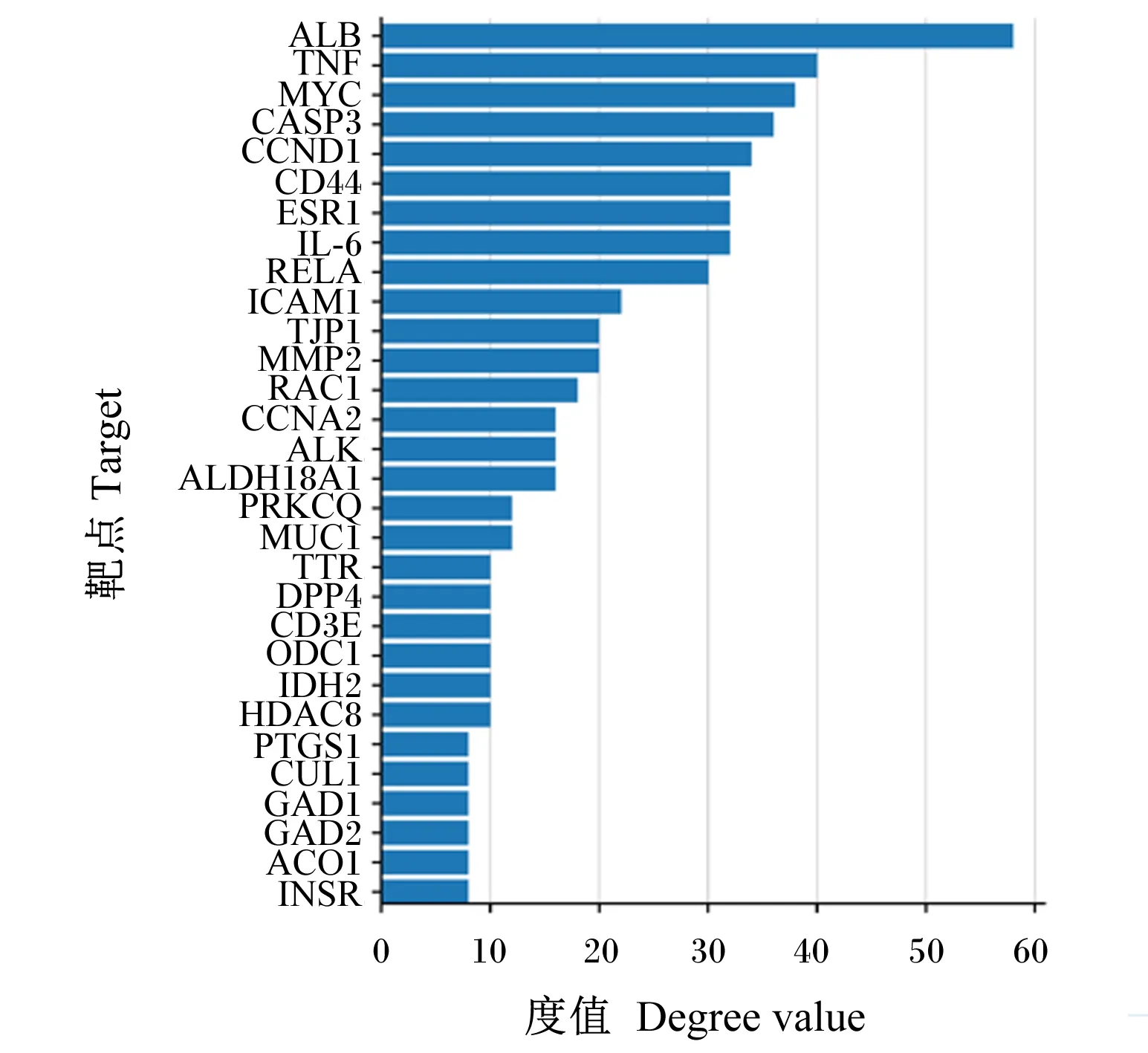
图3 苦参碱炎症潜在靶点度值排序
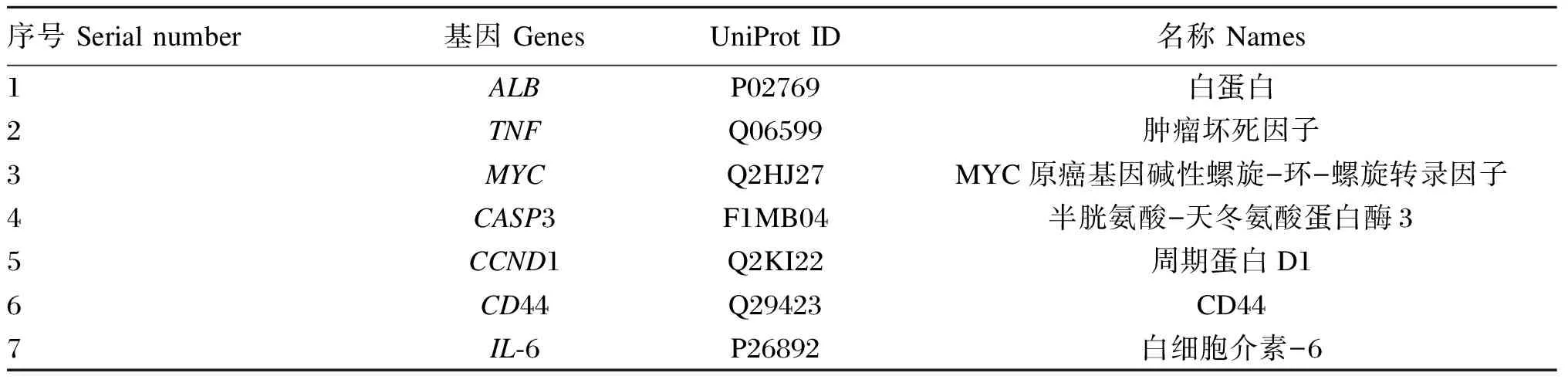
表1 苦参碱炎症核心靶点
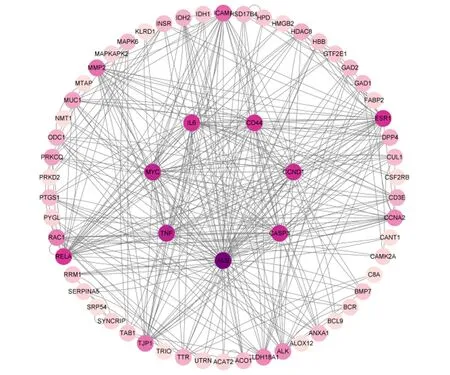
通过拓扑分析,确定苦参碱对奶牛炎症作用相关靶点的PPI网络,颜色越深,其度值越高。
2.4 GO功能和KEGG通路富集分析
登录David数据库上传71个苦参碱抗炎靶点,该物种限定为“Bostaurus”,并进行GO功能和KEGG通路富集分析。GO功能富集分析结果获得62种BP、16种CC和12种MF。选取阈值P<0.01的条目,在微生信(http://www.bioinformatics.com.cn/)中导入GO term、Count、P-value以及分类相关数据生成BP、CC和MF三合一图(图5)。其中,BP主要包括细胞对过氧化氢的反应(cellular response to hydrogen peroxide)、一氧化氮(NO)生物合成过程的正调控(positive regulation of nitric oxide biosynthetic process)、脂多糖细胞反应(cellular response to lipopolysaccharide)、异型细胞黏附的正调控(positive regulation of heterotypic cell-cell adhesion)以及白细胞介素-8产生的正调控(positive regulation of interleukin-8 production)等;CC主要包括细胞质(cytoplasm)和细胞外间隙(extracellular space)等;MF主要包括蛋白激酶结合(protein kinase binding)、ATP结合(ATP binding)和质膜(membrane)等。
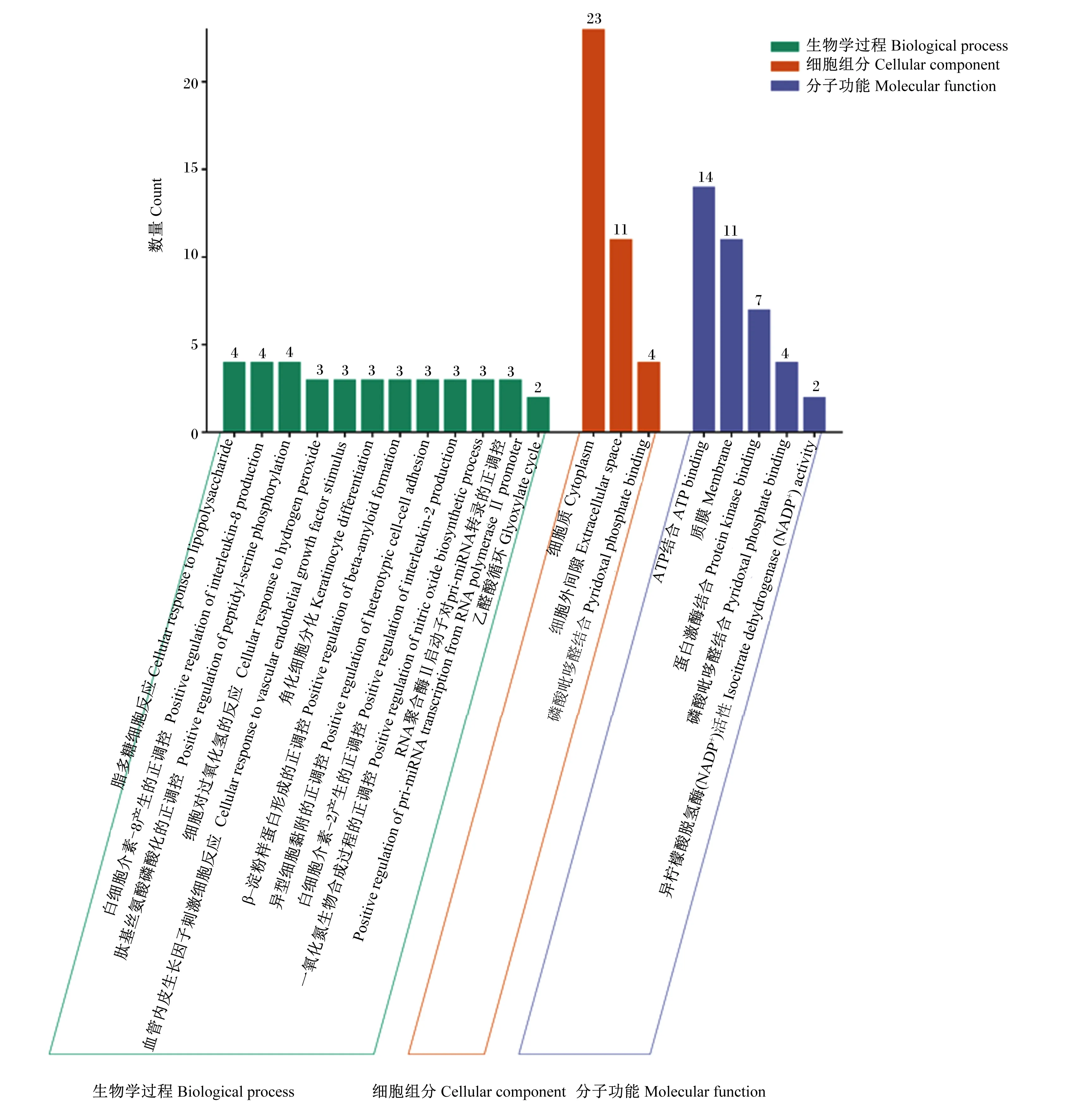
图5 GO功能富集分析
KEGG通路富集分析(图6)共获得22条信号通路,主要包括肿瘤坏死因子信号通路(TNF signaling pathway)、丝裂原活化蛋白激酶信号通路(MAPK signaling pathway)、白细胞介素-17信号通路(IL-17 signaling pathway)、核因子-κB信号通路(NF-κB signaling pathway)以及Toll样受体信号通路(Toll-like receptor signaling pathway)等通路,与苦参碱发挥抗炎作用密切相关。
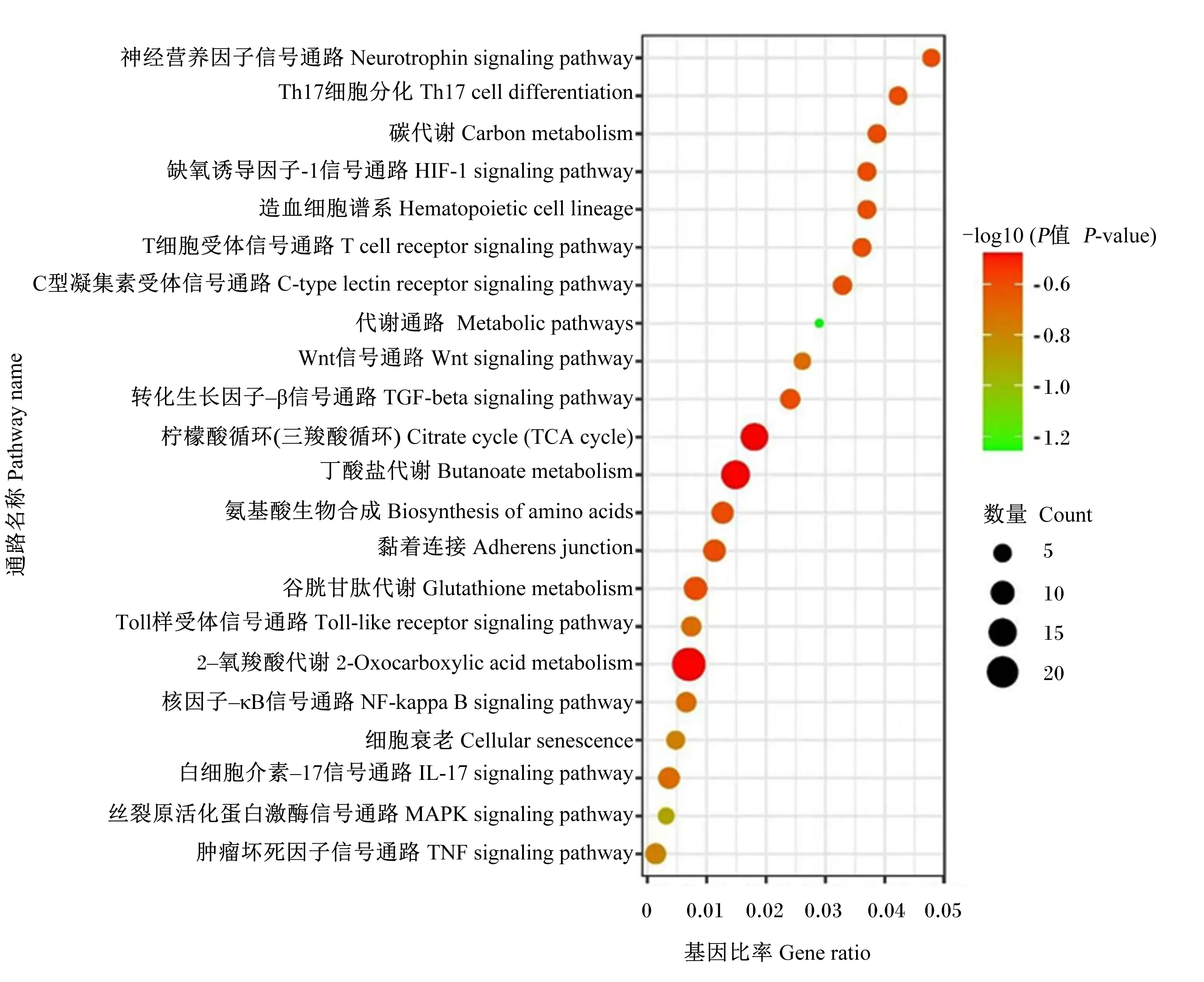
图6 KEGG通路富集分析
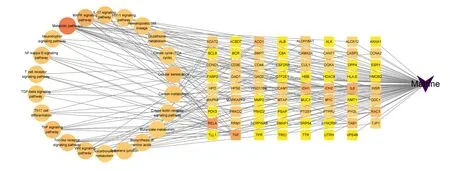
2.5 苦参碱-炎症靶点-信号通路网络构建
将David通路注释得到的数据,登录Cytoscape 3.9.1软件上传相关数据,构建苦参碱-炎症靶点-信号通路网络图(图7)。Network Analyzer结果显示,网络节点数为94,网络边数为182,网络密度为0.04,网络直径为4,网络半径为2,网络中心度为0.74,网络异质性为1.92,特征路径长度为2.35。
2.6 分子对接结果
将苦参碱相关活性成分与潜在作用靶点拓扑分析网络图中连接度最高的成分苦参碱与7个核心靶点进行对接,即受体为ALB、TNF、MYC、CASP3、CCND1、CD44和IL-6,配体为苦参碱,分子对接结果见表2和图8。结合自由能用来评估成分和靶点之间的结合;如果结合能小于0,则表明活性成分和靶点可以自由结合。研究表明,若两者之间结合自由能较低,则两者之间亲和力较强[21]。通常认为,结合自由能<-5 kcal/mol表示活性成分与作用靶点之间亲和力良好[20]。本研究结果表明,ALB、TNF、MYC、CASP3、CCND1、CD44和IL-6皆可与苦参碱稳定结合,提示苦参碱与上述靶点之间的相互作用可能为苦参碱发挥抗炎的重要作用机制之一,需要进一步试验验证。
2.7 苦参碱对无乳链球菌诱导的bMECs相关蛋白表达量的影响
如图9所示,与CON组相比,TRT组CASP3蛋白表达量极显著升高(P<0.01),CCND1蛋白表达量极显著降低(P<0.01);与TRT组相比,MAT组CASP3蛋白表达量极显著降低(P<0.01),CCND1蛋白表达量极显著提高(P<0.01)。
Matrine:苦参碱;Metabolic pathways:代谢通路;MAPK signaling pathway:丝裂原活化蛋白激酶信号通路;IL-17 signaling pathway:白细胞介素-17信号通路;HIF-1 signaling pathway:缺氧诱导因子-1信号通路;Hematopoietic cell lineage:造血细胞谱系;Glutathione metabolism:谷胱甘肽代谢;Citrate cycle (TCA cycle):柠檬酸循环(三羧酸循环);Cellular senescence:细胞衰老;Carbon metabolism:碳代谢;C-type lectin receptor signaling pathway C型凝集素受体信号通路;Butanoate metabolism:丁酸盐代谢;Biosynthesis of amino acids:氨基酸生物合成;Adherens junction:黏着连接;2-oxocarboxylic acid metabolism;2-氧羧酸代谢;Wnt signaling pathway Wnt信号通路;Toll-like receptor signaling pathway Toll样受体信号通路;TNF signaling pathway:肿瘤坏死因子信号通路;Th17 cell differentiation:Th17细胞分化;TGF-beta signaling pathway:转化生长因子-β信号通路;T cell receptor signaling pathway:T细胞受体信号通路;NF-kappa B signaling pathway:核因子-κB信号通路;Neurotrophin signaling pathway:神经营养因子信号通路。
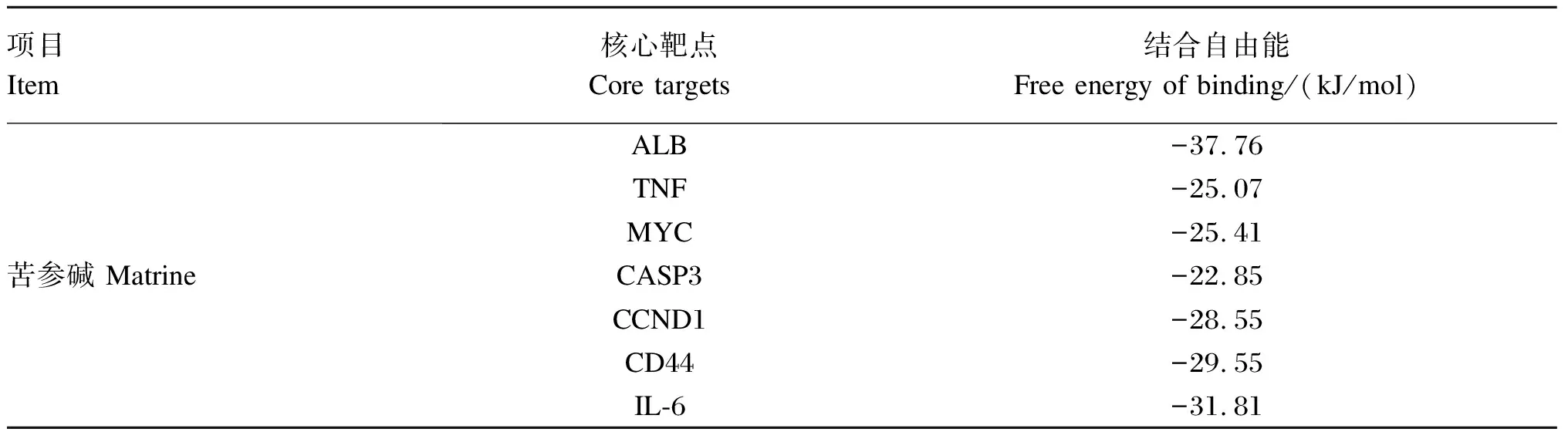
表2 苦参碱与核心靶点的分子对接结果
3 讨 论
3.1 苦参碱抗炎关键靶点分析
本研究发现,苦参碱在奶牛生产中发挥抗炎的核心靶点为ALB、TNF、MYC、CASP3、CCND1、CD44和IL-6。据报道,由巨噬细胞和单核细胞等特定细胞产生的促炎因子——肿瘤坏死因子-α(TNF-α),用于刺激炎症发生,并调节细胞中引起坏死和凋亡的一系列信号调控。这种炎性因子在抵抗感染、癌症等过程中发挥一定的作用[24]。有研究表明,苦参碱对金黄色葡萄球菌脂磷壁酸(LTA)诱导的小鼠子宫内膜炎具有一定的保护作用,且呈剂量依赖性降低促炎细胞因子[TNF-α和白细胞介素-1(IL-1)]的表达。此外,研究发现,在LTA刺激的牛子宫内膜上皮细胞(bEECs)的炎症模型中,苦参碱处理可抑制Toll样受体(TLR)2的表达及其下游核因子NF-κB的活化,从而降低炎症损伤[25]。于晓红等[26]建立了脂多糖(LPS)诱导的牛子宫内膜上皮细胞炎症模型,结果表明,苦参碱能显著降低TNF-α、IL-1、IL-6和白细胞介素-8(IL-8)mRNA的表达,具有较强的抗炎作用。据报道,IL-6是一种多功能细胞因子,通过其独特的受体系统具有多种生物活性,能够调节免疫应答、急性期应答和炎症反应[27]。此外,与本研究结果一致,丁园园等[28]研究发现,苦参碱通过调节病毒复制、凋亡和炎症反应作用于TNF-α、IL-6和CASP3靶点,从而达到治疗COVID-19的目的。本研究通过Western blot结果证明,苦参碱可通过对CASP3和CCND1蛋白的调节发挥抗炎作用。据报道,清肝化瘀颗粒的有效成分苦参碱以剂量依赖方式抑制了肝癌细胞的增殖[29],对TP53和CCND1等核心靶点具有调节作用,对肝癌细胞氧化应激胁迫标志物产生影响,引起细胞凋亡。综上可知,本研究进一步阐明了苦参碱抗炎作用的核心靶点及其作用机制。
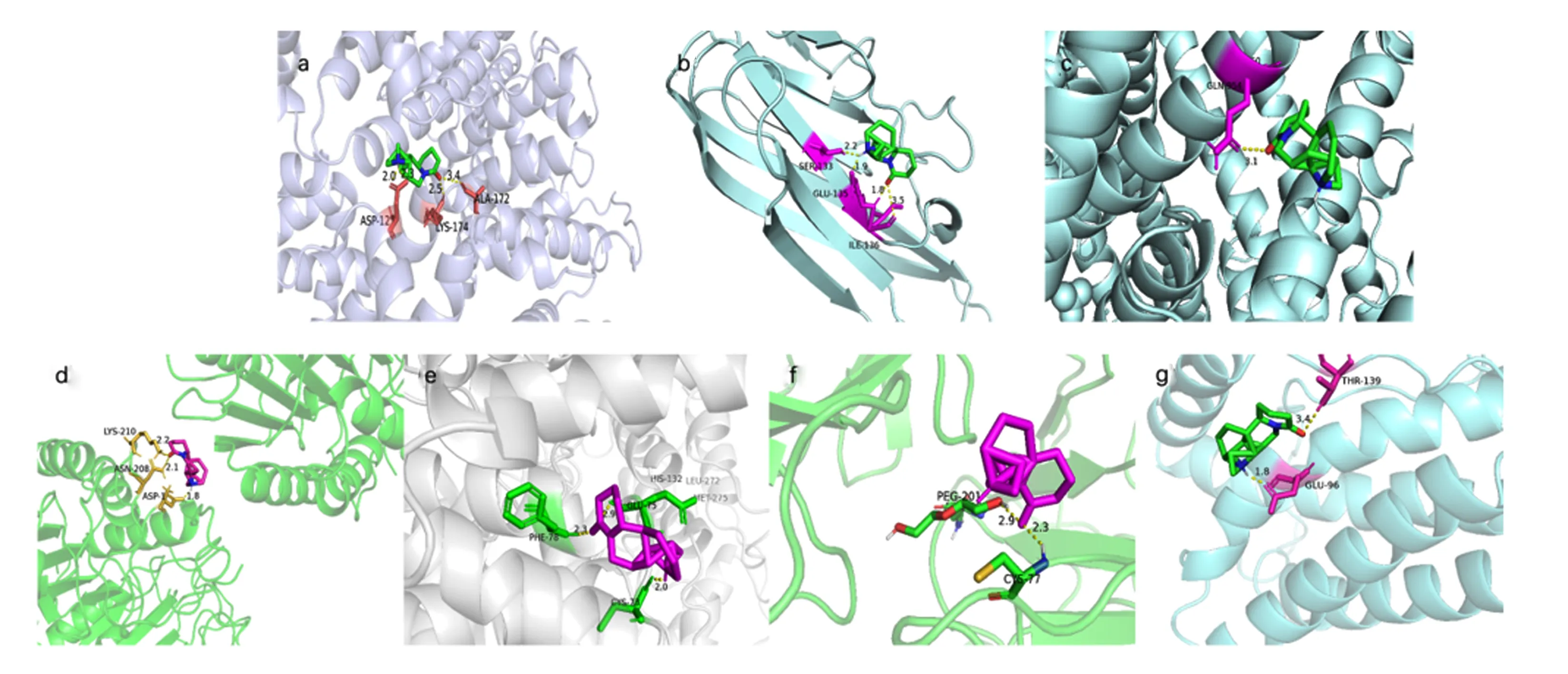
a~g分别代表苦参碱与ALB、TNF、MYC、CASP3、CCND1、CD44和IL-6的对接示意图。

**表示P<0.01,****表示P<0.000 1。
3.2 苦参碱炎症GO功能和KEGG关键通路分析
GO功能富集分析结果表明,苦参碱发挥抗炎作用的主要靶点是通过过氧化氢反应、NO生物合成过程和IL-8等途径。这与先前的研究结果一致,苦参碱可作用于白细胞介素-1β(IL-1β)、IL-17淋巴细胞或单核巨噬细胞释放的炎性细胞因子,通过Nrf2信号通路发挥作用,与提高机体抗氧化能力及降低机体氧化损伤密切有关[30]。NO作为机体重要的信号传递因子,对中枢神经系统、免疫系统及生殖系统等都具有重要作用,可广泛参与哺乳动物的生理调节。张想军等[31]发现,25~100 μg/mL的苦参碱可显著促进bMECs的增殖,并可抑制金黄色葡萄球菌入侵感染bMECs,此外苦参碱可通过干预抑制NO的分泌和NF-κB的活化发挥其抗炎作用。而且,研究表明细胞因子干扰素-γ(INF-γ)和IL-1可诱导巨噬细胞表达大量的诱导型一氧化氮合酶(iNOS)蛋白并产生NO,NO作为一个免疫功能分子从而发挥抗炎抗病毒作用[32]。IL-8作为一种细胞因子,在炎症反应发生时,具有重要的调节作用[33],研究证明,苦参碱可显著降低血清中IL-8含量,有效抑制中晚期舌癌术后患者炎症反应和肿瘤转移[21]。由此可见,苦参碱对炎症反应具有显著的抑制作用。
KEGG通路富集分析显示,苦参碱在奶牛生产中发挥抗炎作用的机制与多种信号通路等密切相关。据报道,MAPK信号通路作为哺乳动物细胞中重要的信号传递方式之一,可将细胞表面的信号通过刺激传导给细胞及其细胞核,参与细胞的增殖、分化以及细胞凋亡等生物学过程[34]。研究发现,LPS与细胞膜表面的TLR结合激活转录因子NF-κB,活化的NF-κB转移到细胞核内,从而启动炎症因子如TNF-α、白细胞介素-19(IL-19)和IL-6等基因的转录[35]。IL-17信号依赖的基因有一种独特的、组织特异性的模式,是奶牛体内重要的生理功能的基础[36]。有研究表明,苦参碱通过抑制丝裂原活化蛋白激酶(MKK)/p38 MAPK信号通路抑制炎症反应,对氧化低密度脂蛋白(ox-LDL)暴露巨噬细胞具有良好的抗炎作用[37]。据报道,苦参碱可通过抑制TNF-α、IL-6和IL-1β的生成,减少炎症浸润和脱髓鞘,缓解自身免疫性脑脊髓炎(EAE)的发生与发展。此外,苦参碱还通过高迁移率族蛋白B1(HMGB1)/TLR4/NF-κB信号通路激活发挥一定的抗炎作用[38]。此外,有研究发现,苦参碱可通过调节Th17所诱导的角质形成细胞,抑制白细胞介素-17A(IL-17A)、白细胞介素-21受体(IL-21R)以及白细胞介素-22受体1(IL-22R1)的表达,对由Th17介导的免疫性皮肤病中发挥较好的抗炎作用[39]。然而,目前关于苦参碱对奶牛抗炎作用相关的通路研究报道较少,本研究结果为进一步阐明苦参碱在奶牛抗炎作用中的机制研究提供了依据。
4 结 论
本研究通过网络药理学、分子对接技术及多种生物信息学工具,对苦参碱多靶点、多途径防治奶牛炎症的互作网络进行分析。苦参碱发挥抗炎作用的核心靶点为ALB、TNF、MYC、CASP3、CCND1、CD44和IL-6。KEGG通路富集分析结果表明,苦参碱可通过MAPK信号通路、TNF信号通路、IL-17信号通路、Toll样受体信号通路和NF-κB信号通路等发挥抗炎作用。本研究结果为苦参碱进一步在治疗奶牛炎症相关疾病中的应用提供了理论依据。
