铁死亡相关基因的卵巢癌患者生存预测模型
2023-01-03李勇廖莎
李勇 廖莎
卵巢癌是常见癌症之一,在女性恶性肿瘤中死亡率最高。许多疗法可以用于治疗卵巢癌,包括外科手术、化疗、激素疗法和放疗等。由于卵巢深居盆腔,体积小,缺乏典型症状,难以早期发现[1]。但是,即使早期接受治疗,大多数卵巢癌患者的预后仍然很差[2]。最近的研究表明,卵巢癌的发生发展涉及了许多铁死亡相关基因功能和通路,表明铁死亡基因可能与卵巢癌的临床结局有关[3]。
铁死亡是一种铁依赖性的调节性细胞死亡,由脂质过氧化的致死性积累驱动[4]。近年来,诱发铁死亡已成为触发癌细胞死亡的一种治疗选择,特别是对于对传统疗法疗效不好的恶性肿瘤[5-6]。除了引起铁死亡的药物外,许多基因也被鉴定为铁死亡的调节剂或标志物。并且已知某些基因(例如CISD1基因的多态性)对铁死亡具有负面调节作用[7]。越来越多的研究证明,铁死亡基因与卵巢癌的发生发展有关[8-9]。对铁死亡相关基因的深入了解可能会提供更准确的预后生物标志物,并可能揭示卵巢癌患者化疗和免疫疗法的更多新靶标。然而,目前还没有研究探究铁死亡相关基因是否与卵巢癌的预后有关。
本研究从公共数据库GEO和TCGA下载了卵巢癌患者的mRNA表达谱和相应的临床数据,通过建立Cox回归模型,鉴定了与预后相关的9个铁死亡相关基因。根据9个基因的表达水平,从GEO数据库患者中构建卵巢癌预后模型,并在TCGA数据库患者中进一步证实该模型的重要预后价值。最后,进一步探讨了铁死亡相关基因涉及的免疫相关通路和功能,以探索其潜在的机制。
资料与方法
1.资料收集:从GEO网站(https://www.ncbi.nlm.nih.gov/geo/)下载了380名卵巢癌患者的3级RNA测序(RNA-seq)数据和相应的临床信息。基因表达谱使用R语言中的“limma” 包标准化。从TCGA网站(https://portal.gdc.cancer.gov)获得另外377个卵巢癌患者的RNA-seq数据和临床信息。这两个数据库样本信息主要来自美国白种人群,均可公开获得。因此,本研究不需要获得地方伦理委员会批准。本研究遵循了GEO和TCGA的数据访问策略和发布指南。最后,通过数据库查找和文献检索检索到60个与铁死亡相关的基因。
2.方法:
(1)构建和验证铁死亡预后相关基因模型。用R语言中的“limma” 包识别肿瘤组织与癌旁正常组织之间的差异表达基因。然后进行总生存期的单变量Cox分析,以筛选与铁死亡相关且有预后价值的基因。通过Benjamini&Hochberg(BH)校正来调整P值。使用STRING数据库(版本11.0)构建差异基因的交互网络。为了防止过度拟合,应用了LASSO算法的Cox回归分析来构建预后模型。LASSO算法与“glmnet” R软件包一起用于变量选择和收缩。回归中的独立变量是候选预后差异基因的标准化表达矩阵,而响应变量是TCGA队列中患者的总体生存率和状态。该模型的惩罚参数(λ)通过遵循最小标准的十倍交叉验证来确定。根据每个基因的标准化表达水平及其相应的回归系数计算患者的风险评分。根据风险评分的中位数将患者分为高危和低危组。基于模型中基因的表达,使用“stats” R包的“prcomp”功能执行PCA。此外,使用“Rtsne” R软件包进行t-SNE探索不同组的分布。对于每个基因的生存分析,最佳阈值由“survminer” R包装的“surv_cutpoint”功能确定。“survivalROC” R软件包用于进行时间依赖的ROC曲线分析,以评估模型的预测能力。
(2)功能丰富分析。将9个差异基因名导入到 WebGestalt 数据库(http://www.webgestalt.org/),设定阈值 FDR<0.05,进行基因本体(GO)功能注释和基于京都基因与基因组百科全书(KEGG)通路分析,分析他们涉及的功能和通路。
(3)核心基因的表达。购买卵巢癌细胞株(OC3)和正常卵巢上皮细胞株(IOSE80)(美国ATCC公司)。使用Western Blot方法检测卵巢癌细胞中核心基因的蛋白质表达水平:先于冰上裂解细胞提取总蛋白,然后进行电泳,转膜到PVDF膜上,在5%的脱脂牛奶上封闭,加入一抗,在4度冰箱中孵育过夜,TBST洗膜,加入二抗,化学发光法拍摄。
(4)统计分析。使用Student′st检验比较肿瘤组织和癌旁正常组织之间的基因表达。通过Kaplan-Meier分析和对数秩检验比较不同组之间的总生存期。进行单因素和多因素Cox回归分析以识别预后的独立预测因子。所有统计分析均使用R软件(版本3.6.3)进行。P<0.05为具有统计学意义。
结果
1.临床特征:研究流程图如图1所示。纳入了GEO数据库的380名卵巢癌患者、TCGA数据库的377名卵巢癌患者和GTEx数据库的正常患者。患者的详细临床特征见表1。
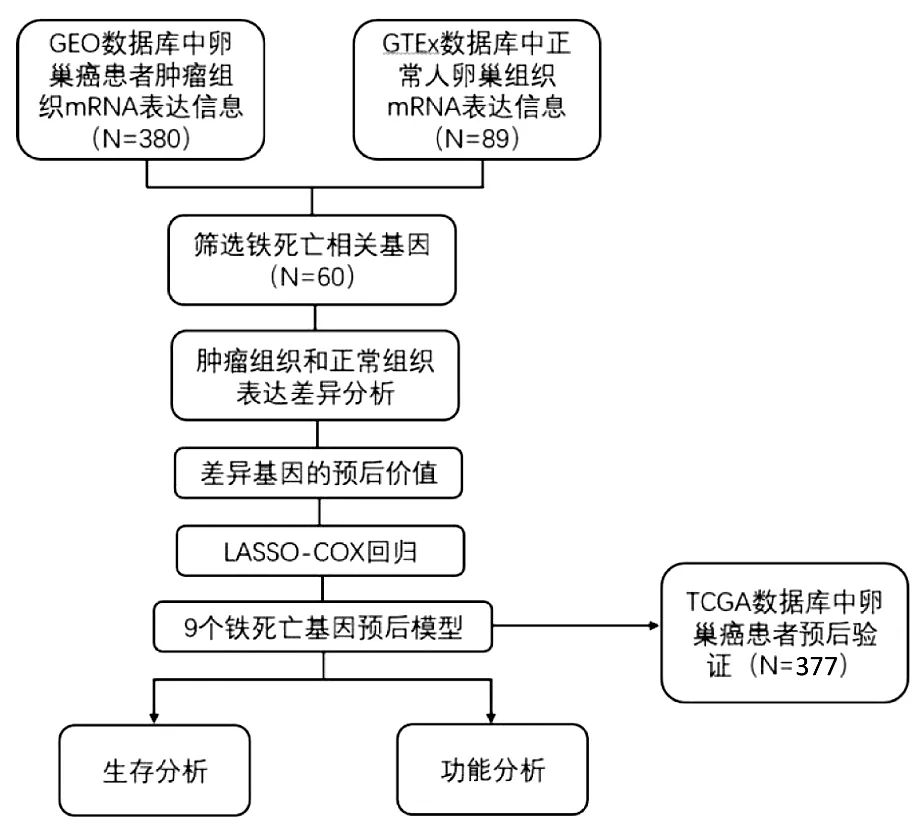
图1 流程图

表1 GEO数据库和TCGA数据库中卵巢癌患者的临床特征[例(%)]
2.在GEO队列中鉴定与预后相关的铁死亡差异基因:大多数与铁死亡相关的基因(45/60,75%)在肿瘤组织和癌旁正常组织之间差异表达(图2-a),在单变量Cox回归分析中,其中有9个(AKR1C2、AKR1C3、GCLM、NCOA4、SAT1、SLC7A11、ZEB1、NOX1、G6PD)与总生存期相关,AKR1C2、AKR1C3、ZEB1、NOX1与不良预后相关(图2-b)。这些基因之间的相互作用网络表明,GCLM、G6PD、AKR1C3、AKR1C2和SLC7A11是核心基因(图3)。这些基因之间的相关性如图4所示。

图2 与总生存期相关的9个预后基因森林图

图3 与铁死亡相关的9个预后基因相互作用图

图4 与铁死亡相关的9个基因相关性图
3.GEO队列中预后模型的构建:使用上述9个基因的表达谱,应用LASSO-Cox回归分析来建立预后模型。根据中位临界值将患者分为高危组(n =190)或低危组(n=190)(图5-a)。PCA和t-SNE分析表明,不同风险组的患者分布在两个方向(图5-b、图5-c)。如图5-d所示,高风险患者比低风险患者有更低的生存时间。同样的,Kaplan-Meier曲线表明,高危组的患者的总生存时间明显低于低危组(图5-e)。总生存时间风险评分的预测性能通过时间依赖性ROC曲线进行评估,1年生存时间的曲线下面积(AUC)为0.842,2年为0.819,3年为0.831(图5-f)。
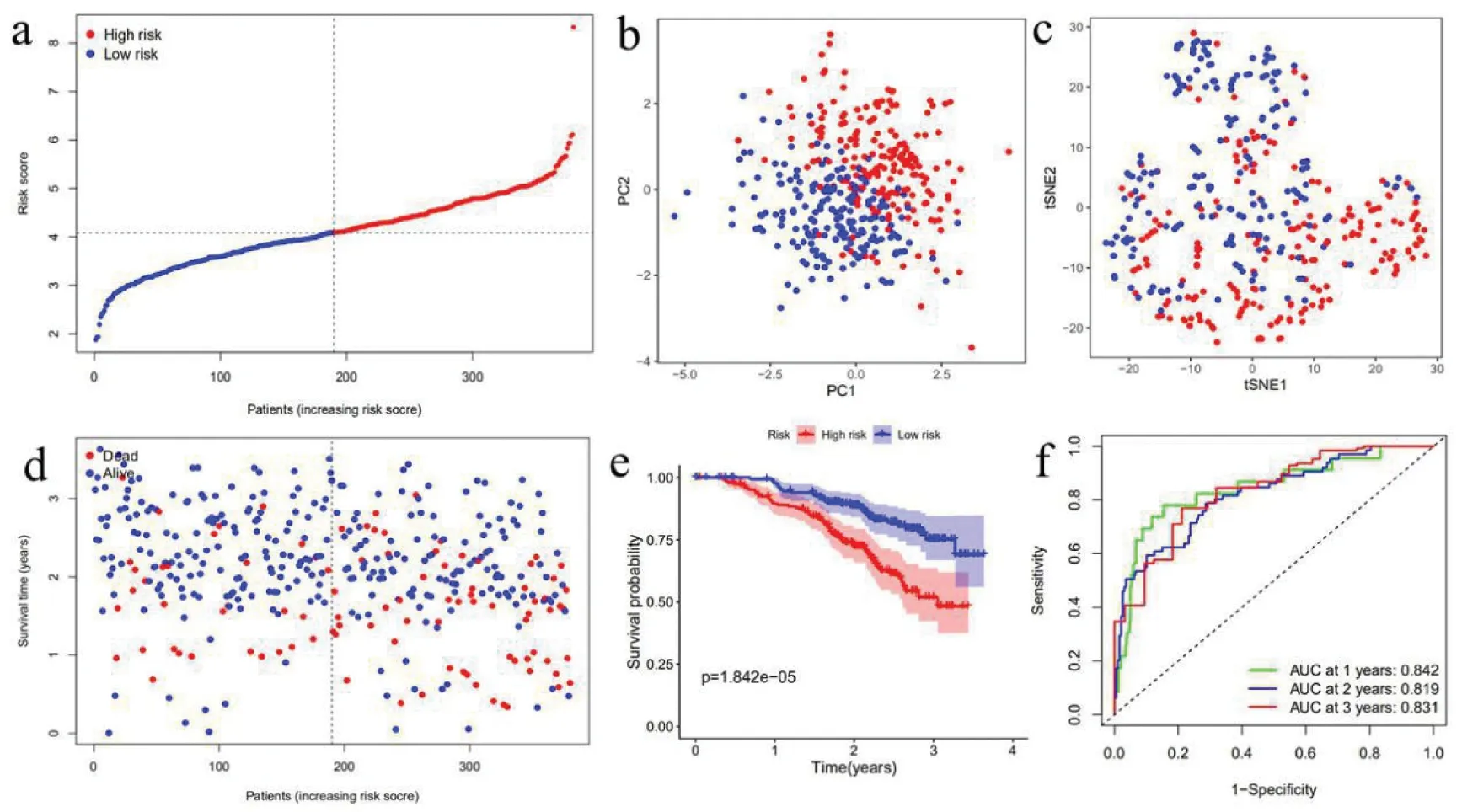
图5 根据GEO队列建立预后模型
4.TCGA队列验证基因模型:验证GEO队列构建的模型鲁棒性,TCGA队列的患者也按照与GEO队列相同的方法分为高危组或低危组(图6-a)。结果与GEO队列相似,PCA和t-SNE分析证实了两个亚组中的患者分布在离散的方向上不同(图6-b、图6-c)。同样,与低危组相比,高危组患者更有可能更早死亡(图6-d),并且生存时间缩短(图6e)。此外,由9个基因建立的模型预测死亡率的AUC也是较高的,在1年时为0.74,在2年时为0.73,在3年时为0.68(图6f)。
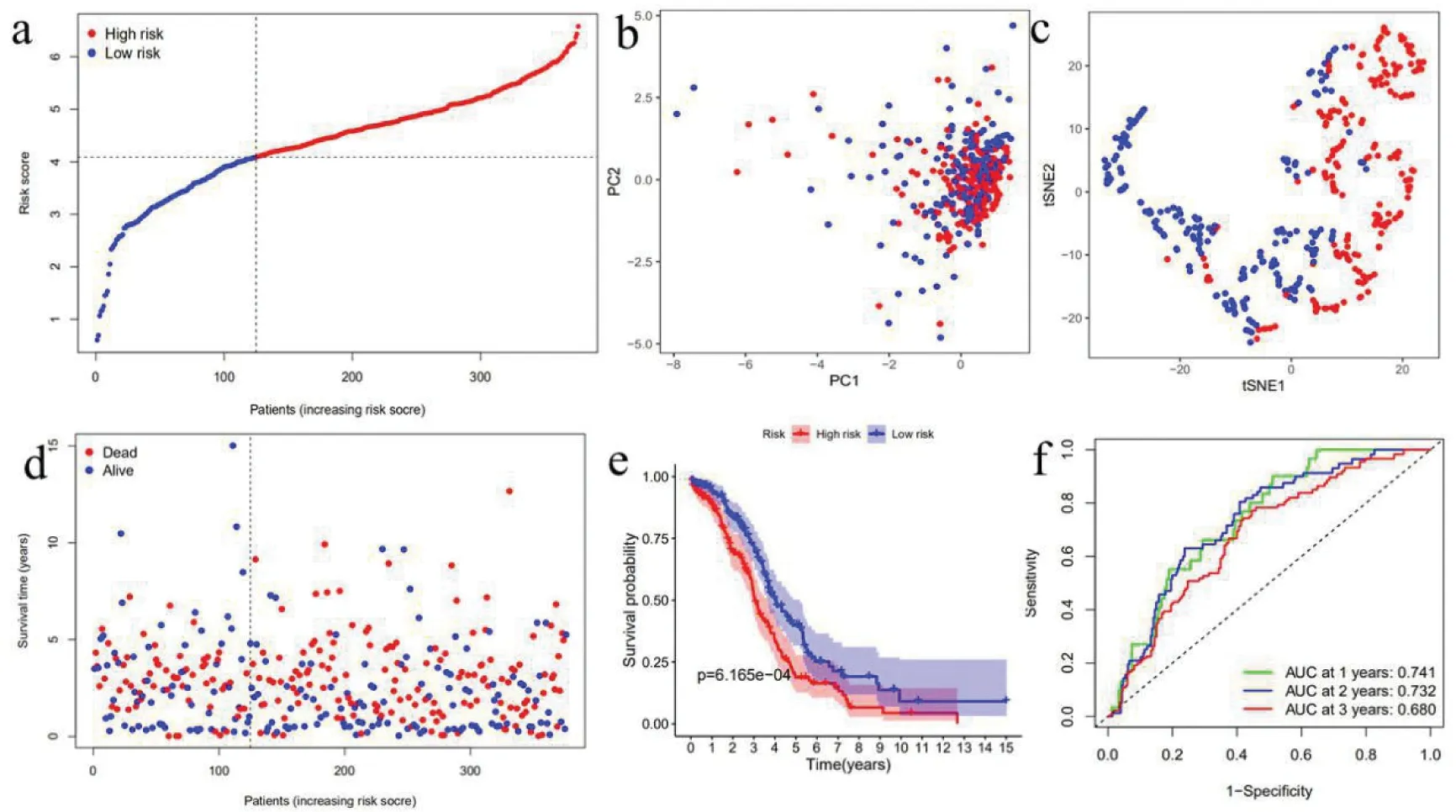
图6 根据TCGA队列验证预后模型
5.GEO和TCGA队列中的功能分析:为了阐明与风险评分相关的生物学功能和途径,使用高风险和低风险组之间的9个差异基因进行GO富集和KEGG途径分析。图7-a表示了GO富集分析,红色,蓝色和绿色的条形表示生物过程,细胞成分和分子功能类别。条形图的高度表示类别中注释基因重叠的基因数。结果显示,差异基因富含多种与铁有关和免疫相关的生物过程和分子功能,生物过程例如细胞代谢的调控、多细胞生物过程、细胞发育过程、对刺激的翻译等,细胞成分主要位于胞质和细胞核,分子功能例如离子结合、转运、酶活性调节等(图7-a)。KEGG通路分析还表明,这9个差异基因富集了蛋白聚糖在癌症中、内质网中蛋白质加工、Th17细胞分化、小细胞肺癌、Th1和Th2细胞分化、脂肪细胞因子、基底细胞癌等和癌症、免疫、细胞因子相关的通路(图7-b)。

图7 GO功能和KEGG途径分析
6.核心基因的表达分析:5个核心基因在卵巢癌细胞(OC3)中的表达与之前生物信息学挖掘数据库分析的情况一致。与正常卵巢上皮细胞(IOSE80)相比,GCLM、G6PD基因的表达在卵巢癌细胞中上调,AKR1C3、AKR1C2和SLC7A11基因的表达在卵巢癌细胞中下调(图8)。
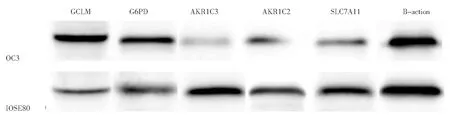
图8 核心基因在卵巢癌细胞中的表达
讨论
本研究系统地研究了60种与铁死亡相关的基因在卵巢癌组织中的表达及其与总生存期的关系。首先建立了一个整合了9个与铁死亡相关基因的新型预后模型,并用外部数据对其进行了验证。功能分析表明,这些基因涉及了丰富的癌症、免疫、细胞因子相关通路。Western Blot实验也表明;核心基因在卵巢癌中的表达与之前分析的情况大致相同。
尽管先前的一些研究表明,几种基因可能在卵巢癌中引起铁死亡,但它们与卵巢癌患者总生存期的相关性仍然未知。在本研究中,大多数与铁死亡相关的基因在肿瘤和癌旁组织之间有差异表达,在单变量Cox回归分析中,超过一半与OS相关。这些结果显着表明了铁死亡在卵巢癌中的潜在作用,以及用这些与铁死亡相关基因建立预后模型的可能性。
本研究中建立的预后模型由9个与铁死亡相关的基因(AKR1C2、AKR1C3、GCLM、NCOA4、SAT1、SLC7A11、ZEB1、NOX1、G6PD)组成。这些基因可大致分为四类,包括铁代谢(NCOA4),脂质代谢(AKR1C2、AKR1C3、ZEB1),抗氧化剂代谢(GCLM、SLC7A11、NOX1)和能量代谢(G6PD,SAT1)[10]。NCOA4是核受体共激活子4,能够介导铁蛋白吞噬,敲除可以抑制由氨基酸或胱氨酸减少引起的铁死亡,还能抑制雌激素引起的铁死亡[11-12]。AKR1C是醛糖酮还原酶家族1成员C1,能够调节氧化脂质分解产物的降解,能上调表达来抗雌激素引起的铁死亡[13]。ZEB1锌指E-盒结合同源异形盒,是EMT调节剂和生脂因子,敲除后可以抑制GPX4减少引起的铁死亡[14]。GCLM也能通过调节氧化作用抑制铁死亡[15]。SLC7A11是溶质载体家族7成员11,是Xc-系统的亚基,可以将胱氨酸导入细胞,能抑制铁死亡[16]。NOX1是NADPH氧化酶超氧化物,能抑制非小细胞肺癌细胞中蛋白素诱导的铁死亡[16]。G6PD和SAT1是两个参与能量代谢的铁锈调节剂[16-18]。据报道G6PD参与磷酸戊糖途径,敲除后能抑制非小细胞肺癌细胞里雌激素引起的铁死亡。这些基因是否通过影响铁死亡的过程而在卵巢癌患者的预后中发挥作用还有待进一步阐明。
肿瘤免疫与铁死亡之间潜在的调控机制仍未得到阐明,本研究根据不同风险组之间的差异基因进行了KEGG途径和GO功能富集分析,结果发现许多与癌症、免疫、细胞因子相关的生物过程和途径被富集。因此,有理由认为铁死亡可能与肿瘤免疫有密切联系。
本研究有几个局限性。首先,预后模型是利用公共数据库的回顾性数据构建和验证,还需要更多的前瞻性数据用以验证其临床效用。其次,本研究仅纳入铁死亡相关模型建立预后模型,难以避免混杂因素,因为卵巢癌中还有许多突变的预后基因可能被排除在外。未来将开展进一步的实验来验证铁死亡基因与肿瘤免疫之间的关系。
综上所述,本研究建立了一个铁死亡相关基因的新型预后模型。该模型在GEO数据库和TCGA数据库中均被证明与预后独立相关。今后将进一步研究卵巢癌中铁死亡相关基因和肿瘤免疫之间的潜在机制,为卵巢癌的治疗和预测预后提供新的思路。
