二氧化硫调控亚硫酸盐代谢对葡萄采后灰霉病的抑制作用
2022-12-31伊丽达娜迪力夏提
王 曼,魏 佳,伊丽达娜·迪力夏提,张 政,吴 斌*
(1 新疆农业大学食品科学与药学学院 乌鲁木齐830052 2 新疆农业科学院农产品贮藏加工研究所 乌鲁木齐830091 3 新疆农产品加工与保鲜重点实验室 乌鲁木齐 830091)
灰霉病是由灰葡萄孢引起的一种真菌性采后病害,引起葡萄浆果采后品质的快速下降[1]。葡萄果实表面发生机械损伤后,容易遭受病原菌的侵染[2]。果皮表面会产生褐色的凹陷斑,病程发展迅速且难以控制,致鲜食葡萄货架期缩短并影响其商品性,造成巨大的经济损失[3]。
自1925 年Winker 采用二氧化硫(Sulfur dioxide,SO2)熏蒸处理葡萄以来[4],SO2作为一种商业化鲜食葡萄保鲜剂至今还无法替代。SO2通过降低果实中氧含量,抑制氧化酶活性和微生物活动,防止果实腐烂变质、变色[5],其作用方式可能与诱导果实组织产生抗病性有关[6]。SO2作为一种常见形态的外源硫,能延缓果实采后贮藏品质劣变,抑制植物病原菌生长,增强其防御机制[7]。外源硫在葡萄贮运期间对其品质起到“保驾护航”的作用[8],不仅能有效抑制灰霉病发生[9],还可以引起葡萄浆果转录组数据的大规模重组[10],参与调节防御相关酶基因的表达,激活次生代谢和抗病相关蛋白的防御系统[11]。然而,外源SO2如何参与硫代谢途径影响果实品质和提高抗病性方面至今还不清楚。
硫代谢途径是植物生长发育过程中重要的防御途径之一,作为植物中含硫化合物吸收和转运的关键途径,它和植物生理反应密切相关。植物中的含硫化合物作为硫代谢的中间产物对植物抗毒素、抗真菌性病害效果显著,并参与耐受和防御生物胁迫反应[12]。内源硫多以硫化氢(Hydrogen sulfide,H2S)形式存在,参与调控植物多种代谢过程[13]。外源SO2气体进入植物细胞质外体与水结合形成SO32-[14],SO32-直接被运输至质体中,被亚硫酸盐还原酶(Sulfite reductase,SiR)还原成硫化物(主要以H2S 形式,S 成为还原态S2-),经乙酰丝氨酸裂解酶(O-Acetylserine(thiol)lyase,OASTL)的催化,H2S 与乙酰丝氨酸(O-Acetylserine,OAS)反应生成半胱氨酸(Cysteine,Cys),而Cys是植物硫代谢途径中的中心位置[15],其中OAS 又是在丝氨酸乙酰转移酶(Serine acetyltransferase,SAT)催化下形成的。关于葡萄采后贮运过程中的硫代谢作用机制尚不明确,外源SO2如何参与硫代谢相关途径鲜见研究报道。本文以外源SO2影响亚硫酸盐代谢对葡萄采后灰霉菌的抑制作用为切入点,从硫代谢角度解析外源SO2处理对葡萄抗灰霉病的调控作用,为进一步揭示其在葡萄保鲜过程中的作用机制提供理论依据。
1 材料与方法
1.1 材料与试剂
木纳格葡萄(Vitis vinifera L.cv ‘Munage’)采摘于新疆阿图什市葡萄种植园,挑选果梗嫩绿、成熟度一致(TSS≥16%)、大小均一、无机械损伤、无病虫害的葡萄果实,立即运往新疆农业科学院农产品贮藏加工研究所,常温放置进行试验。
SO2标准气体(≥99.99%),新疆乌鲁木齐鑫天意有限公司;磷酸氢二钠、磷酸氢二钠、聚乙烯吡咯烷酮,天津市福晨化学试剂厂;三氯乙酸,天津市致远化学试剂有限公司;盐酸,天津福晨化学试剂厂;氢氧化钠,天津市光复科技发展有限公司;碘、酚酞,天津市致远化学试剂有限公司;硫代巴比妥酸,上海展云化学有限公司;还原甲基紫精、乙酰辅酶A 钠盐、O-乙酰基-L-丝氨酸盐,乌鲁木齐国耀化玻仪器有限公司,以上试剂均为分析纯级。RNA 提取试剂盒、反转录试剂盒,天根生化科技有限公司。
1.2 仪器与设备
UV-2000 型紫外分光光度仪,日本岛津有限公司;DELTA320 分析天平,梅特勒-托利多仪器(上海)有限公司;SIM-F140ADL 制冰机,日本松下电器;DW-86L626 超低温冰箱,青岛海尔特种电器有限公司;D-78532 微型离心机,德国Hettich公司;DYY-6D 电泳仪,北京市六一仪器厂;SERIAL N 凝胶成像系统,英国Uvitec Firereader 公司;LightCycler96 荧光定量PCR 仪,美国罗氏公司;OSE-MP25 TGear Plate 微孔板离心机,天根生化科技有限公司。
1.3 处理方法
1.3.1 菌悬液的制备 灰葡萄孢菌种由新疆农业科学院微生物所提供。将灰葡萄孢接种在马铃薯葡萄糖琼脂培养基上,在22 ℃的恒温保湿培养箱中培养7 d 后,加入5.0 mL 含有0.05%吐温80 的无菌去离子水,轻轻刮取培养基表面收集孢子。将收集液倒在灭菌后的纱布上面进行过滤,再将滤液调配到最终浓度为1×105个/mL 进行后续试验。
1.3.2 样品处理方法 将试供材料随机分组,放置在一定体积的密闭箱中,以200 μL/L 的SO2熏蒸处理2 h 为试验组,无处理作为对照组。熏蒸完成后室温放置24 h,将葡萄果粒剪下(保留果柄),果实表面先用无菌水擦拭,再用75%的酒精溶液擦拭果实表面需要接种的位置。在葡萄赤道部位刺伤(直径1.67 mm,深度3.00 mm),接种10 μL的灰霉菌菌悬液(浓度为1×105个/mL),放入聚乙烯样品盒中,放置恒温培养箱中(22±1)℃培养。每个处理3 次平行,每次选用700 个果粒,进行每天取样,共7 次。选取果实病斑外围2~10 mm 的果肉样品,切碎混匀后用液氮速冻并置于-80 ℃保存,以测定其它相关指标。
1.4 指标测定方法
1.4.1 失重率和硬度的测定 失重率参考公式(1)计算。

硬度的测定,每个处理随机选取30 颗葡萄(含皮),采用GY-4 型硬度计测定果实硬度,单位N。
1.4.2 可溶性固形物的测定 每个处理随机挑选20 颗葡萄,采用PR-PAL-1 型数显糖度计测定,各处理重复3 次。
1.4.3 可滴定酸的测定 参照Loay[16]的方法,略有改动,随机选取30 粒果实,榨汁机榨汁后,将果汁在4 ℃,8 500 r/min 离心10 min。用0.05 mol/L的NaOH 对加入酚酞的上清液进行滴定,测定3次,取平均值。
1.4.4 发病率的测定 在接种果皮处,用游标卡尺在病斑处进行十字交叉法测量,病斑直径若大于1.67 mm 则为接种发病果实。发病率计算方法如下:

1.4.5 亚硫酸盐含量 参照GB 5009.34-2016《食品安全国家标准 食品中二氧化硫的测定》[17]中的方法,略有改动。取8.0 g 样品,置于蒸馏瓶中,加入250 mL 水,装上冷凝装置,冷凝管下端插入预先备用的25 mL 乙酸铅吸收液,然后在蒸馏瓶中加入10 mL 盐酸溶液,立即盖塞,加热蒸馏。当蒸馏液约200 mL 时,再蒸馏1 min。用少量的蒸馏水冲洗插入乙酸铅溶液装置做空白试验。用碘标准溶液(0.005 mol/L)滴定。
1.4.6 硫化氢含量的测定 H2S 含量的检测方法参考杜鑫哲[18]的方法,略有改动。将装有0.5 mL Zn(Ac)2溶液的1.5 mL Ep 管放入25 mL 三角瓶中,取1.0 g 样品,冰浴研磨,加入2 mL 50 mmol/L磷酸盐缓冲溶液(0.1 mmol/L 二乙胺四乙酸、0.2 mmol/L 抗坏血酸,pH 7)放入三角瓶底部并在底部加入1 mL 1 mol/L HCl 启动反应,室温反应30 min,取出Ep 管,加入0.2 mL 20 mmol/L DPD 和30 mmol/L FeCl3混匀黑暗反应15 min,在波长670 nm 处测定吸光值。
H2S 含量的计算公式如下:

式中,c——H2S 浓度,mol/L;m——样品质量,g。
1.4.7 半胱氨酸含量的测定 参照Rahat 等[19]的方法,略有改动。取1.0 g 样品,冰浴研磨,体积分数为5%的高氯酸中研磨。12 000 r/min 离心20 min。收集上清液加1 mL 酸性茚三酮试剂。在波长560 nm 处读取吸光值,半胱氨酸的量为参照标准半胱氨酸在类似条件下获得标准曲线计算。
1.4.8 SiR、SAT、OAS-TL 活力测定 SiR 活力参照Randewig 等[20]的方法进行测定,略有改动,取1.0 g 样品冰浴研磨,加入5 mL 0.1 mol/L Hepes-NaOH(pH 7.8),在4 ℃、14 000 r/min 离心10 min,取80 μL 上清液加入20 μL 100 mmol/L 醋酸缓冲溶液再加入400 μL 反应液(25 mmol/L Hepes-NaOH、1 mmol/L Na2SO3、5 mmol/L OAS-HCl、10 mmol/L DTT、30 mmol/L NaHCO3、15 mmol/L Na2SO4、5 mmol/L还原甲基紫精)15 min 后 加 入50 μL 20% TCA。测定半胱氨酸含量,以每分钟生成1 μmol Cys 为1 U,酶活性以U/g 表示。
SAT 活力参照王璐怡[21]的方法进行测定,略有改动,取1.0 g 样品冰浴研磨,加入3 mL 提取液(30 mmol/L Tris-HCl 内含10 mmol/L DTT)冰浴研磨,在4 ℃、14 000 r/min 离心20 min。取100 μL 上清液加入100 μL 反应液(4 mmol/L L-丝氨酸、2 mmol/L 乙酰辅酶A、0.5 mmol/L DTT、1 mmol/L Na2S、50 mmol/L K2HPO4-KH2PO4、pH 7.5)25 ℃条件下培养10 min,加50 μL 20% TCA终止反应,测定半胱氨酸含量,以每分钟生成1 μmol Cys 为1 U,酶活性以U/g 表示。
OAS-TL 活力参照Liang 等[22]方法进行测定,略有改动。取1.0 g 样品冰浴研磨,加入1 mL 20 mmol/L Tris-HCl 冰浴研磨,在4 ℃、13 000 r/min离心10 min,取上清50 μL 加入1 mL 反应液(5 mmol/L OAS、5 mmol/L Na2S、33.4 mmol/L DTT,100 mmol/L Tris-HCl)。37 ℃孵育30 min,测定半胱氨酸含量,以每分钟生成1 μmol Cys 为1 U,酶活性以U/g 表示。
1.4.9 果实中SiR1、SAT1、SAT2、SAT5 和OASTL 的基因表达量分析 样品加入液氮研磨成粉末,参照快速RNA 提取试剂盒说明书的步骤进行操作。RNA 浓度及纯度检测合格后采用反转录试剂盒进行反转录,合成的cDNA 第一链置于-20℃备用。采用qPCR 仪分析基因的相对表达量。95℃预变性30 s;95 ℃变性10 s,退火温度,10 s,72℃延伸10 s,40 个循环;95 ℃10 s,59 ℃60 s,97℃1 s;37 ℃30 s。每个样品重复3 次。采用2-ΔΔCT法[23],将第0 天样品数据定义为1,其它取样时间点基因表达均与第0 天比较,计算出相对表达量,Actin 为内参基因。

表1 亚硫酸盐代谢相关引物序列Table 1 Sulfite metabolism-related primer sequences
1.5 数据处理
使用GraphPad Prism 8.0.2 软件作图,SPSS 20.0 进行数据分析以及利用Duncan 法来比较均值。P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 SO2 处理对果实生理品质的影响
如图1a 表明,两组果实硬度的变化趋势一致,均呈下降趋势,处理组硬度显著高于对照组(P<0.01),SO2处理能够显著延缓果实软化进程。在图1b 中,失重率总体呈现上升趋势,处理组均低于对照组。在0~3 d 时无差异显著,在4~6 d 呈极显著差异(P<0.01),表明SO2处理在贮藏期间能够有效地延缓水分的流失。
果实中可溶性固形物含量变化呈先上升后下降趋势,对照组高于处理组(图1c)。所有处理在第0~4 天缓慢上升,随之又呈急速下降趋势,且对照组下降速度大于处理组,并在第4 天出现峰值(P<0.01)。至贮藏结束时,处理组比对照组高0.84%。
果实中可滴定酸含量在贮藏期间呈先下降后上升再下降的变化趋势(图1d)。在贮藏前2 d 出现下降趋势,且处理组高于对照组,第2 天同时出现最低点。处理组在第3~4 天出现上升趋势,第4天达到峰值随之开始下降,而对照组则是第3 天出现峰值。贮藏后期处理和对照组同步出现下降趋势,随着贮藏时间的延长,导致有机酸含量逐渐降低。

图1 SO2 处理对果实生理品质的影响Fig.1 Effects of SO2 treatment on postharvest physiological quality of fruit
2.2 SO2 处理对果实发病率的影响
由图2 可知,果实发病率的变化趋势一致且呈现上升趋势。在第2~4 天时果实发病率出现极显著差异(P<0.01)且对照组高于处理组。对照组和处理组的发病时间分别为第2 天和第3 天;第4 天时对照组的发病率达到了100%。
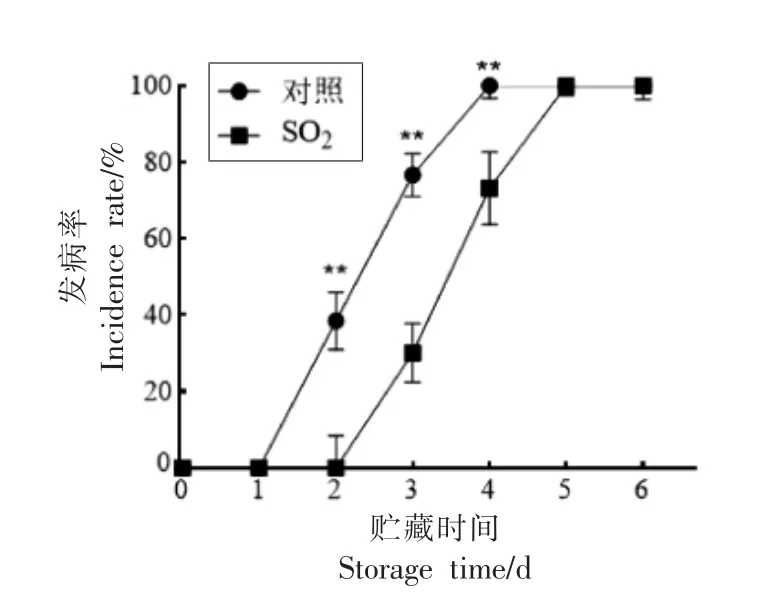
图2 SO2 处理对果实发病率的影响Fig.2 Effects of SO2 treatment on postharvest morbidity of fruit
2.3 SO2 处理对果实亚硫酸盐相关代谢物含量的影响
果实中亚硫酸盐含量变化趋势一致,处理组高于对照组(P<0.01)。(图3a)。处理组前4 d 缓慢上升,第4~5 天期间出现快速上升趋势,第5 天达到峰值(24.71 mg/kg),随之开始下降;而对照组前4 d 亚硫酸盐含量变化趋于平稳,无显著变化,第5~6 天呈现上升趋势,第6 天达到最大值(14.11 mg/kg)。
在图3b 中,果实中的硫化氢含量变化呈先上升后缓慢下降趋势,处理组均高于对照组,在0~4 d 期间呈极显著差异。处理组第0 天的硫化氢含量是对照组的2.77 倍,所有处理第2 天均达到峰值,贮藏后期处理组的下降速度较快,而对照组的下降速度较缓慢。
处理组显著提升了果实中半胱氨酸的含量,呈先上升后平稳下降的趋势(图3c)。处理组第3天达到峰值,贮藏后期平缓下降,下降幅度较小,第6 天半胱氨酸含量是对照组的2.35 倍(P<0.01)。对照组第0~3 天呈现上升趋势,而在第4~6 天呈曲折下降趋势且第5 天达到最大值(0.4 nmoL/g)。

图3 SO2 处理对果实亚硫酸盐相关代谢物含量的影响Fig.3 Effects of SO2 treatment on the content of postharvest sulfite related metabolites in fruit
2.4 SO2 处理对果实亚硫酸盐代谢相关酶活力的影响
SiR、SAT 和OAS-TL 是亚硫酸盐代谢途径中的主要相关酶。由图4a~c 可知,与对照组相比,SiR、SAT 和OAS-TL 的活力分别提高了4.33,1.02倍和1.37 倍。处理组的SiR 活力平稳上升,对照组的SiR 活力先平稳上升后缓慢下降(图4a)。第0~2 天处理和对照组无显著差异,而第3~6 天出现极显著差异(P<0.01)。处理组中SiR 活力由0.06 U/g 升高到0.26 U/g,对照组中SiR 活力由0.08 U/g 上升到0.14 U/g,第6 天处理组是对照组的1.86 倍。
由图4b 可知,所有处理中SAT 活力保持在一个相对平稳的状态,在第3 天均出现最低点,第0 天和第2~4 天呈现极显著差异(P<0.01)。处理组第2 天出现最大值是对照组的1.31 倍。
OAS-TL 活力变化呈先上升后下降的趋势,第0~2 天无显著差异,第3~6 天呈差异极显著(图4c)。处理和对照出现峰值时间分别为第4 天和第2 天,第4 天时OAS-TL 活力是对照组的4.07 倍(P<0.01),对照组在第2 天后出现快速下降趋势。
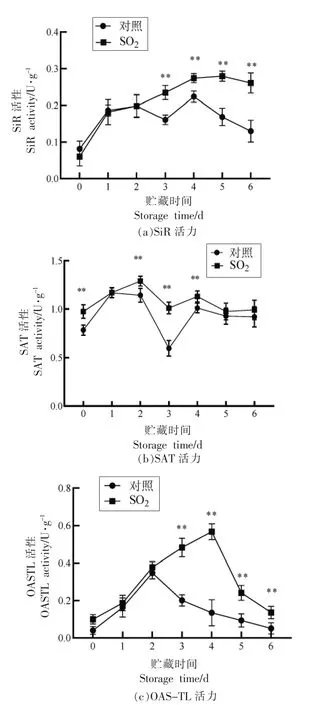
图4 SO2 处理对果实亚硫酸盐代谢相关酶活力的影响Fig.4 Effects of SO2 treatment on activities of enzymes related to sulfite metabolism in postharvest fruit
2.5 SO2 处理对果实亚硫酸盐代谢相关基因表达量的影响
图5a~e 为亚硫酸盐代谢的相关基因表达量。处理组中VvSiR1 相对表达量在第0~5 天持续上调,表达水平呈现先上升后下降趋势;第2 天时相对表达量达到最大值是对照组的39.18 倍,随之呈下降趋势;第3~5 天相对表达量分别是对照组的3.67,4.00 和1.55 倍(P<0.01)。对照组则是呈缓慢上升的趋势;在0~2 d 相对表达量无明显变化,至贮藏结束时,达到最大值并高于处理组50.39%(图5a)。
VvSAT1 基因的相对表达量总体呈现曲折上升的变化趋势(图5b)。两组处理前期无显著差异,则在后期表现极显著差异。处理组在第3,4,6天时高于对照组(P<0.01),VvSAT1 的相对表达量上调,第6 天时出现最大值(5.78)。对照组中的VvSAT1 基因的相对表达量平稳上升,并和处理组同在第6 天出现峰值。
如图5c 所示,VvSAT2 基因的相对表达量处理和对照组均是呈现下降趋势,对照组高于处理组,下调了VvSAT2 基因表达。处理和对照组的VvSAT5 基因相对表达量变化趋势有一定差异(图5d)。处理组第3 天出现峰值,在第0,2,3,5 天时上调了该基因的表达,分别是对照组的2.82,1.31,1.50 倍和5.21 倍。对照组第1~3 天无明显变化,在第4 天时快速下降随后保持相对平稳趋势。
VvOAS-TL 相对表达量在对照组中呈现先上升后下降的趋势(图5e)。处理组在第0~4 天显著上调了VvOAS-TL 相对表达量(P<0.01),第4 天达到最大值为1.46,随后呈现下降趋势且低于对照组。第0 天处理组VvOAS-TL 相对表达量是对照组的1.71 倍。

图5 SO2 处理对果实亚硫酸盐代谢相关基因表达量的影响Fig.5 Effects of SO2 treatment on the expression levels of genes related to postharvest sulfite metabolism in fruit
3 讨论
灰霉病是导致葡萄采后贮运过程中腐烂变质的主要病害,严重制约葡萄产业的发展。本文通过外源SO2熏蒸处理后损伤接种灰葡萄孢的方式,研究SO2调控亚硫酸盐代谢途径对提高葡萄采后对灰霉病抗性的作用。本研究发现贮藏期外源SO2处理不仅延迟了发病时间,降低果实发病率和贮藏过程中果实的失重率,还延缓了果实软化。接种的灰葡萄孢在生长繁殖过程中需要消耗果实中营养物质造成可溶性固形物含量的下降[24]。此外,有机酸转化成其它物质成分[25],或是果实接种灰霉菌使得有机物被消耗分解[26],导致可滴定酸含量的下降。图1d 中第2~4 天出现返酸的现象可能是由于微生物代谢产酸。
鲜食葡萄在熏蒸处理过程中,SO2进入葡萄果实,并诱导了亚硫酸盐的生成,从而使其含量增加[27]。有研究表明一定浓度的亚硫酸盐可以提高小麦的防御体系,增强了植物的抗性减轻植物所受的伤害[28]。本试验中亚硫酸盐含量前期缓慢平稳后期快速上升,并且处理组显著高于对照组。在亚硫酸盐代谢过程中SO32-运入质体后被SiR 持续还原为H2S,随后通过SAT、OAS-TL 合成Cys 来解除其细胞毒性[29]。因此,亚硫酸盐含量的上升为下游H2S 的合成提供必需化合物。H2S 可通过调节植物生长发育和生物胁迫的抵御能力,来增强植物生物与非生物的抗病性[30]。Cys 是硫代谢的枢纽,也是参与植物抗氧化和抗感染防御反应的含硫有机物[31]。有研究表明施硫可以激发植物硫相关代谢过程,提高Cys 和H2S 含量导致病情指数的下降从而增强植物对真菌的抗性,为植物抵御真菌提供代谢途径[32]。整个贮藏期处理组中H2S和Cys 含量显著高于对照组,这与前人研究结果一致,说明外源SO2处理可以提高葡萄果实贮藏期间亚硫酸盐代谢途径中代谢物含量来增强对灰霉菌的抵御能力。
SiR 和OAS-TL 是促进无机硫转化为有机硫的关键酶。本试验结果显示SiR 和OAS-TL 酶活性在第3 天之后上升幅度较大,这与Cys 含量变化趋势相似,说明在贮藏后期酶活性的上升增加了Cys 的含量,从而增强果实对灰霉病的抗病性。其中OAS-TL 是亚硫酸盐代谢途径中的最后一个酶。研究发现OAS-TL 对胁迫有更强的耐受力和抵抗力,其酶活力受硫含量的影响[33],因此,SO2处理后H2S 含量维持较高水平有利于下游OAS-TL酶活力的增强,而OAS-TL 酶活力的上升有助于合成Cys。外源SO2处理显著上调了果实中亚硫酸盐代谢途径相关基因VvSiR1、VvSAT1、VvSAT5和VvOAS-TL 的相对表达量,这与外源SO2处理后相关酶SiR、SAT 和OAS-TL 活力变化趋势一致,说明外源SO2有助于增强葡萄果实亚硫酸盐代谢途径中相关酶活性和基因表达量,从而促进对灰霉病的抑制作用。贮藏前期VvSiR1 基因的高表达与H2S 前期出现高峰一致,说明VvSiR1 基因通过调控SiR 的活性提高H2S 的含量来增强果实抵御灰霉病的能力。SAT 酶活力总体上调幅度趋于一个相对平稳的状态,VvSAT5 基因相对表达量在贮藏前期显著上调,VvSAT1 基因在贮藏后期显著上调。值得注意的是不同SAT 家族基因对Cys的反馈抑制敏感性不同。本文中VvSAT2 基因表达下调,研究表明只有在缺硫或镉胁迫情况下此基因才会上调表达[34]。
4 结论
外源SO2可以通过调控葡萄采后亚硫酸盐代谢过程,降低贮藏期间果实的失重率,保持其硬度,延缓可溶性固形物和可滴定酸含量的下降,诱导亚硫酸盐含量的上升。由于VvSiR1、VvSAT1、VvSAT5 和VvOAS-TL 基因表达的上调,提高了SiR、SAT、OAS-TL 酶活性,增加了Cys 和H2S 含量,抑制果实的发病率延迟其发病时间,从而增强了果实对生物胁迫的抗性,抑制了果实中灰葡萄孢的生长,激活了果实防御能力。外源SO2调控可以促进葡萄采后亚硫酸盐代谢水平,诱导果实对灰葡萄孢的抗病性,可为深入解析外源SO2在葡萄采后生物学调控机制的研究提供理论依据。
