茶多酚对谷氨酸脱氢酶和纳豆氨含量的影响
2022-12-31肖雅丽张建华钟耀广
肖雅丽,张建华,钟耀广*
(1 上海海洋大学食品学院 上海201306 2上海交通大学农业与生物学院 上海 200240)
我国现有心血管疾病患者约3.3 亿人,40%的患者存在死亡风险[1]。近年来,通过食疗“治未病”的思想越来越受到人们的认可。纳豆是一种由纳豆芽孢杆菌发酵而成的传统豆制品,因富含能溶解血栓的纳豆激酶(Nattokinase,NK)而具有预防心血管疾病的功效[2-5],一直备受营养学界的推崇,在我国推广纳豆具有深远意义。然而,在纳豆发酵过程中,谷氨酸脱氢酶(Glutamate dehydrogenase,GDH)能够催化谷氨酸经脱氨基作用产氨[6-7],使纳豆带有强烈的氨味,极大地降低了我国消费者对其的接受度。
为了降低纳豆的氨味,目前大部分研究主要从菌种改良、原料调整和调味料添加等方面进行尝试[8]。郑丹妮等[9]筛选出两株优良纳豆芽孢杆菌,用其混合发酵纳豆,氨含量降低了42.30%。耿晓然等[10]和高沛汝[11]利用纳豆芽孢杆菌和酿酒酵母混合发酵,分别使纳豆的氨含量降低了40.10%和11.64%。谭周进等[12]在纳豆发酵原料中加入10%的糯米,得到氨味较淡的产品。耿晓然[13]根据我国消费者的口味偏好和需求设计了纳豆调味包,有效掩盖了纳豆的氨味。这些方法虽行之有效,但仍存在诸如工艺繁琐、成本较高、发酵控制难度增加等不足。本研究旨在通过抑制GDH 酶活来减少纳豆中氨的产生,从根本上改善纳豆的风味。
目前已有多种GDH 抑制剂的相关报道。Jin等[14]和Yu 等[15]发现依布硒啉(Ebselen)是大肠杆菌和人源GDH 的可逆活性位点抑制剂。王丹[16]研究发现,Zn2+、Cu2+、Ag+、Ca2+、Pb2+、尿素、甲醇、异丙醇等均对牛肝GDH 酶活有抑制作用。Li 等[17]通过高通量筛选发现多种牛源GDH 抑制剂,包括表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)、表儿茶素没食子酸酯(Epicatechin gallate,ECG)、氨三乙酸、六氯苯等。随后又证明茶多酚(Tea polyphenols,TPP)中的EGCG 和ECG是人源GDH 的可逆抑制剂[18]。Hou 等[19]合成了丙烷硒啉(Propylselen)并证明其可有效抑制大肠杆菌和人源GDH 酶活。Domith 等[20]发现绿原酸(Chlorogenic acid,CGA)以剂量依赖的方式抑制鸡胚视网膜细胞GDH 酶活。本研究从中选取可在食品中添加的TPP、CGA、Zn2+和Ca2+进行抑制效果比较,拟将GDH 抑制剂添加到纳豆中,降低纳豆中氨的含量,改善纳豆的风味,为纳豆这一食疗佳品在我国消费市场的推广提供技术支持。
1 材料与方法
1.1 试剂与菌种
谷氨酸脱氢酶标准品、尿激酶、葡萄糖酸锌,上海麦克林生化科技有限公司;茶多酚、L-谷氨酸、纤维蛋白原,侨怡生物科技(上海)有限公司;绿原酸,上海阿拉丁生化科技股份有限公司;NAD+、NADH、凝血酶,西格玛奥德里奇(上海)贸易有限公司。纳豆芽孢杆菌,实验室保藏。
1.2 仪器与设备
UV-9000S 紫外-可见分光光度计,上海元析仪器有限公司;ES-315 型高压蒸汽灭菌锅,日本Tomy 公司;超净工作台,北京东联哈尔仪器制造有限公司;Sunrise 酶标仪,瑞士Tecan 公司;ZQZY-CF 型全温恒温培养摇床,上海知楚仪器有限公司;Centrifuge 5810R 高速冷冻离心机,德国Eppendorf 公司;FOSS 自动凯氏定氮仪,上海瑞玢国际贸易有限公司;TCS SP8 STED 3X 活细胞超高分辨率多光子激光共聚焦显微镜,徕卡显微系统(上海)贸易有限公司。
1.3 方法
1.3.1 GDH 抑制剂的筛选
1.3.1.1 GDH 酶活测定原理
GDH 能催化如下反应:

本试验以L-谷氨酸为底物,NAD+为辅酶,反应朝L-谷氨酸分解的方向进行。反应中的生成物NADH 在波长340 nm 处有一强吸收峰,通过测定反应液的OD340nm即可根据NADH 标准曲线计算出GDH 酶活。NADH 标准曲线的制作参考尚原冰等[21]的方法,NADH 标准溶液用80 mmol/L 甘氨酸缓冲液(pH 9.0)配制。
1.3.1.2 试剂的配制
1)GDH 酶液 用1 mL 20%甘油溶解1 kU GDH 标准品。
2)酶活测定反应液[16]0.1 mol/L Tris-HCl(pH 7.4),含15 mmol/L L-谷氨酸和2 mmol/L NAD+。
3)抑制剂 用超纯水配制5.00 mg/mL TPP溶液、11.10 mg/mL CaCl2溶液和9.11 mg/mL 葡萄糖酸锌溶液;用0.1 mol/L Tris-HCl(pH 7.4)配制0.35 mg/mL CGA 溶液。
1.3.1.3 抑制效果的比较
1)TPP 的抑制效果 取酶活测定反应液480 μL,加入TPP 溶液5 μL、0.1 mol/L Tris-HCl(pH 7.4)9 μL 和GDH 酶液6 μL,37 ℃反应1 min 后测定酶活。以未添加抑制剂的酶活为100%,计算相对酶活。
2)Zn2+、Ca2+和CGA 的抑制效果 分别取10 μL 3 种抑制剂与10 μL GDH 酶液混合,于4 ℃放置30 min 后加入480 μL 酶活测定反应液,37℃反应1 min,测定相对酶活。
1.3.1.4 TPP 进入细菌胞内能力的检测
1)菌体培养 挑取典型的纳豆芽孢杆菌单菌落于无菌LB 培养基中,37 ℃、200 r/min 条件下培养6 h 后加入5 mg/mL TPP,继续培养3 h。取同等条件下培养9 h 但未添加TPP 的菌液做对照。
2)制片 将菌液5 000×g 离心2 min,菌体用PBS 缓冲液清洗5 遍后重悬,吸取5 μL 滴于洁净干燥的盖玻片上,另取一片盖玻片覆盖于菌液上。
3)激光共聚焦显微镜检测 在100X STED油镜下找到物象,然后切换到荧光光路。设置激发波长为430~494 nm,检测波长为500~600 nm,开启xyz 扫描和LIGHTNING 模式采集共聚焦荧光图像。
1.3.2 TPP 对GDH 的抑制类型以及IC50
1.3.2.1 抑制类型的判定
1)底物竞争型抑制 将底物谷氨酸与GDH 酶液提前混合,4 ℃放置30 min 后测定酶活并将其定为100%,测定添加不同质量浓度TPP后的相对酶活;以谷氨酸不与GDH 酶液预先混合的相对酶活为对照。
2)酶竞争型抑制 将辅酶NAD+与GDH 酶液提前混合,用与1)同样的方法测定NAD+与GDH酶液预先混合对TPP 抑制效果的影响。
1.3.2.2 IC50的测定 在酶活测定反应液中分别加 入0,10,20,30,40,50,60 μg/mL 和70 μg/mL TPP 并测定酶活,通过软件SPSS 22.0 回归分析求得IC50(即抑制50%酶活时的TPP 质量浓度)。
1.3.3 TPP 对纳豆氨含量的影响
1.3.3.1 发酵液的制备 挑取典型的纳豆芽孢杆菌单菌落接种至液体LB 培养基培养至OD600nm达到1.23±0.05。
1.3.3.2 纳豆发酵过程中氨含量的变化 挑取颗粒完整饱满的极小粒黄豆,加入3 倍体积的水于室温浸泡16 h,沥干水分后于121 ℃高压蒸煮25 min,冷却后按10%的接种量接种发酵液,于37 ℃恒温发酵24 h 后转移至4 ℃冷藏24 h。在发酵和冷藏期间定时取样,按1.3.3.4 节测定氨含量。
1.3.3.3 TPP 添加量的确定 在大豆发酵11 h 后分别加入0.56,0.96,1.36,1.76,2.16,2.56,2.96,3.36,3.76,4.16 mg/g 和4.56 mg/g TPP 后混匀,继续发酵13 h 后4 ℃冷藏24 h。空白对照组用同等体积的水代替TPP。
1.3.3.4 纳豆中氨含量的测定 纳豆氨含量的测定参考挥发性盐基氮的测定方法[22]。
1.3.3.5 NK 活性的测定 参考Kim 等[23]和Astrup等[24]的方法,制备琼脂糖-纤维蛋白平板及尿激酶标准曲线。
称取5.0 g 纳豆,加入15 mL 生理盐水振荡摇匀,4 ℃静置24 h,8 000×g 离心10 min,取上清液即为NK 粗提液。取NK 粗提液7 μL 点样于琼脂糖-纤维蛋白平板,37 ℃孵育16 h 后测量溶解圈的两垂直直径。参照尿激酶标准曲线的线性方程计算样品酶活。
1.3.4 纳豆的感官评定 在纳豆样品制备好的第2 天按表1 的标准对其进行感官分析,采用加权评分法[25],气味、质地和风味、外观的加权系数分别为0.5,0.25 和0.25。由10 人组成评定小组(5名男性和5 名女性),采取盲评模式,随机提供样品,所有评定人员独立完成样品的评分。将各个指标的得分乘以相对应的权重系数,然后去掉一个最高分和一个最低分,计算平均值即为样品所得综合评分。

表1 纳豆感官评定标准Table 1 Criteria for sensory evaluation of natto
1.3.5 数据处理 每组试验重复3 次,利用Excel 2010、SPSS Statistics 22.0 对试验所得数据进行处理和作图。
2 结果与分析
2.1 GDH 抑制剂的比较
NADH 标准曲线为y=4.7943x+0.0314(R2=0.9979),TPP、CGA、Zn2+和Ca2+对GDH 酶活的抑制效果如图1 所示。结果表明,Ca2+表现出轻微的促进作用,而Zn2+、TPP 和CGA 对GDH 酶活均有抑制作用。大部分被鉴定的GDH 都以六聚体的结构形式存在,分为两大家族[26]。家族I 由细菌和低等真核生物的GDH 组成,家族II 主要由古细菌和高等真核生物(包括植物)的GDH 组成[27]。本研究的结果不同于王丹[16]得出的40 mmol/L Ca2+即能抑制约20%牛肝GDH 酶活的结论,原因可能是本试验所用细菌GDH(家族I)与牛肝GDH(家族II)属于不同的家族,保守结构域不同,Ca2+虽能破坏牛肝GDH 活性中心的构象而使酶失活,但却不能作用于细菌GDH。
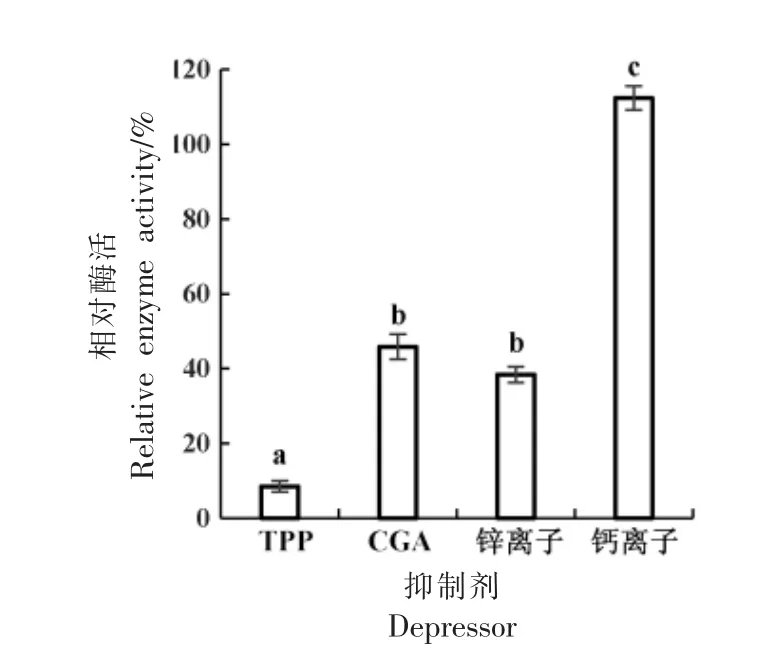
图1 4 种抑制剂对GDH 酶活的影响Fig.1 The effects of four kinds of inhibitors on GDH enzyme activity
图1 中,TPP 的抑制效果显著优于CGA(P<0.001)和Zn2+(P<0.001)。虽然,试验中TPP 质量浓度高于CGA,但其在该质量浓度下的应用成本远远低于CGA。此外,TPP 还具有降血脂、降血糖、抗癌、抗氧化、抗放射损伤等药理活性[28-34],和纳豆一样具有预防心血管疾病的功效[33],被广泛应用于保健品的开发[35-37]、食品的保鲜及品质的改良[38-41]。Wang 等[42]研究发现TPP 以剂量依赖性方式降低高脂肪饮食小鼠的血清总胆固醇、甘油三酯、低密度脂蛋白、葡萄糖和胰岛素水平。TPP 中抑制GDH的主要活性物质是EGCG[43-44],Liu 等[45]认为EGCG通过抑制线粒体凋亡来防止人脐静脉内皮细胞的凋亡,从而预防动脉粥样硬化,减少心血管疾病的发生。还有研究证明,TPP 能够通过诱导细胞周期阻滞和线粒体凋亡抑制人乳腺癌细胞MCF-7 增殖[28]。综上,本研究选用TPP 作为纳豆固态发酵的添加剂,期望既能降低纳豆的氨含量,又能提高纳豆的保健功效。
2.2 检测TPP 进入细菌胞内的能力
TPP 水溶液在胞外对GDH 酶活有较强的抑制作用,而GDH 是纳豆芽孢杆菌的胞内酶。为了确定TPP 是否能进入纳豆芽孢杆菌体内抑制GDH 酶活进而抑制氨的产生,本研究用含TPP 的LB 培养基培养纳豆芽孢杆菌并测定其体内GDH酶活。然而,纳豆芽孢杆菌在含TPP 的LB 培养基中培养后,菌体表面附着的TPP 即使用水、DMSF和乙醇等不同溶剂多次清洗也无法将其完全去除。细菌超声破碎液中GDH 酶活均为零(数据未显示),无法判断是否存在胞内的TPP 发挥了抑制作用。
本研究利用TPP 在波长430~494 nm 的光激发下可产生绿色荧光这一特性[46],通过激光共聚焦显微镜观察菌体并检测荧光强度的变化来探究TPP 是否能进入纳豆芽孢杆菌细胞,结果如图2所示。将共聚焦平面锁定在菌体的中心横剖面处,选取ROI1、ROI2 和ROI3 3 处观察荧光强度的变化。图2d 横坐标上的值代表荧光测定点距ROI 线条左端点的距离;纵坐标为灰度值,反应了TPP 的量。结合图2c 可以看出,菌体细胞膜发出强烈荧光;虽然在大部分区域,越靠近菌体中心荧光越弱,但3 条ROI 中的最低灰度值仍高达763.22;阴性对照组(图2b)则几乎不发荧光。说明经TPP 培养后,菌体表面的确吸附有较多的TPP,并且有一部分TPP 进入了胞内。结合TPP 的体外抑制效果,可以推断TPP 能进入纳豆芽孢杆菌体内并抑制GDH 酶活。如果在纳豆发酵过程中加入TPP,有望减少纳豆的氨含量,改善纳豆风味。

图2 在含及不含TPP 的LB 培养基中培养的纳豆芽孢杆菌的荧光图像和荧光强度变化Fig.2 Fluorescence image and intensity of Bacillus subtilis var.natto cells cultured in LB broth with and without TPP
2.3 TPP 对GDH 的抑制类型以及IC50 值
2.3.1 IC50值的测定 文献报道,TPP 对蜡样芽孢杆菌的最小抑菌浓度为0.96 mg/mL[47]。为确定TPP抑制GDH 酶活的有效质量浓度是否远低于其最小抑菌浓度,本研究探究了TPP 质量浓度对GDH酶活的影响并测定了IC50,结果如图3 所示。在0-40 μg/mL 范围内,GDH 活性随着TPP 质量浓度的升高而快速下降;在40~70 μg/mL 范围内,随着TPP 质量浓度的升高,GDH 活性的下降速率逐渐变得缓慢。TPP 的IC50为20.60 μg/mL,低于其最小抑菌浓度,说明有望通过添加适量TPP 抑制纳豆芽孢杆菌胞内GDH 酶活并且不影响细菌生长。

图3 不同质量浓度TPP 对GDH 酶活的影响Fig.3 Effects of tea polyphenols with different mass concentrations on GDH activity
Li 等[17]测定了EGCG 和ECG 对牛GDH 的IC50值,均为0.5 μmol/L,即0.23 μg/mL 和0.22 μg/mL。可能因为TPP 是混合物,除了含有EGCG 和ECG 外,还含有对GDH 酶活没有抑制作用的物质,所以其IC50高于EGCG 和ECG。
2.3.2 抑制类型 在TPP 质量浓度分别为0.5 μg/mL 和1.5 μg/mL 的反应体系中,将底物L-谷氨酸与GDH 酶液预先处理30 min 能使相对酶活分别提高17.52%(P<0.01)和43.28%(P<0.001)(图4),说明在4 ℃混合静置的30 min 里,L-谷氨酸率先与GDH 结合,可能减少了催化反应过程中TPP 与底物结合位点的结合[48];用同样的方法将辅酶NAD+与GDH 预先处理30 min,相对酶活没有提高(图5),说明TPP 对GDH 存在底物竞争型抑制而不存在辅酶竞争型抑制。

图4 底物与GDH 预先混合对酶活的影响Fig.4 Effects of pre-mixing glutamic acid with GDH on enzyme activity
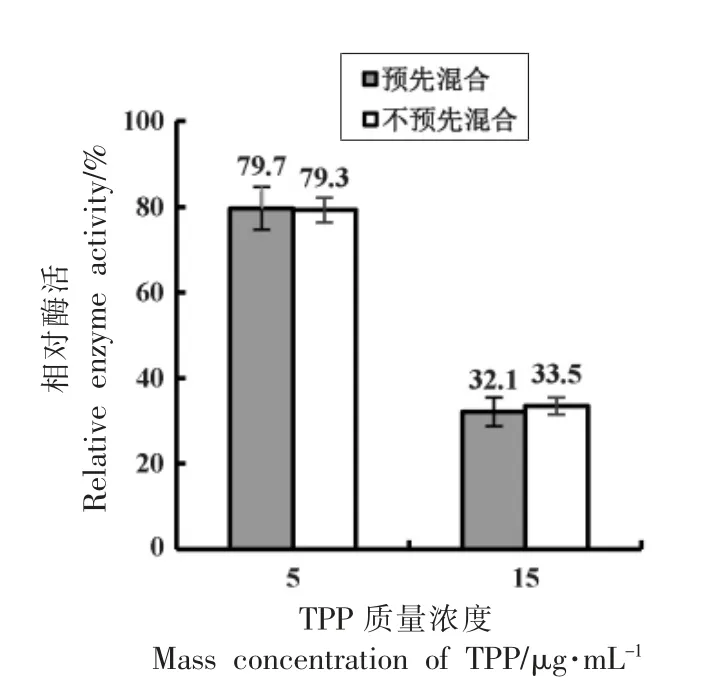
图5 NAD+与GDH 预先混合对酶活的影响Fig.5 Effects of pre-mixing NAD+ with GDH on enzyme activity
2.4 纳豆发酵过程中氨含量的变化
TPP 具有抑菌作用,高浓度下会抑制细菌的生长[47],影响发酵效果。为了使添加到纳豆中的TPP 既能抑制氨的产生,又不影响发酵效果,本试验分析了纳豆在发酵和后熟过程中氨含量的变化趋势和纳豆芽孢杆菌的生长曲线,结果如图6 和图7 所示。在发酵的前12 h,纳豆中的氨含量未出现明显增长,保持在8 mg/100 g 以下;发酵12 h后,氨含量急剧上升,直到24 h 发酵结束,达到了109.5 mg/100 g 左右;在24~48 h 的冷藏期间,纳豆中的氨含量只出现极小幅度的增长,最终为118.0 mg/100 g,说明产氨主要发生在发酵12 h后,而纳豆芽孢杆菌的生长曲线表明在第12 h 细菌已处于对数生长末期。考虑到不同发酵批次间有一定的差异,TPP 进入胞内也需要一定的时间,因此确定TPP 的添加时间为发酵的第11 小时,以期最大程度抑制氨的产生并尽可能地减少对发酵的不利影响。

图6 纳豆芽孢杆菌生长曲线Fig.6 The growth curve of Bacillus subtilis var.natto
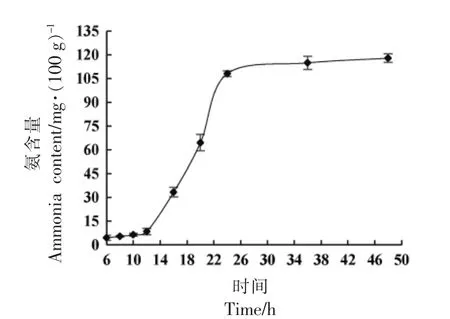
图7 纳豆发酵过程中氨含量的变化Fig.7 Changes of ammonia content during natto fermentation
2.5 TPP 对纳豆氨含量和NK 活性的影响
2.5.1 TPP 对纳豆中氨含量的影响 发酵过程中添加TPP 对纳豆氨含量的影响如图8 所示。在2.16~4.16 mg/g 范围内,随着TPP 含量的升高,纳豆的氨含量下降率稳步上升;当TPP 含量从4.16 mg/g 上升到4.56 mg/g 时,下降率从63.90%上升到64.86%,下降不明显。综合考虑下,将TPP 添加量定为4.16 mg/g。在该条件下,纳豆氨含量为45.5 mg/100 g,下降率可达63.90%,高于文献所报道结果[9-11,49],说明在纳豆发酵过程中适量添加TPP 的确可以显著减少氨的产生,改善纳豆的风味。
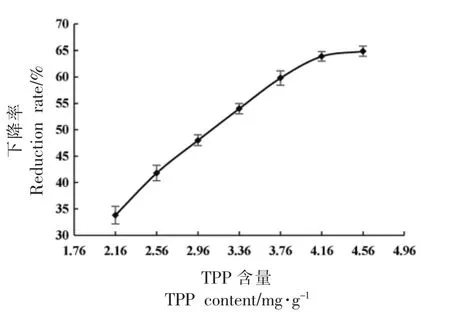
图8 不同含量TPP 对纳豆氨含量的影响Fig.8 Effects of TPP with different content on ammonia content of natto
2.5.2 纳豆中NK 活性的测定 纳豆中最关键的功能性物质是NK[50],因此选取添加了3.76,4.16 mg/g 和4.56 mg/g TPP 的纳豆测定NK 活性。尿激酶标准曲线方程为y=1.5696x+36.926(R2=0.9959),NK 活性测定结果如图9 所示。未添加TPP 的纳豆中NK 活性为(2 153.0±48.6)U,与市售纳豆相当[51];添加了4.16 mg/g TPP 的纳豆,氨含量下降了63.90%,而NK 活性未见显著下降(P>0.05),说明TPP 不仅降低了纳豆的氨含量,还保留了纳豆的保健功效。
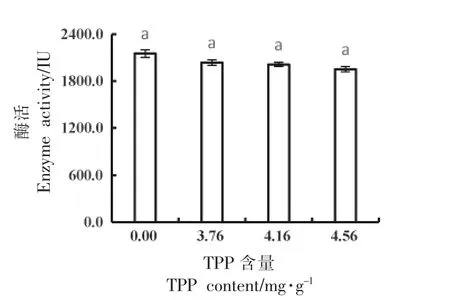
图9 添加不同含量TPP 的纳豆中NK 的活性Fig.9 Nattokinase activity of natto samples with different TPP content
2.6 纳豆的感官评定
感官评分是评估消费者对产品接受度的重要参数。纳豆的感官评定结果如表2 所示。添加TPP后纳豆的味道更接近于豆豉,软糯湿润。不仅纳豆的气味得到极大改善,风味和质地评分有所提高,而且我国消费者不易接受的拉丝现象也得到了改善。由于TPP 自带褐色,所以使纳豆呈现浅褐色且有少许分布地不均匀,外观评分稍有下降。在不添加任何调味料的情况下,添加TPP 的纳豆综合评分为(8.07±0.36)分,远高于未添加TPP 的纳豆。说明在纳豆发酵过程中添加适量TPP 的确能改良纳豆的风味,提高我国消费者对纳豆的接受度,并使纳豆兼备了TPP 的保健功效。

表2 纳豆感官评分结果Table 2 Sensory evaluation of natto samples
3 结论
对4 种可应用于食品的GDH 抑制剂进行了比较,发现TPP 的抑制效果最佳,IC50为20.60 μg/mL,是底物竞争型抑制剂,且可进入纳豆芽孢杆菌体内发挥作用。纳豆发酵前12 h 基本不产氨,且此时细菌的生长进入了对数末期,因此确定TPP 添加时间为发酵的第11 小时。添加TPP 可抑制产氨,而当质量浓度超过4.16 mg/g 时,抑制效果增强不显著。综上,确定最终生产工艺为37 ℃发酵11 h 后添加4.16 mg/g TPP。该工艺可使氨含量降低63.90%,而且NK 活性没有显著下降,发酵产品感官综合评分为(8.07±0.36)分,优于未添加TPP 的纳豆。本研究通过添加TPP 不仅改良了纳豆风味,而且使纳豆兼备TPP 的保健功效,为纳豆在我国的推广提供了技术支持。
