牛血清白蛋白与辛烯基琥珀酸淀粉酯糖基化产物改善谷维素的理化性质和生物可及度
2022-12-29刘曼丽钟金锋刘雄覃小丽
刘曼丽,钟金锋,刘雄,覃小丽
(西南大学 食品科学学院,重庆,400715)
谷维素(γ-oryzanol,GO)是米糠油中的重要活性成分,在米糠油中含量约占1.5%~3%,它是阿魏酸酯、植物甾醇和三萜醇的混合物[1]。其抗氧化活性是维生素E的4倍,具有抗炎、抗糖尿病、抗衰老等多种作用[2],因此在食品[3]、医药[4]等领域备受关注。但是,由于谷维素自身存在溶解度低、吸收效果差以及光、热不稳定等缺点[5],从而限制了其广范应用。因此,如何提高谷维素的水溶性、吸收率和稳定性,进而改善其生物可及度,已成为相关产品在应用方面急需关注的重点。
包埋是一种可以保持活性食品成分的稳定和提高其生物可及度的有效方式。包埋谷维素常用的方法有微囊化[6]和微乳化法[7],但这两种方法得到的粒径往往为微米级,不利于细胞对被封装生物活性化合物的吸收[8]。因此有必要研究纳米技术对谷维素的包埋。目前,纳米技术已被广泛应用于槲皮素[9]、姜黄素[10]等活性分子的包埋,采用蛋白与多糖复合物为载体构建的纳米颗粒载体对活性分子有很好的包埋效果且提高了活性分子的稳定性和生物可及度[11]。然而,负载谷维素的纳米颗粒研究鲜有报道。
牛血清白蛋白(bovine serum albumin,BSA)是牛乳中经过酸凝乳或凝乳酶凝固后剩余的液态部分(乳清)中的一种蛋白,因其与人血清蛋白具有高度同源性,常作为标准蛋白来使用[12]。辛烯基琥珀酸淀粉酯(octenyl succinate anhydride starch,OSAS)是由淀粉经辛烯基琥珀酸酯化改性生成,具有两亲性,常被用作乳化剂、微胶囊壁材等应用广泛[13]。但未见以BSA和OSAS的糖基化产物做载体构建纳米颗粒的研究,因此,本研究以BSA和OSAS为原料,通过干法美拉德反应制备BSA-OSAS糖基化产物,探讨糖基化产物对谷维素的包埋效果,并研究谷维素纳米粒子的抗氧化性、体外抗消化性和生物可及度,以期为糖基化产物在谷维素的包埋递送中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
牛血清白蛋白(CAS No.9048-46-8,纯度≥98%),北京兰杰柯有限公司;辛烯基琥珀酸淀粉酯(CAS No.26544-38-7),国民淀粉化学(上海)有限公司;谷维素(CAS No.11042-64-1,纯度>98%),大连美伦生物技术有限公司;其他试剂均属于分析纯。
1.2 仪器与设备
JY98-ⅢDN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司;T6新世纪紫外分光分度计,北京谱析通用仪器有限责任公司;DYCZ-24DN型电泳仪,北京六一生物科技有限公司;Zetasizer ZS90型激光粒径仪,英国Malvern公司。
1.3 实验方法
1.3.1 BSA-OSAS糖基化产物的制备
将30 g/L的BSA与30 g/L的OSAS分别溶于超纯水中,室温下搅拌过夜,得到BSA母液和OSAS母液。取BSA和OSAS母液按质量比1∶1混合,用1 mol/L 的NaOH和HCl调节溶液pH至7.0,混匀溶液置于37 ℃反应12 h。样品经冷冻干燥48 h后,研磨平铺在培养皿内于60 ℃,相对湿度为79%的恒温恒湿培养箱内反应48 h,取出样品后调节至蛋白等电点,去除未反应的OSAS,样品冻干得到BSA-OSAS糖基化产物。
1.3.2 聚丙烯酰胺电泳
参考YU等[14]的方法。取1 mg/mL的样品溶液,与上样缓冲液按体积比1∶1混合,沸水浴2 min,取10 μL样品加到凝胶泳道中,样品在浓缩胶时电压为80 V,进入分离胶后电压为120 V。分离胶和浓缩胶的浓度分别为12%和5%。
1.3.3 负载谷维素的BSA-OSAS纳米粒子的制备
参考FAN等[10]的方法,并稍作修改。配制BSA-OSAS糖基化产物溶液(4 g/L,pH 5.8),取一定量10 g/L的GO乙醇溶液加入BSA-OSAS糖基化产物溶液中,使BSA-OSAS与GO的质量比分别为10∶1、20∶1、30∶1、40∶1和50∶1,磁力搅拌60 min后将溶液在180 W下超声6 min 得到负载GO的纳米粒子溶液。此外,以负载GO的BSA与OSAS质量比为1∶1的物理共混物(Mix-GO)和BSA作对照,按照上述步骤制备。
1.3.4 纳米粒子的粒径和电位的测定
参考YI等[15]的方法,采用Zetasizer ZS90型激光粒径仪测定,水相溶液的折射率设置为1.33,测试温度为25 ℃,平衡时间为2 min。
1.3.5 包埋率和负载率的测定
先用紫外光谱确定谷维素的吸收波长[16],再用分光光度法测定谷维素含量,绘制标准曲线。在327 nm处测其吸光值,以谷维素的质量浓度(μg/mL)为横坐标,吸光度值为纵坐标绘制标准曲线(y=0.030 5x-0.009,R2=0.998 8)。
包埋率与负载率的测定参考FENG等[17]的方法,并作适当修改。在4 ℃放置 24 h后,取10 mL负载谷维素的纳米粒子溶液在8 000 r/min下离心10 min,上清液用10 mL乙醇萃取,充分振荡30 min后离心(8 000 r/min,5 min),得到乙醇相。萃取重复2次,合并萃取液。将萃取液用乙醇适当稀释,在327 nm处测吸光值,包埋率和负载率计算分别如公式(1)和公式(2)所示:

(1)

(2)
1.3.6 谷维素纳米粒子的抗氧化特性
参考FAN等[10]的方法,并稍作修改。用超纯水配制蛋白质量浓度为0.5 g/L的BSA-OSAS-GO、Mix-GO、OSAS-GO(其中GO质量浓度为12.5 μg/mL)各5 mL;用超纯水配制质量浓度为0.5 g/L的BSA、BSA-OSAS、BSA与OSAS的物理共混(Mix)、OSAS溶液5 mL。以无样品的超纯水作为空白对照。取上述样品溶液各100 μL加入到2 mL 1.75×10-4mol/L的DPPH 乙醇溶液中,室温避光反应60 min,检测其在517 nm处的吸光值,按公式(3)计算DPPH自由基清除率。
取7 mmol/L的ABTS水溶液与2.45 mmol/L的过硫酸钾溶液等体积混合,避光反应12 h以上。取上述样品溶液各100 μL加入到2 mL ABTS溶液中,振荡20 s,反应6 min,在734 nm波长处测定其吸光值, ABTS阳离子自由基清除率计算如公式(3)所示:
(3)
式中:A1为DPPH自由基或ABTS阳离子自由基空白对照的吸光值,At为反应60 min或6 min后样品溶液的吸光值,B为样品空白的吸光值。
1.3.7 谷维素纳米粒子的贮藏稳定性
参考刘尧等[18]的方法,并作适当修改。配制负载谷维素的纳米溶液20 mL,用超纯水和无水乙醇配制GO溶液做对照,分别置于4、25 ℃下避光、25 ℃自然光下贮藏15 d,每隔3 d取出2 mL 的纳米粒子溶液,在10 000 r/min下离心10 min,上清液用乙醇萃取,充分涡旋3 min后离心(8 000 r/min,5 min),得到乙醇相。萃取重复2次,合并萃取液。将萃取液用乙醇适当稀释,测定327 nm 处的吸光值,根据1.3.5中的标曲测定纳米粒子的谷维素含量,按公式(4)计算残留率,以残留率表征其贮藏稳定性。

(4)
1.3.8 谷维素纳米粒子的体外消化特性
参考PRIMOZIC等[19]的方法, 并作适当修改。将各样液(20 mL)与等体积的胃液(3.2 g/L的胃蛋白酶,150 mmol/L的NaCl)混合,并调pH至2.0。将混合溶液置于摇床(37 ℃,100 r/min)中保温60 min后,将pH调至7.0以终止反应。取20 mL胃液消化60 min后的溶液与等体积的肠液(0.3 g/L的CaCl2、30.72 mmol/L NaCl、5 g/L胆汁盐和8 g/L的胰酶)混合,并调pH至7.0,置于摇床(37 ℃,100 r/min)中保温180 min。在胃-肠液的消化过程中,每隔30 min取出2 mL的消化液测定其粒径。
1.3.9 谷维素纳米粒子的生物利用度
参考FENG等[17]的方法,并作适当修改。取10 mL 1.3.8中消化180 min后的样品于离心管中,离心(4 ℃,10 000 r/min,20 min)。样品离心后一般被分为上层(负载谷维素的透明胶束)和下层(未消化的样品形成的致密不溶物质)。分别取2 mL消化180 min 后的样品和2 mL上层溶液检测谷维素的含量,并按公式(5)计算谷维素的生物可及度:

(5)
1.4 数据处理
所有试验均进行3次平行,结果以平均±标准偏差表示。数据用统计软件SPSS 26进行单因素ANOVA分析(P<0.05时表示组间差异显著)。
2 结果与分析
2.1 BSA-OSAS的表征
当多糖与蛋白质发生交联时,交联产物在聚丙烯酰胺电泳图的浓缩胶中显现染色条带或者在浓缩胶和分离胶的交界处展现拖尾条带[20]。BSA 的分子质量主要分布在67 kDa处[21],聚丙烯酰胺电泳图中呈现了相应的特征带(图1,泳道2)。Mix(泳道3)在67 kDa 处出现条带且与BSA(泳道2)类似。与泳道2和3相比,泳道4蛋白质在67 kDa 的条带出现轻微上移,在浓缩胶与分离胶交界处出现新的染色条带。这表明OSAS以共价的形式接到BSA中,形成了大分子质量的糖蛋白聚合物。GUO等[22]也有类似的发现,在聚丙烯酰胺电泳图中也显示有较大分子质量的聚合物生成,这表明干法美拉德反应生成了大分子量的糖蛋白。
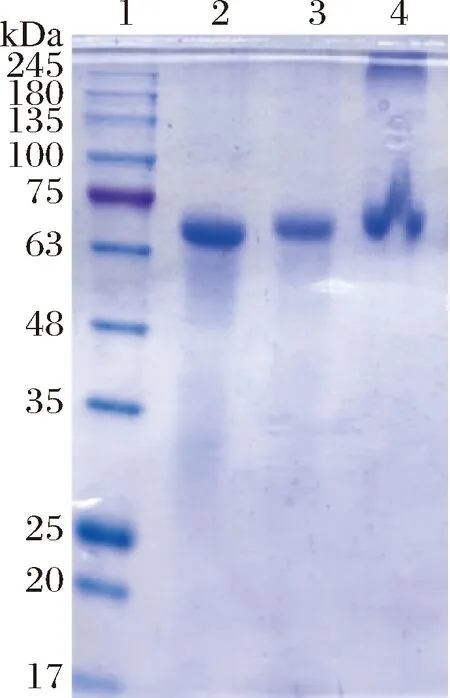
图1 聚丙烯酰胺凝胶电泳Fig.1 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis band注:图泳道1~4分别为标准蛋白Marker、BSA、Mix和BSA-OSAS
2.2 BSA-OSAS与谷维素的质量比对纳米粒子物理性质的影响
如图2-a所示,BSA-OSAS与谷维素的质量比从10∶1增加到50∶1时,BSA-OSAS-GO的纳米粒子粒径稳定在110 nm左右(50∶1时粒径增加了10.96 nm);BSA-GO的粒径从144.74 nm 降低为123.43 nm;Mix-GO则从111.32 nm增加到151.94 nm。这些结果表明,相较于Mix和BSA,BSA-OSAS糖基化产物提高了颗粒的密度,形成了结构更为致密的尺寸较小的颗粒。纳米粒子的电位随着BSA-OSAS与谷维素的质量比的增加呈现先增大后趋于稳定的趋势(图2-b)。通常,电位绝对值越高,纳米颗粒之间的静电斥力越大,它们彼此缔合的可能性越小,体系越稳定[23]。当BSA-OSAS与谷维素的质量比在20∶1与40∶1之间时,此时的纳米粒子的粒径较小,电位绝对值较高,说明该质量范围内负载谷维素的纳米粒子溶液更稳定。

a-粒径;b-电位图2 质量比对谷维素纳米颗粒的粒径及电位的影响Fig.2 Effect of mass ratio on the particle size and ζ-potential of γ-oryzanol nanoparticles注:不同字母表示各处理之间存在显著差异(P<0.05)(下同)
2.3 BSA-OSAS与谷维素的质量比对谷维素的包埋率与负载率的影响
随着BSA-OSAS与GO的质量比的增加,包埋率呈现先增加后降低的趋势(图3-a)。当质量比为40∶1时,BSA-OSAS-GO的包埋率(84.46%)显著高于Mix-GO(75.67%)和BSA-GO(62.78%)的包埋率,表明蛋白质经过糖基化之后可以提高其对GO的包埋效果。可能是由于BSA经过糖基化后,分子间提供更强的疏水作用力和氢键,从而更好地与GO结合,提高包埋能力。由图3-b可知,3种纳米粒子均随着质量比的增加而荷载能力降低。考虑到纳米粒子的荷载率不能过低并具有较高的包埋率,因此选取BSA-OSAS与GO的质量比为40∶1进行后续研究。

a-包埋率;b-负载率图3 质量比对谷维素的包埋率和负载率的影响Fig.3 Effect of mass ratio on the encapsulation efficiency and loading rate of γ-oryzanol
2.4 谷维素纳米粒子的抗氧化性分析
谷维素抗氧化能力主要来源于阿魏酸分子的酚羟基基团,可阻止自由基链的传递[24]。如图4所示,BSA的DPPH自由基清除率(6.31%)和ABTS阳离子自由基清除率(3.29%)均显著低于BSA-OSAS的DPPH自由基清除率(11.67%)和ABTS阳离子自由基清除率(10.37%)。这可能是因为OSAS共价接入BSA,产生了协同作用,使BSA-OSAS的抗氧化性提高。谷维素在水溶液和乙醇溶液对DPPH自由基的清除率分别为13.05%和77.31%,ABTS阳离子自由基活性清除结果与DPPH自由基清除结果有着相似的趋势。BSA-OSAS-GO的DPPH自由基清除率(55.44%)显著高于BSA-GO(48.32%)和Mix-GO(41.03%),但低于溶解在无水乙醇中的谷维素溶液(77.31%)。其原因可能是谷维素中的活性基团与蛋白质分子间形成氢键,对活性基团产生一定的屏蔽效果[25]。这些结果表明相较于Mix和BSA,经过糖基化修饰的BSA-OSAS显著提高了谷维素的抗氧化性。

图4 不同样品的DPPH自由基和ABTS阳离子自由基的清除能力Fig.4 DPPH radical and ABTS cation radieal scavenging ability of different samples
2.5 谷维素纳米粒子的贮藏稳定性分析
在自然光照下贮存15 d后,谷维素在水溶液和乙醇溶液2种体系中的残留率(分别为50.48%和54.72%)显著低于BSA-OSAS-GO的残留率72.75%(图5-a)。这表明BSA-OSAS能够减缓谷维素的降解,且BSA-OSAS-GO的双层结构对谷维素有更好的保护效果。由图5-a和图5-b可知,在光照条件下 BSA-OSAS-GO 中谷维素的残留率从76.96%下降至 72.75%,其他 4 种体系也表现出相似的降低趋势。这表明光照会加速谷维素的降解。由图5-b和图5-c可得出,贮存温度从25 ℃降为4 ℃后,BSA-OSAS-GO中谷维素的残留率从76.96%变为84.45%,这表明贮存温度越低,纳米粒子对谷维素的保护效果越好。此外,BSA-OSAS-GO纳米粒子中谷维素的残留率均高于其他4种体系(图5),表明BSA-OSAS-GO能够有效地保护谷维素,减少外界条件对谷维素的影响。
2.6 谷维素纳米粒子的体外抗消化性分析
在0~60 min模拟胃液消化阶段,BSA-GO的粒径增加最大(从1 692 nm迅速增加到3 285.55 nm,图6),可能是BSA-GO经过胃液水解后,胃液中的盐离子屏蔽了蛋白质表面电荷,使分子间静电斥力降低,导致蛋白质发生聚集[26]。BSA-OSAS-GO纳米粒子在胃液消化过程中的粒径增加幅度要远小于BSA和Mix-GO纳米粒子。这可能由于BSA经过糖基化后,不容易被胃蛋白酶水解[27];也可能是BSA-OSAS在经过胃蛋白酶消化过程中,先消化OSAS外壳从而延缓了蛋白质被消化聚集;还有可能是BSA-OSAS-GO纳米粒子初始电位绝对值较高,纳米颗粒之间的静电斥力较大,体系较稳定(图2-b)。在60~180 min模拟肠液消化阶段,3种纳米粒子的粒径都出现降低的趋势,其中BSA-OSAS-GO粒径最小为641.55 nm。这表明经过肠液消化后,其在胃液中形成的聚集体大部分发生解离,使溶液中的纳米粒子粒径减小。综上,BSA-OSAS为载体的纳米粒子在消化过程中,能起到缓慢消化的效果。

a-25 ℃自然光;b-25 ℃避光;c-4 ℃避光图5 贮藏条件对谷维素的残留率的影响Fig.5 Effect of storage conditions on the retention rate of γ-oryzanol

图6 模拟胃肠消化过程中谷维素纳米颗粒的粒径变化Fig.6 Changes in average particle size of γ-oryzanol nanoparticles during in vitro digestion
2.7 谷维素纳米粒子的生物可及度分析
未包埋的谷维素经过胃肠道消化后,其生物可及度为(9.94±0.59)%。谷维素经过纳米粒子包埋后,BSA-OSAS-GO的生物可及度(40.23±1.04)%显著高于Mix-GO(28.99±0.75)%和BSA-GO(23.16±0.96)%(P<0.05),其原因可能是糖基化作用使得BSA-OSAS-GO纳米粒子在消化系统中更加稳定(图6),从而促进了结晶谷维素在胶束化过程中的溶解[28]。因此,BSA-OSAS-GO纳米粒子能显著提高谷维素的生物可及度,且BSA-OSAS-GO的提升效果要优于Mix-GO和BSA-GO。
3 结论与讨论
本文利用干法美拉德反应制备了BSA-OSAS,研究了BSA、Mix和BSA-OSAS糖基化产物负载谷维素的纳米粒子的理化性质和生物可及度。BSA-OSAS与谷维素质量比为40∶1时,BSA-OSAS纳米粒子对谷维素的包埋率最大为84.46%。相较于对照组(BSA-GO,Mix-GO),BSA-OSAS-GO纳米粒子能够更加有效地保护谷维素,提高其抗氧化性(DPPH自由基清除率为55.44%,ABTS阳离子自由基清除率为49.81%)并减缓了外界条件对谷维素的影响(在4 ℃避光,25 ℃避光和25 ℃ 自然光照下分别贮藏15 d,谷维素的残留率分别为84.45%,76.96%和72.75%)。此外,BSA-OSAS-GO纳米粒子在体外模拟胃肠道中能够起到缓慢消化的效果且提高了谷维素的生物可及度(40.23%),进一步拓宽了其在功能性食品领域的应用。在今后的研究中,可探究利用不同的多糖进行糖基化,将结果与本文对比,比较不同多糖接枝蛋白纳米粒子对谷维素的保护效果,以期为拓宽其应用提供一定的技术参考。
