害虫Bt抗性机制研究新方向:昆虫体液免疫系统
2022-12-28廖文宇吕卓鸿张友军杨中侠
廖文宇, 吕卓鸿, 张友军, 杨中侠,*
(1. 湖南农业大学植物保护学院, 植物病虫害生物学与防控湖南省重点实验室, 长沙 410128; 2. 中国农业科学院蔬菜花卉研究所, 北京 100081)
苏云金芽孢杆菌Bacillusthuringiensis(Bt)是革兰氏阳性细菌,多分布于土壤中,短杆状,单生或成短链,产芽孢、以周生鞭毛运动;该菌首先由石渡繁胤于1902年在家蚕Bombyxmori中发现,随后Ernst Berliner于1911年从德国图林根州(Thüringen)一面粉厂染病的地中海粉螟Ephestiakuehniella中再次发现,并被正式命名为Bacillusthuringiensis。Bt伴孢晶体含有多种杀虫晶体蛋白(insecticidal crystal proteins, ICPs, 又称δ-内毒素)及β外毒素等多种其他毒素,可特异性地杀死多种不同昆虫。Bt于1938年首次作为农药上市,目前已成为最成功的生物农药(Ayersetal., 1977; Reardonetal., 1994; Ibrahimetal., 2010; Bravoetal., 2011)。然而已有约13种害虫对Bt产生了抗性(Tabashnik and Carrière, 2017; Xiao and Wu, 2019)。因此探明昆虫对Bt产生抗性的机制意义重大。
长久以来,人们对昆虫Bt抗性机制的研究主要集中在两个方向:由于中肠蛋白酶突变或表达减少导致Cry原毒素的激活受阻(Forcadaetal., 1996; Liuetal., 2014)导致的昆虫Bt抗性;因各类Cry毒素受体突变或表达减少(Gahanetal., 2001; Guoetal., 2020),进而导致昆虫对Bt产生抗性。而近年来的许多研究发现昆虫免疫系统也参与了对Bt的对抗(Liuetal., 2019; Cacciaetal., 2020; Linetal., 2020)。本文详细介绍了昆虫体液免疫及昆虫Bt抗性机制的研究成果,对昆虫体液免疫参与昆虫形成Bt抗性的主要通路进行了归纳和推论,根据已有研究成果描绘了一个较为清晰的关于昆虫体液免疫系统与昆虫Bt抗性之间关系的图谱,为探究昆虫对Bt的抗性机制提供新的思路。
1 昆虫体液免疫系统
有别于脊椎动物,昆虫的免疫防御主要依赖于其高效的先天免疫系统。先天免疫是有机体在演化中逐步形成的一系列天然防御功能,其对多种病原侵染都有作用,没有明显的选择性,并可稳定遗传。
昆虫的免疫系统主要包括屏障结构、细胞免疫和体液免疫。屏障结构包括外骨骼、骨质气管、肠道围食膜等,为抵御病原物的第一防线。病原物突破第一防线后,昆虫通过模式识别受体(pattern recognition reporters, PRRs)如:肽聚糖识别蛋白(peptidoglycan recognition proteins, PGRPs)、β-葡聚糖识别蛋白(β-glucan recognition proteins, βGRPs)以及清道夫受体(scavenger receptors, SRs)等,特异性识别病原体,进而激活下游细胞免疫及体液免疫相关反应,如:诱导吞噬作用和包囊作用、激活免疫缺陷(immune deficiency, IMD)或Toll等免疫信号通路、激活酚氧化酶原级联反应等。细胞免疫主要通过不同血细胞介导的吞噬作用、凝集或包被作用对抗病原物。同时昆虫的体液免疫和细胞免疫并不是相互独立的,而是相互联系的。很多体液免疫的因子会影响到血细胞的功能,同时血细胞产生的酶也会影响到体液免疫。体液免疫主要依赖血淋巴中的各种抗菌肽(antimicrobial peptides, AMPs)及蛋白,它们主要通过水解破坏微生物细胞壁、破坏微生物细胞膜通透性、阻止微生物分裂、代谢毒物的杀伤与钝化作用等方式对抗病原物(王荫长等, 2001; Söderhäll, 2010; 杨代群, 2012; 张明明等, 2012)。昆虫抗菌肽受IMD或Toll等免疫信号通路控制表达,是昆虫体液免疫的主要效应因子。抗菌肽为小分子多肽,目前人们从不同生物中已发现7 000~8 000余种抗菌肽,其中昆虫抗菌肽400余种,并构建了相关数据库(Wangetal., 2015; Waghuetal., 2016)。抗菌肽不仅可杀死革兰氏阳性和革兰氏阴性细菌,还对真菌、病毒,甚至原生动物和癌细胞有杀伤活性,当然,不同种类的抗菌肽有不同的活性谱(Reddyetal., 2004; Hoskin and Ramamoorthy, 2008; Wuetal., 2018; Tonketal., 2019)。
1.1 模式识别受体
模式识别受体(PRRs)通过感知被称为病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)的保守结构,例如细菌脂多糖(lipopolysaccharide, LPS)、肽聚糖(peptidoglycan, PGN)、磷壁酸(lipoteichoic acid, LTA)以及真菌β-1, 3-葡聚糖(β-1, 3-glucan),从而在病原体识别中起关键作用(Akiraetal., 2006)。已发现的昆虫PRRs主要包括以下6类:PGRPs、βGRPs或革兰氏阴性菌结合蛋白(Gram-negative bacteria-binding proteins, GNBPs)、SRs、含硫酯蛋白(thioester-containing proteins, TEPs)、唐氏综合症细胞粘附分子(Down syndrome cell adhesion molecule, Dscam)及凝集素(lectin)(Luetal., 2020)。其中PGRPs被研究较多,且其在昆虫免疫系统中扮演了多种不同的角色。
肽聚糖识别蛋白(PGRPs)是大多数无脊椎动物和哺乳动物中最常见的模式识别受体(PRRs),但未在较低级的后生动物或植物中发现。所有PGRP均包含至少一个与噬菌体或细菌2型酰胺酶(type 2 amidases, Amidase-2)同源的保守PGRP结构域(Wang Jetal., 2018)。根据分子量的大小,PGRP可以被分为长(L)、短(S)两种类型。短型PGRP(PGRP-S)一般为小于20 kDa的胞外蛋白;而长型PGRP(PGRP-L)通常有PGRP-S两倍大,它们可能是胞外蛋白(如PGRP-LB),或跨膜蛋白(如PGRP-LC),或胞内蛋白(如PGRP-LE和PGRP-LB)(Werneretal., 2000; Charrouxetal., 2018)。PGRP保守结构域一般由外围3~4个α螺旋,中心5~7个β折叠构成,它们均具有PGN结合槽(PGN-binding groove)(Kimetal., 2003; Limetal., 2006; Huetal., 2019)。如果PGN结合槽中具有3个锌离子(Zn2+)配位残基(His, His, Cys),则该PGRP具有酰胺酶活性,称为催化性PGRP(catalytic PGRPs);如缺乏关键的与Zn2+结合的半胱氨酸残基(Cys),则该PGRP无酰胺酶活性,称为非催化性PGRP(non-catalytic PGRP)(Lowetal., 2011; Paredesetal., 2011)。PGRPs在昆虫免疫系统中扮演的角色可概括为3种:识别受体、免疫调节因子、杀菌剂。
识别受体(图1):PGRP-SA-GNBP1复合物识别赖氨酸型肽聚糖(Lys-type PGN)激活Toll通路(Micheletal., 2001; Gobertetal., 2003),PGRP-SD作为革兰氏阳性细菌受体在功能上与PGRP-SA-GNBP1复合物有部分冗余(Bischoffetal., 2004)。另外PGRP-SD似乎还可以识别二氨基庚二酸型肽聚糖(DAP-type PGN)从而激活Toll通路(Leoneetal., 2008; Valanneetal., 2011)。PGRP-LC识别DAP-type PGN激活IMD通路(Gottaretal., 2002; Rämetetal., 2002a)。Yoshida等(1996)最早报道了家蚕的PGRP-S1可以结合PGN并激活酚氧化酶(phenoloxidase, PO)级联反应,而PGRP-S5可以同时识别且降解Lys-type PGN和DAP-type PGN,并启动PO级联反应(Chenetal., 2014, 2016)。果蝇Drosophila的PGRP-LE结合DAP-type PGN激活PO级联反应(Takehanaetal., 2002, 2004),同时细胞内全长PGRP-LE识别DAP-type PGN后可独立于IMD和Toll通路诱导自噬以消除细胞内细菌,如李斯特菌Listeriamonocytogenes(Yanoetal., 2008)。棉铃虫HelicoverpaarmigeraPGRP-A可同时识别Lys-type PGN和DAP-type PGN,并激活PO级联反应(Lietal., 2015)。
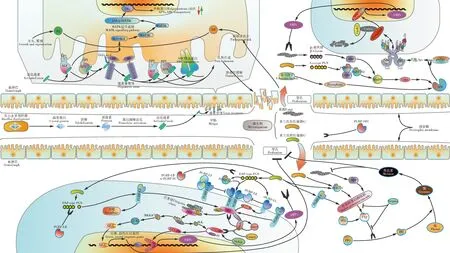
图1 Cry毒素作用机制及昆虫体液免疫系统Fig. 1 Mechanism of Cry toxin action and the humoral immune system of insects左上角示意Bt作用机制,左下角示意IMD通路,右上角示意Toll通路,右下角示意酚氧化酶原激活系统。Top left corner: Mechanism of Bt action. Lower left corner: IMD pathway. Top right corner: Toll pathway. Lower right corner: proPO-AS. ALP: 碱性磷酸酶Alkaline phosphatase; AMP: 抗菌肽Antimicrobial peptide; APN: 氨肽酶N Aminopeptidase-N; CAD: 钙粘蛋白Cadherin; GNBP: 革兰氏阴性细菌结合蛋白Gram-negative bacteria-binding protein; 20E: 20-羟基蜕皮酮20-Hydroxyecdysone; GPI: 糖基磷脂酰肌醇Glycosylphophatidyl inositol; Grass: 革兰氏阳性细菌特异的丝氨酸蛋白酶Gram-positive-specific serine protease; JH: 保幼激素Juvenile hormone; PGRP: 肽聚糖识别蛋白Peptidoglycan recognition protein; ModSP: 模块化丝氨酸蛋白酶Modular serine protease; Spz: Spätzle; proSpz: Spätzle前体pro-Spätzle; SPE: Spätzle加工酶Spätzle-processing enzyme; SPH: 丝氨酸蛋白酶同系物Serine protease homologs; PAP: 酚氧化酶原激活丝氨酸蛋白酶proPO activating serine protease; PPO: 酚氧化酶原Prophenoloxidase; PO: 酚氧化酶Phenoloxidase; Serpins: 丝氨酸蛋白酶抑制剂Serine protease inhibitors; TFs: 转录因子Transcription factors.
免疫调节因子(图1):PGRP-LA参与IMD通路的调节(Gendrinetal., 2013),PGRP-SD对IMD通路进行正调节(Iatsenkoetal., 2016),而PGRP-LF, rPGPR-LC(PGRP-LC的一种剪接体), PGRP-LB, PGRP-SC1a/b和PGRP-SC2是IMD通路的负调控因子(Mellrothetal., 2003; Bischoffetal., 2006; Zaidman-Rémyetal., 2006; Mailletetal., 2008; Paredesetal., 2011)。
杀菌剂(图1):PGRP-SB1可通过降解DAP-type PGN直接杀死细菌(Mellroth and Steiner, 2006; Zaidman-Rémyetal., 2011)。家蚕的PGRP-S5对革兰氏阳性及阴性细菌均具有抗菌活性(Chenetal., 2014, 2016)。
1.2 IMD免疫信号通路
IMD通路(图1)主要通过识别DAP-type PGN应对革兰氏阴性菌的感染(Ferrandonetal., 2007; Buchonetal., 2014; Galenza and Foley, 2019):PGRP-LCa-PGRP-LCx异二聚体以及细胞内的全长PGRP-LE识别单体PGN,PGRP-LCx同源二聚体识别聚合的PGN,从而激活IMD通路(Choeetal., 2002; Kanekoetal., 2004, 2006)。只含有PGRP结构域的细胞外PGRP-LE促进PGN与PGRP-LCx的相互作用(Kanekoetal., 2006; Neyenetal., 2012)。PGRP-SD与DAP-type PGN结合并增强激活IMD通路(Iatsenkoetal., 2016)。PGRP-LF和PGRP-LCx可以形成非信号异二聚体下调IMD通路(Mailletetal., 2008)。rPGRP-LC可选择性识别死亡革兰氏阴性菌聚合的PGN,并抑制IMD通路,同时它可与IMD通路的负调节因子Pirk相互作用(Neyenetal., 2016)。PGRP-LB和PGRP-SC(均具有酰胺酶活性)通过降解PGN充当IMD通路的负调节剂(Mellrothetal., 2003; Bischoffetal., 2006; Zaidman-Rémyetal., 2006; Mailletetal., 2008; Paredesetal., 2011)。如图1所示:识别PGN信号后,形成了由IMD、Fas死亡结构域相关蛋白(Fas-associated protein with death domain, FADD)及与胱天特异性蛋白酶(cysteinyl aspartate specific proteinase) caspase-8同源的Dredd(death-related Ced-3/Nedd2-like protein)组成的复合物(Lemaitreetal., 1995; Georgeletal., 2001; Leulieretal., 2002; Choeetal., 2005)。Dredd被E3连接酶凋亡抑制剂2 (E3-ligase inhibitor of apoptosis 2, Iap2)泛素化激活(Meinanderetal., 2012)。而Iap2与Uev1a(E2-ubiquitin-conjugating enzyme variant 1a)、Ubc13(Bendless)及Ubc5(Effete)结合(Zhouetal., 2005)。被激活后,Dredd裂解IMD,为Iap2创建一个新的结合位点,使IMD被K63多泛素化(Paquetteetal., 2010; Meinanderetal., 2012)。这导致Tab2/Tak1复合体(transforming growth factor β-activated kinase, Tak; Tak-binding protein, Tab)的形成和激活,Tab2/Tak1复合体继而激活IκB 激酶(IκB kinase, IKK)复合体,Relish的N端被IKK复合体磷酸化从而被激活(Rutschmannetal., 2000; Silvermanetal., 2000; Luetal., 2001; Kleinoetal., 2005; Ertürk-Hasdemiretal., 2009)。Relish是IMD通路中一种NF-κB样转录因子(transcription factors, TFs)(Dushayetal., 1996; Khushetal., 2001),它被Dredd水解,C端部分(Rel-49, IκB样片段)被留在细胞质中,而被IKK活化的N末端部分(Rel-68,具有Rel同源域)进入细胞核内,激活AMP基因的转录(Stövenetal., 2000, 2003)。同时该转录的激活必须有Akirin(一种高度保守的核蛋白)的存在,且受其正向调控(Gotoetal., 2008)。Sickie是Relish激活所必需的(Foley and O′Farrell, 2004);Pirk(Kleinoetal., 2008)、Caspar(Kimetal., 2006)和Dnr1(defence repressor 1)(Foley and O′Farrell, 2004; Guntermannetal., 2009)是IMD通路的负调控因子。
IMD通路在Tab2/Tak1处分出了c-Jun氨基末端激酶 (c-Jun N-terminal kinase, JNK)通路(Silvermanetal., 2003; Delaneyetal., 2006; Valanneetal., 2007)。JNK是丝裂原活化蛋白激酶家族成员(mitogen-activated protein kinase family, MAPK family)(Davis, 1994; Pelech, 1996)。而已有的研究表明,Tak1是一种MAP3K(mitogen-activated protein kinase kinase kinase)(Wangetal., 2001; Silvermanetal., 2003)。Tak1通过激活MKK4(MAPK kinase 4)及Hep(Hemipterous, 与MAPK kinase 7同源)而激活JNK,继而激活AP-1(activating protein 1),AP-1进入细胞核激活应激基因(stress genes)的转录(Gliseetal., 1995; Slussetal., 1996; Tournieretal., 1997; Boutrosetal., 2002; Rämetetal., 2002b; Silvermanetal., 2003; Valanneetal., 2011)。AP-1主要是由Jun和Fos家族亚单位组成的二聚体转录因子,它们与一个共同的DNA位点——AP-1结合位点——结合(Perkinsetal., 1988, 1990; Karin, 1996; Karinetal., 1997; Riesgo-Escovar and Hafen, 1997)。同时Tak1还能激活其他不同类型的MKKs,进而激活不同通路的MAPK级联反应,如p38(stress-activated MAPK of 38 kDa)通路(Wangetal., 2001; Delaneyetal., 2006; Buchonetal., 2014)。
此外蜕皮激素20-羟基蜕皮酮(20-hydroxyecdysone, 20E)对果蝇先天免疫的调节至关重要(Reganetal., 2013)。20E可控制IMD主要受体PGRP-LC的表达,从而调控IMD通路的活性(Rusetal., 2013)。
1.3 Toll免疫信号通路
Toll通路(图1)主要应对真菌及革兰氏阳性细菌感染(Ferrandonetal., 2007; Lemaitre and Hoffmann, 2007; Chamyetal., 2008; Buchonetal., 2014):革兰氏阳性细菌被PGRP-SA-GNBP1复合体或PGRP-SD识别(Micheletal., 2001; Gobertetal., 2003; Bischoffetal., 2004; Leoneetal., 2008),真菌的β葡聚糖(β-glucan)被GNBP3所识别,细菌或真菌的毒力因子(virulence factors)被一种丝氨酸蛋白酶Persephone所识别(Ligoxygakisetal., 2002; Gottaretal., 2006)。PGRPs及GNBPs的识别信号被模块化丝氨酸蛋白酶(modular serine protease, modSP)整合,然后激活革兰氏阳性细菌特异的丝氨酸蛋白酶(Gram-positive-specific serine protease, Grass),进而激活丝氨酸蛋白酶级联反应,最终导致Spätzle加工酶(Spätzle-processing enzyme, SPE)被激活,而Persephone则直接激活SPE(Gottaretal., 2006; Jangetal., 2006; Kambrisetal., 2006; Chamyetal., 2008; Buchonetal., 2009; Rohetal., 2009)。Spätzle(Spz)是一种结构类似于哺乳动物白细胞介素-17(interleukin-17, IL-17)的具有胱氨酸结(cystine knot)的细胞因子,以非活性的前体(proSpz)形式存在,被SPE激活后裂解为Toll的活性配体(Morisato and Anderson, 1994; Mizuguchietal., 1998; Hymowitzetal., 2001; Weberetal., 2007; Arnotetal., 2010)。有两种Spz与Toll结合的模型,一种认为1个Spz二聚体与2个Toll形成复合物(Weberetal., 2003, 2005),另一种认为2个Spz二聚体与2个Toll形成复合物,复合物的形成导致Toll构象变化,进而激活下游信号(Gangloffetal., 2008)。
果蝇的Toll与哺乳动物IL-1Rs均有一个被称为Toll/IL-1R(TIR)结构域的胞质同源结构域(Imler and Hoffmann, 2001)。激活的Toll受体通过细胞内的TIR结构域与接头蛋白MyD88结合(Horng and Medzhitov, 2001; Sunetal., 2002; Tauszig-Delamasureetal., 2002)。而后MyD88、Tube和激酶Pelle通过死亡结构域(death domain, DD)介导的相互作用被招募来,形成MyD88-Tube-Pelle异源三聚体复合物(Xiaoetal., 1999; Sunetal., 2002)。MyD88和Pelle并不接触,而是由接头蛋白Tube中的两个不同的DD表面分别结合MyD88和Pelle(Sunetal., 2002; Moncrieffeetal., 2008)。高度保守的Pelle/IL-1R相关激酶(Pelle/IL-1R-associated kinase, IRAK)互作蛋白Pellino是Toll信号的正调节因子(Haghayeghietal., 2010)。Pellino作为含有RING样结构域的蛋白家族,具有内在的泛素E3连接酶活性,因此果蝇Pellino可能以类似于哺乳动物Pellinos多泛素化IRAK1的方式泛素化Pelle(Moynagh, 2009)。
Dorsal是一种Rel蛋白,最初被认为与背腹(dorsal-ventral, DV)极化有关,和Dif(dorsal-related immunity factor)均是NF-κB转录因子,而Cactus是一种IκB因子,与Dorsal和(或)Dif结合,从而抑制两者的核定位及活性(Ipetal., 1993; Tatei and Levine, 1995; Grossetal., 1996)。信号经过MyD88-Tube-Pelle异源三聚体复合物及细胞内传导导致Cactus的磷酸化和降解,从而释放Dorsal和(或)Dif,它们转运至细胞核,并激活相关基因(如AMP基因)的转录(Kidd, 1992; Reichhartetal., 1993; Edwardsetal., 1997; Wu and Anderson, 1998; Fernandezetal., 2001; Towbetal., 2001; Huangetal., 2010)。G蛋白偶联受体激酶2(G protein-coupled receptor kinase 2, Gprk2)虽不参与Cactus的降解,但可与其相互作用,是Toll通路的调节因子(Valanneetal., 2010)。
1.4 酚氧化酶原激活系统
PO是昆虫重要的免疫防卫因子,在昆虫血淋巴中主要以无活性的酚氧化酶原(prophenoloxidase, PPO)的形式存在(Söderhäll and Cerenius, 1998)。它通过酚氧化酶原激活系统(prophenoloxidase-activating system, proPO-AS)参与黑化反应、吞噬作用、凝集作用、伤口愈合等多种免疫反应及生理过程(Lemaitre and Hoffmann, 2007; Jiangetal., 2009; González-Santoyo and Córdoba-Aguilar, 2012)。一个通用的proPO-AS模型如下所述(图1):S型PGRP识别革兰氏阳性和(或)阴性细菌(Yoshidaetal., 1996; Chenetal., 2014, 2016; Lietal., 2015),PGRP-LE识别革兰氏阴性细菌(Takehanaetal., 2002, 2004),GNBP3识别真菌(Gottaretal., 2006; Mishimaetal., 2009; Matskevichetal., 2010)。而后这些识别信号激活一系列丝氨酸蛋白酶级联(serine protease cascade),最终激活酚氧化酶原激活丝氨酸蛋白酶(proPO activating serine protease, PAP),也被称为酚氧化酶原激活酶(proPO-activating enzyme, PPAE),PAP继而激活PPO形成活化的PO,PO则促使酚氧化为醌,醌最终形成黑色素(Ashidaetal., 1974; Ashida and Dohke, 1980; Chaseetal., 2000; Cerenius and Söderhäll, 2004; Kanost and Gorman, 2008; González-Santoyo and Córdoba-Aguilar, 2012)。某些情况下,PAPs需要蛋白辅助因子或丝氨酸蛋白酶同系物(serine protease homolog, SPH)才对PPO表现出活性(Jiangetal., 1998; Kwonetal., 2000; Yuetal., 2003)。丝氨酸蛋白酶抑制蛋白(serine protease inhibitor proteins, Serpins)作为丝氨酸蛋白酶抑制剂调控proPO-AS(De Gregorioetal., 2002; Gettins, 2002; Jiangetal., 2003; Jiangetal., 2009)。同时有研究表明proPO-AS与Toll通路被相同的丝氨酸蛋白酶级联控制调节(图2)(Kanetal., 2008; Jiangetal., 2009; Parketal., 2010)。

图2 Toll和黑色素合成级联调控模型(改自Jiang et al., 2009和Park et al., 2010)Fig. 2 Model summarizing the molecular events in the regulation of the Toll and melanin synthesis cascades (adapted from Jiang et al., 2009, and Park et al., 2010)黄粉虫Toll通路导致抗菌肽产生(Kim et al., 2008; Roh et al., 2009)和pro-PO级联导致黑色素合成(Kan et al., 2008)的分子激活机制分别被报道。经过加工的Spätzle诱导内源性SPN40和SPN55产生,并作为Toll通路的负反馈调节器。此外,这3种Serpins阻断了proPO的激活,从而抑制了黑色素的合成。The molecular activation mechanism of the Toll cascade of Tenebrio molitor leading to production of antimicrobial peptides (AMPs)(Kim et al., 2008; Roh et al., 2009) and the pro-PO cascade leading to melanin synthesis (Kan et al., 2008) were reported. Processed Spätzle induces the production of endogenous SPN40 and SPN55 as a negative feedback regulator of the Toll cascade. Also, the three Serpins block the activation of proPO, leading to inhibition of melanin synthesis. aMSP: 激活的MSP Activated MSP; aSAE: 激活的SAE Activated SAE; aSPE: 激活的SPE Activated SPE; GNBP: 革兰氏阴性细菌结合蛋白Gram-negative bacteria-binding proteins; PGRP: 肽聚糖识别蛋白Peptidoglycan recognition protein; PO: 酚氧化酶Phenoloxidase; ProMSP: 模块化丝氨酸蛋白酶前体Pro-modular serine protease; Pro-PO: 酚氧化酶原Prophenoloxidase; ProSAE: SPE激活酶前体Pro-SPE-activating enzyme; ProSPE: Spätzle加工酶前体Pro-Spätzle-processing enzyme; Pro-SPH: 丝氨酸蛋白酶同源物前体Pro-serine protease homologue; proSpz: Spätzle前体Pro-Spätzle; SPH: 丝氨酸蛋白酶同源物Serine protease homologue; SPN: 丝氨酸蛋白酶抑制蛋白Serine protease inhibitor protein; Spz: Spätzle.
2 Bt杀虫晶体蛋白及其作用机制
Bt杀虫晶体蛋白由Cry基因编码,在大多数Bt菌株中,Cry基因位于质粒上,目前已有800多种Cry毒素被发现(http:∥www.btnomenclature.info/)(Dean, 1984; Crickmoreetal., 1998)。Cry毒素对鳞翅目、双翅目、鞘翅目、膜翅目等昆虫,以及线虫均有活性(Schnepfetal., 1998; Weietal., 2003),但不同的Cry毒素抗虫谱并不一样(Frankenhuyzen, 2009),具体可在网站http:∥www.glfc.cfs.nrcan.gc.ca/bacillus中查询。
以鳞翅目昆虫为例,Bt被摄入后,伴孢晶体随着Bt菌体细胞壁的破裂而与孢子一起被释放;伴孢晶体在肠道碱性环境下溶解,并释放出Cry原毒素;Cry原毒素分子量约130~140 kDa,在碱性环境下被蛋白酶水解,形成活化的单体Cry毒素(约60~65 kDa);活化的Cry毒素最初与中肠上皮细胞的顶端微绒毛结合,可使昆虫中肠上皮细胞裂解脱落,释放大量细胞内容物,为微生物生长提供丰富的营养物质,同时微生物(包括肠道菌群及Bt)通过肠道受损部位侵入血淋巴,进而引发严重的败血症,最终导致昆虫死亡(Heimpel and Angus, 1959; Materu, 1962; Sutter and Raun, 1967; Tojo and Aizawa, 1983; Salama and Sharaby, 1985; Knowles and Ellar, 1987; Bravoetal., 1992, 2005; Schnepfetal., 1998; de Maagdetal., 2001; Johnston and Crickmore, 2009; Raymondetal., 2010; Adangetal., 2014; Jurat-Fuentesetal., 2021)。然而活化的Cry毒素使昆虫中肠上皮细胞死亡的机制还未完全明确。关于这一问题,目前主要有以下3种理论模型(仍以鳞翅目为例)。
孔道形成模型(图1):活化的Cry毒素穿过围食膜,与中肠上皮细胞膜上的受体氨肽酶N(aminopeptidase-N, APN)或碱性磷酸酶(alkaline phosphatase, ALP)以低亲和力(APN: Kd=101 nmol/L; ALP: Kd=267 nmol/L)结合(Massonetal., 1995; Jurat-Fuentes and Adang, 2004; Arenasetal., 2010)。ALP及APN在细胞膜上具有很高的丰度,它们被糖基磷脂酰肌醇(glycosylphophatidyl inositol, GPI)锚定在膜上(Upadhyay and Singh, 2011)。活化毒素在与ALP和APN的相互作用下,集中在中肠上皮细胞的微绒毛膜上,在此处,活化毒素以高亲和力(Kd=1 nmol/L)与钙粘蛋白(cadherin, CAD)结合(Vadlamudietal., 1995; Gómezetal., 2006; Pachecoetal., 2009; Arenasetal., 2010)。CAD与活化毒素相互作用,进一步将毒素N端水解(包括Domain I中的α螺旋1),这使Cry毒素Domain I中的疏水区域暴露出来,触发了活化毒素的寡聚化,形成Cry毒素前孔寡聚体(Gómezetal., 2002; Soberónetal., 2007; Pachecoetal., 2009; Arenasetal., 2010)。Cry毒素前孔寡聚体与ALP及APN的亲和力增加了约200倍(APN: Kd=0.6 nmol/L; ALP: Kd=0.5 nmol/L),Cry毒素以前孔寡聚体的形式再次与ALP和APN结合,而后这些前孔寡聚体被诱导插入细胞膜形成孔洞,最终导致细胞溶解(Knowles and Ellar, 1987; Zhuangetal., 2002; Bravoetal., 2004, 2005, 2007, 2011, 2013; Pachecoetal., 2009; Arenasetal., 2010; Pardo-Lópezetal., 2013)。最近十年的研究发现,三磷酸腺苷结合盒式(ATP-binding cassette, ABC)转运蛋白也是重要的Cry毒素受体(Adangetal., 2014)。烟芽夜蛾Heliothisvirescens(Gahanetal., 2010)、小菜蛾Plutellaxylostella和粉纹夜蛾Tricholusiani(Baxteretal., 2011)最早被发现对Cry毒素产生抗性与ABC转运蛋白有关。Gahan等(2010)认为ABCC2蛋白可以促进Cry毒素寡聚体插入细胞膜。Xiao和Wu(2019)认为ABC转运蛋白可能与CAD一起发挥关键作用:CAD负责激活Cry毒素的寡聚,这是Cry毒素与ABC转运蛋白结合所必需的,而Cry毒素寡聚体与ABC转运蛋白结合从而形成细胞膜穿孔。但是Cry毒素与ABC转运蛋白相互作用的机制仍然不是十分清楚,需要更多更深入的研究来揭示。
信号转导模型:Cry原毒素被水解释放出活化的Cry毒素,Cry毒素与受体钙黏蛋白BT-R1结合,激活鸟嘌呤核苷酸结合蛋白α亚基(guanine nucleotide-binding protein α-subunit, Gαs)及腺苷酸环化酶(adenylyl cyclase, AC),导致环磷酸腺苷(cyclic adenosine monophosphate, cAMP)积累,进而激活蛋白激酶A(protein kinase A, PKA)。AC/PKA信号通路的激活,使得细胞骨架及细胞膜上的离子通道被破坏,这种对细胞结构和功能完整性的损害导致细胞死亡(Zhangetal., 2005, 2006)。然而有许多研究表明毒素仅与CAD结合不足以产生毒性(Vachonetal., 2002, 2004; Jiménez-Juárezetal., 2007; Girardetal., 2008; Rodríguez-Almazánetal., 2009),此外,经改造去除α螺旋1的Cry1AMod毒素能够跳过与CAD结合的步骤而杀死因CAD突变而对Bt产生抗性的棉红铃虫Pectinophoragossypiella或是CAD被沉默的烟草天蛾Manducasexta,支持毒素仅与CAD结合,不足以在目标昆虫的中肠细胞中诱导毒性的假设(Soberónetal., 2007)。同时该模型完全忽略了一些已被充分证实的结论,使得信号转导模型被质疑(Soberónetal., 2009; Vachonetal., 2012; Bravoetal., 2013; Pardo-Lópezetal., 2013; Adangetal., 2014)。
孔道形成+信号转导模型:该模型认为Cry毒素的活性是在上述孔道形成和信号传导的共同作用下引起的(Jurat-Fuentes and Adang, 2006),Adang等(2014)推测在Cry毒素浓度较低的情况下,可能会以信号转导引起细胞死亡为主,而浓度较高则会以孔道形成为主。但上述均为假设,且信号转导模型存疑,因此并未得到广泛认同。
3 昆虫Bt抗性机制
昆虫对Bt的抗性机制复杂多样,但主要可归结为以下3种类型。
其一,由于昆虫中肠中缺乏蛋白酶、组成变化或蛋白酶启动子突变,使得Cry原毒素的激活受阻,进而对Bt产生抗性(Forcadaetal., 1996; Oppertetal., 1997; Herreroetal., 2001; Lietal., 2004; Rajagopaletal., 2009; Liuetal., 2014)。
其二,Cry毒素受体CAD, ALP, APN或ABC转运蛋白的突变或减少,导致昆虫对Bt产生抗性。如反转录转座子介导的插入破坏了一个CAD基因,导致烟芽夜蛾对Cry1Ac的高水平抗性(Gahanetal., 2001)。Wang L等(2018)报道了首例与昆虫Bt抗性相关的CAD跨膜区域突变,该研究发现由于突变基因编码缺失跨膜区域的CAD,导致CAD胞内运输被破坏,无法定位于细胞膜上发挥其毒素受体的作用,使棉红铃虫获得对Cry1Ac的抗性。Jurat-Fuentes和Adang(2004)从烟芽夜蛾中鉴定出一种膜结合形式的ALP,并发现该ALP可与Cry1Ac结合,且在抗Cry1Ac品系幼虫中肠刷状缘膜囊泡(brush border membrane vesicles, BBMV)中的含量降低。Jurat-Fuentes等(2011)进一步的研究发现相较于敏感品系,烟芽夜蛾、棉铃虫及草地贪夜蛾Spodopterafrugiperda抗Cry毒素品系的中肠膜结合ALP表达水平均降低,并提出应将ALP表达量的降低作为鳞翅目害虫对Cry毒素产生抗性的标志。APN也是重要的Cry毒素受体。一种APN的表达缺失使得甜菜夜蛾Spodopteraexigua对Cry1Ca产生抗性(Herreroetal., 2005);而Xu等(2014)在对亚洲玉米螟Ostriniafurnacalis的研究中也发现,抗Cry1Ab品系的APN相对于敏感品系有多个氨基酸变异,且其表达量也与敏感品系存在差异。Gahan等(2010)最早报道ABC转运蛋白与昆虫Bt抗性有关:ABCC2的失活突变使Cry1Ac与BBMV的结合减少,导致烟芽夜蛾对其表现出高水平抗性。Tanaka等(2013)则首次证明ABCC2是Cry毒素的受体,并发现表达BmABCC2的Sf9细胞系对Cry毒素的敏感性远高于仅表达BtR175(一种CAD样受体)毒素结合区的Sf9细胞系。有丝分裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路是调节小菜蛾中ALP和ABCC基因表达的总开关(Guoetal., 2015),而最新研究表明,昆虫两种主要激素:20-羟基蜕皮酮(20E)和保幼激素(juvenile hormone, JH)之间的串扰可以激活和微调MAPK级联,进而导致小菜蛾对Bt的抗性(Guoetal., 2020)。
其三,也有人指出昆虫对Bt的抗性与免疫系统有关(Gunningetal., 2005)。Caccia等(2016)发现,Bt的杀虫活性不仅与宿主的肠道菌群有关,还与宿主免疫系统的强弱有关。最近的一些研究也证明昆虫对Bt的抗性与免疫系统有关。例如,Liu等(2019)发现,作为免疫系统重要模式识别受体的PGRPs的表达水平在小菜蛾Cry1Ac抗性品系和敏感品系间存在显著差异,同时抗性品系幼虫具有更高的酚氧化酶活性;通过RNA干扰敲除海灰翅夜蛾Spodopteralittoralis的免疫基因(Sl102)可以显著增强Bt对其幼虫的杀虫活性(Cacciaetal., 2020),García-Robles等(2020)发现马铃薯甲虫Leptinotarsadecemlineata暴露于Cry3Aa毒素后,血淋巴中参与昆虫生长的蛋白含量减少,免疫反应相关蛋白含量增加,说明其对Bt的耐受性受到其免疫系统的影响。Lin等(2020)研究发现Toll, IMD, JNK和JAK-STAT等免疫通路均参与小菜蛾对Bt的免疫防御,而用重组的酚氧化酶原(PPO)饲喂受Bt感染的小菜蛾幼虫可提高其成活率。Li等(2021)在研究肠道微生物对小菜蛾Bt敏感性的影响时亦得到与Lin等(2020)类似结果。在受到Bt侵染时,Anticarsiagemmatalis体内激活IMD和Toll通路相关基因,以及proPO-AS相关丝氨酸蛋白酶基因的表达量均显著上调(Pezentietal., 2021)。如上所述,近年来已有一些研究发现昆虫的免疫系统参与了对抗Bt,同时多数研究提示昆虫免疫系统在对抗Bt时主要依靠IMD和Toll免疫信号通路及proPO-AS(表1)。然而这些研究多是侧面证明或很笼统地指出昆虫免疫系统或某类免疫基因与其Bt抗性有关(Gunningetal., 2005; Liuetal., 2019; García-Roblesetal., 2020; Lietal., 2021; Pezentietal., 2021)。极少有研究能直接证明具体哪个免疫基因对昆虫Bt抗性起了显著作用(Cacciaetal., 2016, 2020; Linetal., 2020),且还没有研究能说明在对抗Bt侵染的过程中昆虫免疫系统具体的作用机制。昆虫免疫系统极为复杂,本文仅对其体液免疫的主要免疫通路做了归纳(图1)。然而结合已有的研究,我们仍可较为清晰地看到这些免疫通路可能的参与对抗Bt的方式。
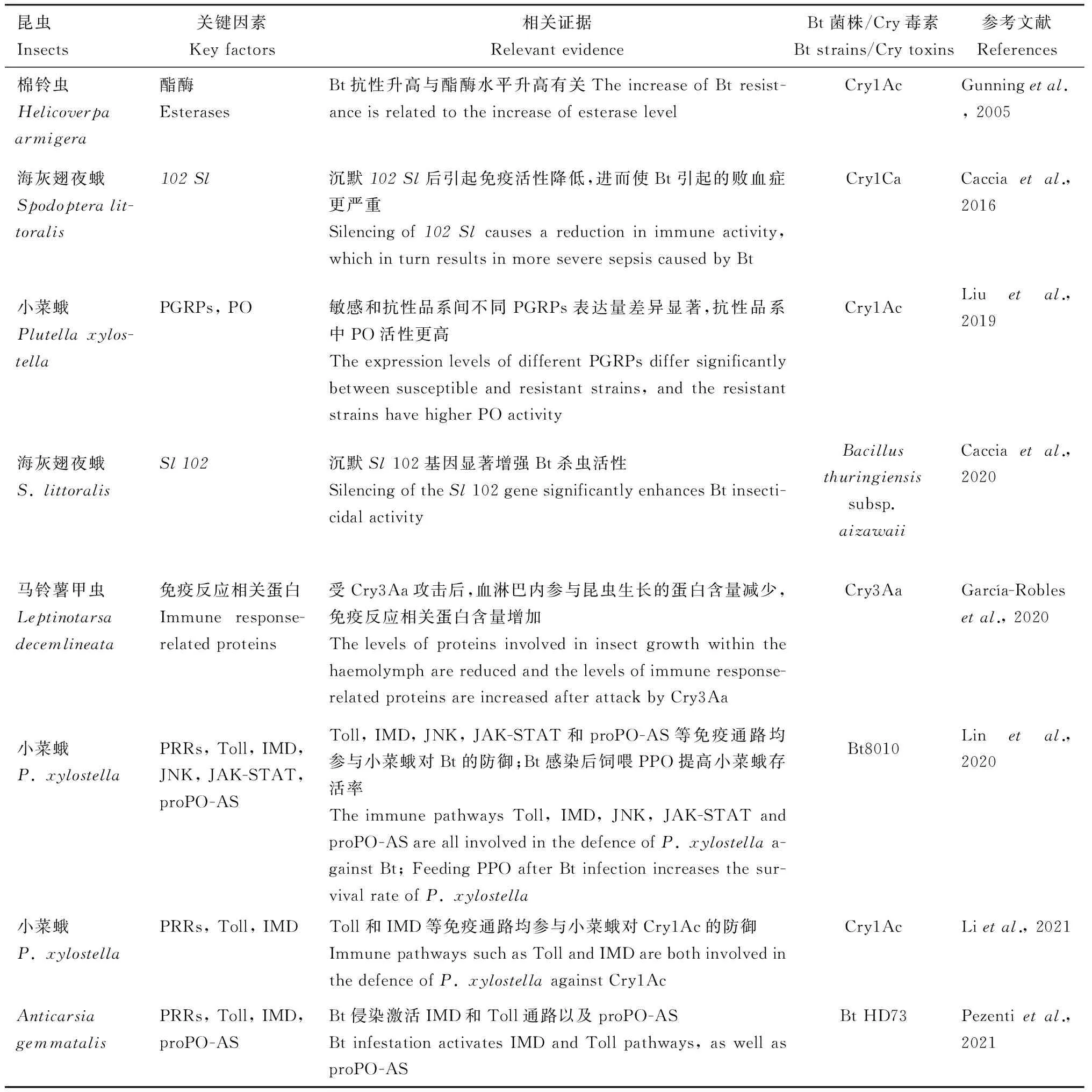
表1 昆虫免疫系统参与对Bt的防御Table 1 Involvement of immune system in the defense against Bt in insects
首先,Guo等(2015)已证明MAPK信号通路是调节小菜蛾中ALP和ABCC基因表达的总开关。MAPKs是细胞表面到细胞核信号转导的重要中介,其调节涉及广泛的生理过程(Davis, 1993, 1994)。MAPK信号通路极为复杂,其不仅包含多个信号通路,同时某些通路间还存在着不同程度的相互串扰,控制着不同基因的表达(Davis, 1993, 1994; Cahilletal., 1996; Pelech, 1996)。而IMD免疫通路中的Tak1是一种MAP3K,与Guo等(2021)研究中发现的MAP3K7作用相同,可以通过不同路径激活下游JNK或p38等MAPK(Wangetal., 2001; Boutrosetal., 2002; Silvermanetal., 2003; Delaneyetal., 2006),进而激活相关转录因子(TFs)。这些TFs可能不仅激活应激或免疫相关的基因表达,也可能直接或间接参与调节ALP和ABCC基因的表达,进而影响昆虫的Bt抗性。另一方面,参与激活和微调MAKP级联,进而导致小菜蛾对Bt表现出抗性的20E(Guoetal., 2020)亦参与了对IMD免疫通路的调控(Reganetal., 2013; Rusetal., 2013)。因此,IMD免疫通路可能通过MAPK信号通路参与调节昆虫对Bt的抗性。
其次,通过AMP、黑化反应,及(或)体液免疫与细胞免疫的相互关联激活血细胞介导的吞噬作用、凝集或包被作用等,对抗因中肠组织被Bt破坏而引起的肠道内微生物大量繁殖及后续的败血症(Sutter and Raun, 1967; Salama and Sharaby, 1985; Bravoetal., 1992, 2005; Johnston and Crickmore, 2009; Lietal., 2021),并通过JNK信号通路促使伤口愈合(Noselli, 1998; Rämetetal., 2002b),进而提高昆虫对Bt毒害的耐受力。 Sutter和Raun(1967)在研究中观察到了血细胞沉积阻止Bt菌进入血淋巴的证据。而本实验室的研究发现小菜蛾Cry1Ac抗性品系中参与黑化反应的PO活性远高于敏感品系(Liuetal., 2019),且已有直接证据证明PPO可提高小菜蛾对Bt的抗性(Linetal., 2020)。这可能是因为Bt可导致昆虫中肠穿孔(Adangetal., 2014),而黑化反应在昆虫伤口愈合方面具有重要作用,且可直接杀死或钝化通过伤口入侵的微生物(Söderhäll and Cerenius, 1998; Lemaitre and Hoffmann, 2007; Söderhäll, 2010; González-Santoyo and Cordoba-Aguilar, 2012),从而控制后续败血症的发展。
4 小结
从20世纪末至今约30年的时间里,科学家们以Bt杀虫晶体蛋白作用机制为向导,逐步探明了Bt原毒素活化受阻及各类Cry毒素受体突变或减少两大类原因导致昆虫产生Bt抗性的机制。然而在肠道因Bt受损后,昆虫是如何应对的?相关研究并不多。结合前文的论述,我们知道这主要涉及到昆虫的免疫系统,且可由此得到两条新的寻找昆虫免疫系统与其Bt抗性关系的思路:(1)免疫系统会否通过MAPK信号通路调节ALP和ABC转运蛋白等Bt受体的表达,从而改变昆虫对Bt的抗性?(2)Bt对中肠组织的破坏形成后,免疫系统的哪些反应对修补组织、控制感染的作用最大?同时这些反应的增强或减弱会否对其Bt抗性产生影响?明确昆虫体液免疫系统与昆虫Bt抗性之间的关系将有助于设计防治害虫的新策略。随着不同层面组学的发展,相关进展将极大促进对害虫Bt抗性机制的深入探索,发现更多新的抗性机制,从而可以开发更多新的、更安全高效的害虫综合防治技术并加以应用。
