禾谷缢管蚜钠通道辅助亚基对钠通道基因表达水平及杀虫剂敏感性的影响
2022-12-28张存环郄杏桃陈茂华
张存环, 刘 朗, 彭 雄, 郄杏桃, 陈茂华
(西北农林科技大学植物保护学院, 农业农村部西北黄土高原作物有害生物综合治理重点实验室,旱区作物逆境生物学国家重点实验室, 陕西 杨凌 712100)
昆虫电压门控的钠离子通道(voltage-gated sodium channel, VGSC)(简称“钠通道”)是拟除虫菊酯等杀虫剂的作用靶标,钠通道基因突变是导致昆虫对拟除虫菊酯产生抗性的主要原因(Lietal., 2013; Rinkevichetal., 2013; Dongetal., 2014)。脊椎动物钠通道由1个α亚基和1个或者几个β亚基组成,α亚基能够独立行使钠通道的基本功能,因此,一般提到的钠通道基因即指α亚基的编码基因,β亚基为功能辅助性亚基,在调节钠通道的功能中有辅助作用(Catterall, 2012)。以往的研究认为,昆虫的钠通道和其他真核生物钠通道相似,由D-Ⅰ, D-Ⅱ, D-Ⅲ和D-Ⅳ 4个结构域组成,由1个基因编码,4个结构域都由S1-S6 6个跨膜螺旋(transmembrane helix, TM)组成,即钠通道为4×6 TM结构。本研究组研究发现,禾谷缢管蚜Rhopalosiphumpadi钠通道与其他类群的昆虫不同,其结构域D-Ⅱ和D-Ⅲ之间分开,形成2个独立的基因(RpNavH1和RpNavH2),即其钠通道为2×6 TM+2×6 TM结构, RpNavH1的D-Ⅰ-D-Ⅱ结构域与黑腹果蝇Drosophilamelanogaster钠通道的有约64%的氨基酸序列一致性,RpNavH2的D-Ⅲ-D-Ⅳ与黑腹果蝇钠通道的有约63%的氨基酸序列一致性(Zuoetal., 2016a)。最新的研究发现,赤拟谷盗Triboliumcastaneum体内也存在两个钠离子通道基因,钠离子通道基因不仅是拟除虫菊酯类杀虫剂的作用靶标,而且和昆虫的发育相关(Qianetal., 2021)。因此,深入开展钠离子通道相关的研究,对于害虫的抗药性治理和农药新靶标的发现具有重要的意义。
昆虫体内没有钠通道β亚基,但在昆虫中发现了与β亚基功能相似的钠通道辅助亚基TipE, TEH1, TEH2, TEH3和TEH4。关于昆虫钠通道辅助亚基功能研究较少,主要集中在黒腹果蝇(Derstetal., 2006; Wangetal., 2013)、美洲大蠊Periplanetaamericana(Bourdinetal., 2015)和西方蜜蜂Apismellifera(Gosselin-Badaroudineetal., 2015)等昆虫。本研究组在前期的研究工作中克隆了禾谷缢管蚜的钠通道辅助亚基基因RpTipE,RpTEH1,RpTEH2,RpTEH3和RpTEH4,发现亚致死剂量的拟除虫菊酯能影响这5个钠通道辅助亚基基因的表达,推测钠通道辅助亚基在调节禾谷缢管蚜钠通道门控中可能有重要作用(林芳菲, 2017)。
禾谷缢管蚜属半翅目(Hemiptera)蚜科(Aphididae),是重要的麦类作物害虫(Blackman and Eastop, 2007),每年给小麦生产造成重大经济损失(Wangetal., 2020; Gongetal., 2021)。拟除虫菊酯类杀虫剂长期应用在禾谷缢管蚜的防治之中,禾谷缢管蚜对拟除虫菊酯类杀虫剂产生了高水平抗性(Wangetal., 2020; Gongetal., 2021)。禾谷缢管蚜钠通道结构与果蝇钠通道结构不同,其钠通道辅助亚基与果蝇钠通道辅助亚基序列差异较大(Zuoetal., 2016a; 林芳菲, 2017),禾谷缢管蚜钠通道辅助亚基的功能研究还未见报道。因此,本研究分析了禾谷缢管蚜钠通道辅助亚基对钠通道功能及高效氯氟氰菊酯敏感性的影响,研究结果对于阐明禾谷缢管蚜钠通道结构的功能特性以及分析该虫对拟除虫菊酯类杀虫剂的抗药性机制具有重要意义。
1 材料与方法
1.1 供试材料
1.1.1供试动物:供试禾谷缢管蚜为实验室内饲养的敏感种群,置于温度22±1℃,相对湿度70%±5%,光周期16L∶8D的人工培养箱;供试性成熟的雌性非洲爪蟾Xenopuslaevis购于中国科学院生态环境研究中心。
1.1.2菌种、质粒、试验动物及培养基:大肠杆菌EscherichiacoliStble3购自广州易锦生物技术有限公司;携带果蝇钠通道基因DmNav22和钠通道辅助亚基基因DmTipE编码序列的质粒由西北农林科技大学胡兆农教授惠赠,表达载体为pGH19;大肠杆菌培养基为LB液体或固体培养基。
1.2 主要试剂及仪器
实验用主要试剂包括Trizol-RNA抽提试剂盒(天根生化科技有限公司)、反转录cDNA合成试剂盒(Promega公司)、实时荧光定量PCR试剂盒(Roche公司)、凝胶胶回收试剂盒和质粒小提试剂盒(Omega公司)、T7 RiboMAXTMExpress RNAi System 试剂盒(Promega公司)、限制性内切酶(NotⅠ,NheⅠ,KpnⅠ,BamHⅠ,EcoRⅠ和XbaⅠ)(TaKaRa公司)、Message Machine®Kit试剂盒(Ambion公司)、96%高效氯氟氰菊酯原药(中国盐城农博生物技术有限公司)。试验用ND-96胶原处理和冲洗溶液、ND-96细胞培养液、ND-96细胞记录液培养液的配制参照文献(Qieetal., 2022)。爪蟾卵母细胞使用ND-96培养液培养,其组分(1 L)为:NaCl (96 mmol/L) 5.610 g, KCl (2.0 mmol/L) 0.149 g, MgCl2(1.0 mmol/L) 0.203 g, CaCl2(1.8 mmol/L) 0.265 g, HEPES (5.0 mmol/L) 1.192 g, Na-pyruvate (2.5 mmol/L) 0.275 g, Theophyline (0.5 mmol/L) 0.090 g溶解于灭菌的ddH2O,定容至1 L。溶解后入2 mol/L NaOH调节pH至7.5,过0.22 μm滤膜除菌,并加入100 mg/L庆大霉素4℃保存。
主要仪器包括Bio-Rad iQ5荧光定量PCR仪(美国Bio-Rad公司)、Nanoject II Autu-Nanoliter Injector 显微注射仪(美国WPI公司)、微电极拉制仪(型号:P-97, 美国Sutter公司)cRNA显微注射仪(型号:Nanoliter2000, 美国Sutter公司)、微电极放大器和数模转换器双电极电压钳系统(型号:AXOCLAMP900A, 美国Molecular Devices Corporation公司)。
1.3 引物设计
根据本研究组之前获得的禾谷缢管蚜钠通道及其辅助亚基基因序列(林芳菲, 2017),利用Primer Premier 5.0设计RT-PCR引物,以β-actin作为内参基因。根据之前获得的cDNA序列,在http:∥www.flyrnai.org/cgi-bin/RNAi_find_primers.pl 网站设计各基因RNA干扰(RNAi)所用引物,并将T7转录启动子序列加到靶标区域两端,引物序列见表1。根据钠通道辅助亚基基因的编码区序列以及表达载体的可用酶切位点,分别设计 1对带有酶切位点的特异性引物,引物序列见表2。

表1 禾谷缢管蚜钠通道基因和钠通道辅助亚基基因RpTipE的荧光定量PCR及dsRNA合成引物Table 1 Primers used for real-time quantitative PCR and dsRNA synthesis of sodium channel genes and sodium channel auxiliary subunit gene RpTipE of Rhopalosiphum padi

表2 禾谷缢管蚜钠通道辅助亚基基因表达所用引物Table 2 Primers for gene expression analysis of sodium channel auxiliary subunit genes of Rhopalosiphum padi
1.4 基因RNAi 和杀虫剂生物测定
RpNavH1,RpNavH2和RpTipE基因的RNAi:根据本实验室前期的研究和预备实验结果,分别注射dsGFP、ddH2O和缓冲液作对照时,目标基因在3种处理条件下表达水平无显著差异,本研究以注射dsGFP(阴性对照)和不注射(空白对照)作为对照。参照Zuo等(2016a)的RNAi方法,随机取禾谷缢管蚜无翅成虫,分别注射dsRpNavH1, dsRpNavH2, dsRpTipE和dsGFP,每种dsRNA注射100头蚜虫,根据本研究组前期的研究和预备实验结果,dsRpNavH1在注射后24 h干扰效率相对最高时,dsRpNavH2在注射后72 h干扰效率最高时(Zuoetal., 2016a),dsRpTipE在注射后24, 48和72 h时,分别挑取存活的成蚜10头,提取总RNA,进行下一步基因的表达量分析。 实验重复3次。
杀虫剂生物测定:随机取禾谷缢管蚜无翅成虫,分别注射dsRpTipE和dsGFP,每种dsRNA注射100头蚜虫,空白对照不注射dsRNA,注射后72 h时收集成活蚜虫40头,使用LC50(1.667 mg/L)浓度的高效氯氰菊酯(Zuoetal., 2016b)和0.1% Triton-X 100水溶液(对照)分别处理20头成活的蚜虫,处理后24 h时记录死亡结果。死亡判断标准:以足不动者视为死亡。实验重复3次。
1.5 实时荧光定量PCR
取纯化后的1.4节提取的总RNA 4 μL和1 μL Oligo(dT)18(500 μg/mL)加入200 μL离心管中,参照Zuo等(2016a)的方法合成cDNA,合成cDNA的反应体系还包括 4 μL 5×Reaction Buffer, 2.5 μL 25 mmol/L MgCl2,1 μL 10 mmol/L PCR Nucleotide Mix,6 μL Nuclease-Free Water, 20 U Ribonuclease Inhibitor和200U GoScriptTM反转录酶。将稀释10倍的cDNA作为模板,制作禾谷缢管蚜RpNavH1,RpNavH2,RpTipE和β-actin的标准曲线,确定扩增效率。每个处理都包括3个生物学重复以及3个技术重复,以ddH2O为模板作为空白对照,进行qRT-PCR分析,PCR反应体系(20 μL): SYBR Green Supermix 10 μL, 上下游引物(10 μmol/L)各0.8 μL, cDNA 模板1 μL, 加ddH2O补足至20 μL。PCR反应程序: 95℃ 10 min; 95℃ 15 s, 58℃ 15 s, 72℃ 20 s, 共40 个循环。PCR 反应结束后,通过熔解曲线判断其特异性。所用引物的扩增效率均接近100%,熔解曲线均为单峰,对应的标准曲线的相关性为0.995以上,根据2-ΔΔCt法计算目标基因的相对表达量。
1.6 异源表达与电生理实验
1.6.1表达载体的构建:利用带限制性酶切位点的特异性引物,分别以构建好的测序正确pMD-Teasy/RpTipE和pMD-Teasy/RpTEH2-RpTEH4质粒为模板进行PCR扩增,将PCR产物与表达载体pGH19同时用限制性内切酶进行双酶切,酶切产物进行胶回收,回收产物进行连接转化涂平板,挑选单克隆置于液体培养基中摇晃培养后提取质粒,经双酶切鉴定正确后,送上海生工生物测序有限公司鉴定。
1.6.2环状质粒线性化:将上述质粒分别利用NotⅠ和NheⅠ限制性内切酶线性化2 h,线性化质粒电泳检测并纯化后,用作体外转录合成cRNA的模板,酶切体系参照说明书。
1.6.3cRNA 的制备及纯化:纯化过的线性化RpTipE和RpTEH2-RpTEH4质粒用T7体外转录试剂盒合成cRNA,操作步骤参照说明书。转录后的RpTipE和RpTEH2-RpTEH4 cRNA用氯化锂沉淀法进行纯化。用分光光度计测定浓度以及A260/A280,分装保存于-80℃超低温冰箱。
本实验所用禾谷缢管蚜钠通道辅助亚基基因及果蝇钠通道基因DmNav22和DmTipE的质粒和线性化质粒及cRNA的质量浓度见表3。

表3 禾谷缢管蚜钠通道辅助亚基基因及果蝇钠通道基因DmNav22和钠通道辅助亚基基因DmTipE的质粒和线性化质粒及cRNA的质量浓度和A260/A280值Table 3 Mass concentrations and A260/A280 values of the plasmids, linearized plasmids and cRNAs of sodium channel auxiliary subunit genes of Rhopalosiphum padi, and sodium channel gene DmNav22 and sodium channel auxiliary subunit gene DmTipE of Drosophila
1.6.4爪蟾的解剖以及其卵母细胞的酶解与筛选:将雌性非洲爪蟾置于配制好的2 g/L的三卡因溶液中,时间20~30 min,待爪蟾麻醉不动后将其取出置于冰上,在其腹部下方用手术刀切一个小口,轻轻拉出卵巢瓣,用手术剪剪下3~5个卵巢瓣,将其置于盛有洗液的培养皿中。缝合爪蟾的肌肉层与表皮层,后将其放入含有抗生素的浅水中(头部露出水面)待其苏醒。18℃条件下,将卵母细胞置于含1 mg/mL IA型胶原酶的卵母细胞洗涤液中消化30 min左右。将酶解后的卵母细胞在洗涤液中多次清洗后保存于卵母细胞培养液中。在显微镜下挑出动物极与植物极界限分明,发育阶段处于V-VI期且表面光滑的卵母细胞,并用镊子剥掉滤泡膜。将处理好的卵母细胞转移置干净的盛有培养液的培养皿里,并于18℃恒温培养箱中培养。
1.6.5cRNA的显微注射:将DmNav22的cRNA分别与DmTipE,RpTipE,RpTEH2-RpTEH4的cRNA等物质量混合后,以石蜡油为载体,吸入针头,注射部位在爪蟾卵母细胞的植物性半球或接近“赤道区”,以避免对核的损伤。以单独注射DmNav22 cRNA为对照,注射后的卵母细胞置于细胞培养液中,在18℃恒温培养中培养,每天更换培养液,且在12~18 h后用于电流检测。
1.6.6电压钳记录:实验过程电流记录方法参照相关文献(Duetal., 2009)。利用双电极电压钳系统测定昆虫钠通道电流。将拉制好玻璃微电极内灌入含琼脂粉的3 mol/L KCl溶液,使其电极电阻小于0.5 MΩ,卵母细胞置于装有记录溶液的记录槽中,将微电极接到电压钳仪器探头上,使用微操动仪分别将电流电极与电压电极同时插入细胞中,设置钳制电压为-120 mV,以5 mV的步阶从-120 mV去极化至-10 mV,时间为100 ms,再给予一组持续20 ms的-10 mV测试脉冲,室温下记录电流。
1.7 数据分析
运用软件SPSS 20.0对禾谷缢管蚜不同处理条件下的死亡率及各基因在不同处理条件下的相对表达量数据进行统计分析。两组间的比较采用Student氏t检验进行分析,差异显著性为P<0.05,数据以平均值±标准误表示。
2 结果
2.1 干扰钠通道基因RpNavH1和RpNavH2对其辅助亚基基因表达量的影响
本实验室前期的研究表明,RpNavH1在注射dsRNA后24 h时的干扰效率相对最高,RpNavH2在注射dsRNA后72 h时的干扰效率最高(Zuoetal., 2016a)。本研究分析注射dsRpNavH1后24 h时的禾谷缢管蚜来分析钠通道辅助亚基基因在处理组(注射dsRpNavH1)与对照组(注射dsGFP)间的表达差异。结果表明,干扰RpNavH1能够显著降低RpTEH1(P=0.003),RpTEH2(P=0.021),RpTEH3(P=0.024)以及RpTipE(P=0.002)(t检验) 4个钠通道辅助亚基基因的表达量,而RpTEH4在处理组和对照组之间的表达量没有显著差异(P=0.076)(图1: A)。本研究分析注射dsRpNavH2和dsGFP后72 h时的禾谷缢管蚜来分析干扰RpNavH2对钠通道辅助亚基基因表达量的影响,结果表明,RNAi干扰RpNavH2显著降低RpTEH1(P=0.001),RpTEH2(P=0.001),RpTEH3(P=0.005),RpTEH4(P=0.003)和RpTipE(P=0.007)的表达(图1: B)。

图1 显微注射dsRNA敲降钠通道基因RpNavH1(A)和RpNavH2(B)后禾谷缢管蚜成蚜5个钠通道辅助亚基基因的相对表达量Fig. 1 Relative expression levels of five sodium channel auxiliary subunit genes in Rhopalosiphum padi adults after knockdown of sodium channel genes RpNavH1 (A) and RpNavH2 (B) by microinjection of dsRNAA: 注射后24 h (At 24 h post injection); B: 注射后72 h (At 72 h post injection). 图中数据为平均值±标准误;柱上符号表示两组间的差异显著性(*P<0.05; **P<0.01; nsP>0.05)(Student氏t检验)。图2同。Data in the figure are mean±SE. Symbols above bars indicate significance of difference between two groups (*P<0.05; **P<0.01; nsP>0.05) (Student′s t-test). The same for Fig. 2.
2.2 RNAi干扰RpTipE对禾谷缢管蚜的钠通道及其辅助亚基基因表达量以及高效氯氟氰菊酯敏感性的影响
以往的报道表明,TipE是昆虫钠通道最重要的辅助亚基(Derstetal., 2006; Wangetal., 2013)。本研究首先利用RNAi技术初步研究禾谷缢管蚜钠通道辅助亚基基因RpTipE的功能。为了确定的RNAi效率,通过qRT-PCR技术分析处理组(注射dsRpTipE)和对照组(注射dsGFP)的禾谷缢管蚜RpTipE在注射后不同时间的表达情况。在注射dsRpTipE后24 h时,与对照组相比,RpTipE的相对表达量降低了14%(P=0.049);在注射dsRpTipE后48 h时,相对表达量下降到39%(P=0.008);在注射dsRpTipE后72 h时,RpTipE的干扰效率降低了24%(P=0.014)(图2: A)。
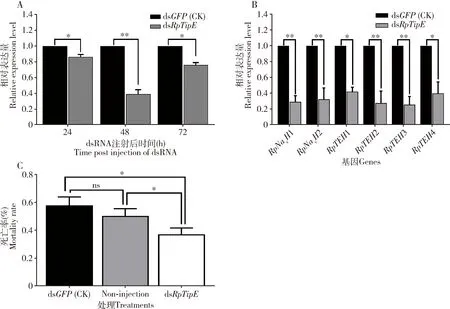
图2 显微注射dsRNA敲降RpTipE对禾谷缢管蚜成蚜的钠通道及其钠通道辅助亚基基因表达量以及高效氯氟氰菊酯敏感性的影响Fig. 2 Effects of knockdown of RpTipE by microinjection of dsRNA on the expression levels of genes of sodium channels and their auxiliary subunits in Rhopalosiphum padi adults and the susceptibility of these adults to beta-cypermethrinA: 注射dsRpTipE后不同时间对RpTipE的RNA干扰效率RNAi efficiency for RpTipE at different time post injection of dsRpTipE; B: 注射dsRpTipE后48 h禾谷缢管蚜成蚜体内钠通道及其辅助亚基基因的相对表达量Relative expression levels of genes of sodium channels and their auxiliary subunits in R. padi adults at 48 h post injection of dsRpTipE; C: 注射dsRpTipE后48 h用LC50浓度的高效氯氟氰菊酯处理禾谷缢管蚜成蚜的死亡率Mortality of R. padi adults treated with LC50concentration of beta-cypermethrin at 48 h post injection of dsRpTipE. Non-injection: 未注射的空白对照Uninjected blank control.
本研究分别取注射dsRpTipE和dsGFP后48 h时的禾谷缢管蚜分析干扰RpTipE对钠通道基因及其同源辅助亚基基因RpTEH1-RpTEH4表达量的影响。结果表明,与对照组相比,RNAi干扰RpTipE显著降低钠通道基因RpNavH1(P=0.012)和RpNavH2(P=0.042)以及辅助亚基基因RpTEH1(P=0.009),RpTEH2(P=0.042),RpTEH3(P=0.018)和RpTEH4(P=0.014)的表达量(图2: B)。
生物测定结果表明,用LC50浓度的高效氯氰菊酯处理后,注射dsRpTipE后48 h时的禾谷缢管蚜成蚜死亡率显著低于注射dsGFP(P=0.011)和未注射的空白对照组(P=0.028)(图2: C)。
2.3 禾谷缢管蚜钠通道辅助亚基对钠通道的门控性质影响
本研究采用双电极电压钳技术研究了禾谷缢管蚜5个钠通道辅助亚基的辅助功能,由于禾谷缢管蚜钠离子通道目前不能在体外真核表达,本研究利用昆虫钠通道功能研究中常用的果蝇钠通道DmNav22研究禾谷缢管蚜钠通道辅助亚基的功能,并使用果蝇钠通道辅助亚基DmTipE进行比较分析。将DmNav22的cRNA单独注射到非洲爪蟾卵母细胞及将DmNav22的cRNA分别与DmTipE,RpTEH2,RpTEH3,RpTEH4和RpTipE的cRNA等物质量混合注射到爪蟾卵母细胞进行表达,结果如图3所示。当注射DmNav22的cRNA到爪蟾卵母细胞时,检测到很小的Na+电流;而当DmNav22的cRNA分别与等物质量的DmTipE,RpTEH2,RpTEH3,RpTEH4和RpTipE的cRNA共同注射爪蟾卵母细胞后,所检测到的Na+电流相对于单独注射DmNav22的cRNA所检测的Na+电流都明显变大。

图3 双电压钳技术检测非洲爪蟾卵母细胞单独注射DmNav22 cRNA(A)及DmNav22 cRNA分别与钠通道辅助亚基基因DmTipE (B), RpTEH2 (C), RpTEH3 (D), RpTEH4 (E)和RpTipE (F)的cRNA共注射时激发的Na+电流Fig. 3 Na+ currents evoked by DmNav22 cRNA (A) injected alone and DmNav22 cRNA co-injected with cRNAs of sodium channel auxiliary subunit genes DmTipE (B), RpTEH2 (C), RpTEH3 (D), RpTEH4 (E) and RpTipE (F), respectively, in Xenopus laevis oocytes detected by two-electrode voltage clamp technology
3 讨论
昆虫钠通道辅助亚基与哺乳动物钠通道β亚基在系统发育树中分为两大支,昆虫TipE与β亚基的氨基酸序列同源性较低。哺乳动物钠通道β亚基(β1-β4)被认为是离子通道的调节原件和细胞粘附分子,能调节钠离子通道的表达和通道门控性质,并且还调节细胞粘附与迁移(Isom, 2002; Brackenburyetal., 2013)。昆虫中尚未发现哺乳动物β亚基的直系同源蛋白,昆虫TipE及其同源亚基具有与哺乳动物钠通道β亚基相似的功能(Derstetal., 2006; Wangetal., 2013, 2015),由于昆虫钠通道辅助亚基与哺乳动物钠通道辅助亚基蛋白的相似性很低,昆虫钠通道辅助亚基可能作为靶标开发新型对人和哺乳动物安全的新型杀虫剂。
关于昆虫钠通道辅助亚基功能研究的文献也较少。Warmke等(1997)研究表明,果蝇5个钠通道辅助亚基在调控果蝇钠通道激活与失活过程中的功能不同。TEH1在超极化方向上能改变依赖电压的快速失活,并延缓黒腹果蝇钠离子通道从快速失活中恢复(Derstetal., 2006)但TipE或TEH1-4调节门控修饰程度是否与它们的变体特异性相关尚不清楚(Bourdinetal., 2015)。将黑腹果蝇钠通道基因分别与其5个辅助亚基基因在非洲爪蟾卵母细胞中共表达后发现,TipE能将黑腹果蝇钠电流提高约20倍,TEH1能将钠电流提高约30倍,TEH2和TEH3能将钠电流提高5~10倍,而TEH4不能显著提高钠电流(Derstetal., 2006);西方蜜蜂钠通道辅助亚基TipE和TEH均增加了钠通道的表达,其TipE, TEH1和TEH2没有改变或增加钠通道稳态失活,而TEH3和TEH4不仅阻碍通道进入失活状态,也阻碍了钠通道的激活(Gosselin-Badaroudineetal., 2015)。Bourdin等(2015)研究发现,美洲大蠊TipE比果蝇TipE更有效地促进DmNav1-1引发的Na+电流,表明美洲大蠊TipE可能具有更强大的伴侣特性。本研究发现,将禾谷缢管蚜钠通道辅助亚基基因RpTipE以及RpTEH2,RpTEH3和RpTEH4分别与果蝇钠通道DmNav22在爪蟾卵母细胞中共表达时,均提高了果蝇DmNav22的钠电流(图3),表明禾谷缢管蚜钠通道虽然具有独特的异源二聚体结构,但其钠通道辅助亚基仍和其他钠通道昆虫辅助亚基一样,能够提高钠通道的钠电流,推测禾谷缢管蚜钠通道辅助亚基TipE可能参与调节钠通道的门控性质。
靶标基因的表达量的变化可以使多聚体靶标的亚基组成发生变化,进而改变了杀虫剂结合靶标的能力(Zhangetal., 2015; Chenetal., 2017)。Chen等(2017)研究表明,烟碱型酰胆碱受体β1亚基的低水平表达与棉蚜Aphisgossypii的吡虫啉抗性相关。Zhang等(2015)研究表明,当RNAi烟碱型乙酰胆碱受体α8亚基后,褐飞虱Nilaparvatalugens对吡虫啉的敏感性降低,α8亚基的下调与吡虫啉抗性相关。Zuo等(2016a)研究表明,干扰禾谷缢管蚜两个钠通道基因后,禾谷缢管蚜对高效氯氰菊酯的敏感性降低。Tian等(2018)研究也表明在具有完整钠离子通道结构域的甜菜夜蛾Spodopteraexigua中,钠通道基因在抗性品系中的表达量显著低于敏感品系。Qian等(2021)研究表明, RNAi干扰赤拟谷盗的两个钠通道基因TcNav1和TcNav2后,显著降低该虫对溴氰菊酯的敏感性。本研究分别干扰了禾谷缢管蚜钠通道基因RpNavH1和RpNavH2后,钠通道辅助亚基基因的表达量都下调(图1);干扰RpTipE后,禾谷缢管蚜钠通道基因RpNavH1和RpNavH2的表达量均显著降低(图2)。黑腹果蝇和西方蜜蜂蝇钠离子通道5个辅助亚基在调控果蝇钠通道门控性质中具有不同的功能,但是昆虫钠通道辅助亚基之间的相关影响目前还缺乏研究,禾谷缢管蚜钠通道基因及其辅助亚基因之间的相互影响模式也有待进一步研究。本研究RNAi干扰RpTipE后,禾谷缢管蚜经高效氯氟氰菊酯处理后的死亡率降低(图2),这可能是因为干扰RpTipE后,钠通道基因以及其他钠通道辅助亚基基因的表达量降低,而高效氯氟氰菊酯的作用靶标为钠通道,作用靶标的减少导致高效氯氟氰菊酯的效果降低。
