果蝇凋亡蛋白Strica的原核表达、多克隆抗体的制备及在放线菌酮诱导下的激活状态检测
2022-12-28胡旭昊石柳柳
孟 昆, 胡旭昊, 石柳柳
(1. 湖北医药学院附属太和医院, 湖北十堰 442000; 2. 湖北医药学院基础医学院, 湖北十堰 442000)
细胞凋亡是真核生物中存在的一种程序化死亡方式,在维持细胞生长分化,介导先天免疫反应等过程发挥了重要作用(Schwarzeretal., 2020)。细胞凋亡由蛋白酶caspase介导,caspase是一类保守的半胱氨酸天冬氨酸特异性蛋白酶,具有半胱氨酸活性位点,可以在底物蛋白的天冬氨酸位置发生切割(Shi, 2004)。近年来的研究发现,除了细胞凋亡,caspase还介导了其他重要的生物学过程,如细胞焦亡(Jiangetal., 2020)、先天免疫(Orning and Lien, 2021)等。在正常细胞中,caspase是以无活性的酶原形式(procaspase)存在的,procaspase通常包括一个N端的原结构域,1个大亚基(p20)和1个小亚基(p10)。有活性的蛋白酶是由两个大亚基和两个小亚基组成的异源四聚体,包含两个活性位点。无活性的procaspase变成有活性的 caspase需要发生两次切割:大亚基与小亚基之间的切割以及原结构域与大亚基之间的切割(Boatright and Salvesen, 2003),因此caspase的激活伴随着其蛋白的切割。根据caspase在通路中发挥作用的时间顺序,可以分为起始caspase和效应caspase两大类。起始caspase通常拥有较长的N端原结构域,通常包含一些募集结构域,例如死亡效应结构域(death effector domain, DED)或半胱天冬酶的激活和caspase募集域(caspase recruitment domain, CARD),而效应caspase通常有一个短的原结构域(Kesavardhanaetal., 2020)。
果蝇Drosophila是研究发育生物学、生物化学重要的模式生物之一(Subhan and Siddique, 2021)。果蝇中存在7个caspases: Dronc, Dredd, Strica (serine- and threonine-rich caspase), Dcp-1, Decay, Drice和Damm,其中,Dronc, Dredd和Strica这3个蛋白含有一个长的原结构域,是起始caspase (Cooperetal., 2009)。比较特殊的是,Strica拥有一个富含丝氨酸和苏氨酸原结构域,在哺乳动物中没有同源蛋白,是昆虫中特有的一类caspase(Doumanisetal., 2001)。前期的研究报道表明Strica与细胞凋亡相关:过表达Strica引发果蝇SL2细胞凋亡(Doumanisetal., 2001);果蝇眼睛异源表达Strica导致果蝇呈现毛糙眼(rough eye);RNAi实验表明Strica参与Hid蛋白诱导的细胞凋亡,DIAP1结合Strica并抑制其凋亡(Leulieretal., 2006)。另外,strica在胚胎和幼虫期表达量较低,而在蛹和成虫中表达量比较高,在果蝇卵子、神经元发育等凋亡过程中与Dronc蛋白存在冗余功能(Baumetal., 2007; Leeetal., 2011; Kaleetal., 2015)。但由于缺乏该蛋白的商业化抗体,Strica蛋白的结构、酶原激活方式以及生化功能等方面仍有待研究。鉴于此,本研究表达纯化Strica蛋白,制备抗Strica的多克隆抗体,并且研究了该蛋白在凋亡刺激物放线菌酮处理后的激活状态,为进一步深入研究Strica的功能提供实验基础。
1 材料与方法
1.1 供试果蝇细胞
果蝇Schneider 2(S2)细胞购买于美国培养物保藏中心(American Type Culture Collection, ATCC),在含有10%胎牛血清(Gibco)的Schneider’sDrosophilaMedium (BI)中,于28℃饱和湿度的无CO2培养箱中培养。
1.2 Strica原核表达载体构建
利用DNAstar和PROSITE在线软件分析果蝇Strica的蛋白质序列(NCBI登录号: NP_001260718),设计引物扩增选取的亲水性较好、表面可及性和免疫原性强的区域(220-330 aa,预测为Strica蛋白原结构域位置)。引物于武汉生工生物公司合成(表1)。以前期构建的含有Strica ORF全长的pAc5-V5-Strica过表达载体(本实验室保存)为模板,利用上述引物进行PCR扩增,反应体系: 10×KOD Buffer 5 μL, dNTPs (2 mmol/L) 5 μL, MgSO4(25 mmol/L) 3 μL, KOD酶1 μL, 上下游引物(10 μmol/L)各0.5 μL, 模板100 ng, ddH2O 34 μL。反应程序: 98℃预变性5 min; 98℃变性30 s, 58℃退火30 s, 68℃延伸30 s, 30个循环;68℃继续延伸10 min。通过1%琼脂糖凝胶电泳分离产物,回收目的片段。将目的片段与pET30a(本实验室保存)通过NdeⅠ和XhoⅠ(NEB公司, 美国)双酶切后连接,将连接产物转化至大肠杆菌EscherichiacoliTop10感受态细胞(本实验室保存),构建表达载体;挑取单菌落摇菌,提质粒后送武汉生工生物测序。DNA回收试剂盒以及质粒小提试剂盒均购自北京天根公司。

表1 本研究所用引物Table 1 Primers used in this study
1.3 Strica原核表达与纯化
将1.2节构建的pET30a-Strica转化大肠杆菌BL21(DE3)感受态细胞(由本实验室保存),挑取单克隆摇菌,当OD600达到0.4时,加入0.4 mmol/L IPTG,于22℃下诱导表达15 h,在OD600达到0.8~1.0停止诱导。菌液经过超声破碎离心后,通过SDS-PAGE检测目的蛋白的表达情况以及在上清和沉淀中的分布。将离心得到的蛋白上清与Ni-NTA琼脂糖(Qiagen)孵育,并利用20, 80, 250和500 mmol/L的咪唑溶液进行洗脱,通过SDS-PAGE检测目的蛋白在不同浓度咪唑洗脱液中的分布。并利用3 kD的超滤管(Millipore)进行超滤浓缩。蛋白浓度用考马斯蓝染色法测定,以不同浓度的牛血清白蛋白为衡量标准。
1.4 Strica抗体的制备与效价检测
实验动物 6周龄的新西兰大白兔的购买与饲养均来自于湖北医药学院动物中心。取200 μg 1.3节重组Strica蛋白样品,用PBS稀释到500 μL,加入等体积弗氏佐剂(初次免疫用弗氏完全佐剂,加强免疫用弗氏不完全佐剂);用混匀仪器将溶液和佐剂混匀,形成油包水。将混匀好的免疫原进行背部皮下注射免疫,打8~10个点。每两周同样剂量加强免疫,共加强两次。耳静脉取血,通过间接ELISA测定抗体效价。达到预期的效价后,颈动脉取血,全血室温静置30~120 min后,5 000 r/min离心10 min,得到血清。血清经过Protein G纯化得到抗体。取1.5 mL未免疫新西兰大白兔耳静脉血制备的血清作为阴性血清。利用间接ELISA法测定抗体的效价:用终浓度为2 μg/mL的抗原于4℃包被过夜。一抗为制作的多克隆抗体,多抗从200倍开始2倍梯度稀释,阴性对照为免疫前血清200倍稀释,空白对照为PBS。二抗为10 000倍稀释的羊抗兔IgG,测定450 nm处的吸光值。效价为大于最大OD/2的最小OD读数所对应的稀释度。用纯化的带His标签的Strica免疫原蛋白通过Western blot实验检测该抗体的灵敏度,具体操作如下:向果蝇Strica重组蛋白样品加入SDS loading,进行SDS-PAGE电泳,24 V恒压转PVDF膜45 min。5% 脱脂牛奶室温封闭30 min,1×TBST洗膜3次,每次5 min。Anti-His抗体(27E8,#9991S)来自CST公司,稀释比例为1∶1 000(v/v);anti-Strica抗体分别按照1∶500, 1∶1 000, 1∶2 000, 1∶5 000以及1∶10 000(v/v)进行稀释;阴性血清稀释比例为1∶1 000(v/v)。室温孵育2 h,1×TBST洗3次后,辣根过氧化物酶HRP标记羊抗鼠或羊抗兔的二抗购买于Thermo Fisher公司,稀释比例为1∶5 000。室温孵育30 min,1×TBST洗3次后进行显影。
1.5 细胞转染
为了在细胞水平上检测Strica蛋白,将果蝇S2细胞铺于24孔板中,细胞密度约为70%,利用Lipofectamine 2000将前期构建的过表达载体pAc5-V5-Strica或空载体质粒进行转染,原核表达的Strica蛋白作为阳性对照。利用Lipofectamine RNAiMAX转染strica的特异性siRNA,siRNA转染果蝇S2细胞的细胞密度约为30%。 果蝇strica的特异性siRNA序列:5′-GCTC TCTTCGCAAAGATAAAG-3′,非特异性siRNA序列:5′-TTCTCCGAACGTGTCA CGT-3′。SiRNA由武汉生工生物公司合成。利用Strica抗体通过Western blot检测(方法同1.4节)S2细胞中内源以及过表达的Strica蛋白。Anti-α-tubulin抗体(T5168)购自Sigma-Aldrich,稀释比例为1∶5 000。
1.6 RT-qPCR检测strica表达量
通过Trizol 裂解法提取1.5节S2细胞总RNA,利用南京诺唯赞公司HiScript 1st Strand cDNA Synthesis Kit合成cDNA,以actin作为内参基因,进行qPCR检测。qPCR体系: 2×SYBR Mix 10 μL, cDNA 100 ng, 上下游引物(10 μmol/L)各0.5 μL, RNase-free-ddH2O补至20 μL。PCR程序: 95℃ 5 min; 95℃ 15 s, 60℃ 40 s, 40个循环; 同时在60~95℃进行溶解度分析。通过2-ΔΔCt计算出strica的相对表达量。实验进行3次生物学重复,每个反应设置3次技术重复。
1.7 免疫荧光实验进行Strica亚细胞定位
S2细胞在多聚赖氨酸处理的细胞爬片上生长,使用4%的多聚甲醛固定10 min。0.2%Triton X-100渗透15 min。2%牛血清白蛋白孵育30 min,阻断非特异性结合。anti-Strica抗体(1∶1 000, v/v)孵育样品,PBS洗3次。FITC标记的荧光二抗(ThermoFisher)孵育0.5 h,PBS洗4次。DAPI染色1 min,PBS洗3次后封片。共焦显微镜(Olympus)上获得共焦荧光图像。
1.8 放线菌酮诱导Strica的切割激活检测
为了研究Strica是否参与果蝇细胞的细胞凋亡通路,向S2细胞中加入放线菌酮(cycloheximide, CHX),对照组加入0.1%的DMSO。CHX购于Selleck公司(S7418),使用浓度为10 μg/mL,处理18 h后裂解细胞,caspase抑制剂z-VAD-FMK(20 μmol/L)于CHX处理前2 h时加入。将5 μL CHX处理过的S2细胞裂解物与20 μmol/L的caspase荧光底物Ac-DEVD-AFC在柠檬酸钠缓冲液(50 mmol/L Tris-HCl,pH 7.4,1 mol/L柠檬酸钠,10 mmol/L DTT和0.05% CHAPS)中混合,并在37℃下共孵育30 min后通过监测荧光AFC的释放测量caspase活性,每5 min测量一次,共持续1 h (Mengetal., 2016)。使用Graphpad Prism 9.0软件收集和分析数据。利用Strica抗体通过Western blot检测CHX处理后S2细胞裂解液中Strica蛋白的切割状态。方法同1.5节。
1.9 数据分析
采用SPSS 19.0进行统计学分析,两组样品比较采用t检验,统计学上以P<0.05表示有显著性差异,P<0.01表示有极其显著性差异。
2 结果
2.1 果蝇Strica重组蛋白的表达与纯化
IPTG诱导表达后出现一条分子量大小约12 kD的蛋白条带(图1: A)。SDS-PAGE检测结果显示,250 mmol/L咪唑洗脱下来的蛋白较多,用梯度浓度的BSA进行蛋白定量,发现目的蛋白浓度处于0.5~1.0 mg/mL(图1: B)。

图1 果蝇Strica重组蛋白的诱导表达(A)及其纯化(B)Fig. 1 Induced expression (A) and purification (B) of the recombinant Drosophila Strica1: 无IPTG诱导的细菌裂解液Bacteria lysate without IPTG induction; 2: IPTG诱导的细菌裂解液Bacteria lysate after IPTG induction; 3: IPTG诱导的上清Supernatant after IPTG induction; 4: IPTG诱导的沉淀Precipitation after IPTG induction; 5: 流穿液Flow through fluid; 6-9: 分别为20, 80, 250和500 mmol/L咪唑洗脱液Eluent with 20, 80, 250 and 500 mmol/L imidazole, respectively; 10-12: 分别为0.2, 0.5和1.0 mg/mL BSA 0.2, 0.5 and 1.0 mg/mL BSA, respectively; M: 蛋白质分子量标准Protein molecular weight marker.
2.2 Strica多克隆抗体效价和灵敏度
间接ELISA方法检测血清的效价达1∶25 600(图2: A)。通过Protein G进行抗体纯化。通过BCA测试,最终Strica抗体浓度为2.3 mg/mL。Western blot灵敏度检测结果表明,Strica蛋白可被anti-His抗体检测到,也可以被1∶10 000稀释度下的多克隆抗体检测到,而不能被阴性的血清检测到(图2: B)。
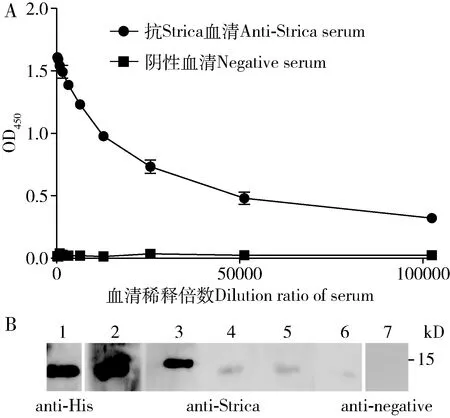
图2 Strica多克隆抗体的效价(A)和灵敏度(B)Fig. 2 Titer (A) and sensitivity (B) of Strica polyclonal antibody1: Anti-His抗体Anti-His antibody, 1∶1 000; 2: Anti-Strica抗体Anti-Strica antibody, 1∶500; 3: Anti-Strica抗体Anti-Strica antibody, 1∶1 000; 4:Anti-Strica抗体Anti-Strica antibody, 1∶2 000; 5: Anti-Strica抗体Anti-Strica antibody, 1∶5 000; 6: Anti-Strica抗体Anti-Strica antibody, 1∶10 000; 7: 阴性血清Negative serum, 1∶1 000 (Anti-negative: 抗Strica阴性血清Anti-Strica negative serum).
2.3 Strica多克隆抗体在果蝇S2细胞中的表达
Western blot检测结果如图3所示,转染了pAc5-V5-Strica质粒的S2细胞样品和原核表达的Strica蛋白样品在55 kD处检测到了特异性条带(#1),符合Strica蛋白的理论分子量。而转染了空载体的样品相应的位置处有一条较浅的条带 (#2),可能是内源性的Strica。结果说明制备的Strica蛋白多克隆抗体能够用于检测果蝇细胞中过表达的Strica蛋白。
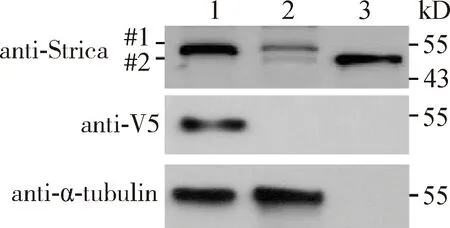
图3 利用Strica多克隆抗体检测果蝇S2细胞中过表达的Strica蛋白Fig. 3 Over-expressed Strica in Drosophila S2 cells detected by Strica polyclonal antibody1: 转染pAc5-V5-Strica质粒Transfected with plasmid pAc5-V5-Strica; 2: 转染pAc5-V5空载体质粒Transfected with blank plasmid vector pAc5-V5; 3: 带His标签的Strica蛋白Strica with His-tag; #1: 过表达的Strica Overexpressed Strica; #2: 细胞内源的Strica Cellular endogenous Strica.
进而为了检测果蝇细胞中内源性的Strica蛋白,我们在S2细胞中转染了strica特异性的和非特异性siRNA,用anti-Strica抗体进行Western blot检测。RT-qPCR结果表明,与转染了非特异性siRNA的样品比较,转染了stricasiRNA的样品strica的表达水平极显著下调了约80%(P<0.01),表明该siRNA的有效性(图4: A);Western blot检测结果表明,与转染了非特异性siRNA的蛋白样品相比,转染了stricasiRNA的蛋白样品在55 kD处的条带变弱,该条带符合Strica蛋白的理论分子量(图4: B)。免疫荧光实验表明,转染了非特异性siRNA后,Strica在S2细胞的细胞质中呈现点状分布,转染了stricasiRNA后亮度变弱(图4: C)。结果说明制备的Strica蛋白多克隆抗体能够用于检测果蝇细胞内源的Strica蛋白。
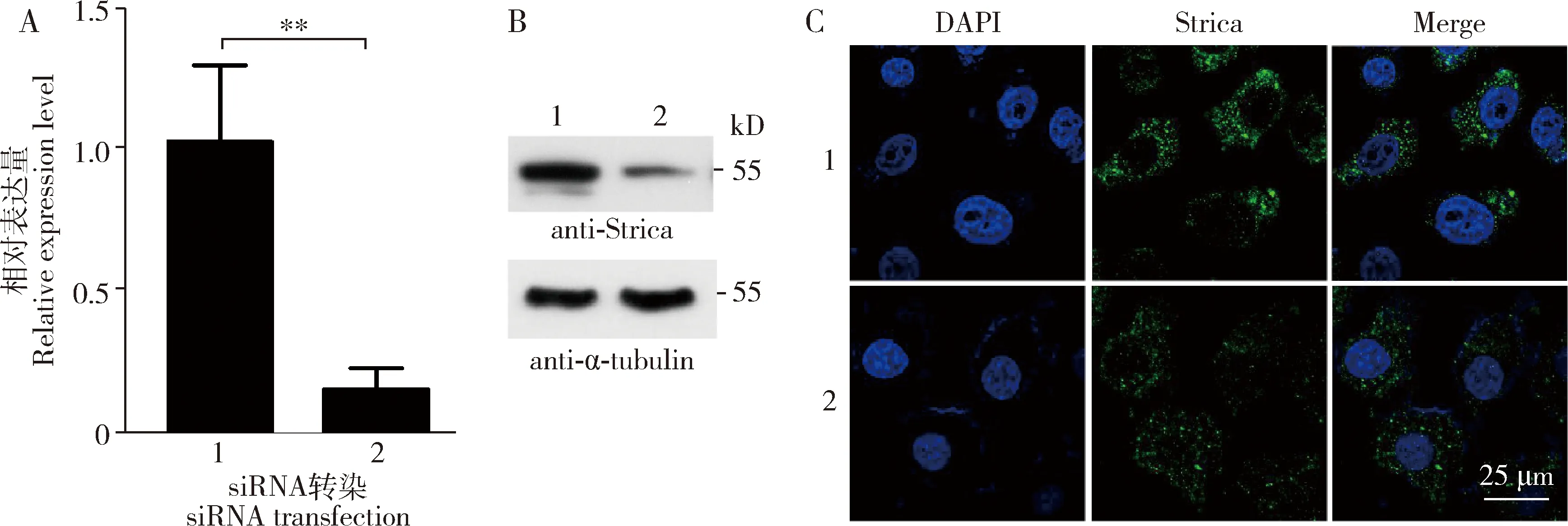
图4 Strica多克隆抗体对果蝇S2细胞内源Strica蛋白的检测Fig. 4 Endogenous Strica protein in Drosophila S2 cells detected by Strica polyclonal antibodyA: RT-qPCR检测strica siRNA的下调Down-regulation of strica siRNA detected by RT-qPCR; B: 通过Western blot利用anti-Strica抗体检测strica siRNA的下调Down-regulation of strica siRNA detected by anti-Strica antibody using Western blot; C: anti-Strica抗体检测Strica蛋白亚细胞定位Subcellular localization of Strica detected by anti-Strica antibody. 1: 非特异siRNA组Non-specific siRNA group; 2: strica siRNA组strica siRNA group; DAPI: 细胞核染料Nuclear dye; Strica: anti-Strica抗体 anti-Strica antibody; Merge: 前两图的合并Merge of the former two pictures. A图中数据为平均值±标准误;柱上双星号表示差异显著(P<0.01, t检验)。图5同。Data in Fig. A are mean±SE. Double asterisk above bars indicates significant difference (P<0.01, t-test). The same for Fig. 5.
2.4 放线菌酮诱导Strica的切割激活
与加入caspase抑制剂z-VAD-FMK的相比,放线菌酮处理后,S2细胞的caspase活性极显著升高(P<0.01),提前加入caspase的抑制剂z-VAD-FMK caspase活性被抑制(图5: A);Western blot结果显示Strica蛋白在放线菌酮处理后发生了切割,切割的条带大小对应Strica蛋白的原结构域加大亚基位置,z-VAD-FMK加入后又被抑制(图5: B)。结果表明,放线菌酮诱导Strica的切割激活过程中。
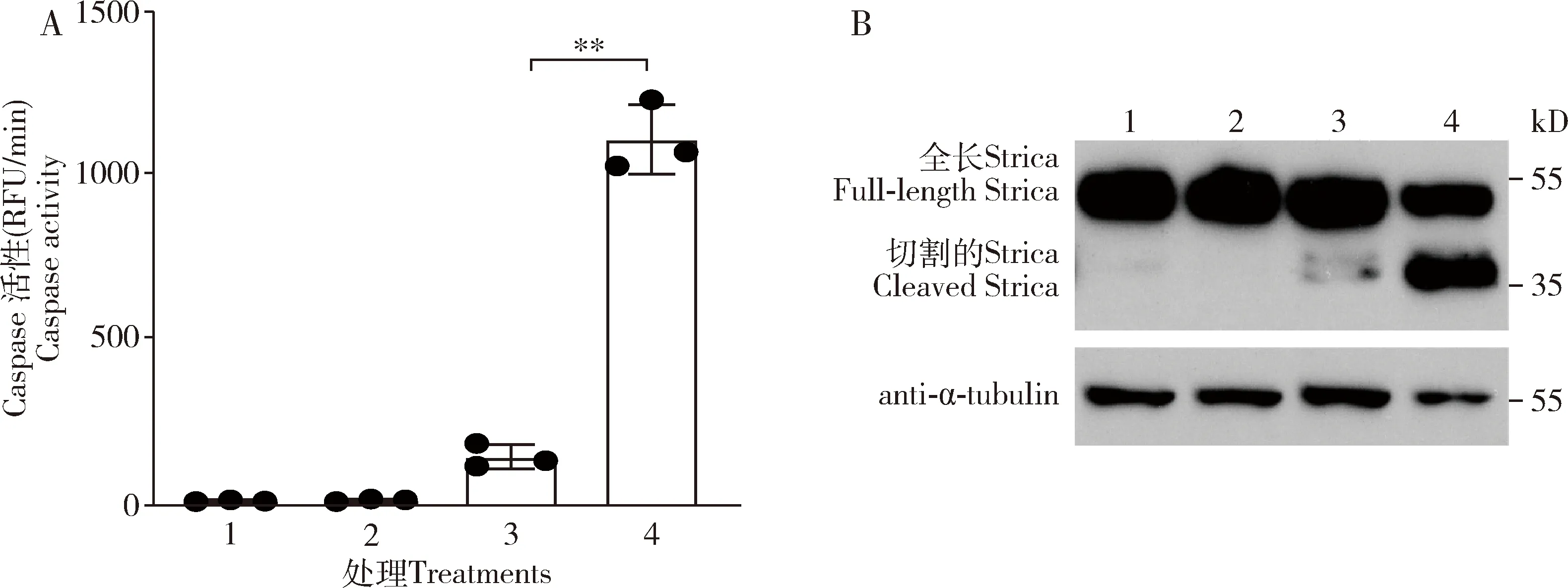
图5 放线菌酮(10 μg/mL)诱导果蝇S2细胞中Strica的切割激活Fig. 5 Cycloheximide (10 μg/mL) induced the cleavage activation of Strica in Drosophila S2 cellsA: Caspase活性测试Caspase activity test; B: anti-Strica抗体检测Strica蛋白的切割Detection of the cleavage of Strica using the anti-Strica antibody. RFU: 相对荧光单位Relative fluorescence unit; 1: DMSO+z-VAD-FMK (CK1); 2: DMSO (CK2); 3: CHX+z-VAD-FMK; 4: 放线菌酮Cycloheximide (CHX); z-VAD-FMK: Caspase抑制剂Caspase inhibitor.
3 讨论
目前缺少Strica商业化抗体,只能通过细胞水平的过表达、杂交和同源重组等间接体系操作。本研究成功制备了高特异性的兔抗果蝇Strica蛋白的多克隆抗体(图2-4),利用该抗体检测发现Strica可以响应放线菌酮诱导的细胞凋亡(图5)。我们的前期鉴定到白纹伊蚊Aedesalbopictus中Strica的一个同源蛋白AaCASPS16参与放线菌素D和紫外线诱导的细胞凋亡(Mengetal., 2016),这与我们的研究结果一致;前期异源表达哺乳动物细胞293T的Strica定位在细胞质(Doumanisetal., 2001),这与本研究的散点亚细胞定位这一结果不同,原因可能是细胞系、图像分辨率以及抗体存在差别,我们在果蝇细胞中利用内源性抗体,通过共聚焦显微镜观察到的Strica定位更接近于生理条件。
虽然我们的结果表明Strica可响应刺激物放线菌酮的激活,但该caspase在细胞中的激活切割方式、生化功能、以及上下游的信号通路并不清楚。Strica具有一个长的富含丝氨酸和苏氨酸的原结构域,在激活过程中很可能受到糖基化和磷酸化等翻译后修饰的影响。未来可以用该抗体进行免疫沉淀,通过质谱鉴定其互作蛋白和原结构域中的修饰位点,从而研究其激活方式以及生理功能。本研究制备的Strica多克隆抗体为进一步研究Strica的细胞凋亡、生长发育以及先天免疫功能奠定了实验基础。
