肾透明细胞癌组织中PGC-1α表达及与患者预后的相关性
2022-12-28尤校雷南力宾黄少鹏
尤校雷,刘 炜,南力宾,黄少鹏
(邯郸市中心医院泌尿外科,河北邯郸 056001)
肾透明细胞癌是泌尿外科常见的恶性肿瘤之一,其发病率占泌尿生殖系统恶性肿瘤第2位[1]。据报道,在中国肾透明细胞癌每年新增病例可达30.4万,死亡病例可达3.1万[2]。肾透明细胞癌的发生是一个缓慢的过程,涉及多种基因表达及多种信号通路,但具体发生的分子遗传机制尚不清楚[3]。过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)是PGC-1家族的第一个成员,它最初被鉴定为一个能与核受体过氧化物酶体增殖物激活受体γ共同作用的含798个氨基酸的蛋白[4]。PGC-1α是线粒体生物合成的关键调控因子,其在多种代谢性疾病中扮演着重要的角色,是氧化代谢和合成代谢的关键节点,参与了肿瘤代谢的调节,可以从氧化代谢和合成代谢2个方面调控肿瘤细胞的存活、增殖和迁移[5]。但PGC-1α的表达是否可参与肾透明细胞癌发病及患者预后尚不明确。因此,本文通过检测肾透明细胞癌组织中PGC-1α的表达水平,并分析其与预后的关系,以期为临床上评估肾透明细胞癌患者预后奠定基础。
1 资料与方法
1.1 一般资料连续性选取2014年2月—2016年12月于邯郸市中心医院泌尿外科接受手术治疗的90例肾透明细胞癌患者,取其肾透明细胞癌组织和癌旁正常肾组织。手术标本切除后立即冻入液氮中,再置于-80 ℃冰箱中保存。患者中男性59例,女性31例;年龄38~75(56.16±9.37)岁,<56岁54例,≥56岁36例;肿瘤直径<5 cm 48例,≥5 cm 42例;有淋巴结转移43例,无淋巴结转移47例;TNM分期[6]:Ⅰ期27例、Ⅱ期19例、Ⅲ期30例、Ⅳ期14例;Fuhrman分级[6]:Ⅰ~Ⅱ级50例、Ⅲ~Ⅳ级40例。纳入标准:①符合《中国肾癌诊治指南2013版》[6]中的肾透明细胞癌诊断标准,术后癌组织经病理检查证实为肾透明细胞癌组织;②均接受根治性肾切除术,术前未接受放、化疗及其他治疗;③患者临床资料完整。排除标准:①合并其他恶性肿瘤;②有严重感染者;③肝、肾功能严重异常者。本研究通过邯郸市中心医院伦理委员会批准,患者均签署知情同意书。
1.2 方法
1.2.1实时荧光定量PCR(realtimefluorescencequantitativePCR,qRT-PCR)法检测肾透明细胞癌组织和癌旁正常肾组织中PGC-1α信使RNA(messengerRNA,mRNA)的表达水平 参照Trizol试剂(浙江联硕生物科技有限公司,批号960189)说明书提取肾透明细胞癌组织和癌旁正常肾组织总RNA,逆转录试剂盒(广州东盛生物科技有限公司,批号SJ-50791H)合成cDNA,然后采用qRT-PCR试剂盒(SYBR Green qPCR Mix,浙江联硕生物科技有限公司,批号50172)进行反应。PCR反应体系共20 μL:SYBR Green qPCR Mix 10 μL,cDNA 1 μL,正、反向引物各1 μL,去离子水7 μL。PGC-1α以GAPDH为内参,引物均由天津鼎赛生物基因科技有限公司合成,引物序列见表1。扩增条件:95 ℃,2 min;95 ℃,20 s、60 ℃,20 s、72 ℃,40 s,循环40次。PGC-1α mRNA的表达水平以2-ΔΔCt法计算。

表1 qRT-PCR引物序列
1.2.2免疫组织化学法检测肾透明细胞癌组织和癌旁正常肾组织中PGC-1α蛋白的表达水平 制作肾透明细胞癌组织和癌旁正常肾组织石蜡切片,脱蜡,再修复抗原,然后用体积分数为3%的H2O2浸泡10 min,阻断切片中H2O2酶活性,加入兔抗人PGC-1α单克隆抗体,室温下孵育1 h,再置于4 ℃过夜,然后用磷酸盐缓冲液清洗1次,然后加入二抗孵育20 min,最后用苏木素复染,脱水、封片,显微镜观察。结果判定[7]:随机选取5个视野(×400),由2位专业人员完成评定。染色强度:无(0分)、浅黄色(1分)、棕黄色(2分)、棕褐色(3分);阳性细胞占比:<5%(0分)、5%~25%(1分)、26~50%(2分)、51%~75%(3分)、>75%(4分)。以染色强度评分×阳性细胞占比评分值作为判断PGC-1α蛋白阳性的依据,两者乘积≤2分为阴性,>2分为阳性。
1.3 预后指标及随访方法所有患者均于手术后采用电话或患者入院复查等方式进行5年随访,随访起始日期为术后第1天,随访终止日期为5年随访期满或者随访期内患者死亡时。记录随访5年内肿瘤复发、转移及患者死亡情况,统计无进展生存率和总生存率。无进展生存期:肾透明细胞癌患者术后第1天至随访到肿瘤进展(复发或转移)、因任何原因死亡或随访期满的时间;总生存期:肾透明细胞癌患者术后第1天至因任何原因死亡或随访期满的时间。
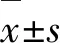
2 结 果
2.1 肾透明细胞癌组织和癌旁正常肾组织中PGC-1α mRNA和蛋白表达水平比较PGC-1α蛋白阳性主要表达于细胞核,呈棕黄色或棕褐色(图1)。与癌旁正常肾组织比较,肾透明细胞癌组织中PGC-1α mRNA表达水平和PGC-1α蛋白阳性表达率较低(P<0.05,表2)。
2.2 肾透明细胞癌组织中PGC-1α蛋白表达与患者临床病理特征的关系PGC-1α蛋白表达均与淋巴结转移、TNM分期、Fuhrman分级相关(P<0.05),而与患者性别、年龄、肿瘤直径无关(P>0.05,表3)。
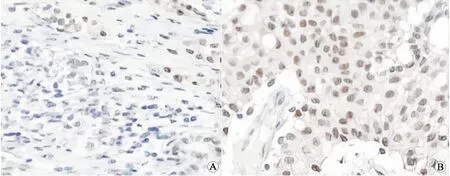
A:肾透明细胞癌;B:癌旁正常肾组织。图1 肾透明细胞癌及癌旁正常肾组织中PGC-1α蛋白表达(免疫组织化学染色,×400)
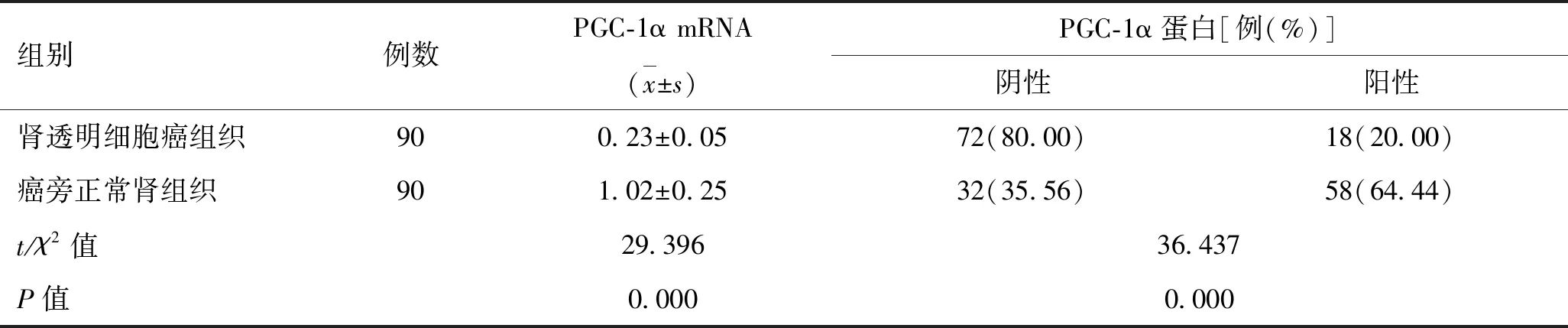
表2 肾透明细胞癌组织和癌旁正常肾组织中PGC-1α mRNA和蛋白表达水平的比较
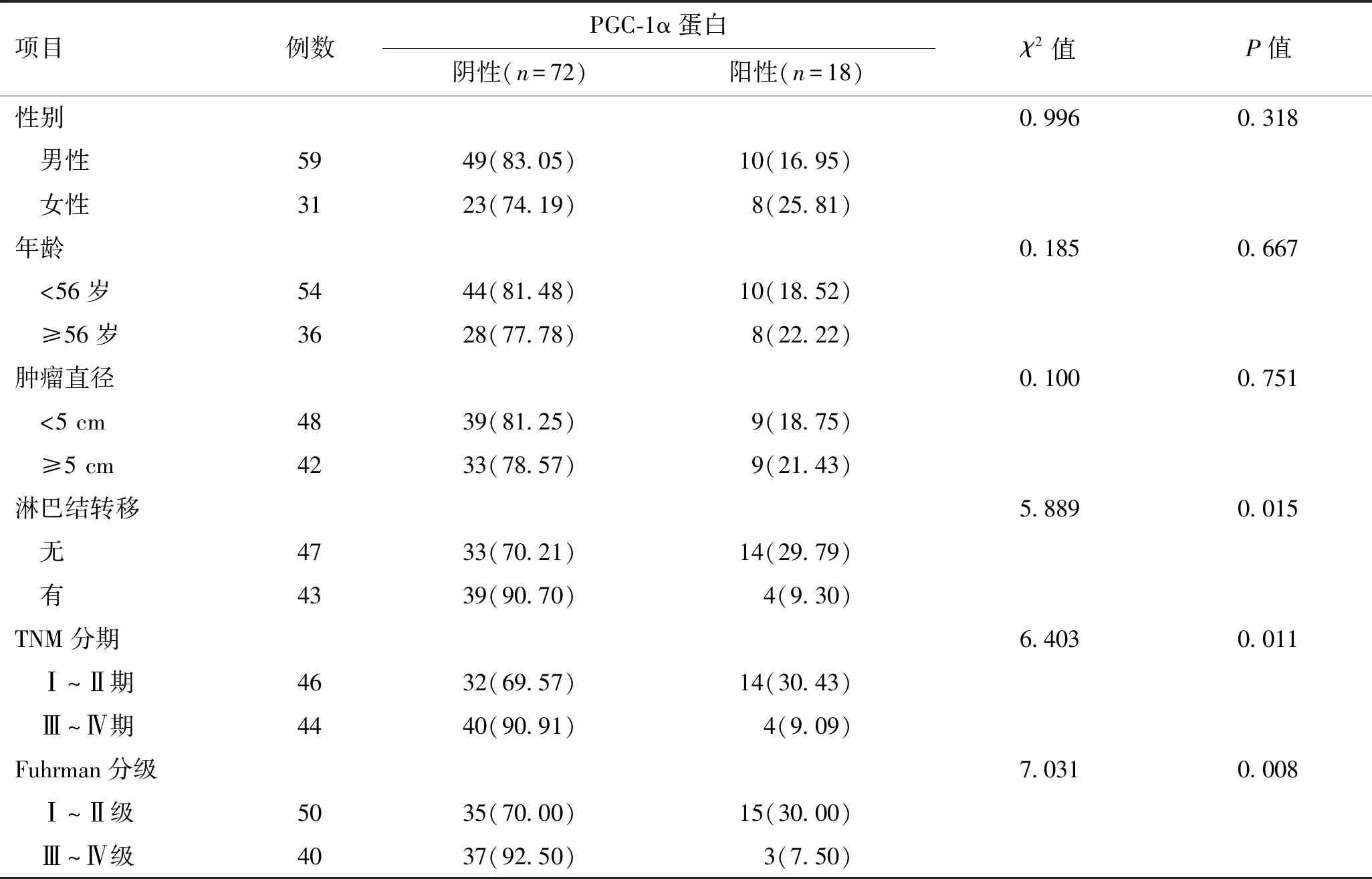
表3 肾透明细胞癌组织中PGC-1α蛋白表达与患者临床病理特征的关系 [例(%)]
2.3 肾透明细胞癌组织中PGC-1α蛋白表达与患者预后的关系90例肾透明细胞癌患者经过5年随访,无进展生存39例,总生存57例,死亡33例(因其他原因死亡4例,因肿瘤进展死亡29例);随访期间复发21例,转移26例,其中41例患者行术后辅助治疗(35例行靶向治疗),局部复发灶切除术12例。PGC-1α蛋白阴性患者5年无进展生存率为36.11%(26/72)低于PGC-1α蛋白阳性患者72.22%(13/18)(χ2=7.217,P=0.007,图2A);PGC-1α蛋白阴性患者5年总生存率为56.94%(41/72)低于PGC-1α蛋白阳性患者88.89%(16/18)(χ2=5.278,P=0.022,图2B)。
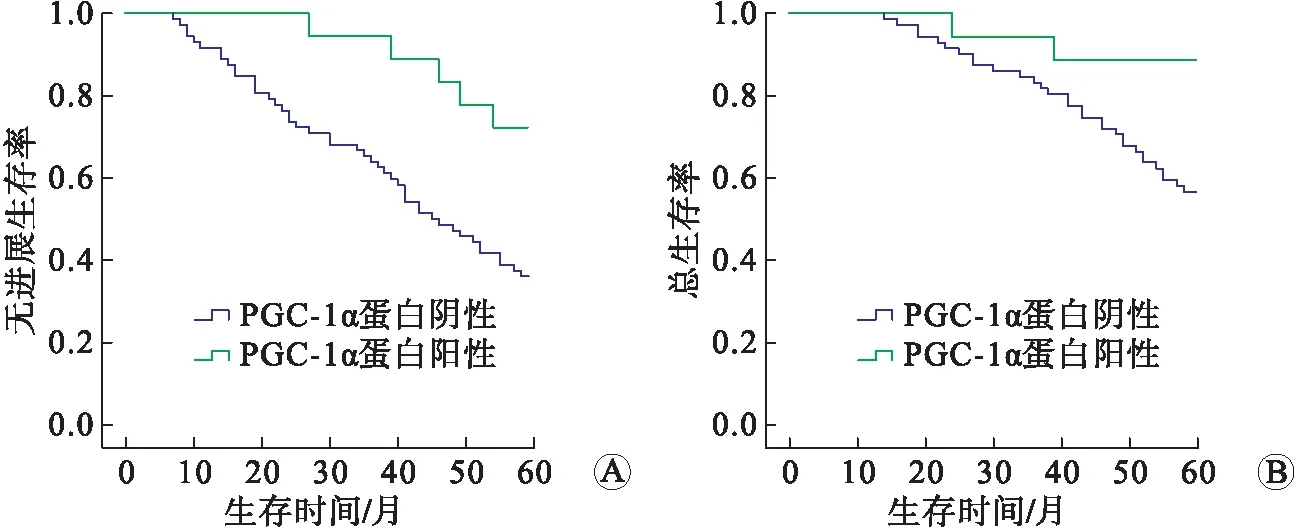
A:5年内无进展生存率;B:5年内总生存率。图2 肾透明细胞癌组织中PGC-1α蛋白表达与患者预后的关系
2.4 影响肾透明细胞癌患者预后的危险因素分析logistic单因素分析显示,淋巴结转移、TNM分期、Fuhrman分级、PGC-1α蛋白均是影响肾透明细胞癌患者预后不良的危险因素(P<0.05,表4);logistic多因素分析显示,TNM Ⅲ~Ⅳ期、Fuhrman Ⅲ~Ⅳ级、PGC-1α蛋白阴性是影响肾透明细胞癌患者预后不良的独立危险因素(P<0.05,表5)。
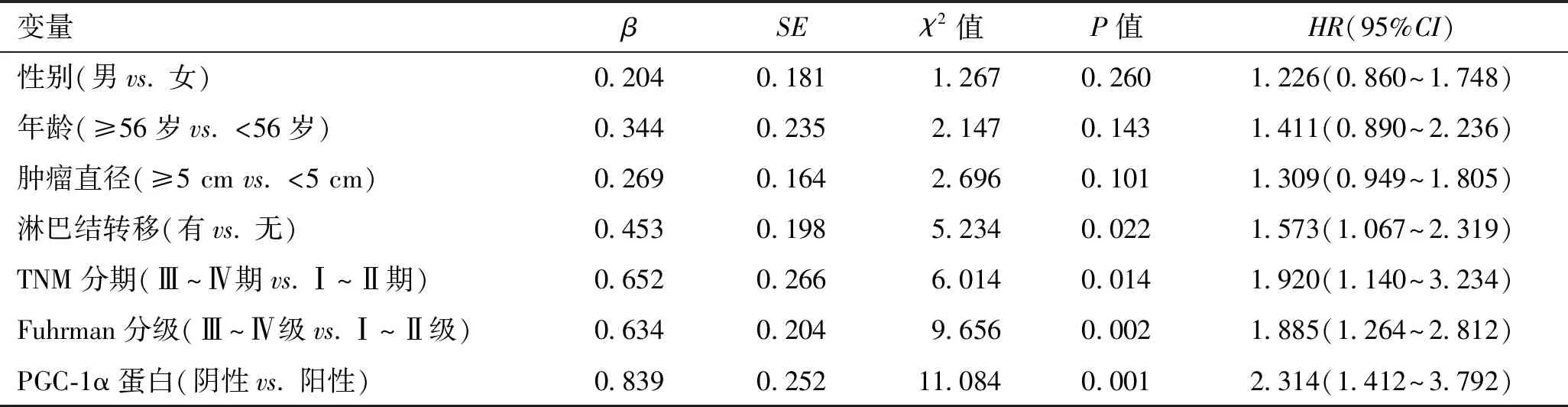
表4 影响肾透明细胞癌患者预后的单因素分析
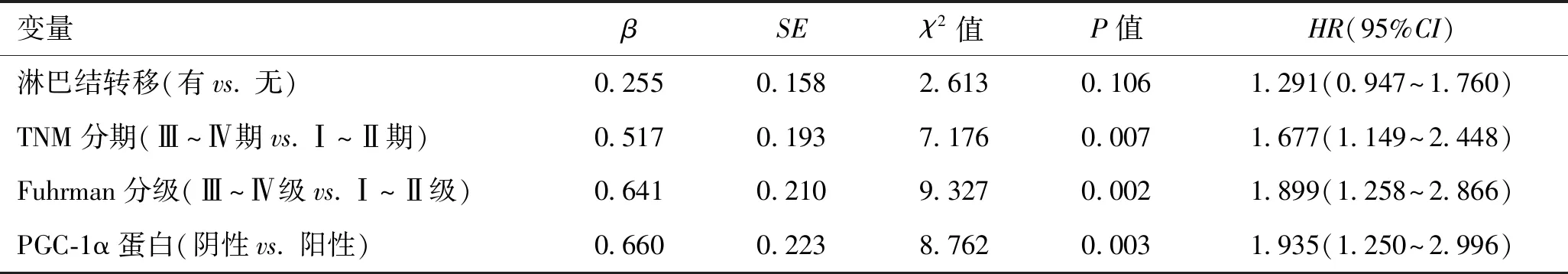
表5 影响肾透明细胞癌患者预后的多因素分析
3 讨 论
肾细胞癌约占原发肾肿瘤的85%,而肾透明细胞癌约占肾细胞癌的67.4%~83.2%,临床上症状少,发现时多为中晚期,其恶性程度较高,且转移早、预后较差,其发生、发展是一个涉及多过程、多基因、多原因累加的繁琐过程[8]。
PGC-1α是一种转录共激活因子,其充当转录调节因子,但没有DNA结合结构域;PGC-1α可与识别其靶基因中特定序列的各种转录因子和核受体结合,虽然其他转录共激活因子具有促进染色质重塑和基因转录的内在组蛋白乙酰转移酶活性,但缺乏酶活性;因此,PGC-1α通过充当其他具有组蛋白乙酰转移酶活性蛋白质的锚平台,并通过促进转录机制的组装以触发基因转录,从而发挥其对基因转录的调节功能[9-10]。PGC-1α主要存在于高能量需求且富含线粒体的组织中,如心脏、骨骼肌、褐色脂肪组织、脑、肝、肾等,其他组织则表达较少或几乎无表达[11-12]。在氧化代谢活跃的器官和组织中PGC-1α的表达量比较高,说明PGC-1α与机体的能量代谢有着密不可分的联系[13-14]。CHANG等[15]研究显示,PGC-1α在肝细胞癌中发挥抑癌基因的作用。YIN等[16]研究显示,PGC-1α在胰腺癌细胞中呈低表达,抑制PGC-1α水平可抑制胰腺癌细胞增殖,诱导其凋亡。本研究结果显示,肾透明细胞癌组织中PGC-1α mRNA表达水平和PGC-1α蛋白阳性表达率低于癌旁正常肾组织,与上述研究结果[15-16]相似,提示PGC-1α异常低表达可能与肾透明细胞癌的发病有关。进一步研究发现,PGC-1α蛋白表达与淋巴结转移、TNM分期、Fuhrman分级相关,表明PGC-1α可能影响肾透明细胞癌的发展。
PGC-1α是氧化代谢的主要调节剂,癌症治疗(如放射和化学疗法)已被证明会在肿瘤中诱导氧化应激,而氧自由基的产生可以通过涉及抗氧化酶的机制诱导细胞死亡或对治疗的抵抗,因此PGC-1α的调节可能会干扰对治疗的反应[17]。PAKU等[18]研究报道,sirtuins家族去乙酰化酶3可通过调控超氧化物歧化酶2和PGC-1α影响结直肠癌细胞的化疗耐药,是结直肠癌患者的独立预后因素。另有研究显示,结直肠癌组织中PGC-1α mRNA低表达,PGC-1α mRNA高表达患者具有更高的3年生存率[19]。本研究显示,PGC-1α蛋白阴性患者5年无进展生存率及总生存率均低于PGC-1α蛋白阳性患者,与王婷婷等[19]研究类似;同时研究发现,TNM Ⅲ~Ⅳ期、Fuhrman Ⅲ~Ⅳ级、PGC-1α蛋白阴性是影响肾透明细胞癌患者预后不良的独立危险因素,表明PGC-1α在肾透明细胞癌进程中发挥作用,可作为肾透明细胞癌患者预后不良的一个参考指标,临床在关注肾透明细胞癌TNM分期及Fuhrman分级的同时,还需关注PGC-1α异常表达对患者预后的影响。
综上所述,肾透明细胞癌组织中PGC-1α呈低表达,与肿瘤的淋巴结转移、TNM分期、Fuhrman分级以及患者预后密切相关。但本研究尚未深入探讨PGC-1α与肾透明细胞癌预后不良病理机制的关系,仍需进一步研究。