黄柄曲霉ASD 胞外酶活性及其性质
2022-12-27辉郑丽娇于舒怡刘丽关天舒李柏宏刘长远
王 辉郑丽娇于舒怡刘 丽关天舒李柏宏刘长远
(1.辽宁省农业科学院植物保护研究所,辽宁 沈阳 110161; 2.新民市农业农村局,辽宁 沈阳 110300)
疫病是辣椒设施生产的一种毁灭性土传病害,严重制约了我国辣椒可持续生产与发展。 随着种植面积的加大与复种指数的提高,辣椒疫病危害逐年加重[1]。 目前生产上该病的防治仍以化学药剂为主,但长期不合理使用增加了防治潜在风险[2,3],同时造成了果品与环境污染。 因此,生物防治作为绿色低风险方法成为其替代技术,备受关注。 已报道的用于辣椒疫病防治的拮抗菌主要为芽孢杆菌(Bacillusspp.)、 假单胞菌(Pseudomonasspp.)、木霉菌(Trichodermaspp.)和链霉菌(Streptomycesspp.)[4~9]。 越来越多的生防资源被发现的同时,其生防机理的研究也随之深入,如细菌多为诱导植物抗性与促生长作用,真菌多为重寄生、竞争与抗生作用,放线菌则多通过次生代谢产物抑制疫霉菌生长[10],这对辣椒疫病的生物防治起到了积极推动作用。 近年研究发现,曲霉属(Aspergillus)次生代谢产物中含有多种对致病疫霉具有抑制作用的物质[11,12],我国李淑彬等(2001)首先发现黄柄曲霉(Aspergillusflavoricum)可产生抗菌素179M 对疫霉菌多种病原真菌具有强烈抑制作用[13],叶旻硕等(2019)发现棘孢曲霉BAS1(Aspergillusaculeatus)可以提高移栽辣椒土壤芽孢杆菌数量、改变土壤的性状,并在28 d时防效显现[14];王光飞等(2019)研究发现曲霉属真菌AS1 与AS2(Aspergillus)可显著减少土壤中辣椒疫霉菌数量,其新鲜菌丝亦可协同生物质炭作用提高抑菌作用[15]。
黄柄曲霉(A. flavoricum)作为曲霉属真菌重要种类,其发酵液对多种动植物病原菌具有抑制或毒杀作用已经被证实[16~18]。 本研究对象黄柄曲霉ASD 来源于辽宁省辣椒连作土壤,其发酵液对辣椒疫霉病有高效、稳定防治效果已经被证实[19],在此基础上测定ASD 菌株胞外酶活性及其理化性质稳定性,以期为黄柄曲霉ASD 更广阔的应用奠定理论基础。
1 材料与方法
1. 1 供试菌株
黄柄曲霉 ASD (Aspergillusflavipes)与辣椒疫霉BZ (Phytophthora.capsici)均由本研究室分离、鉴定并保存。 BZ 菌株为辽宁省优势3 号生理小种、A1 交配型,致病力中等。
1. 2 培养基
PDA 培养基[20]:用于扩繁培养。
JBZ 菌丝的制取:将纯化的JBZ 菌株接种到PDA 培养液中25 ℃ 140 rpm 振荡培养 7 d,无菌水5 000 rpm 15 min 清洗3 次,无菌滤纸吸干水份,4 ℃保存备用。
诱导培养基:各成分质量百分比如下:0. 1%蛋白胨,0.2% KH2PO4,1.4% (NH4)2SO4,0.03%MgSO4·7H20,0.1% 微量元素(Fe2+、Zn2+、Mn2+、Cu2+),碳源分别采用质量百分比为5%、10%、15%的JBZ 菌丝。
1. 3 粗酶液的准备
ASD 孢子悬浮液以1%的接种量接入辣椒菌丝含量分别为5%、10%、15%诱导培养液中,震荡培养6d 后1. 5×104rpm 离心20min,去除JBZ 与ASD 菌丝及孢子,并用0. 22 μm 细菌过滤器除菌,即为待测粗酶液。 酶活性测定前进行稀释,使光吸收值在0.25 ~0.4 范围内。
1. 4 胞外酶活性的测定
纤维素酶活性、木聚糖酶活性与1,3 葡聚糖酶活性采用3,5-二硝基水杨酸法[21~23],蛋白酶活性采用福林试剂法[24]。
1. 5 稳定性测定
1. 5. 1 酸碱稳定性
将诱导后的培养液pH 调至2 ~11,按1 ∶10与冷却至40 ~50 ℃ PDA 培养基混匀制成平板。将JBZ 菌碟(d=7 mm)置于平板中央,25 ℃培养5 d 后,测量菌落直径。 设pH 7.0 为对照,按下式计算抑菌率,3 次重复。
1. 5. 2 溶解性
利用不同极性有机溶剂:石油醚、甲苯、乙醚、乙酸乙酯、乙醇10 ml 与等体积的粗酶液进行混合萃取,静置过夜后将上层有机相及下层水相按1 ∶10 与冷却至40 ~50 ℃ PDA 培养基混匀制成平板,25 ℃培养5 d 后,测量菌落直径。 按下式计算抑菌率,3 次重复。

1. 6 SD 毒性试验
将纯化的ASD 菌株接种到PDA 培养液中25 ℃ 140 rpm 振荡培养 7 d,8 层无菌纱布过滤后进行动物经皮经口6 项急性毒性试验,于沈阳化工研究院有限公司安全评价中心进行。
1. 7 数据统计与分析
利用Excel 2003 作图,并利用SPSS 22. 4 进行邓肯氏新复极差法(DMRT)进行0. 05 水平差异分析。
2 结果与分析
2. 1 ASD 菌株胞外酶活性
2. 1. 1 纤维素酶活性
胁迫后纤维素酶活性显著提高(F=0. 05),酶活性随着底物含量的增加而提高,底物含量为15%时酶活性最高。 3 个底物含量的酶活性随时间变化趋势一致:1 ~4 d 酶活性不断增加,第4 d时纤维素酶达到最高,分别为;42.84 U/ml、54.87 U/ml、82.32 U/ml,4 ~5 d 酶活性陡然下降,5 d 后酶活性下降缓慢(图1)。
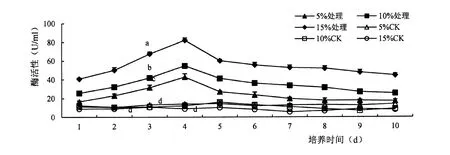
图1 纤维素酶活性变化Figure 1 Effect of ASD strain on CMC activity
2. 1. 2 木聚糖酶活性
胁迫后不同底物含量的木聚糖酶活性显著提高(F=0. 05),随着底物含量的增加木聚糖酶活性升高,在底物含量为15%时,酶活性最高。 其中;1 ~3 d 酶活性逐渐增加,第3 d 分别达到最高分别为64.88 U/ml、77.88 U/ml、83.47 U/ml,第3 d 后木聚糖酶活性开始下降,直至第10 d 酶活性最低(图2)。
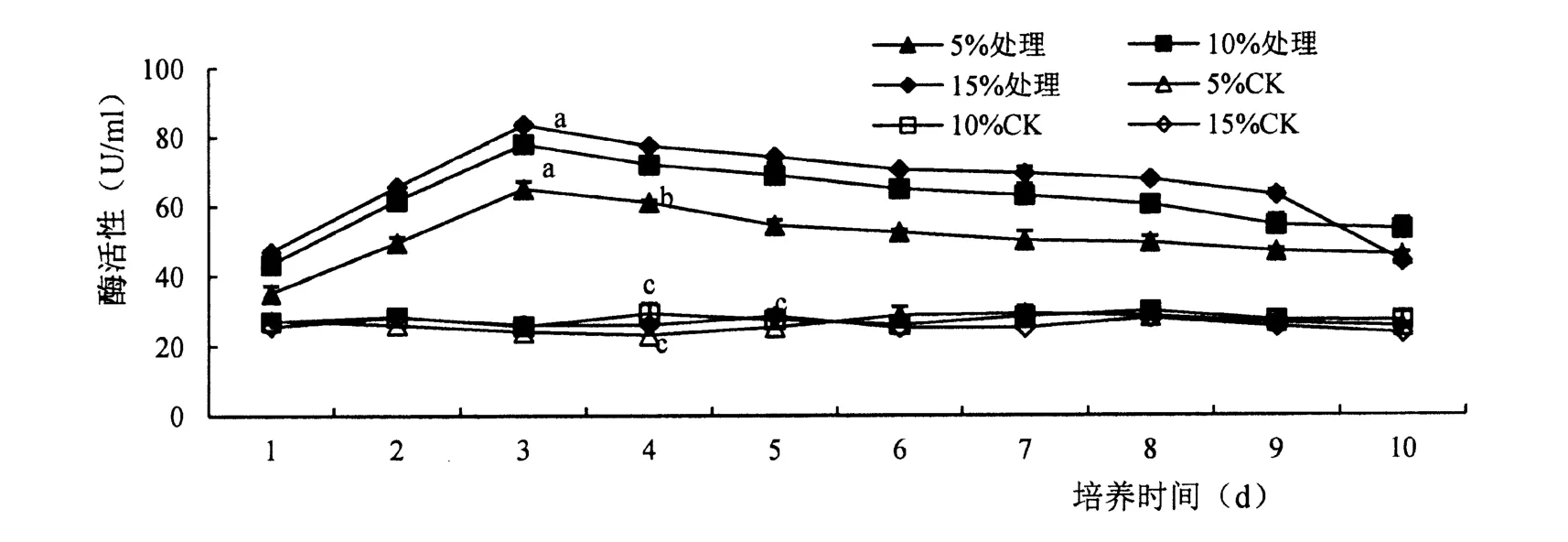
图2 木聚糖酶活性变化Figure 2 Effect of ASD strain on xylanase activity
2. 1. 3 蛋白酶活性
胁迫后ASD 粗酶液中的蛋白酶活性变化复杂,底物含量为5%时酶活性最高,其次为15%,含量为10%蛋白酶活性最低。 处理后酶活性只显著高于相同底物含量下的对照处理。 培养时间对ASD 发酵液中蛋白酶活性没有明显影响,抑菌率始终在10%~20%之间波动,说明ASD 的抑菌机理与蛋白酶活性关系不大(图3)。
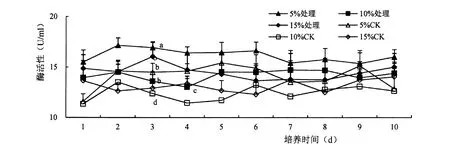
图3 蛋白酶活性变化Figure 3 Effect of ASD strain on proteinase activity
2. 1. 4 β-1,3 葡聚糖酶活性
胁迫前ASD 粗酶液中β-1,3 葡聚糖酶活性很低,诱导后β-1,3 葡聚糖酶活显著提高(F=0.05),且酶活性受底物含量与培养时间影响不大(图4)。
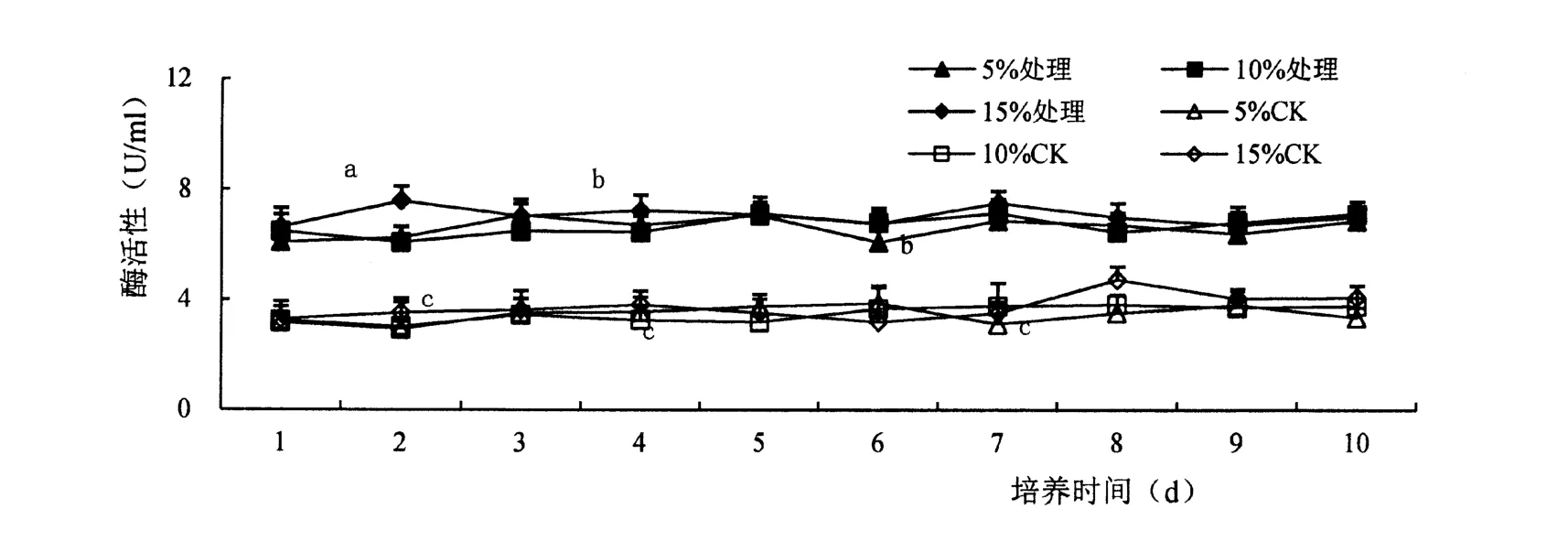
图4 β-1,3 葡聚糖酶活性变化Figure 4 Effect of ASD strain onβ-11,3-1Glucanase activity
2. 2 ASD 粗酶液理化性质
2. 2. 1 耐酸碱性
酸碱耐性结果表明(表1),在诱导培养6 h,pH 6 时抑菌率最高,可达77. 18%,其余依次为pH 7>pH 8>pH 5> pH 9>pH 4>pH 10,pH 10 抑菌率最低,为70.74%;诱导培养12 h 时,pH 6 时抑菌率最高,其余依次为pH 5 >pH 7>pH 4>pH 8>pH 9> pH 10;24 h 诱导后 pH 5 时抑菌率较高为72.42%,其次为pH 6>pH 4>pH 7> pH 8> pH 9>pH 10;48h 抑菌率依次为pH 6 >pH 7>pH 8>pH 9>pH 5> pH 4 > pH 10。 结合差异显著分析(F=0.05),ASD 粗酶液抑菌率在中性(pH 7)、微酸(pH 5 与pH 6)条件下较好。
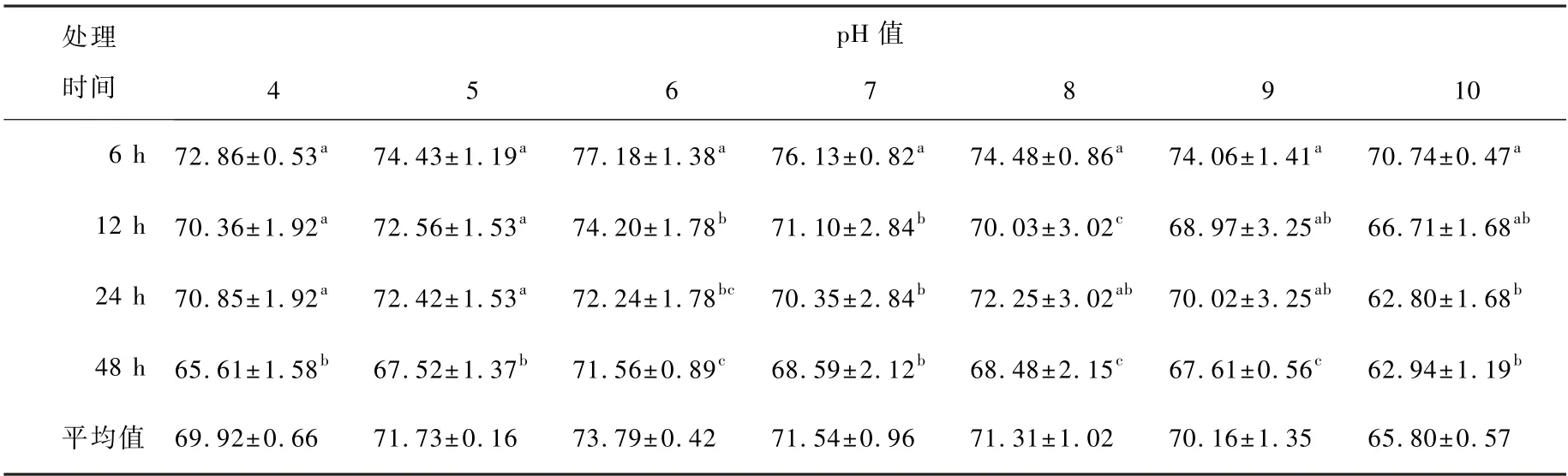
表1 酸碱性对ASD 粗酶液抑菌率的影响Table 1 Effect of acid and alkalinity on the bacteriostatic rate of crude enzyme solution of ASD
相同pH 条件下,不同时间点抑菌率比较可以看出,pH 5、pH 6、pH 7 在不同时间点抑菌率表现趋势一致:诱导培养6 h 抑菌率最高,其次为12 h>24 h>48 h;pH 4、pH 8、pH 9 条件下抑菌率表现趋势一致:6 h>24 h>12 h>48 h,而pH 10 时抑菌则为6 h>12 h>48 h>24 h。 总体可以看出,ASD 粗酶液抑菌率随酸碱处理时间延长而降低,酸碱性处理与处理时间对抑菌率有一定影响,处理持效时间为36 h。
2. 2. 2 溶解性
用5 种极性不同的有机溶剂对发酵液进行萃取,试验结果见表2,石油醚、甲苯、乙醚、乙酸乙酯均没有将抑菌物质萃取出,而水相中抑菌率55.55%~76.83%,说明抑菌物质为亲水性物质;但乙醇溶液萃取后无抑菌效果,可能是由于乙醇破坏了抑菌物质。
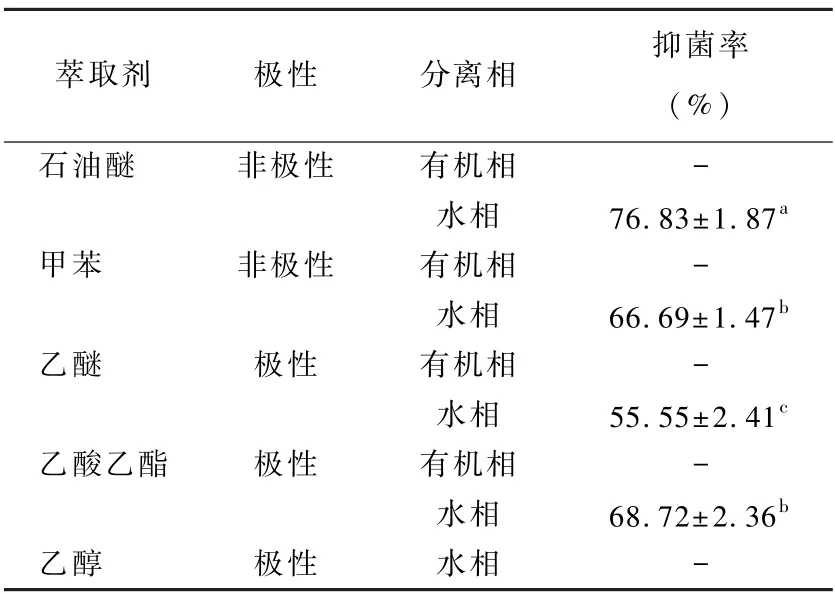
表2 ASD 粗酶液抑菌物质溶解性测定Table 2 Determination of solubility of antimicrobial substances in crude enzyme solution of ASD
2. 3 ASD 发酵液安全性评价
大鼠急性经口毒性检测、大鼠急性经皮毒性与豚鼠皮肤变态反应(致敏)试验与急性吸入毒性试验均未出现中毒症状及死亡;兔急性皮肤刺激性试验与兔急性眼刺激性试验均未见刺激症状,说明ASD 对动物安全。
3 结论与讨论
本研究以致病辣椒疫霉菌作为胁迫底物开展,黄柄曲霉ASD 菌株经底物胁迫后次生代谢产物中纤维素酶与木聚糖酶酶活性变化显著,且含量较高,而蛋白酶与β-1,3 葡聚糖酶活性变化则不显著。 分析认为,ASD 菌株分泌的纤维素酶与木聚糖酶酶,是防治辣椒疫霉菌的主要生防机制。许多研究表明,辣椒疫病生防菌可以通过竞争、拮抗、重寄生、促生抗病与诱导抗性等机理达到控制病害的目的[25,26]。 因此,辣椒疫病的生防机理往往不是单一的,而是多种机理并存的,孙敬祖等发现舒展曲霉F1(AspergilluseffusesTiraboschi)既可以分泌抑菌物质抑制辣椒疫霉菌菌丝生长及游动孢子的萌发,又提高辣椒植株体内苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)活力,同时F1 较强的根部定殖能力又与疫霉菌产生空间竞争,从而达到对辣椒疫病较高的防治作用[14]。 谢梓语等(2018)研究发现枯草芽孢杆菌B1409(Bacillus subtilis)可导致辣椒疫霉菌菌丝发生畸变,从而抑制辣椒疫霉菌菌丝的生长,同时可以提高辣椒植株体内3 种防御酶活性[27]。 本研究对象黄柄曲霉ASD 已经被证实可以改变辣椒罹病土壤微生物区系结构,并提高土壤脲酶、酸性磷酸酶、蔗糖酶及脱氢酶活性[28],为开发ASD 菌株更多潜在的生防机制。 Pang ZL 等(2020) 与李腾蛟等(2019)研究表明,纤维素在疫霉菌生长发育和致病过程中起关键作用,是其难以防治的屏障,与本研究结果相符合[29,30]。
目前有许多研究表明,生防菌可以在有底物胁迫情况下,特别是致病菌胁迫下可产生或提高胞外酶活性,张红霞研究发现枯草芽孢杆菌HT-6(Bacillussubtilis)在与致病疫霉菌(Phytophthorainfestans)共培养后可诱导师HT-6 产生纤维素酶,在对峙培养中HT-6 产生的抑菌物质可导致疫霉菌菌丝畸形,从而抑制生长[31]。 此外,许多学者利用真菌细胞壁的主要成分纤维素、几丁质、壳聚糖与葡聚糖等做为底物对生防真菌、细菌与放线菌的次生代谢产物进行胁迫,均获得较高的抑菌活性酶[32~35]。 本研究结果表明,ASD 菌株在致病疫霉菌为底物的条件协迫下可以获得较高活性的细胞壁降解酶:纤维素酶与木聚糖酶,这与前人研究结果一致,是ASD 主要的生防抑菌机制。而在未发病及健康土壤中ASD 菌株是不会分泌过多的胞外酶破坏或改变原有的土壤环境,这是化学农药所不具备的生物自动调节功能。 此外,ASD 粗酶液在中性与微酸环境中仍能保持较高的抑菌活性。 综上,黄柄曲霉ASD 具有广阔的应用前景。
