超高压辅助超声波法提取紫玉米籽粒花色苷的工艺研究
2022-12-21邓微,冯颖
邓 微,冯 颖
(沈阳农业大学食品学院,沈阳 110161)
花色苷是一种水溶性的具有强抗氧化活性的黄酮类植物色素,能够抗癌抗肿瘤、控制血糖[1],强化人体免疫系统及抗炎的作用[2-3]。紫玉米(Zea maysL.)是一种原产于秘鲁的作物,在世界上一些国家也广泛种植[4]。紫玉米对生长条件要求不苛刻,不仅产量高,而且耐贮存[5],是一种便宜且富含高质量高含量花色苷的原材料。紫玉米中的花色苷含量非常高且花色苷单体种类也丰富,中国的紫玉米籽粒中,花色苷总量为42~354mg·100g-1[6]。
超声波提取法是目前比较常用的花色苷提取方法[7],提取效率高,时间短,对有效成分的结构破坏小[8]。张钟等[9]用超声辅助法提取黑糯玉米穗轴的色素,不仅很大程度地缩短了提取时间,而且提取率高达18.66%。刘长龙[10]采用超声法提取黑玉米花色苷得到提取率为2.93mg·g-1。孙梦洋等[11]在单因素实验的基础上采用响应面分析法得到黑糯玉米芯中花色苷含量为57.29mg·g-1。
超高压是指压力在100~1000MPa的液体静压力,超高压辅助提取技术是利用水或其他流体为媒介。在超高压的作用下,富含活性物质的植物原料发生结构变化,其细胞壁被破坏,从而原料内的活性物质能够释放,并且与提取溶剂充分接触反应,提取率得到明显的提升[12]。目前,已有应用于多酚[13]、多糖[14]等物质提取的研究报道。李鹏等[15]应用超高压提取桑葚花色苷得到含量为(1.97±0.02)mg·g-1。许志新[16]应用超高压提取紫玉米穗轴花色苷,得到含量为(743.158±11.304)mg·100g-1。目前,将超高压与超声波两种提取技术相结合用于提取的工艺鲜有报道,本研究将二者联合来对紫玉米籽粒花色苷进行提取,旨在进一步提高花色苷提取率,节约提取时间,以期为紫玉米花色苷产业化开发提供参考。
1 材料与方法
1.1 材料与试剂
紫玉米籽粒(烘干后磨成粉过60目筛备用)、无水乙醇、柠檬酸、(AR,上海国药集团化学试剂有限公司)、DPPH、ABTS试剂盒(上海源叶生物技术有限公司)、透明光面真空袋(福创辰品牌食品级全新PET+PE复合材质)。
1.2 主要仪器与设备
JGY-2500B打粉机(广州大祥电子机械设备有限公司)、KQ5200B超声波清洗机(昆山市超声仪器有限公司)、全自动超高压杀菌机(德阳四创科技有限公司)、TU-1810紫外-可见分光光度计(北京普析通用仪器有限公司)、ELX-800酶标仪(美国BIOTEK公司)。
1.3 试验方法
1.3.1 紫玉米花色苷提取步骤称取研磨过筛的紫玉米籽粒粉2.0g于真空袋中,按照1:16的料液比向其加入乙醇和柠檬酸提取溶剂,使料液充分混合均匀后封口,进行超高压预提取。
预处理结束后,将样品置于超声波中超声提取,超声功率为200W,超声结束后离心收集上清液,即为花色苷提取液。
1.3.2 提取紫玉米籽粒花色苷单因素试验(1)超高压压力。选取超高压力为50,150,250,350,450MPa,保压时间为2min,超声波处理时间为5min,以总花色苷含量为评价指标。(2)超高压时间。选取超高压时间为1,2,3,4,5min,超高压力为250MPa,超声波处理时间为5min,以总花色苷含量为评价指标。(3)超声时间。选取超高压时间为2min,超高压压力为250MPa,超声时间为4,6,8,10,12,14,16min,以总花色苷含量为评价指标。
1.3.3 紫玉米籽粒花色苷的含量测定采用pH示差法[17-18]测定花色苷含量:提取完成后无损转移到离心管,离心条件为4℃、8000r·min-1离心20min,离心结束后将收集好的上清液加入提取溶剂定容至50mL,再吸取定容后的样液0.5mL和盐酸-氯化钾缓冲液(pH=1)与盐酸-乙酸钠缓冲液(pH=4.5)4.5mL分别于试管内,每组3个平行,在40℃的水浴锅中反应0.5h,接着将其无损转移进行二次离心,条件为4℃、8000r·min-1离心10min,收取上清液分别测定吸光度OD520、OD700,计算花色苷收率,具体公式为[19]:

式中:A=(A510-A700)pH1.0-(A510-A700)pH4.5;M为矢车菊-3-葡萄糖苷的摩尔质量(449.2g·mol-1);DF为稀释倍数;V为提取液总体积(mL);ε为矢车菊-3-葡萄糖苷的摩尔消光系数(26900L·mol·cm-1);m为称取的紫玉米籽粒粉质量(g);L为比色皿的光距长度(1cm)。
1.4 响应面优化超高压辅助超声提取花色苷
通过单因素试验确定对超声波提取紫玉米籽粒花色苷影响最大的3个因素为超高压压力、超高压时间和超声时间。每个因素设3个水平,以花色苷含量为响应值,值越大,提取效果越好,通过响应面优化设计分析,确定各因素配比。试验因素与水平设计见表1[20-21]。

表1 响应面设计因素与水平Table 1 Factors and levels of response surface experiment
1.5 生物活性测定
1.5.1 DPPH自由基清除活性测定根据CHEN等[22]的方法稍加改动。取0.2mL经过稀释处理过的样品溶液于96孔板中,再向其加入0.2mL DPPH-乙醇工作液(乙醇配制),使其振荡混匀,室温避光反应30min后,测定其在波长为517nm处吸光度值记A1,取0.2mL同等条件稀释的样液与0.2mL无水乙醇混合均匀于96孔板中,相同波长测吸光度值记A2,平行测定3次取平均值,结果以DPPH自由基清除率来表示。

式中:A0为以蒸馏水替代样品的吸光值;A1为样品吸光值;A2为以乙醇替代工作液的吸光值。
1.5.2 ABTS自由基清除能力测定根据黄彪等[23]方法稍作修改。制备的ABTS工作液用80%无水乙醇稀释,调节其吸光值在734nm波长下为0.7±0.05,同时在405nm波长下为1.4。取10μL紫玉米花色苷样液与200μL ABTS工作液共同加入到96孔板中,避光孵育6min,在734nm下测定吸光值,记为A1。再取10μL紫玉米花色苷样液提取液与200μL ABTS工作液共同加入到96孔板中,反应条件相同测定吸光值,记为A0。再以等体积80%无水乙醇代替ABTS工作液,其他反应条件不改变测吸光值,记为A2。重复3次平行试验取平均值。

式中:A0为以紫玉米花色苷提取液替代样品的吸光值;A1为样品吸光值;A2为以80%乙醇替代工作液的吸光值。
1.6 超声波提取和结合提取紫玉米籽粒花色苷组成分析
使用HPLC-MS法鉴定和测定紫玉米籽粒花色苷组成。采集软件:Agilent MassHunter Workstation Data Acquisition(versions B.06.00)。处理软件:Agilent MassHunter Qualitative Analysis(versions B.06.00)。
1.6.1 液相条件色谱柱:Agilent ZORBAX SB-C18 column(4.6×100mm,1.8μm);进样量:5uL;柱温:30℃;流速:0.5mL·min-1;流动相:A:0.1%甲酸水,B:乙腈;梯度洗脱A:95%~0%(0~35min),A:0%(35~40min)。
1.6.2 质谱条件采用正离子扫描模式,用于鉴定的MS参数如下:雾化气温度:360℃;雾化气气流:7L·min-1;鞘气温度:400℃;鞘气气流:11L·min-1;扫描范围为100~950Da;碎裂电压:150V;碰撞能量:20/30/40V。定量的MS参数如下:雾化气温度:350℃;雾化气气流:8L·min-1;鞘气温度:380℃;鞘气气流:11L·min-1;扫描范围为100~1000Da。用矢车菊素-3-O-葡萄糖苷等绘制标准曲线,并用其当量表示其葡萄糖苷衍生物的含量。
1.7 数据统计分析方法
所有试验步骤都重复3次取平均值±标准差(X±SD),单因素试验的每个因素的显著性分析用SPSS 22.0来计算,然后用Design-Expert 8.0.6软件进行响应面设计。
2 结果与分析
2.1 超高压辅助超声波提取花色苷的单因素试验结果
2.1.1 超高压压力对花色苷提取量的影响由图1可知,经超声波与超高压结合处理的紫玉米籽粒花色苷提取量高于超高压单独处理,且压力在50~250MPa范围内,超高压压力在不断增大的同时,紫玉米籽粒花色苷提取率在逐渐升高。这是因为压力的增大会对紫玉米表面直接产生影响,其细胞膜的结构会发生变化,使其细胞膜表面的膜孔发生改变,通透性变强,细胞内的活性物质传输能力增大[15];压力的不断增加,会使紫玉米原料更多的细胞膜发生破坏,这样原料内的花色苷释放的更多,整个体系也会达到最佳状态[24],从而达到了花色苷提取的最佳提取条件。当压力达到250MPa时,紫玉米籽粒花色苷的提取量最大为54.01mg·100g-1。但是随着压力继续增加时,提取量开始下降,可能是因为花色苷的结构被破坏,从而影响了花色苷的提取。张唯等[25]在用超高压提取玫瑰花色苷时也得到了相同的结论。所以,选取150~350MPa进行响应面优化试验。

图1 超高压压力对花色苷提取量的影响Figure 1 Effect of ultra-high pressure on anthocyanin extraction
2.1.2 超高压时间对花色苷提取量的影响由图2可知,经超声波与超高压结合处理的紫玉米籽粒花色苷提取量高于超高压单独处理,在增加超高压提取时间的情况下,花色苷的提取量呈现先上升后下降的趋势,可能是因为超高压提取起初紫玉米原料细胞内花色苷含量高,而原料细胞外部也就是整个提取体系的花色苷含量较低,从而以原料细胞为界限形成了较大的浓度差,也就是浓度梯度,有利于花色苷向外释放,使得花色苷含量增加[24]。当超高压提取时间为2min时,此时花色苷提取量最大为48.03mg·100g-1。时间超过2min后,花色苷提取量开始下降,原因可能是过长的时间会造成已经从细胞内释放的花色苷在外界条件作用下产生降解而变少,而且超高压时间过长也会造成资源浪费[26]。陈亚利等[27]在超高压提取紫薯花色苷时得到了相同的结论。所以,选取1~3min进行响应面优化试验。
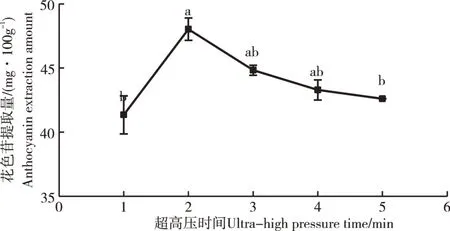
图2 超高压时间对花色苷提取量的影响Figure 2 Effect of ultra-high pressure time on anthocyanin extraction
2.1.3 超声时间对花色苷提取量的影响由图3可知,超声时间在4~8min时,花色苷提取量不断增加,超声8min后,花色苷提取量显著下降,可能是由于在超声处理过程中,整个提取体系的温度在不断上升,便会对花色苷的结构、活性造成破坏,因为花色苷不耐热,一旦温度超过花色苷的耐受范围,就会发生降解,从而使花色苷的提取量降低[28],当超声时间达到8min时,花色苷提取量最大为50.81mg·100g-1。所以,选取超声温度为6~10min进行响应面优化试验。
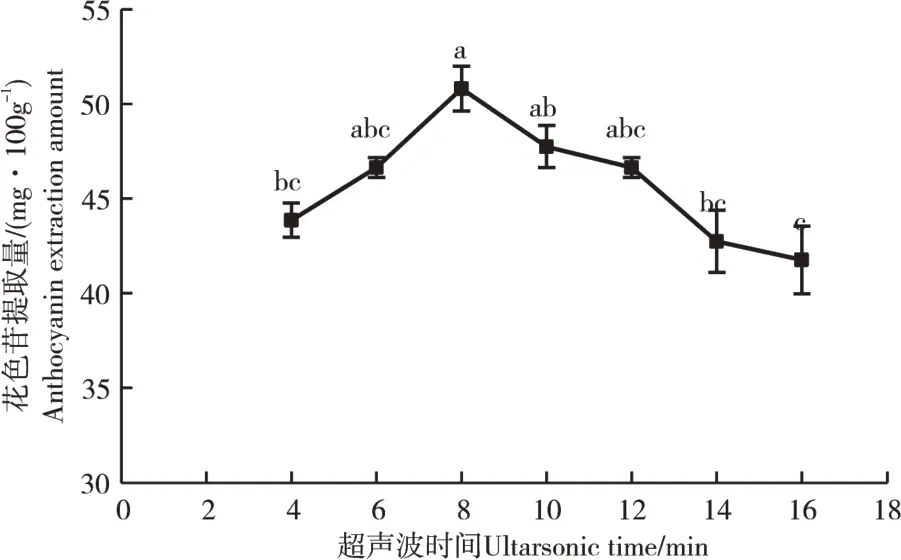
图3 超声时间对花色苷提取量的影响Figure 3 Effect of ultrasonic time on anthocyanin extraction
2.2 响应面优化紫玉米籽粒花色苷提取量结果
2.2.1 响应面优化试验设计及结果在单因素试验的基础上,以超高压压力(A)、超高压时间(B)、和超声时间(C)为自变量,以花色苷含量为响应值,通过响应面优化法进行结果分析。试验设计及结果见表2。
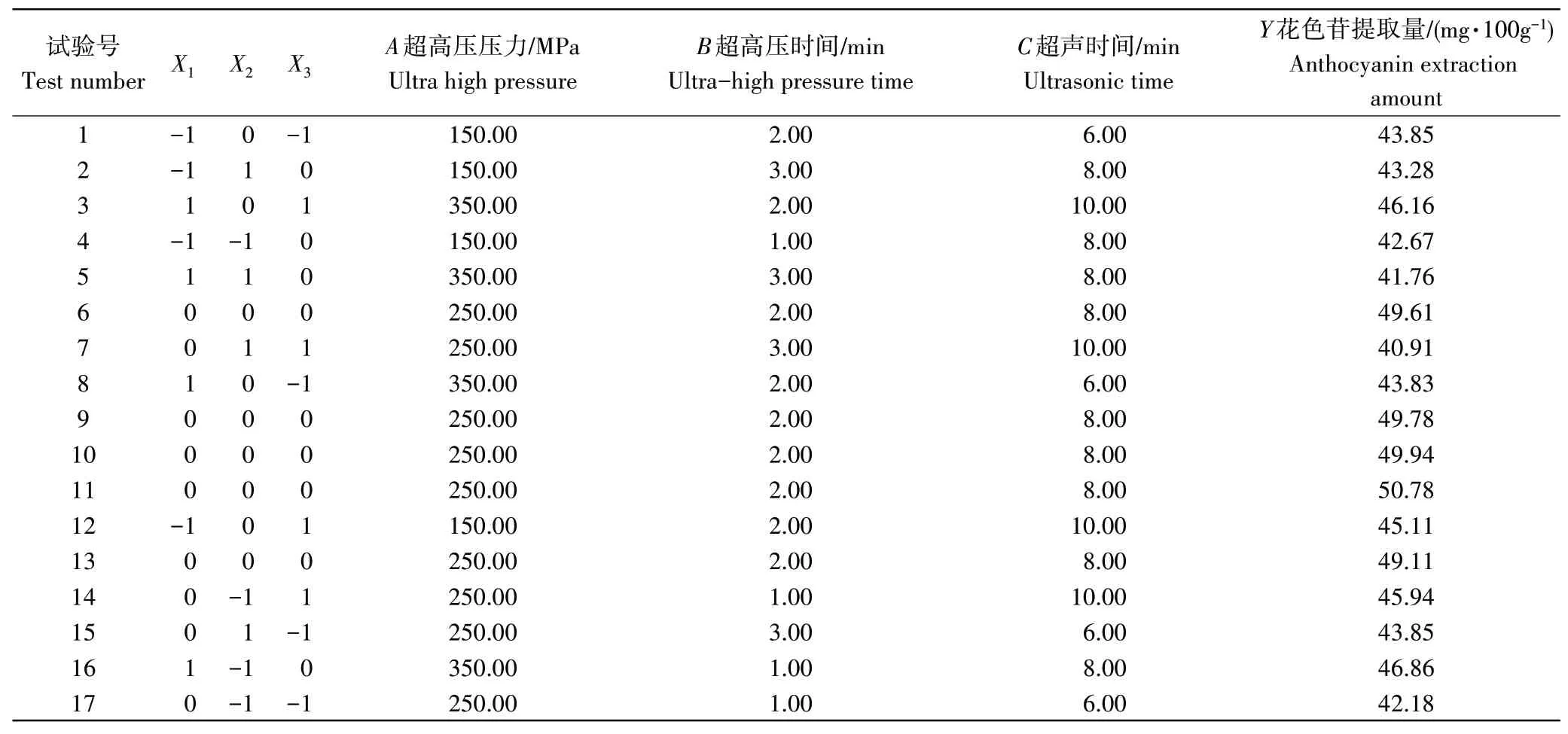
表2 响应面优化试验设计及结果Table 2 Experimental design and results for response surface analysis
2.2.2 回归模型的建立及方差分析运用Design-Expert 8.0.6软件分析实验结果得到的回归方程如下:
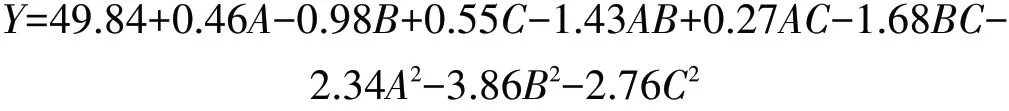
为了检验方程的有效性,对结果进行分析。由表3可知,对于响应值花色苷含量,模型p<0.05,说明显著;模型失拟项p>0.05,说明不显著。由表4可知,该响应值的模型相关系数R2为0.98,校正后R2为0.96,表示模型相关度良好;模型的变异系数小于10%,说明该模型可以较好地反应试验的真实性。综上,此回归模型及方差分析合理的呈现响应值与每个自变量之间的作用关系,拟合程度较好。

表3 回归方程方差分析Table 3 Analysis of variance of regression equations

表4 模型可信度分析Table 4 Reliability analysis of models
2.2.3 响应面分析及优化根据Design-Expert8.0软件绘制的三维曲面图以及等高线图,可以清楚地看出每个因素与响应值之间的关系。图4和图5中,花色苷含量随着超高压压力的增加先升高后降低。图5和图6中,花色苷含量随着超高压时间的增加先升高后降低。图4和图6中,花色苷含量随着超声时间的增加先升高后降低。3个提取因素对花色苷提取量的影响可以比较直观地从响应面分析图和等高线分布图得出,若交互作用显著等高线则会呈现椭圆形,越接近圆形越不显著;3D曲面的陡峭则可以得出每个因素对花色苷提取量的影响大小,交互作用是否明显[28]。因此得出超高压时间(B)>超高压压力(A)>超声时间(C)。超高压压力和超高压时间、超高压时间和超声波时间交互作用显著,超高压压力和超声波时间交互作用不显著。
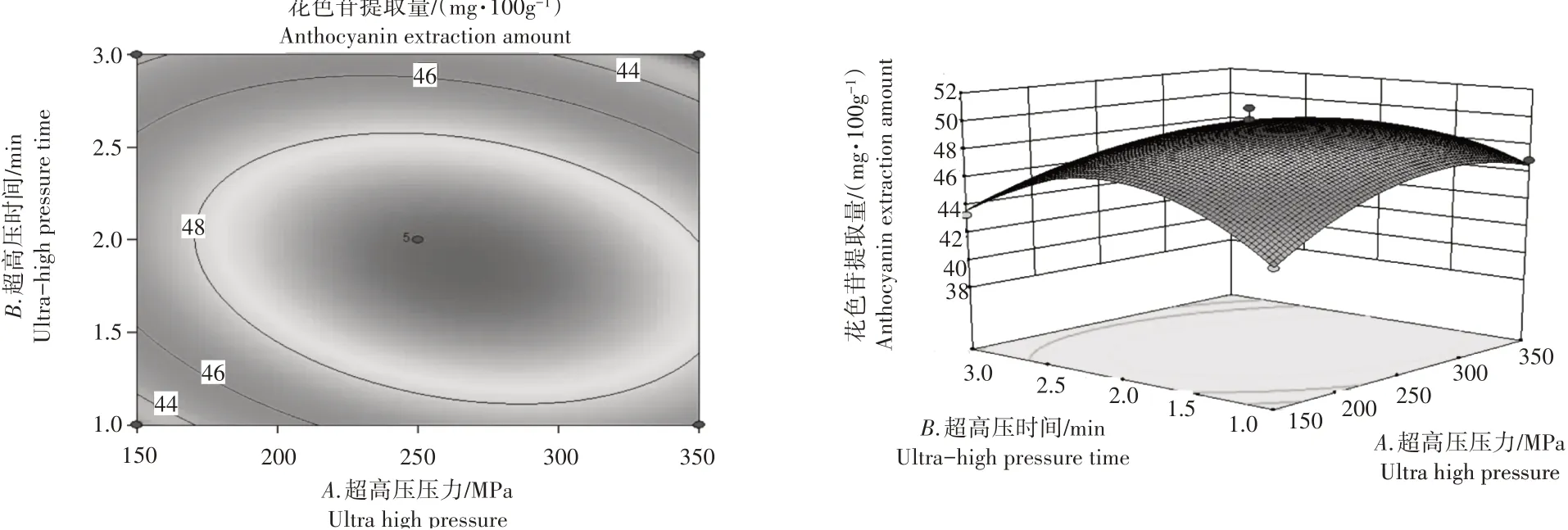
图4 因素A、因素B响应面分析图及等高线分布图Figure 4 Response surface analysis and contour distribution of factors A and B
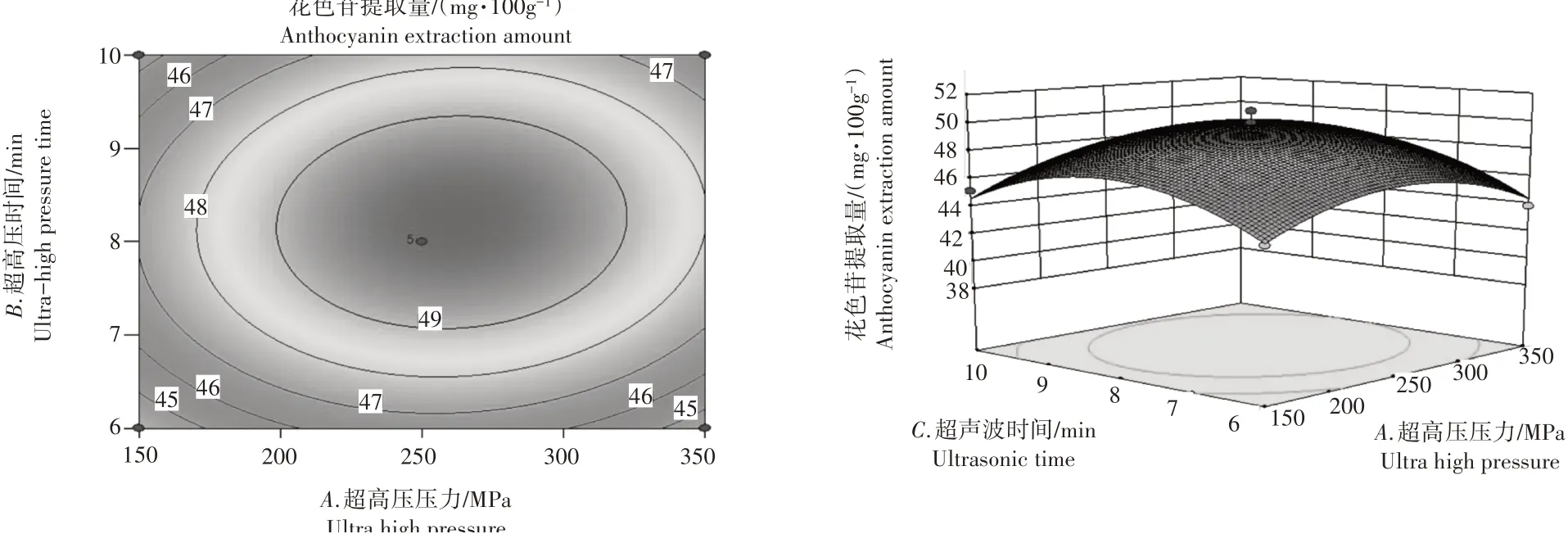
图5 因素A、因素C响应面分析图及等高线分布图Figure 5 Response surface analysis and contour distribution of factors A and C

图6 因素B、因素C响应面分析图及等高线分布图Figure 6 Response surface analysis and contour distribution of factors B and C
2.2.4 响应面优化结果回归模型预测的紫玉米籽粒花色苷的提取最佳工艺为超高压压力为266.75MPa、超高压时间为1.81min、超声时间为8.33min,花色苷提取的理论值达到50.02mg·100g-1。根据实际情况进行调整,超高压压力为270MPa、超高压时间为1.9min、超声时间为8.5min,此条件下进行3次试验得到花色苷提取量最大为49.68mg·100g-1,与模型预测值吻为合度达到99.31%,说明此条件为回归模型拟合出紫玉米籽粒提取花色苷的最佳条件,这样也证明了响应面法对紫玉米籽粒花色苷提取条件参数优化具有可行性。
2.3 超高压辅助超声波提取方式与单一提取方式的比较
由表5可得出,单一超声波提取,随超声时间延长,先增加后下降,其中以超声12.5min时提取率最高,为(42.18±0.27)mg·100g-1。超高压辅助超声波提取较单一超声波提取方式相比,花色苷提取率显著提升,提取时间也大大缩短。辅助提取方式比单一超声波提取方式花色苷提取率增幅为17.80%。辅助提取方式在提高花色苷提取率的同时缩短了提取时间,有效提高了提取效率。

表5 超高压辅助超声波提取方式与单一提取方式的比较Table 5 Comparison between compound and single extraction
2.4 紫玉米花色苷提取液活性的测定结果
紫玉米籽粒花色苷提取液活性结果如图7。DPPH溶液由于形成自由基呈深紫色,ABTS溶液可被强氧化剂氧化呈现绿色,加入花色苷提取液后发生反应使DPPH自由基浓度下降,所呈现出的颜色相应变浅[29-30]。单一超声提取所得紫玉米籽粒花色苷提取液的DPPH自由基和ABTS+自由基清除率分别为54.74%和42.48%,超高压辅助超声波提取所得提取液DPPH自由基和ABTS自由基清除率分别为57.62%和44.83%。
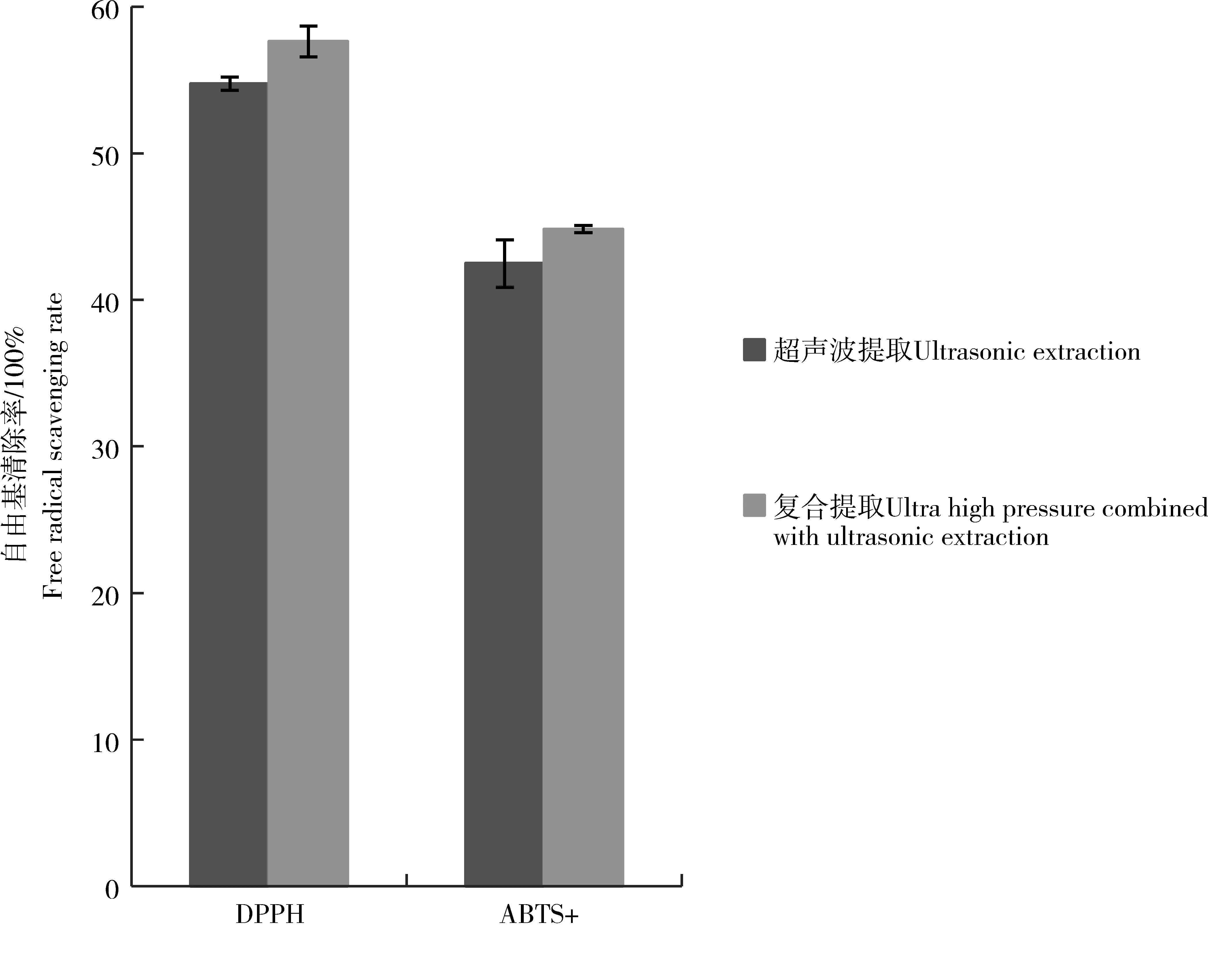
图7 紫玉米花色苷籽粒提取液活性结果Figure 7 Activity of purple corn anthocyanin seed extract
2.5 单一超声波提取和超高压辅助超声波提取紫玉米籽粒花色苷组成分析结果
由表6可知,在超声提取紫玉米籽粒花色苷提取液中鉴定出11种花色苷,结合提取花色苷提取液中也鉴定出11种花色苷,两种提取方式鉴定出的花色苷中有10种是相同的。其中矢车菊-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷、天竺葵素-3-O-葡萄糖苷等7种花色苷在紫玉米中广泛存在,而其他花色苷未见报道[31-34]。从含量测定结果来看,矢车菊-3-O-丙二酰基葡萄糖苷、矢车菊-3-O-葡萄糖苷等5种花色苷为主要花色苷。其中,以天竺葵素-3-O-丙二酰基葡萄糖苷含量最高,单一超声提取和辅助提取的提取含量分别达到(1254.37±85.45)μg·g-1和(12477.06±77.18)μg·g-1,而芍药素-3-O-葡萄糖苷在12种花色苷中含量最低,两种提取方式所得提取含量分别为(0.10±0.01)μg·g-1和(0.07±0.01)μg·g-1。SURIANO等[34]检测的紫玉米中矢车菊-3-O-丙二酰基葡萄糖含量最高,这可能与品种和生长条件有关[35]。

表6 超声波提取和结合提取紫玉米籽粒花色苷的组分鉴定及含量测定结果Table 6 Identification and determination results of anthocyaninfrom purple corn seeds by ultrasonic extraction and compound extraction
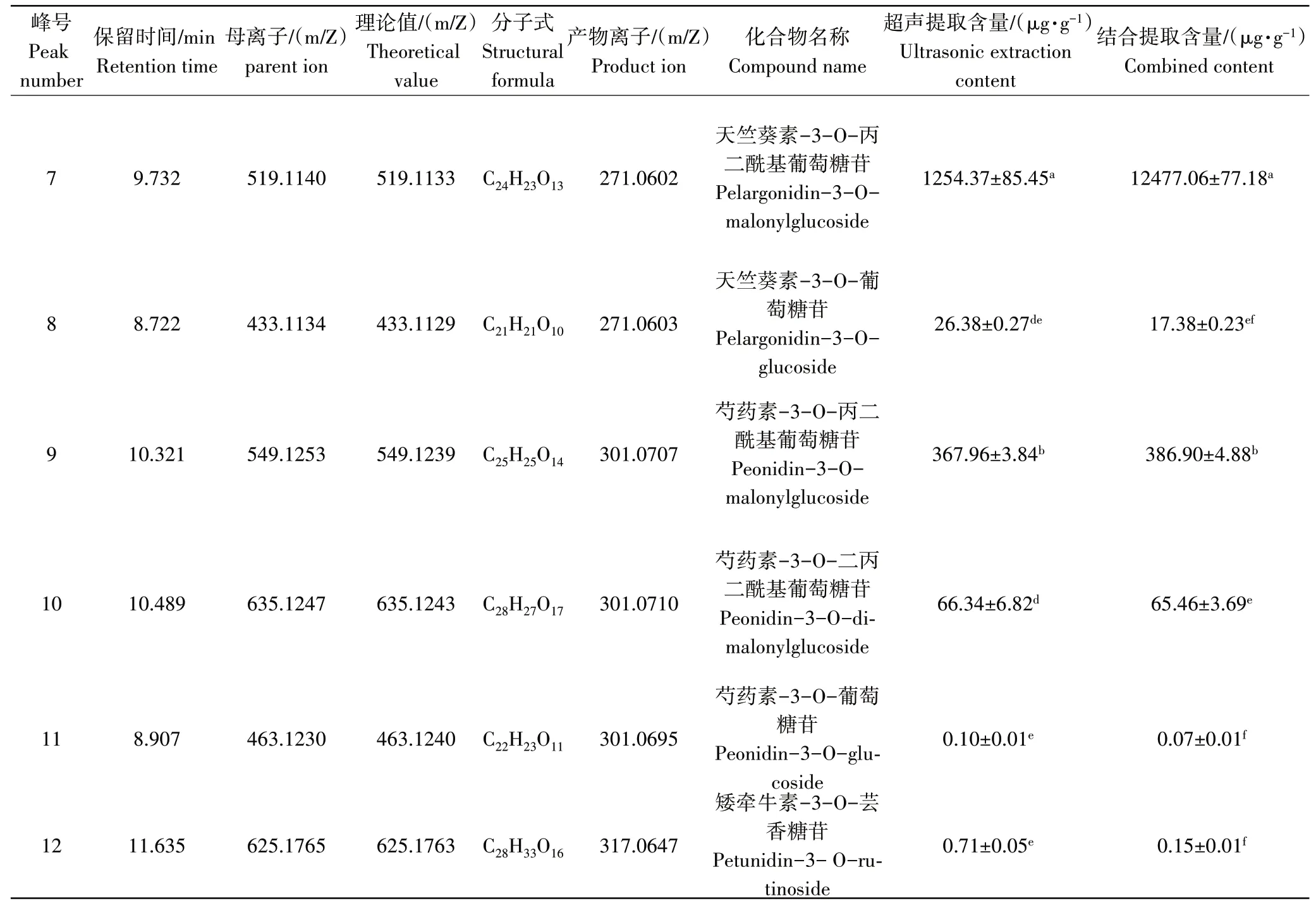
续表
3 讨论与结论
超声提取时间过长会导致提取体系温度的升高,从而造成热敏性物质的损失[22]。将超高压辅助超声波对原料中花色苷进行提取,原料首先进行超高压辅助处理,可破坏原料细胞膜的通透性,促进花色苷的充分释放及其与提取剂的充分接触,从而有效减少超声波提取的时间,这样会避免热敏性物质因热度过高而导致降解及生物活性降低。本研究以紫玉米籽粒为原料,采用超高压辅助超声波提取紫玉米籽粒中的花色苷,以响应面法优化确定了最佳提取工艺为:超高压压力为270MPa、超高压时间为1.9min、超声时间为8.5min,在此条件下,花色苷提取的理论值达到49.68mg·100g-1。与单一超声波法提取紫玉米籽粒花色苷相比较,花色苷提取率增幅达到17.80%,提取时间较单一超声波提取相比缩短了30.58%。超声波单一提取紫玉米籽粒花色苷提取液DPPH自由基清除率为54.74%,超高压辅助超声波提取花色苷提取液DPPH自由基清除率为57.62%;超声波单一提取紫玉米籽粒花色苷提取液ABTS自由基清除率为42.48%,超高压辅助超声波提取花色苷提取液ABTS自由基清除率为44.83%。由此可见,辅助提取相较于单一超声提取,不仅提高花色苷提取率、缩短了提取时间,而且其提取液对自由基清除能力并没有被破坏,甚至同单一超声提取相比有所增强。说明相较于单一超声提取,采用超高压辅助超声波法可以在更短时间内得到产量更高、活性相当甚至更强的紫玉米花色苷提取物。通过HPLC-MS对两种提取方式下提取所得的花色苷进行分析鉴定,共鉴定出12种花色苷,其中,两种提取方式下所得花色苷提取液中花色苷组成和含量并不相同,矢车菊素-3-O-二丙二酰基葡萄糖苷只存在于辅助提取所得紫玉米籽粒花色苷提取液中,锦葵素-3-O-葡萄糖苷只存在于单一超声波提取液中,而且,矢车菊-3-O-丙二酰基葡萄糖苷、芍药素-3-O-丙二酰基葡萄糖苷在辅助提取的提取液中含量较高,这可能与两种提取条件下不同结构花色苷化合物稳定性不同有关。目前,关于紫玉米中各种花色苷自由基清除活性及其在超高压和超声波提取条件下稳定性的研究鲜有报道,有待下一步深入研究。综上所述,超高压辅助超声波提取紫玉米籽粒花色苷具有提取量高、速度快、抗氧化能力强等优点,这也为紫玉米籽粒花色苷的工业化生产提取提供了有力的支持。
