好氧颗粒污泥耐受PFOS的结构稳定性及微生物响应
2022-12-20徐佳杰谢周云徐伊漪夏静芬杨国靖
徐佳杰,张 妮,,谢周云,徐伊漪,唐 力,夏静芬,杨国靖,*
好氧颗粒污泥耐受PFOS的结构稳定性及微生物响应
徐佳杰1,张 妮1,2,谢周云1,徐伊漪2,唐 力1,夏静芬1,杨国靖1,2*
(1.浙江万里学院生物与环境学院,浙江 宁波 315100;2.湖南大学环境科学与工程学院,湖南 长沙 410082)
以好氧颗粒污泥为接种污泥,通过全氟辛烷磺酸(PFOS)长期驯化实现耐PFOS颗粒的培养,考察不同驯化时期的污泥基本特性,并结合微生物群落演替过程、微生物表型分布以及功能途径的变化情况,以揭示其耐受机制.结果表明,好氧颗粒污泥经历解体、再形成和成熟3个阶段后可在PFOS暴露下稳定维持.驯化成熟后的好氧颗粒污泥表面丝状菌减少,并且被大量胞外聚合物(EPS)所包裹,结构更加致密.驯化期间颗粒污泥中存在大量抗性细菌以及维持颗粒稳定相关细菌,主要包括unclassified、、、、、、、、和A4b,且部分菌属间存在显著的正相关性.群体感应途径和细菌趋化途径相关基因丰度在解体期上调,在颗粒形成和成熟期恢复至初始水平,说明细菌的群体感应效应和趋化性能够在颗粒应激过程中起重要作用.因此,好氧颗粒污泥可以通过特定菌群积极响应、促进细菌趋化作用和群体感应作用、提高EPS分泌量、增强系统抗氧化胁迫能力等多种方式耐受PFOS.采用菌胶团型好氧颗粒污泥以及向好氧颗粒污泥系统中投加上述菌剂或添加信号分子有利于处理含PFOS废水.
全氟辛烷磺酸;好氧颗粒污泥;驯化;微生物群落;耐受
近几十年来,全氟辛烷磺酸(PFOS)成为污水处理厂中普遍存在的一种新兴持久性有机污染物[1].据报道,中国市政污水处理厂进水中的PFOS水平为1.8~176.0ng/L[2],工业废水处理厂进水中的PFOS浓度则达到了5.0mg/L以上[3],当下越来越多的污水处理厂倾向于将生活污水和工业废水进行混合处理.由于PFOS的生物蓄积性,污泥中的PFOS浓度可高达5383ng/g(干重)[4].好氧颗粒污泥是微生物在好氧条件下相互作用形成的生物聚合体,具有优良的沉降性能以及生物活性,是一种极具潜力的生物处理技术[5].PFOS能够与生物分子相互作用并产生生物毒性,如诱导细胞氧化应激,增加其膜损伤和遗传损伤等[6],PFOS的长期浓集必然会对好氧颗粒污泥微生物乃至整个污泥系统的稳定运行产生不利影响.
驯化是强化污泥耐受能力的一种主要方式.相关研究表明,盐度、低温、酸性等条件的驯化均能使污泥产生耐性从而维持较好的性能[7-9].迄今PFOS驯化下的好氧颗粒污泥研究较少.微生物群落调控着好氧颗粒污泥的形成、发育、功能及其稳定性.例如,丝状菌的过度增殖容易引起颗粒强度下降乃至解体;介导群体淬灭细菌的生长则会导致群体感应活性下降,影响胞外聚合物以及ATP的合成代谢,进而影响颗粒污泥的稳定性[10].微生物16S rRNA基因测序可以较为准确的提供好氧颗粒污泥群落的完整图像,是研究微生物多样性及功能的主要方法.目前的研究往往只关注PFOS对微生物氮代谢的影响而不是其耐性行为[11-12].
本研究以好氧颗粒污泥为对象,采用PFOS长期胁迫的方式定向驯化耐PFOS的好氧颗粒污泥.考察不同浓度PFOS驯化期间好氧颗粒污泥特性的变化情况,并采用高通量测序技术,探讨PFOS驯化过程中污泥微生物群落的演替过程,从分子生物学角度揭示好氧颗粒污泥对PFOS的耐受机制,提供PFOS废水处理过程中优化颗粒稳定性的调控策略,以期为未来处理含PFOS废水提供理论参考.
1 材料与方法
1.1 合成废水
合成废水中进水组成如表1所示,其中CH3COONa·3H2O、NH4Cl和KH2PO4分别作为微生物所需碳源、氮源和磷源,添加NaHCO3用于调整废水pH值.
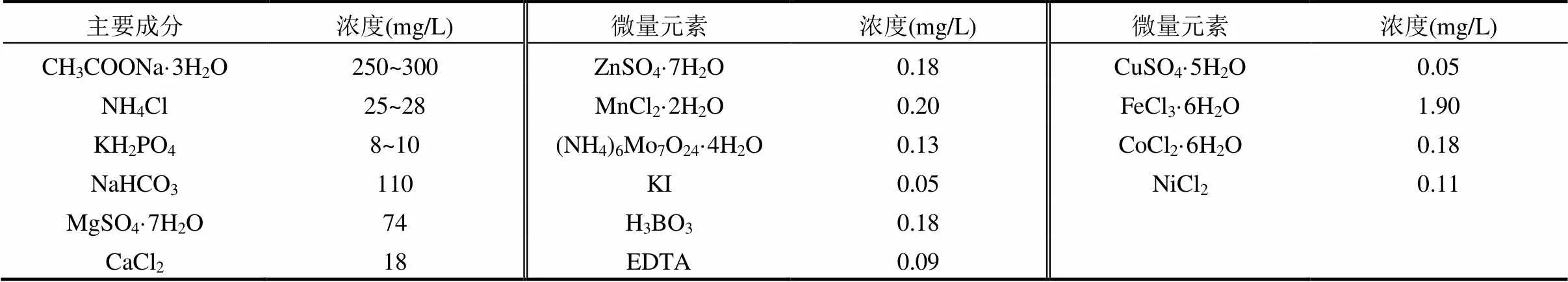
表1 合成废水组成
1.2 接种污泥及装置运行
试验在3个内径为140mm、高为1100mm、有效容积为13L的序批式反应器中进行(对照组不添加PFOS,试验组分别添加0.1,0.5mg/L PFOS).接种好氧颗粒污泥由本课题组实验室培育,各反应器初始污泥浓度(MLVSS)为7500mg/L左右,污泥体积指数(SVI)约30mL/g.反应器在室温环境(21±1)℃下以厌/好氧模式每天运行3周期,具体运行方式为:进水5min、厌氧120min、好氧240min、沉降5min、出水5min、闲置45min.其中厌氧阶段采用机械搅拌实现,好氧阶段控制溶解氧在4~5mg/L,出水体积交换比为60%,水力停留时间约360min.采集对照组及PFOS驯化50,150,350d后的好氧颗粒污泥,进行外观和微观结构分析、EPS含量测定以及高通量测序.样品编号如下:A(对照组)、B和C(0.1,0.5mg/L PFOS驯化50d)、D和E(0.1,0.5mg/L PFOS驯化150d)、F和G(0.1,0.5mg/L PFOS驯化350d).
1.3 污泥特性检测
分别利用相机和扫描电镜(Hitachi S-4800,日本)对好氧颗粒污泥进行外观和微观结构分析.EPS采用改进的热提取法提取[13],EPS中蛋白质(PN)含量采用改良型BCA试剂盒测定,多糖(PS)含量采用苯酚-硫酸法测定,EPS含量为PN和PS含量之和.
1.4 污泥样品采集及微生物多样性分析
取约2mL好氧颗粒污泥样品,置于15mL无菌离心管中,在-80℃下保存至DNA提取.使用淤泥基因组DNA快速提取试剂盒(离心柱型)对采集的污泥样本DNA进行提取,在后续分析前于-20℃保存.对细菌16S rRNA基因的V3~V4区域进行PCR扩增,引物选取为:338F(5’-ACTCCTACGGGAGGC- AGCAG-3’)和806R(5’-GGACTACHVGGGTWTC- TAAT-3’);PCR反应参数为:95℃预变性3min,95℃变性30s,55℃退火30s,72℃延伸45s,循环数30,72℃后保温10min,于10℃保存扩增产物;配制2%琼脂糖凝胶电泳检测PCR产物,当PCR产物目的条带大小正确,浓度合适,可进行后续实验.委托上海美吉生物科技有限公司,使用Illumina MiSeq系统进行高通量测序.通过FLASH、Fastp对所测序列进行优化,然后按97%相似度划分操作分类单元(OTU),并使用SILVA数据库对OTU代表序列进行注释,最后采用BugBase和PICRUSt对微生物表型及基因功能预测.
2 结果与讨论
2.1 颗粒驯化期间的污泥基本特性分析
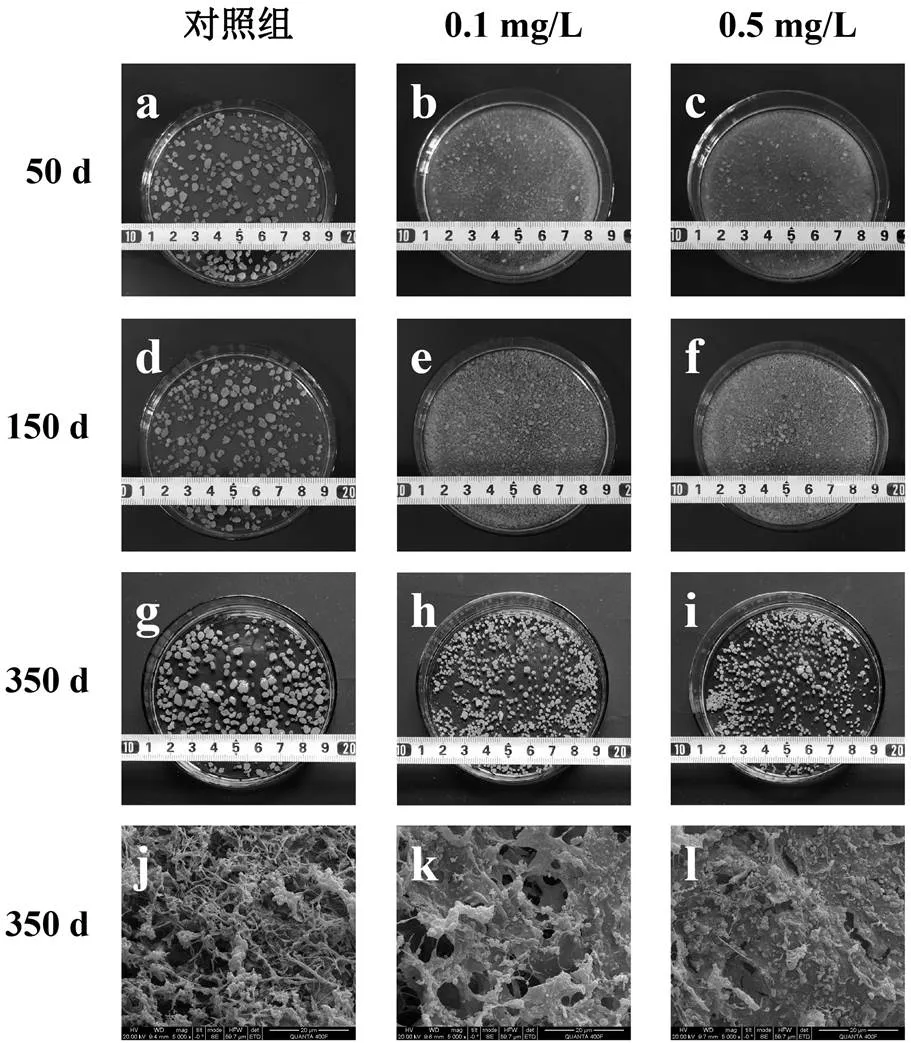
由图1a~图1i可见,在PFOS驯化至50d时,大部分好氧颗粒污泥处于解体状态,小颗粒及絮体在系统中占据主导地位(粒径由对照组的2~5mm缩减至0.5mm以下),导致混合液水体浑浊;当驯化至150d时,系统内已产生颗粒晶核,表明污泥再次颗粒化(粒径主要分布在0.5~1.5mm),但由于此时颗粒粒径较小、致密性较低,仍会出现粘连现象,因此泥水分离效果不理想;将驯化时间继续延长至350d时,好氧颗粒污泥结构基本达到稳定,粒径不再增加(此时粒径分布在1~3mm,较对照组减小),且颗粒外部轮廓清晰,泥水分离现象明显.因此,根据不同时间颗粒形态的差异,将整个驯化过程依次分为解体期(0~50d)、形成期(51~150d)和成熟期(151~350d)3个阶段.
从图1j可以看出,对照组好氧颗粒污泥表面生物相丰富,外部主要由丝状细菌包裹,且丝状菌骨架上附着生长着大量球状和杆状微生物.然而经PFOS驯化之后,颗粒原有结构遭到破坏并发生重塑.由图1k和图1l可见,驯化成熟后的好氧颗粒污泥表面被膜状物质覆盖,并粘连球状和杆状细菌.同时研究过程中发现,好氧颗粒污泥对0.1,0.5mg/L PFOS的去除率在70%以上,质量平衡分析表明该过程主要以吸附为主而非微生物代谢,吸附的PFOS则能够诱使微生物产生应激行为.据此推断,该膜状物可能由PFOS刺激微生物分泌EPS所致.从图1m中可以看出,EPS分泌量在颗粒形成期上升最为显著,最高可达到(740.31±10.63)mg/g VSS,颗粒成熟后EPS含量下降至(458.62±5.16)~(528.37±4.49)mg/g VSS,但仍显著高于对照组的(269.12±3.68)mg/g VSS.EPS中含有大量羟基、羧基等带电官能团以及疏水官能团,这些官能团能够减少细胞间的排斥力,使得EPS成为一种极好的聚合物,对于细菌的附着和颗粒的形成必不可少,可见EPS的大量分泌是PFOS驯化过程中污泥再次颗粒化的重要前提[14-15].
好氧颗粒污泥在污水处理中的风险往往来源于其结构的不稳定性,通过扫描电镜(SEM)分析可知,PFOS暴露下丝状菌减少可能是导致颗粒失稳的关键因素.但经PFOS长期驯化后的好氧颗粒污泥EPS含量显著增加,同时粒径减小,表明其结构更加密实,更易于抵抗环境冲击.陈颖等[16]根据颗粒内部结构组成的差异性将其划分为丝状菌型、菌胶团型以及综合型好氧颗粒污泥.因此综合分析认为,采用菌胶团型好氧颗粒污泥能够减少污泥解体的风险,更适用于处理含PFOS废水.
2.2 不同驯化时期的微生物多样性分析
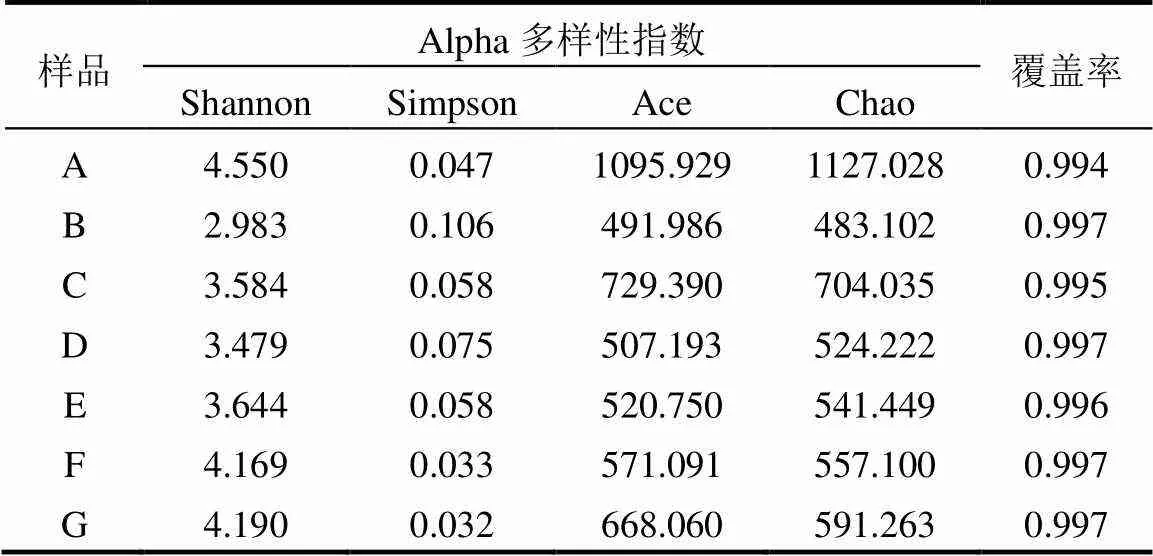
表2 Alpha多样性指数表
按97%相似性对各污泥样品有效序列进行分类统计,共获得OTU数1243个,分属于31个门和442个属.在OTU水平上对各样本的Alpha多样性进行比较,结果如表2所示.其中各样本文库的覆盖率均高于0.994,这可以代表样本测序数据的充分性和真实性.根据污泥样品序列丰度,对样品OTU多样性指数(Shannon、Simpson)以及丰富度指数(Ace、Chao)进行计算可知,不同驯化阶段好氧颗粒污泥微生物的多样性和丰富度存在一定差异.但总体而言,相比对照组A样品,0.1,0.5mg/L PFOS驯化后的群落多样性和丰富度随驯化时间延长均呈现先降低后上升的趋势,表明PFOS驯化初期好氧颗粒污泥内部微生态失稳.这主要是由于PFOS能够破坏细菌的氧化平衡体系,无法适应PFOS压力的生物体往往处于死亡或进入休眠状态.而PFOS驯化后期多样性和丰富度上升主要是由于抗性物种的富集,并且好氧颗粒污泥逐渐成熟,能够营造相对更加稳固的环境供菌群生长.
2.3 不同驯化时期的微生物群落差异分析
为揭示PFOS长期驯化下好氧颗粒污泥微生物群落结构产生的差异变化,通过Venn图考察OTU在各样品中的分布特征,并将各样品在OTU水平上进行主坐标分析(PCoA).
对各组样品的独特OTU以及组间样品的重叠OTU进行Venn图可视化分析发现(图2a),7个样品间的OTU种类存在显著差异,独有OTU由对照组的306降至40以下,共有OTU数仅为113个,约占总数的9.09%,相似度较低,表明大部分微生物难以适应PFOS环境.通过将不同浓度PFOS驯化50,150,350d的污泥样品分别与对照组进行Venn分析,进而得出OTU在不同驯化时间下的重叠状况.对照组样品中共检测到OTU 908个,在0.1,0.5mg/L PFOS驯化50d后,OTU数量分别降至372和529个,且对照组与试验组共有物种仅为262.当PFOS驯化至150d时,试验组OTU分别为391和410,对照组与试验组共有物种从262降至246,相较50d变化较小.而350d时,其共有OTU数仍为246个,且重叠及特有部分变化不显著,这表明随着驯化时间延长,存留的微生物已逐渐适应PFOS的毒性作用.
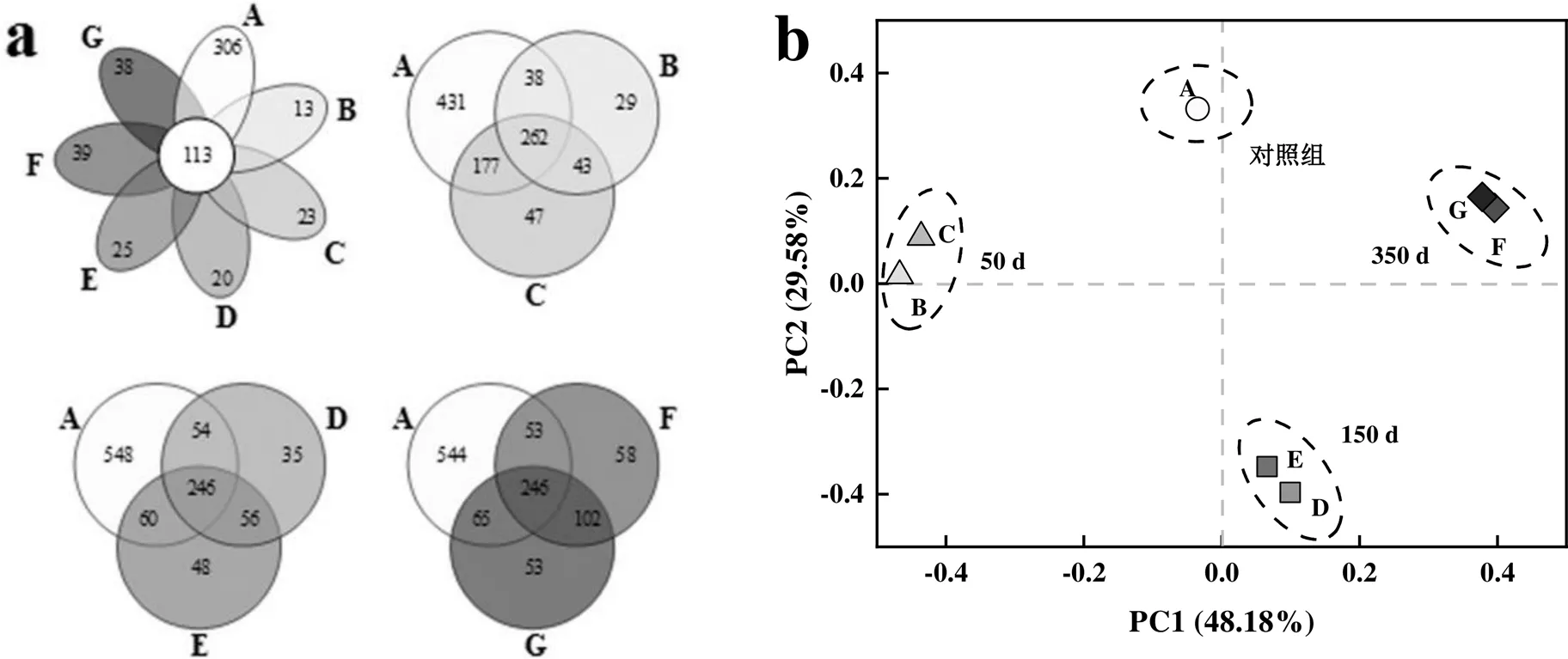
图2 基于维恩图(a)和PCoA(b)的好氧颗粒污泥微生物群落差异分析
由图2b可见,第一主成分(PC1)和第二主成分(PC2)的差异解释率分别为48.18%和29.58%.整体上,对照组与PFOS试验组样品点分布较为离散,空间距离较大,表明PFOS的投加使细菌群落结构发生了较大的变化.然而B和C、D和E、F和G样品倾向于各自聚为一类,表明0.1,0.5mg/L PFOS在相同驯化时间下的细菌群落具有很强的相似性,但不同时间样品在空间上呈现出显著的分异特征,这说明驯化时间对微生物菌群结构同样有着较为直接的影响,使得微生物种类发生了较大差异,同时这也意味着不同驯化时期所起耐受作用的微生物种类可能不同.这主要是受污泥解体后外界环境的影响以及颗粒在形成和成熟过程中内环境变化,微生物种群之间产生竞争造成的.
2.4 颗粒驯化过程中的优势群落组成及演替
如图3a和图3b所示,度和加权度排序越靠前的微生物,其位置越靠近网络图的中心,共现性和鲁棒性越好.Proteobacteria、Bacteroidota、Chloroflexi度和加权度最高,为PFOS驯化期间主要的微生物菌门.有96类菌属共同存在于7个样品中,其中加权度最高的10种菌属分别为、、、OLB12、unclassified、、A4b、、env.OPS_17和,表明这些菌属在PFOS赋存环境下具有较好的生存能力.
为了继续寻找各样品之间优势物种的差异,分别对各系统不同驯化时期门、属水平上总丰度前5和前10的物种进行筛选.由于PCoA结果显示,在相同时间下,各浓度PFOS驯化的好氧颗粒污泥微生物群落组成相似.因此,将空白样品分别与不同时期0.1,0.5mg/L PFOS驯化后的污泥样品进行比较,生成三元相图.由图3c可见,PFOS驯化期间Proteobacteria始终维持在一个较高的比例,但在0.1mg/L PFOS驯化50d后,Bacteroidota和Chloroflexi相对比例由对照组的77.88%和71.71%显著下降至10.74%和10.78%.当驯化至150,350d时,Bacteroidota再次富集,Chloroflexi相对比例虽有所上升,但仍低于对照组.由图3d可见,、、unclassified在0.1,0.5mg/L PFOS驯化50d时有着较大程度的富集,、、相比对照组也有一定增长;但在150d时,、、、、逐渐成长为优势菌属,相对比例相比50d下降显著,但仍稍高于对照组;当PFOS继续驯化至350d,即好氧颗粒污泥成熟时,依旧维持着较高的相对比例,但系统中也富集了新的优势菌属,主要包括、NS9group和OLB12.
从图3e可以看出,在门水平上,不同程度PFOS污染下好氧颗粒污泥群落组成基本相似,但在相对丰度上表现出差异性.驯化后的好氧颗粒污泥仍以Proteobacteria、Bacteroidota和Chloroflexi为主,三者的总丰度在各样品内始终维持在80%以上.其中对照组内三者的关系表现为Proteobacteria (43.05%)>Chloroflexi(32.09%)>Bacteroidota(10.82%),在成熟的好氧颗粒污泥中则演变为Proteobacteria (34.91%~35.66%)>Bacteroidota(26.61%~30.80%)>Chloroflexi(18.18%~21.37%),可见Chloroflexi中的部分菌属对PFOS的耐受性较低.Chloroflexi门内细菌多为丝状菌,主要起骨架和载体作用[17-18],这也与前述SEM中丝状菌减少引起颗粒解体的结论一致.然而,属水平上的微生物群落组成在不同驯化时期发生重塑(图3f).和unclassified初始丰度分别为2.24%和0.58%,在颗粒解体后快速增至22.18%和27.09%,但在颗粒重构过程中逐渐下降至初始水平.、、和相对丰度呈现同样的变化趋势.、、、、在颗粒解体期相对丰度基本接近于0,但在形成期快速上升.其中、被认为与EPS分泌相关[19-21],也被认为是菌胶团形成菌[22].当驯化至350d时,这些菌属丰度又下降至较低水平,这与EPS含量先上升后下降的现象相呼应.NS9group和则是颗粒污泥在成熟过程中逐渐富集的优势细菌,、A4b也在颗粒成熟期恢复至初始水平.再一次证明不同时期起维持颗粒稳定作用的微生物是不同的.
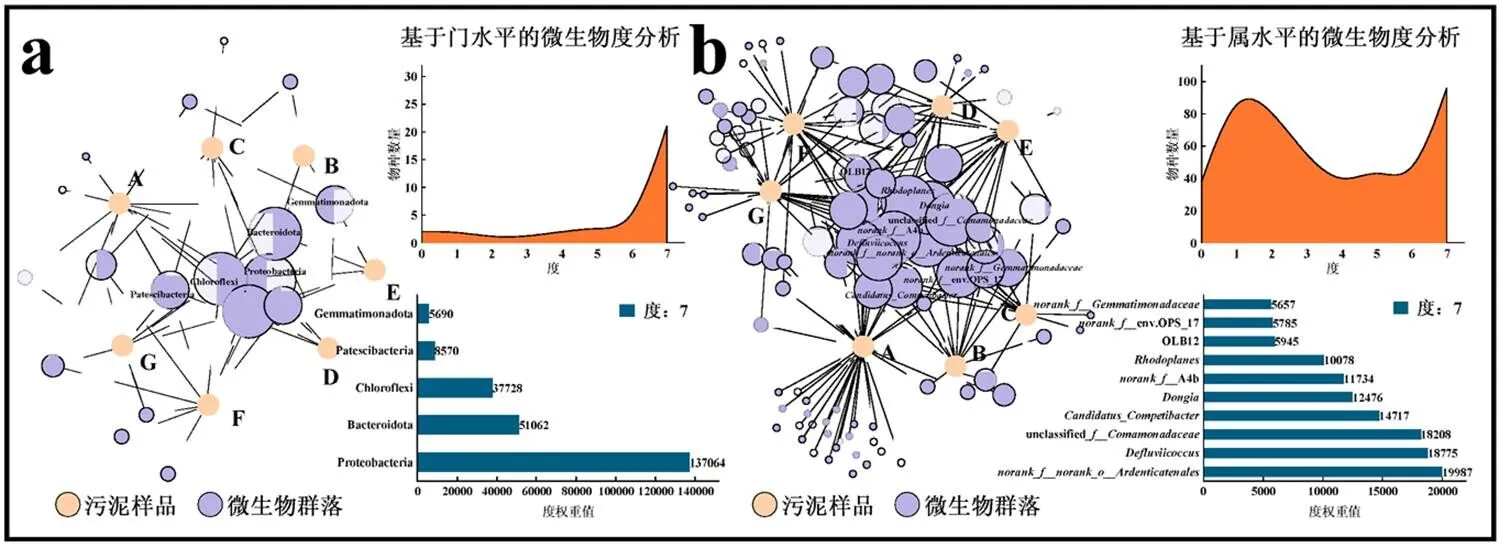
图3 不同驯化时期门和属水平下微生物种群共现性网络分析(a,b)、优势物种分析(c,d)以及微生物群落演替分析(e,f)
Fig.3 The co-occurrence network analysis (a, b), dominant species analysis (c, d), and microbial community succession analysis (e, f) at phylum and genus levels in different domestication periods
2.5 PFOS赋存环境下的微生物群落间相互作用
通过Spearman相关性分析(图4)可知,PFOS赋存环境下菌属间的正相关关系比例约占50%.其中unclassified、、、、之间呈显著正相关(<0.05). unclassified被报道能够产生菌胶团[23],则可以降解糖类和蛋白质[24],提供更多可利用的有机碳源,这有利于[25]、[26]、[27]等反硝化细菌进行生命活动,可见它们之间可能存在偏利共生的关系.3种菌胶团形成菌、、之间存在显著的正相关关系.是一种群体感应细菌[28],虽不能合成N-酰基高丝氨酸内酯(AHL),但其含有AHL受体蛋白从而可以参与AHL调控作用[29],的富集则可以促进环二鸟苷酸(c-di-GMP)的产生[30],这表明三者可能通过群体感应促进EPS分泌来相互辅助生长.Weber等[31]利用一对“sender”和“receiver”的模块,实现了细菌、真菌和哺乳动物细胞间的跨界交流,成功模拟出存在共生、寄生以及捕食等不同相互作用的合成群落,证实了通过信号传导进行共生的可能性.另外相互间有着显著正相关性的还包括A4b、、NS9group和,表明这些菌属间同样可能为共生关系而非竞争.这些菌属大多是各驯化时期富集的优势菌属,据报道,细菌间的共生效应能够提高它们对污染物的耐受性[32-33],因此上述优势菌属间的相互作用或许是提高好氧颗粒污泥对PFOS耐受的一种潜在方式.
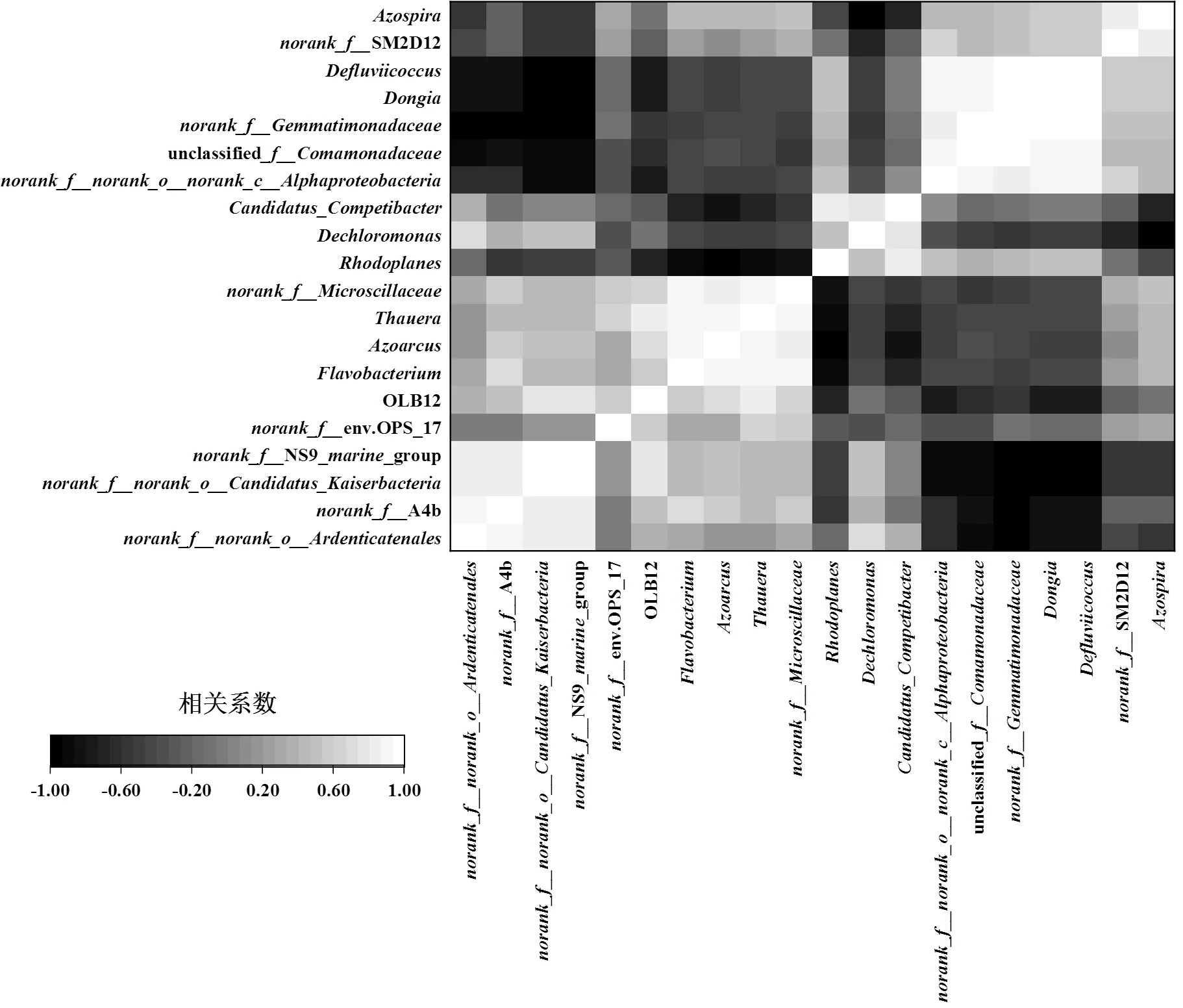
图4 PFOS赋存环境下的微生物群落相关性
2.6 微生物表型分布对颗粒耐受性的影响
由图5a可见,厌氧表型相对丰度在0.1,0.5mg/L PFOS驯化至150d时由对照组的28.40%大幅度降至3.55%和4.03%,在350d时又逐渐上升至36.06%和33.87%.这是因为最初颗粒污泥的解体破坏了厌氧细菌的定殖区域,而成熟后的好氧颗粒污泥内环境稳定,为厌氧细菌重新提供了厌氧环境,这也再一次反映了驯化后的好氧颗粒污泥中不同生境的恢复和稳定.与此同时,革兰氏阳性表型丰度在PFOS驯化后同样出现降低,这主要是由于革兰氏阴性菌的外膜比革兰氏阳性菌更能抵抗膜损伤[34].此外, PFOS可以通过破坏氧化平衡体系的方式使微生物细胞受损,因此PFOS诱导的氧化应激增加了耐胁迫的表型[35],其相对丰度在驯化50d时由对照组的32.63%最高升至63.27%,在后续驯化过程中该表型丰度虽然有所下降,但仍高于对照组.生物膜形成表型表现出与耐胁迫表型相似的趋势,在0.1,0.5mg/L PFOS驯化至50d时,其相对丰度由81.56%分别升至82.76%和88.35%,但随着驯化时间延长丰度逐渐下降.这主要是由于50d时颗粒仍处于解体阶段,微生物表现出明显的应激反应.微生物表型的转变使好氧颗粒污泥更能适应不利的生态环境.
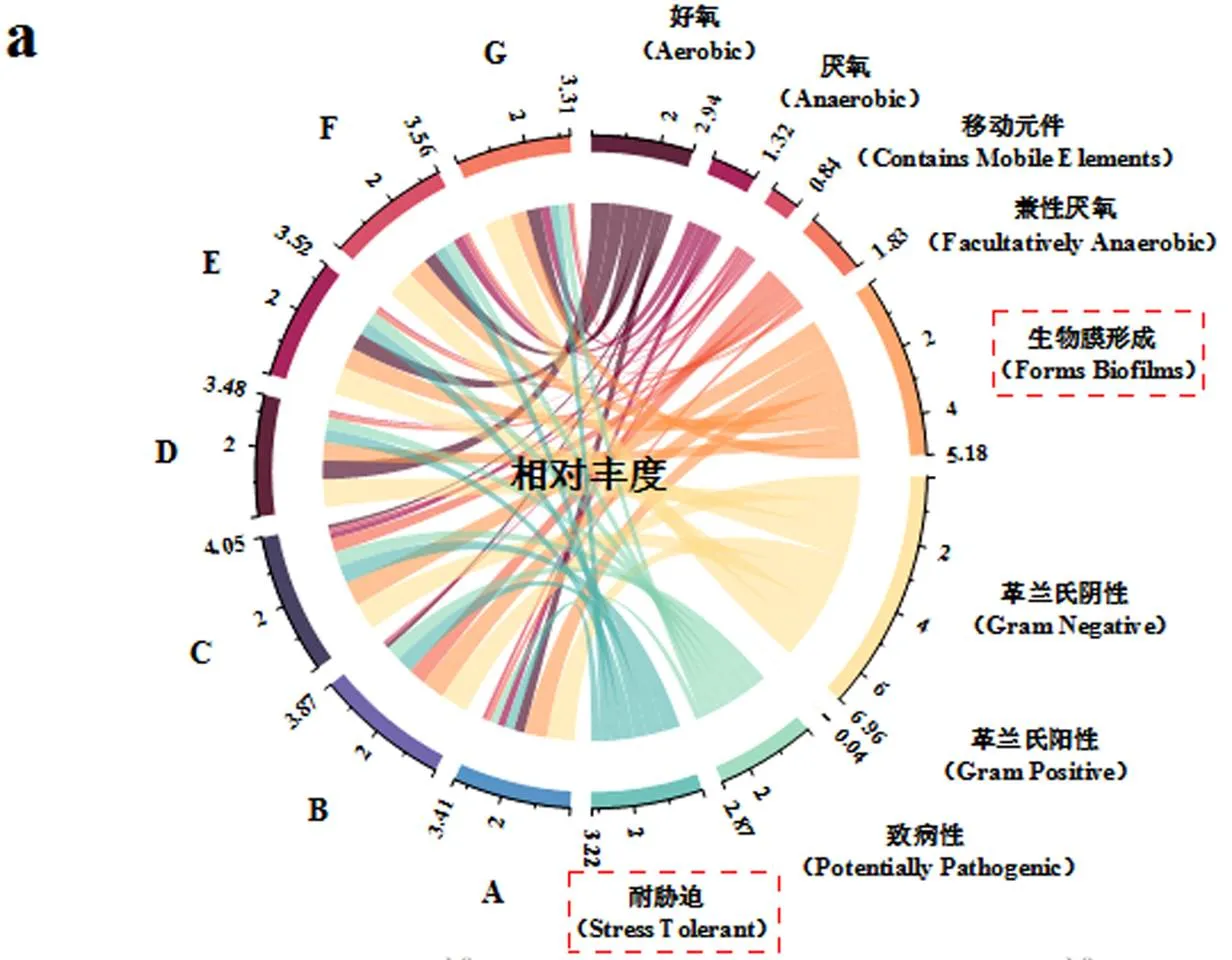
由图5b~图5e可见,不同驯化时期的主要贡献细菌有着极大差异.门水平上,均以Proteobacteria为主要贡献菌,尤其在耐胁迫表型中.属水平上,经PFOS驯化50d后,生物膜形成表型中当属unclassified、、、和贡献度最高,在耐胁迫表型中则以、unclassified和为主要贡献细菌;当驯化至150d时,生物膜形成表型中的贡献细菌转变为以、、、unclassified、、、为主,在耐胁迫表型中则以、unclassified、、、为主;而经PFOS驯化350d后可见,、、、、A4b在生物膜形成表型中的贡献最高,其中、、在耐胁迫表型中也有着较高的贡献度.
综合考虑章节2.4优势群落组成分析认为,解体期以、unclassified、、为主要生物膜形成和抗氧化胁迫细菌,形成期则以、、、为主,而成熟期以、A4b为主.生物强化相关研究表明,外来菌群的投加或许不能定殖成为污泥体系中的优势群落,但依旧能够提高污泥系统对环境压力的适应性[36-37].因此通过对上述菌群进行筛选和培养,以添加外源菌剂的方式强化颗粒污泥系统,对颗粒结构的稳定以及处理含PFOS废水均具有建设意义.
2.7 优势功能基因在颗粒耐性驯化中的作用
由图6a可见,优势基因总丰度在驯化50d时出现上升,但在后续驯化过程中逐渐降低.其中(K03088)、(K01990)、(K01992)、(K02004)、(K02003)、(K06147)等基因相对丰度在解体期出现下降,但在颗粒成熟时期逐渐增长至初始水平,这些基因多与转运蛋白和转录调节相关,这也再一次证实重塑后的好氧颗粒污泥已基本适应PFOS,各项功能有所恢复.
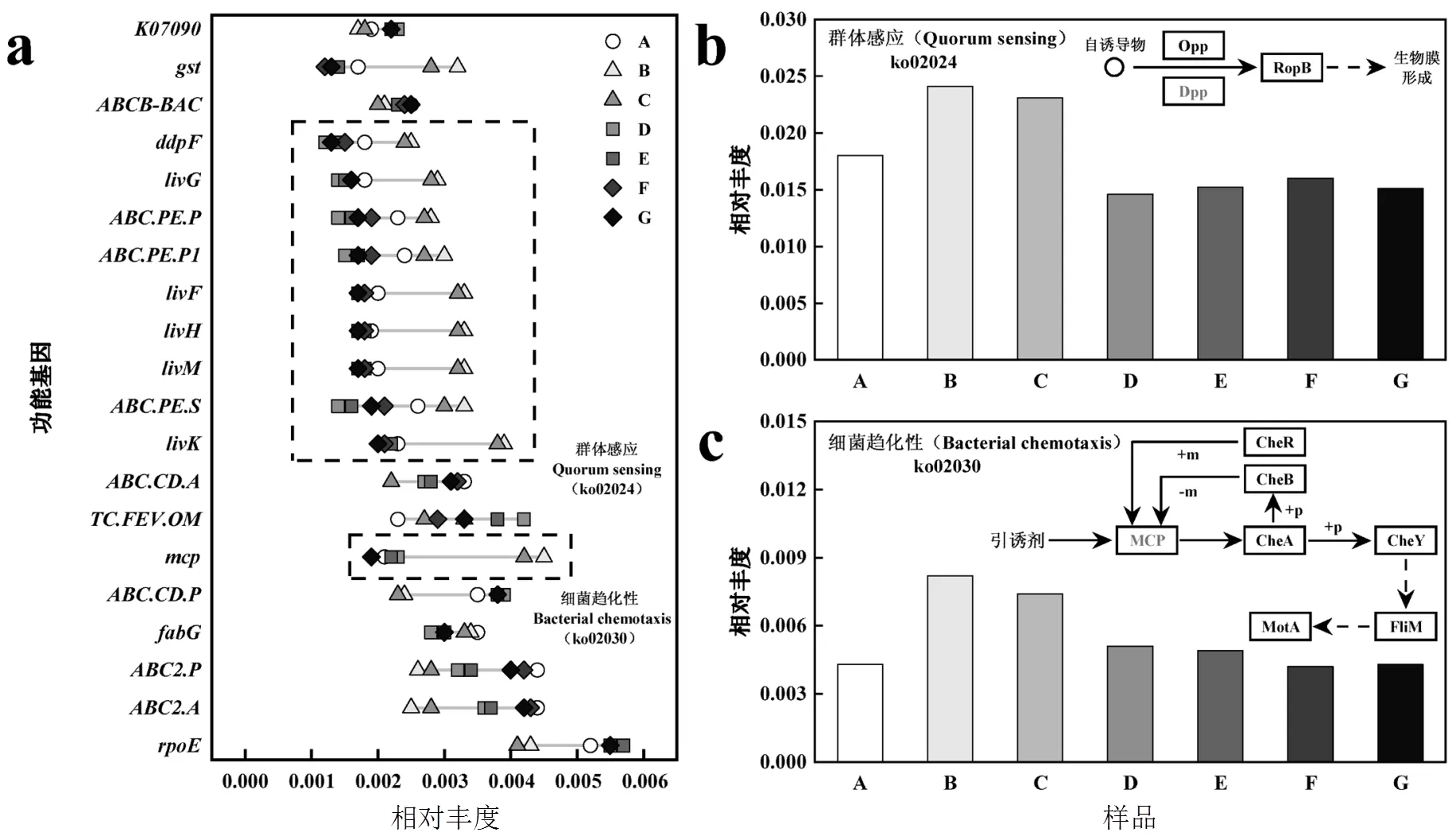
图6 PFOS驯化过程中微生物功能基因的变化
群体感应是由细菌释放信号分子进行种内和种间交流的过程,能够调控细菌的生物行为,如EPS的合成与代谢、生物膜的形成等,因此群体感应与好氧颗粒污泥的形成及结构稳定密切相关[38].由图5a可见,(K01999)、(K01996)、(K01998)、(K01997)、(K02035)、(K02034)、(K02033)、(K02032)等基因均来源于群体感应途径(ko02024),与耐胁迫表型和生物膜形成表型变化过程一致的是,这些基因丰度均在驯化50d时显著上调,而此时颗粒的解体程度基本达到最高,表明群体感应在微生物应激过程中起着关键性作用.进一步分析发现,(K02035)、(K02034)、(K02033)、(K02032)等基因编码Dpp受体蛋白,其所在通路与生物膜的形成有着间接关系,然而该通路中的信号分子类型尚未明确(图6b),明确该信号分子的类型对好氧颗粒污泥的形成和稳定具有重要意义.
趋化性是微生物细胞感知外在环境中的化学物质从而产生趋向的运动,其价值在于寻找食源并远离有害环境[39],该途径中丰富的基因有助于阐释长期暴露于PFOS环境下微生物的耐性机制.由图6a和图6c可以看出,细菌趋化途径(ko02030)以及该途径中的优势基因(K03406)相对丰度同样在PFOS驯化50d时大幅度上升,但在150d和350d时有所下降,逐渐接近于于对照组.据报道,细菌可以利用群体感应机制,根据细胞密度控制基因表达,从而调控其生物过程,趋化性则为群体感应行为提供了协作机制,其可以通过增加细菌种群密度,从而达到细胞对信号分子的感应阈值[40].因此,污泥细菌可能在PFOS诱导下通过执行适宜的趋化运动从而促进种间群体感应作用,这或许是好氧颗粒污泥适应PFOS的一种有效应激途径.
3 结论
3.1 PFOS驯化期间好氧颗粒污泥主要经历解体期,形成期和成熟期3个阶段,驯化成熟后的好氧颗粒污泥在含PFOS的废水处理中能够维持稳定的结构.
3.2 扫描电镜下的微观结构显示,颗粒表面丝状菌数量减少,覆盖着大量膜状EPS,使颗粒结构更加致密稳定.
3.3 群落组成及表型预测显示,不同驯化时期维持颗粒稳定的微生物群落组成存在显著差异,解体期以、unclassified、、为主,形成期以、、、为主,成熟期以、A4b为主.
3.4 基因预测结果显示,(K01999)、(K02035)等8种群体感应相关基因,以及细菌趋化途径中的(K03406)基因在解体期上调.
[1] Gao X Y, Liu Z T, Li J, et al. Ecological and health risk assessment of perfluorooctane sulfonate in surface and drinking water resources in China [J]. Science of The Total Environment, 2020,738:139914.
[2] Chen H, Zhang C, Han J B, et al. PFOS and PFOA in influents, effluents, and biosolids of Chinese wastewater treatment plants and effluent-receiving marine environments [J]. Environment Pollution, 2012,170:26-31.
[3] Qu Y X, Huang J, Willand W, et al. Occurrence,removal and emission of per- and polyfluorinated alkyl substances (PFASs) from chrome plating industry:A case study in Southeast China [J]. Emerging Contaminants, 2020,6:376-384.
[4] Guo R, Zhou Q F, Cai Y Q, et al. Determination of perfluorooctanesulfonate and perfluorooctanoic acid in sewage sludge samples using liquid chromatography/quadrupole time-of-flight mass spectrometry [J]. Talanta, 2008,75(5):1394-1399.
[5] 王建龙,张子健,吴伟伟.好氧颗粒污泥的研究进展[J]. 环境科学学报, 2009,29(3):449-473.
Wang J L, Zhang Z J, Wu W W. Research advances in aerobic granular sludge [J]. Acta Scientiae Circumstantiae, 2009,29(3):449-473.
[6] Liu G S, Zhang S, Yang K, et al. Toxicity of perfluorooctane sulfonate and perfluorooctanoic acid to Escherichia coli: Membrane disruption, oxidative stress, and DNA damage induced cell inactivation and/or death [J]. Environmental Pollution, 2016,214:806-815.
[7] He Q L, Wang H Y, Chen L, et al. Robustness of an aerobic granular sludge sequencing batch reactor for low strength and salinity wastewater treatment at ambient to winter temperatures [J]. Journal of Hazardous Materials, 2019,384:121454.
[8] 陆 玉,钟 慧,丑三涛,等.乙酸驯化对厌氧污泥微生物群落结构及发酵特性的影响[J]. 环境科学学报, 2018,38(5):1835-1842.
Lu Y, Zhong H, Chou S T, et al. Effects of acid-tolerant acclimation on microbial community structure and fermentation performance of anaerobic sludge [J]. Acta Scientiae Circumstantiae, 2018,38(5):1835- 1842.
[9] Li W, Yao J C, Zhuang J L, et al. Metagenomics revealed the phase-related characteristics during rapid development of halotolerant aerobic granular sludge [J]. Environment International, 2020,137: 105548.
[10] 郑婧婧,张智明,徐向阳,等.污水处理好氧颗粒污泥生产运行中的结构与稳定性[J]. 应用与环境生物学报, 2021,27(6):1672-1685.
Zheng J J, Zhang Z M, Xu X Y, et al. Structure and sability of aerobic granular sludge during operation in wastewater treatment [J]. Chinese Journal of Applied and Environmental Biology, 2021,27(6):1672- 1685.
[11] Ji J, Peng L, Redina M M, et al. Perfluorooctane sulfonate decreases the performance of a sequencing batch reactor system and changes the sludge microbial community [J]. Chemosphere, 2021,279:130596.
[12] 唐琳钦,宿程远,黄 娴,等.PFOA与PFOS对厌氧氨氧化污泥特性和微生物群落的影响[J]. 中国环境科学, 2022,42(1):194-202.
Tang L Q, Su C Y, Huang X, et al. Evaluation of sludge characteristics and microbial community of anammox sludge during exposure to perfluorooctane acid and perfluorooctane sulfonate [J]. Chinese Environmental Science, 2022,42(1):194-202.
[13] Yang G J, Zhang N, Yang J N, et al. Interaction between perfluorooctanoic acid and aerobic granular sludge [J]. Water Research, 2020,169:115249.
[14] Sheng G P, Yu H Q, Li X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review [J]. Biotechnology Advances, 2010,28(6):882-894.
[15] Chen H, Li A, Cui C W, et al. AHL-mediated quorum sensing regulates the variations of microbial community and sludge properties of aerobic granular sludge under low organic loading [J]. Environment International, 2019,130:104946.
[16] 陈 颖,陈 垚,李 聪,等.好氧颗粒污泥结构特点及稳定性研究进展[J]. 工业水处理, 2021,41(10):28-35.
Chen Y, Chen Y, Li C, et al. Research pogess on the sutural cacerists and sbili of arbie granular sludge [J]. Industrial Water Treatment, 2021, 41(10):28-35.
[17] Björnsson L, Hugenholtz P, Tyson G W, et al. Filamentous Chloroflexi (green non-sulfur bacteria) are abundant in wastewater treatment processes with biological nutrient removal [J]. Microbiology, 2002, 148(8):2309-2318.
[18] 鲜文东,张潇橦,李文均.绿弯菌的研究现状及展望 [J]. 微生物学报, 2020,60(9):1801-1820.
Xian W D, Zhang X T, Li W J. Research status and prospect on bacterial phylum Chloroflexi [J]. Acta Microbiologica Sinica, 2020, 60(9):1801-1820.
[19] Lv Y, Wan C L, Lee D J, et al. Microbial communities of aerobic granules: Granulation mechanisms [J]. Bioresource Technology, 2014, 169:344-351.
[20] Fra-Vázquez A, Morales N, Figueroa M, et al. Bacterial community dynamics in long-term operation of a pilot plant using aerobic granular sludge to treat pig slurry [J]. Biotechnology Progress, 2016, 32(5):1212-1221.
[21] 郭海娟,顾一宁,马 放,等.好氧颗粒污泥处理市政污水性能与微生物特性研究[J]. 环境科学学报, 2020,40(10):3688-3695.
Guo H J, Gu Y N, Ma F, et al. Performances and microbial properties of aerobic granular sludge treating municipal wastewater treatment [J]. Acta Scientiae Circumstantiae, 2020,40(10):3688-3695.
[22] 邱东茹,高 娜,安卫星,等.活性污泥微生物胞外多聚物生物合成途径与菌胶团形成的调控机制 [J]. 微生物学通报, 2019,46(8):2080- 2089.
Qiu D R, Gao N, An W X, et al. Biosynthesis pathway of extracellular polymeric substance and regulatory mechanism underlying floc frmation of acivated sludge bacteria [J]. Microbiology China, 2019, 46(8):2080-2089.
[23] 张晓红,姜 博,张文武,等.京津冀区域市政污水厂活性污泥种群结构的多样性及差异 [J]. 微生物学通报, 2019,46(8):1896-1906.
Zhang X H, Jiang B, Zhang W W, et al. Microbial community diversity of activated sludge from municipal wastewater treatment plants in Bejjing-Tianjin-Hebei region [J]. Microbiology China, 2019, 46(8):1896-1906.
[24] 肖才林,沈建华,杨 洋,等.三段A/O工艺处理发制品产业集聚区综合废水 [J]. 中国环境科学, 2018,38(4):1304-1311.
Xiao C L, Shen J H, Yang Y, et al. Utilizing three step feed A/O process to treate comprehensive wastewater from hair product production cluster area [J]. Chinese Environmental Science, 2018, 38(4):1304-1311.
[25] Maszenan A M, Seviour R J, Patel B K C, et al. Defluvicoccus vanus gen. nov., sp. nov., a novel Gram-negative coccus/coccobacillus in the 'Alphaproteobacteria' from activated sludge [J]. International Journal of Systematic and Evolutionary Microbiology, 2005,55:2105-2111.
[26] Liu Y, Jin J H, Liu Y H, et al. Dongia mobilis gen. nov., sp. nov., a new member of the family Rhodospirillaceae isolated from a sequencing batch reactor for treatment of malachite green effluent [J]. International Journal of Systematic and Evolutionary Microbiology, 2010,60:2780-2785.
[27] Gao G F, Li P F, Zhong J X, et al. Spartina alterniflora invasion alters soil bacterial communities and enhances soil N2O emissions by stimulating soil denitrification in mangrove wetland [J]. Science of The Total Environment, 2019,653:231-240.
[28] Güneş G, Taşkan E. Quorum quenching strategy for biofouling control in membrane photobioreactor [J]. Chemosphere, 2022,288:132667.
[29] Jiang K, Sanseverino J, Chauhan A, et al. Complete genome sequence of Thauera aminoaromatica strain MZ1T [J]. Standards in Genomic Sciences, 2012,6(3):325-335.
[30] Wan C L, Lee D J, Yang X, et al. Calcium precipitate induced aerobic granulation [J]. Bioresource Technology, 2015,176:32-37.
[31] Weber W, Daoud-El Baba M, Fussenegger M. Synthetic ecosystems based on airborne inter-and intrakingdom communication [J]. Proceedings of the National Academy of Sciences, 2007,104(25): 10435-10440.
[32] Sheng Z Y, Liu Y. Effects of silver nanoparticles on wastewater biofilms [J]. Water Research, 2011,45(18):6039-6050.
[33] Quan X C, Cen Y, Lu F, et al. Response of aerobic granular sludge to the long-term presence to nanosilver in sequencing batch reactors: Reactor performance, sludge property, microbial activity and community [J]. Science of The Total Environment, 2015,506-507: 226-233.
[34] Akhavan O, Ghaderi E. Toxicity of graphene and graphene oxide nanowalls against bacteria [J]. ACS Nano, 2010,4(10): 5731-5736.
[35] Du J J, Wang T, Zhou Q X, et al. Graphene oxide enters the rice roots and disturbs the endophytic bacterial communities [J]. Ecotoxicology and Environmental Safety, 2020,192:110304.
[36] Ramos C, Amorim C L, Mesquita D P, et al. Simultaneous partial nitrification and 2-fluorophenol biodegradation with aerobic granular biomass: reactor performance and microbialcommunities [J]. Bioresource Technology, 2017,238:232-240.
[37] Amorim C L, Duque A F, Afonso C M, et al. Bioaugmentation for treating transient 4-fluorocinnamic acid shock loads in a rotating biological contactor [J]. Bioresource Technology, 2013,144:554-562.
[38] Tan C H, Koh K S, Xie C, et al. The role of quorum sensing signalling in EPS production and the assembly of a sludge community into aerobic granules [J]. The ISME Journal, 2014,8(6):1186-1197.
[39] Adler J. Chemotaxis in bacteria [J]. Science, 1966,153(3737):708- 716.
[40] Wong-Ng J, Celani A, Vergassola M. Exploring the function of bacterial chemotaxis [J]. Current Opinion in Microbiology, 2018,45: 16-21.
Structural stability and microbial response mechanism of aerobic granular sludge exposed to perfluorooctane sulfonate.
XU Jia-jie1, ZHANG Ni1,2, XIE Zhou-yun1, XU Yi-yi2, TANG Li1, XIA Jing-fen1, YANG Guo-jing1,2*
(1.College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, China;2.College of Environmental Science and Engineering, Hunan University, Changsha 410082, China)., 2022,42(11):5117~5127
The aerobic granular sludge that can tolerate perfluorooctane sulfonate (PFOS) was successfully cultivated in a lab-scale sequence batch reactor system. The tolerance mechanism of aerobic granular sludge to PFOS was discovered by examining the sludge characteristics, microbial communities, microbial phenotypes, and functional pathways in various domestication periods. In the presence of PFOS, the granular sludge maintained good stability through the disintegration, formation and maturation phases. PFOS reduced the filamentous bacteria, but promoted EPS secretion. The aforementioned phenomena were beneficial for the formation of compact structure of granules. During the whole domestication stage, a significant number of resistant bacteria and bacteria associated with the maintenance of granule stability emerged in granules, mainly including unclassified,,,,,,,,, andA4b, and there were significant positive correlations among some genera. In addition, the abundance of genes related to the quorum sensing pathway and the bacterial chemotaxis pathway up-regulated in the disintegration period, but returned to the initial level in the formation and maturation periods. It suggested that the bacterial quorum sensing system and chemotactic ability could play important roles in the process of granular stress. Therefore, aerobic granular sludge could tolerate PFOS in various ways such as positive response of specific bacterial communities, promotion of bacterial chemotaxis and quorum sensing, enhancement of EPS secretion, and enhancement of antioxidant stress capacity of the system. The application of EPS-based aerobic granular sludge, microbial agents, and signal molecules was conducive to the treatment of wastewater containing PFOS.
perfluorooctane sulfonate;aerobic granular sludge;domestication;microbial community;tolerance
X703.1
A
1000-6923(2022)11-5117-11
徐佳杰(1997-),男,浙江杭州人,浙江万里学院硕士研究生,主要从事污水处理及资源化研究.发表论文2篇.
2022-04-07
国家自然科学基金项目(51408551);浙江省自然科学基金项目(LY21E080028);浙江省公益技术应用研究计划(LGF22E090008);浙江省一流学科课题(CX2020025);浙江万里学院科研创新团队资助
* 责任作者, 教授, guojing_yang@163.com
