HT29 和HCT116 结直肠癌细胞增殖及其裸鼠移植成瘤研究*
2022-12-16朱飞艳韦云芳魏红江赵红业
王 霞,朱飞艳,王 晶,熊 喆,韦云芳,李 彬,魏红江,赵红业
(1.大理大学 药学与化学学院,云南 大理 671000;2.云南省动物基因编辑与体细胞克隆技术重点实验室,云南 昆明 650201;3.云南省异种器官移植工程研究中心,云南 昆明 650201;4.云南农业大学 动物医学院,云南 昆明 650201)
根据国家癌症中心公布的数据,近年来结直肠癌新发病例和死亡病例居高不下[1]。结直肠癌早期生存率高但隐匿性强,因此早期诊断至关重要[2-3]。结直肠癌的治疗主要是手术切除加药物治疗,病灶切除后,复发和转移的可能性大,晚期患者只能接受化疗,但副作用很大[4]。在结直肠癌治疗方案的研究中,动物试验在体外研究结果向体内研究转化方面发挥着重要的桥梁作用。由于生物学的相似性和重复性等特点,高质量动物模型的建立为肿瘤的发病机制、预防及药物研发提供了客观可靠的平台。目前,建立的结直肠癌动物模型主要以小鼠(免疫缺陷)为试验动物,通过化学诱导、转基因和移植等3 种方式获得肿瘤模型[5]。化学诱导的肿瘤模型生长缓慢,肿瘤细胞增殖率低,诱导过程所需时间较长,且个体差异较大;转基因动物模型通过改变基因组的表达而建立,成瘤率及转移率较低,试验时间较久,在试验研究中应用尚少;移植模型操作简单,成功率高,重复性好[6]。皮下肿瘤移植是把体外培养的肿瘤细胞移植到小鼠的皮下部位从而建立动物模型,该方法操作简单、成瘤率高、应用广泛[7-8]。由于裸鼠的免疫缺陷性,它不排斥移植源于异种动物的细胞或组织;此外,由于其可以保留原发肿瘤本身的遗传性和形态特征[9],故具有较强的生物学相似性和较高的重复性。
HT29 和HCT116 细胞同为人结直肠癌细胞。已有研究得到HCT116 细胞系小鼠皮下移植瘤[10];在裸鼠爪垫皮下部位注射可获得人结直肠癌HCT116细胞系转移模型[11];将结直肠癌细胞接种于裸鼠左侧腋窝皮下可获得人结直肠癌的裸鼠皮下移植瘤模型[12]。皮下生长的肿瘤通常易被纤维膜所包绕,故不易表现恶性肿瘤浸润和转移的特性,肿瘤转移率低。突变或缺失可使机体失调进而导致肿瘤发生[13-14]。HT29 是细胞发生p53基因突变的结直肠癌细胞,是最常见的人类肿瘤基因。野生型p53是肿瘤的抑制关键因子,肿瘤发生过程中产生错误的突变积累到较高水平时,会导致肿瘤恶性增殖[15]。细胞周期抑制蛋白p21 在细胞增殖过程中与p53基因共同作用,调控细胞的增殖和细胞周期[16]。当DNA 发生损伤时,细胞周期阻滞,对DNA 复制错误的细胞生长进行抑制,达到抑制癌细胞恶性生长的作用[17];p53基因突变或缺失的细胞中,DNA 损伤没有得到及时修复,且不断增殖导致错误蛋白积累,最终发展为恶性肿瘤[18]。因此,我们认为HT29 的恶性程度更高。
肿瘤细胞在体外培养过程中,增殖受到传代等因素的影响,移植到体内的细胞系增殖能力可能会受到体内微环境影响而发生改变。本研究以2 株不同的人结直肠癌细胞系HT29 和HCT116为材料,分析其在体外培养和在裸鼠体内的增殖能力,比较2 株细胞的成瘤效果和成瘤条件,为结直肠癌动物模型的构建提供合适的细胞移植量,缩短成模周期,为移植瘤模型的成功建立提供可靠依据,也为结直肠癌的进一步研究奠定基础,以期后续对裸鼠皮下移植瘤进行更进一步的生理生化和病理分析以及药物试验。
1 材料与方法
1.1 肿瘤细胞的增殖培养
1.1.1 细胞系来源及培养试剂
人结直肠癌细胞系HT29 和HCT116 购自中国科学院细胞库;RPMI1640 培养基购于美国Gibco 公司;双抗(青霉素—链霉素)购于Biological industries 公司;胎牛血清购于 ExCell Bio 公司;CCK-8 细胞增殖检测试剂盒和BCA 总蛋白浓度测定试剂盒购自上海碧云天公司;p53 抗体、p21 抗体和β-actin 抗体购自美国 Abcam 公司;二抗购自美国R&D 公司。
1.1.2 细胞培养
取冻存的细胞株HT29 和HCT116 于37 ℃水浴锅中迅速解冻3 min,加入DMEM 培养液,1 500 r/min 离心3 min 以洗去冻存液;将细胞置于培养皿中,加入含有10%胎牛血清和1%双抗的RPMI1640 培养基,置于37 ℃、5% CO2培养箱中培养;隔天换液,分皿,1 周后收集细胞并计数。将HT29 和HCT116 细胞密度调整为2×106和1×107mL-1,将细胞悬液分装于1.5 mL 离心管中,每支离心管装200 μL,置于冰盒中保存,以备接种。
1.1.3 CCK-8 检测细胞增殖活性
将细胞培养于96 孔细胞培养板中,待细胞贴壁后,每孔加人CCK-8 反应液10 μL,随后放入培养箱中继续孵育4 h;取出后使用酶标仪读取每个孔在450 nm 的OD 值,并计算细胞相对增殖率。
1.1.4 细胞单克隆试验
取对数生长期的细胞,按每孔1 000 个细胞接种于10 cm 培养皿中,培养7 d 后用细胞固定液固定30 min,然后用10% Gisma 染色30 min,用蒸馏水轻轻洗去Gisma 染色液,放置干燥,于显微镜下观察细胞单克隆生长情况并拍照。
1.2 肿瘤细胞p53 和p21 蛋白表达测定
HT29 和HCT116 细胞使用阿霉素(doxorubicin,DOX)诱导后,采用蛋白质免疫印迹试验进行测定。使用RIPA 细胞裂解液将处理组细胞放置于4 ℃裂解20 min,离心,收集细胞上清,采用BAC 法测定上清液中的总蛋白浓度;加入SDS 上样缓冲液,100 ℃水浴加热10 min,得到变性的全细胞总蛋白样品。细胞总蛋白使用SDS-PAGE 电泳,然后取出SDS-PAGE 凝胶,铺上聚偏氟乙烯树脂(polyvinylidene fluoride,PVDF)膜,使用膜转印仪进行蛋白转印;转印了蛋白的PVDF 膜首先经5%脱脂奶粉室温封闭60 min,随后加入稀释后的一抗于4 ℃孵育过夜,然后加入二抗于室温孵育2 h。经增强化学发光底物显色后,使用凝胶成像仪进行蛋白表达量显影。
1.3 肿瘤细胞的成瘤差异比较
1.3.1 肿瘤细胞接种
为比较HT29 和HCT116 细胞裸鼠移植成瘤的差异并筛选两者的最适细胞接种量,设置单只细胞接种量为4×105(IN1)和2×106个 (IN2)进行肿瘤细胞接种。将25 只裸鼠在恒定条件下适应性饲养1 周,随机分为5 组:对照组、HT29 细胞IN1组、HT29 细胞IN2组、HCT116 细胞IN1组和HCT116 细胞IN2组。对照组每只裸鼠于腹股沟部位皮下注射PBS 溶液200 μL,试验组裸鼠每只相同部位注射细胞悬液200 μL。
1.3.2 裸鼠体质量和肿瘤体积的测定
各组裸鼠体质量和肿瘤体积从细胞接种的第4 天起,每2 d 测量1 次,持续14 d,每次于固定时间使用电子游标卡尺测量肿瘤最长直径(d1)和最短直径(d2),并计算肿瘤体积(V)。V=1/2d1d22。
1.4 肿瘤组织的病理学检测
1.4.1 肿瘤组织的获取
裸鼠成瘤14 d 后,使用5%水合氯醛对所有裸鼠进行麻醉,剥取裸鼠皮下肿瘤组织和癌旁组织,置于4%甲醛溶液中固定,于4 ℃冰箱保存。
1.4.2 肿瘤组织切片和HE 染色
将固定的组织块装入包埋盒,置于广口瓶中用水流冲洗20 min,使用全自动生物组织脱水机对切片进行脱水,脱水后使用生物组织包埋机进行石蜡包埋。将包埋的石蜡块放入切片机,切取厚度为5 μm 的石蜡切片,将切片摊至载玻片,将载玻片置于60 ℃烤片机上烘烤20 min。将石蜡切片装入载玻片架,经二甲苯脱蜡和梯度酒精复水→苏木素室温染色15 min→水洗→分化液分化3 s→水洗→反蓝液反蓝10 s→水洗→纯溶伊红染色5 min→梯度酒精脱水→二甲苯透明→中性树脂封片得到HT29 和HCT116 肿瘤组织和癌旁组织的HE 染色切片,于显微镜下观察组织学形态并拍照。
1.5 统计与分析
采用 GraphPad Prism 7 和SPSS 17.0对试验数据进行统计学分析。对蛋白表达水平以及小鼠体质量和肿瘤体积进行双因素方差分析,然后进行Tukey’s 事后检验;对细胞增殖采用Student’st检验进行分析。试验结果采用“平均值±标准差”表示,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 HT29 和 HCT116 肿瘤细胞的增殖
由图1 可知:在接种细胞量相同情况下,HCT116 细胞的增长率极显著高于HT29 细胞(P<0.01);单克隆形成试验也表明:接种相同数量的HCT116 和HT29 细胞7 d 后,HCT116 克隆点的细胞面积明显大于HT29 的细胞面积。
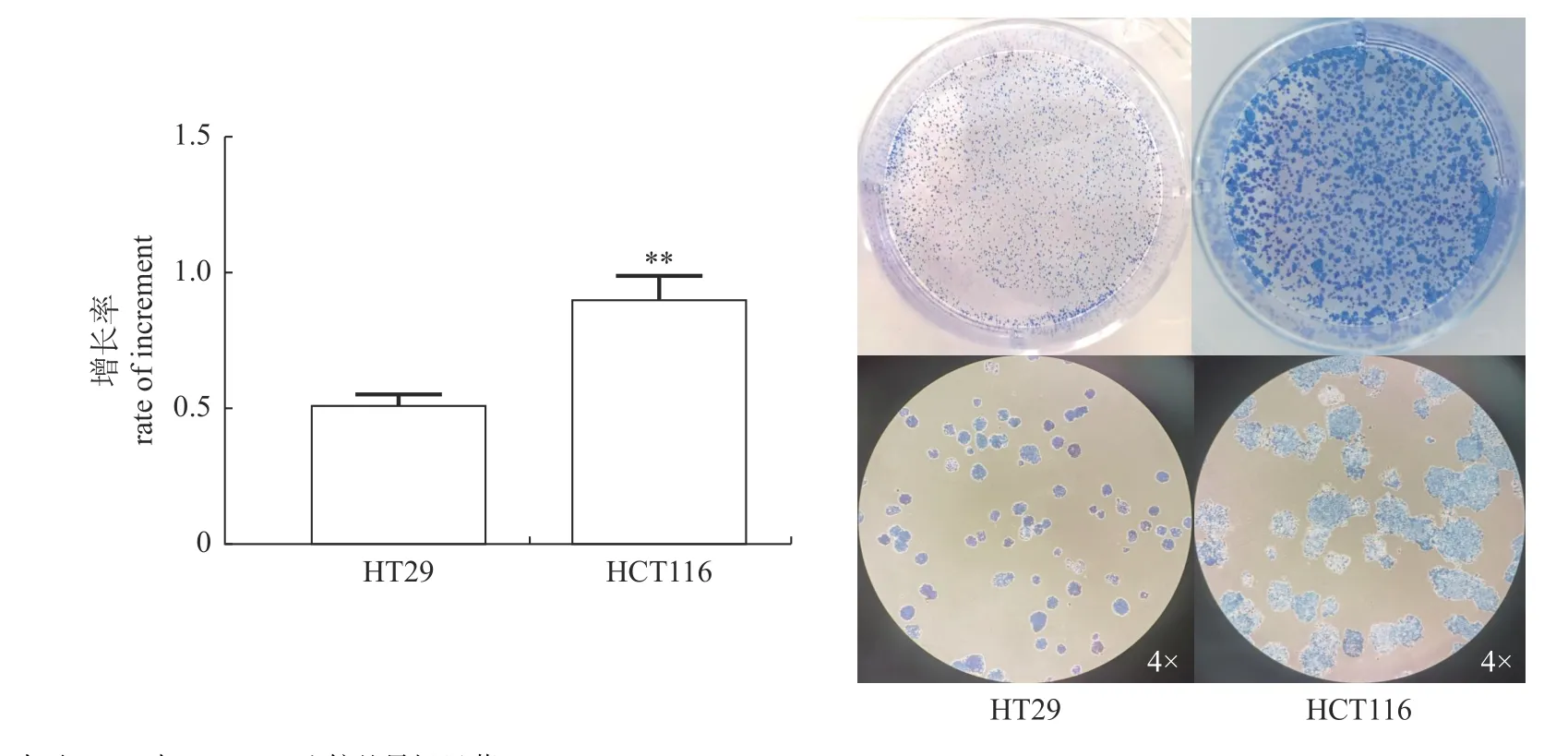
图1 HT29 和HCT116 肿瘤细胞增殖差异比较Fig.1 Differences of proliferation between HT29 and HCT116 tumor cells
2.2 HT29 和HCT116 肿瘤细胞p53 和p21 蛋白的表达水平
由图2 可知:DOX 诱导后,HT29 和HCT116细胞的p53 蛋白水平均无显著变化(P>0.05),且HT29 细胞中p53 蛋白水平极显著高于HCT116细胞(P<0.01);HT29 细胞中,p21 蛋白在DOX诱导前、后均不表达,HCT116 细胞中p21 蛋白正常表达,且在DOX 诱导后表达水平极显著升高(P<0.01)。
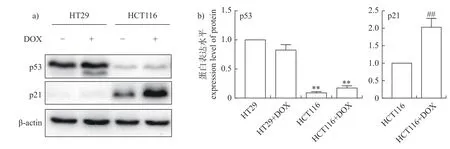
图2 HT29 和HCT116 肿瘤细胞p53、p21 蛋白表达水平差异Fig.2 Differences of protein expression levels of p53 and p21 between HT29 and HCT116
2.3 HT29 和HCT116 肿瘤细胞移植对小鼠体质量的影响
由图3 可知:细胞移植12 d 内,HT29 和HCT-116 的单只接种量为4×105和2×106个时,裸鼠体质量均无显著变化(P>0.05)。

图3 接种HT29 和HCT116 的裸鼠体质量变化Fig.3 Changes in body weight of nude mice inoculated with HT29 and HCT116
2.4 HT29 和HCT116 肿瘤细胞的成瘤性
由图4 可知:单只细胞接种量为4×105和2×106个时,HT29 细胞移植裸鼠在移植的第4 天观察到肿瘤生成,HCT116 细胞移植裸鼠仅在2×106个的接种量下第4 天后观察到肿瘤产生;各处理组产生的肿块体积在第8 天开始呈逐渐增大的趋势,但与其他移植时间的大小无显著差异(P>0.05);同一接种量下,HT29细胞移植裸鼠肿瘤体积显著高于HCT116 细胞移植组(P<0.05)。说明HT29 细胞比HCT116 细胞的成瘤效果显著,高浓度的癌细胞移植有利于肿瘤形成。

图4 HT29 和HCT116 细胞接种裸鼠的肿瘤体积Fig.4 Tumor volume in nude mice inoculated with HT29 and HCT116 cells
2.5 肿瘤组织病理学检测
成瘤14 d 后,HT29 细胞移植组成功从裸鼠皮下剥离肿瘤组织,而HCT116 组未获得肿瘤组织。将HT29 肿瘤组织与正常肌肉组织进行切片和HE 染色,结果(图5)显示:正常肌肉组织呈正常分化的肌肉细胞;HT29 细胞肿瘤组织内可见细胞核膨大,呈圆形,染色体着色不均,有空泡样细胞核,肿块组织内细胞间联系松散,未见明显组织分化。
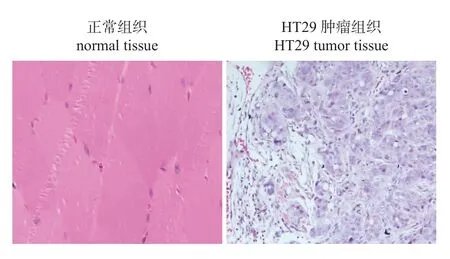
图5 HT29 细胞接种裸鼠癌组织及正常组织的HE 染色 (20×)Fig.5 HE staining of cancer tissue and normal tissues of nude mice inoculated with HT29 cells
3 讨论
移植瘤的形成在动物模型建立过程中受许多因素影响,如细胞活力及数量、注射用细胞悬液的制备情况和细胞培养条件等细胞因素以及裸鼠品种及大小、发育时间、健康与否和接种方法等试验动物因素。本研究主要针对细胞活力、细胞数量和细胞周期等进行试验设计。
在进行皮下移植肿瘤细胞试验时,如果接种量太小,可能造成移植瘤生长缓慢或效果不明显,过高则可能造成裸鼠死亡。本研究设置了4×105和2×106个2 种单只细胞接种量,探究细胞接种量对裸鼠成瘤效果的影响。HCT116 细胞在2×106个的单只接种量下可以成瘤,说明该接种量是HCT116 细胞的较合适接种量;而 HT29细胞在4×105和2×106个的单只接种量下均可成瘤,表明高浓度的肿瘤细胞移植有利于成瘤,且HT29细胞的成瘤效果较好。与HT29 相比,HCT116细胞的体内成瘤效果较差,其一,可能是荷瘤时间过短,瘤体还没有完全发育,瘤体体积较小;其二,可能是因为HT29 是p53突变的结直肠癌细胞,HCT116 细胞p53野生型使癌细胞凋亡,从而防止癌变。
靶向高增殖是侵袭性肿瘤的突出问题,肿瘤的特征之一是无限制的细胞增殖[19]。体外培养过程中,肿瘤细胞增殖速率的快慢并不能完全反映肿瘤细胞在体内的增殖。在体外,HT29 细胞增殖速率低于HCT116,其原因可能是HT29 细胞过度产生p53 肿瘤抗原,但在p53基因的273 位发生突变,导致组氨酸取代精氨酸[20];本研究也表明:p53 蛋白在HT29 细胞内高表达,且p53蛋白的高表达可能抑制了p53 下游p21 蛋白表达。前期研究表明:p53基因缺失可促进猪成纤维细胞增殖[21];在本研究中,与HT29 相比,HCT116 细胞增殖速率显著升高,p53 蛋白表达量极显著下降,且在HCT116 细胞中,DOX 诱导下p21 显著升高,可能是由于p53 蛋白表达过低使细胞稳态维持能力下降,细胞受到胁迫后应激反应增强,p21 蛋白表达水平升高。
突变型p53可增加癌细胞的恶性程度,还能转变为癌基因[22],可阻止细胞凋亡和细胞周期停滞,还能直接与 DNA 启动子附近区域结合,或者反式激活启动相关基因的表达[23]。突变型p53转录的下游靶基因大多上调了肿瘤的生存信号通路,促进肿瘤血管生成[24]。HCT116 的p53 蛋白表达量极显著低于HT29 细胞,恶性肿瘤通常具有恶性增殖的特点,该结果提示HT29 为恶性程度更高的肿瘤细胞。可见,肿瘤细胞在体外增殖速率的快慢不能完全真实反映肿瘤细胞的恶性程度,必须结合肿瘤细胞的其他生物学特性、相关分子机制以及在体内的增殖状况才能较全面地分析和判断肿瘤细胞的恶性程度。
4 结论
高浓度的癌细胞移植利于肿瘤的形成。HCT-116 细胞的增殖速率高于HT29,但HT29 细胞移植成瘤效率显著优于HCT116 细胞,这可能与HT29细胞中p53基因突变导致p53 蛋白高表达及其下游p21 蛋白低表达有关。
