鹅星状病毒刺突蛋白单克隆抗体的制备与鉴定
2022-12-13卢清侠金前跃郭振华冯丽丽邢云瑞柴书军邢广旭张改平
卢清侠, 李 伟, 金前跃, 郭振华, 冯丽丽, 邢云瑞, 柴书军, 邢广旭, 张改平
(1.河南省农业科学院动物免疫学重点实验室,河南郑州 450002; 2.河南农业大学生命科学学院,河南郑州 4500023;3.河南省农业科学院农业经济与信息研究所,河南郑州 450002)
2016年以来,我国各地养鹅场相继暴发了一种雏鹅全身性痛风疫病,经病原分离鉴定,证实该疫病由鹅星状病毒(goose astrovirus,GAstV)感染引起[1-2]。该病毒主要感染5~20日龄雏鹅,临床症状表现为关节肿胀,解剖后可见肾脏与关节腔内有大量的白色尿酸盐沉积[3],发病率为70%~80%,死亡率最高可达50%,给我国养鹅业造成了重大经济损失[4-5]。目前市场上缺乏有效的疫苗与药物,临床上主要通过控制饲料中的蛋白含量进行预防控制。快速准确诊断对于该病的临床防控具有重要的指导作用,目前主要通过RT-PCR和ELISA等检测方法来监控病毒感染[6-8],尚缺少适合现场操作的快速检测技术。
GAstV是一种无囊膜的单股正链RNA病毒,基因组长度为6.8~7.9 kb,包括5′端非编码区(5′-UTR),3′端非编码区(3′-UTR),多聚腺苷酸(Poly A)尾巴和3个开放阅读框(open reading frame,ORFs),分别是:ORF1a、ORF1b、ORF2[9]。ORF1a编码非结构蛋白,如核定位信号、丝氨酸蛋白酶等;ORF1b编码RNA依赖性RNA聚合酶(RNA dependent RNA polymerase,RdRp);ORF2编码的衣壳蛋白其中包含4个功能域:S、P1、P2和酸性C末端结构域( acidic C-terminal domain,ACTD),其中P2结构域编码的Spike蛋白,构成病毒表面的刺突结构,是GAstV的主要保护性抗原蛋白,可以诱导机体的免疫反应[10-11]。本研究通过原核表达系统获得可溶性表达的截短Spike蛋白,制备出3株针对该蛋白的单克隆抗体,为建立有关GAstV 诊断方法提供了材料支持。
1 材料与方法
1.1 病毒、细胞和实验动物
pET-28a-Spike重组质粒由河南省农业科学院动物免疫学重点实验室保存;GAstV XX株(GenBank登录号:MN337323)由河南省农业科学院动物免疫学重点实验室分离、鉴定和保存;鸡肝癌细胞系(LMH)由河南省农业科学院动物免疫学重点实验室保存;BALB/c雌鼠购自济南朋悦实验动物繁殖有限公司。
1.2 主要试剂
质粒小量提取试剂盒购自北京天根生物公司;Ex-Taq酶、 DL2000 marker购自北京宝日医生物公司;Ni-NTA填料、His Trap excel预装柱购自美国GE生物公司,HRP-His单克隆抗体、羊抗鼠 IgG-HRP、山羊抗鼠IgG Alexa Fluor 488、鼠源单克隆抗体亚型鉴定试剂盒购自武汉三鹰生物公司;ECL显色液、胰蛋白酶、无血清细胞冻存液购自苏州新赛美公司;1 mol/L的Tris-HCl(pH值7.5)、IPTG、彩虹180广谱蛋白marker、AEC显色液、单组分TMB显色液、DMEM培养基、RPMI1640培养基购自北京索莱宝生物公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物公司;BL21(DE3)感受态细胞、澳洲胎牛血清购自北京全式金生物公司;HT、HAT、PEG-1500、弗氏完全佐剂与弗氏不完全佐剂购自美国Sigma-Aldrich生物公司。
1.3 Spike蛋白的表达与纯化
将构建好的pET-28a-Spike质粒转化至BL21(DE3)感受态细胞,挑取单菌落转至1 mL含卡那霉素的LB培养基中,37 ℃、220 r/min振荡培养。当D600 nm值为0.6~0.8时,分别加入终浓度为0.5 mmol/L、1 mmol/L IPTG,16 ℃诱导表达14~16 h 后,12 000 r/min 条件下离心10 min 弃去培养基,重悬菌体沉淀,冰上超声破碎后再次离心,分别取上清与沉淀进行SDS-PAGE来检测蛋白的表达情况。将超声破碎后的菌液上清先用0.45 μm滤膜过滤,再用0.22 μm滤膜过滤,通过镍柱系统进行蛋白纯化,20 mmol/L咪唑缓冲液除去杂蛋白,100 mmol/L咪唑缓冲液洗脱并收集。将洗脱液转入透析袋,置于10 mmol/L Tris-HCl缓冲液中,4 ℃ 条件下利用磁力搅拌器搅拌。每隔30 min换液,至少换5次后结束透析。
1.4 Spike蛋白的鉴定
利用SDS-PAGE、Western-blot鉴定纯化后的蛋白,电泳结束后通过半干法转膜,然后用5%脱脂奶37 ℃封闭1 h,1 ∶2 000稀释的HRP-His单抗室温孵育1 h,用PBST洗涤3次,每次5~8 min,最后滴加ECL超敏显色液后凝胶成像仪显色。使用BCA蛋白浓度测定试剂盒进行蛋白浓度的测定,分装后保存于-80 ℃冰箱。
1.5 Spike蛋白单克隆抗体的制备
1.5.1 小鼠免疫 按1 ∶1的比例将Spike蛋白与弗氏完全佐剂乳化后,以200 μL/只(蛋白含量 30 μg)剂量皮下多点注射BALB/c小鼠,同时对照组的小鼠注射等体积的无菌PBS。2周后,按相同的比例、剂量与弗氏不完全佐剂充分乳化后进行二次免疫,之后每隔2周免疫1次小鼠,共免4次。在四免2周后通过断尾采血法收集10 μL血液加到 190 μL 的PBS中,5 000g离心8 min左右,吸取血清,利用ELISA方法检测小鼠血清效价。在融合前3 d,以50 μg/只的蛋白剂量腹腔注射到小鼠体内。
1.5.2 间接ELISA方法 用CBS溶液将Spike蛋白稀释为2.5 μg/mL转入酶标板(100 μL/孔)后 37 ℃ 包被2 h,再用5%脱脂奶于37 ℃封闭1 h,小鼠的阴性、阳性血清倍比稀释后作为一抗,二抗为 1 ∶2 000 稀释的羊抗鼠IgG-HRP,PBST洗涤3~4次,经TMB显色后加入终止液,最后利用酶标仪读取各稀释度D450 nm值,当阳性血清D450 nm/阴性血清D450 nm>2.1所对应的最大稀释倍数为小鼠的抗体效价。
1.5.3 细胞融合与筛选 用PEG-1500将对数生长期的骨髓瘤细胞与脾细胞按一定比例进行融合,待杂交瘤细胞密度达到孔底面积1/3左右时,吸取细胞上清通过ELISA进行初步筛选,并将相同载体的不同蛋白包板,利用ELISA进行反筛来排除针对His标签的假阳性杂交瘤细胞株。借助有限稀释法对阳性杂交瘤细胞进行2次亚克隆,通过ELISA、IPMA方法筛选出阳性单克隆细胞,置于液氮中冻存。
1.5.4 腹水制备 提前2周向BALB/c小鼠腹腔内注射500 μL灭菌石蜡致敏,将PBS重悬的4×106个阳性单克隆细胞注射到小鼠腹腔,7 d左右观察到小鼠腹部明显膨胀,采集腹水,5 000 r/min 离心10 min吸取上清,-40 ℃保存。
1.6 单克隆抗体的鉴定
1.6.1 Western-blot鉴定 Spike蛋白进行SDS-PAGE后转膜进行分析,将按1 ∶500稀释的小鼠腹水作为一抗,室温孵育1 h,以1 ∶1 000稀释的羊抗鼠IgG-HRP作为二抗,室温孵育1 h,最后滴加ECL显色液,并在凝胶成像仪中成像。
1.6.2 IFA鉴定 将LMH细胞经胰酶消化后,以每孔100 μL细胞转入96孔板,待细胞密度达到80%左右时,用无血清DMEM/F12(含1 μg/mL胰酶)将GAstV稀释100倍后接种到LMH细胞上,37 ℃ 培养2 h后,更换2%FBS-DMEM/F12维持液(含1 μg/mL胰酶)继续培养36 h。用预冷的甲醇固定20 min后,5%脱脂奶37 ℃温箱封闭1 h,一抗为1 ∶300稀释的腹水,二抗为1 ∶500稀释的山羊抗鼠IgG Alexa Fluor 488,经DAPI染核后,在荧光显微镜下观察并拍照保存。
1.6.3 效价与亚类的测定 通过ELISA方法测定单克隆抗体的效价,CBS溶液包被Spike蛋白,分别以2倍倍比稀释的腹水作为一抗,羊抗鼠IgG-HRP作为二抗,最后利用酶标仪读取各稀释度D450 nm值。按照亚型鉴定试剂盒说明书进行单抗的亚类测定。
1.6.4 表位鉴定 利用肽扫描方式筛选单克隆抗体的抗原表位,根据GAstV XX株的截短Spike蛋白序列合成了15个氨基酸的25条重叠肽,重叠长度为7个氨基酸,所合成多肽的纯度均大于95%。通过间接 ELISA 方法进行表位筛选,用CBS溶液将合成多肽稀释成为浓度2.5 μg/mL后转入酶标板(100 μL/孔),每条多肽重复3个孔,4 ℃包被过夜或37 ℃包被2 h,以Spike 蛋白作为阳性对照,PBS作为阴性对照,用5%脱脂奶37 ℃温箱封闭1 h,一抗为1 ∶500稀释的3株单克隆抗体,1 ∶2 000稀释的羊抗鼠IgG-HRP为二抗,根据酶标仪读取D450 nm值鉴定单抗的抗原表位。通过Dot-blot方法进行表位鉴定,将1 μg合成肽点至硝化纤维素膜上,Spike蛋白为阳性对照,PBS为阴性对照,室温干燥后5%脱脂奶37 ℃封闭1 h,将1:500稀释的阳性血清单克隆抗体作为一抗,1 ∶2 000稀释的羊抗鼠IgG-HRP为二抗,PBST洗涤4次,最后用ECL试剂显影。
2 结果与分析
2.1 Spike蛋白的表达、纯化与鉴定
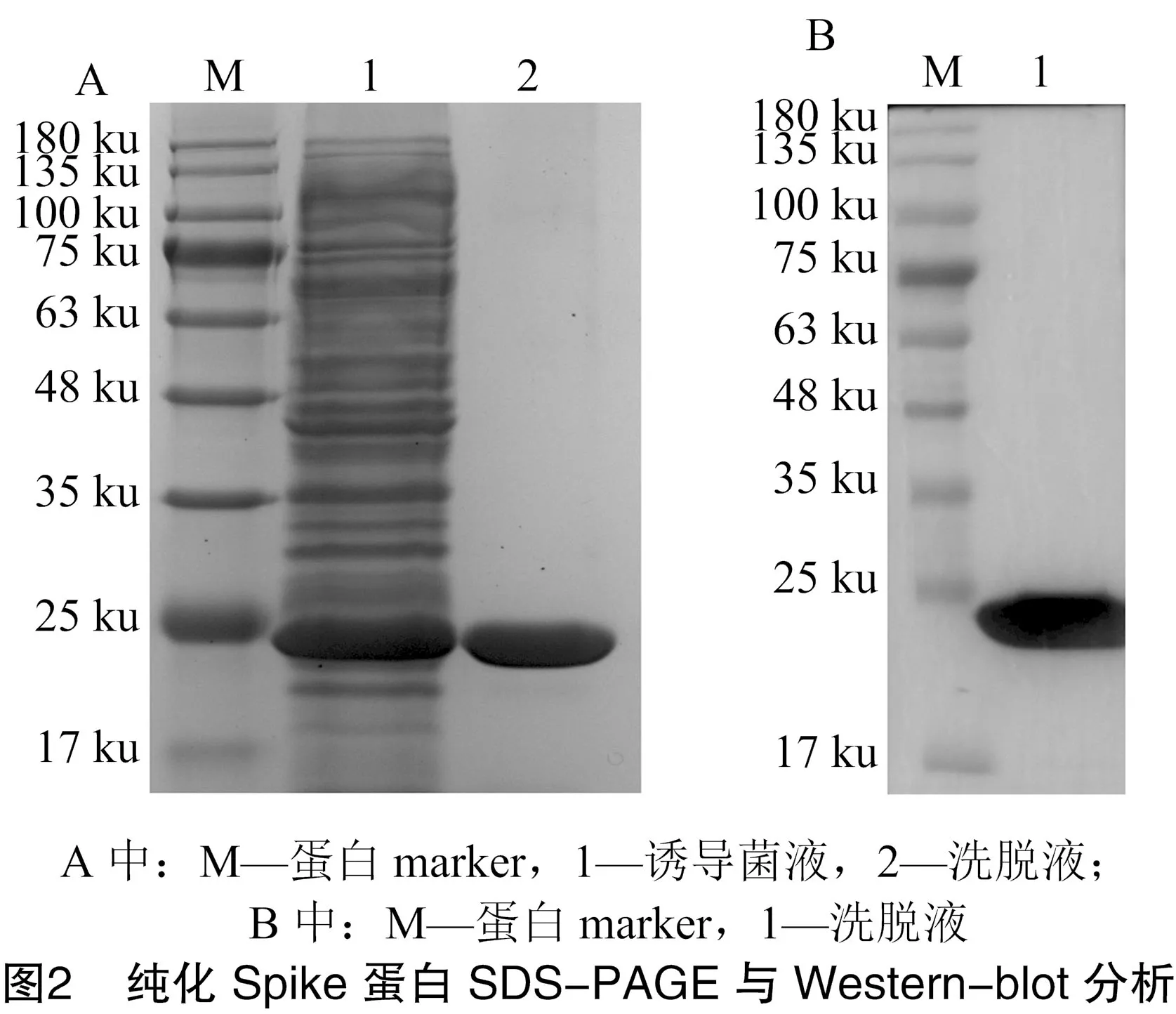
SDS-PAGE结果显示:IPTG诱导后,Spike蛋白在菌液上清中大量表达,1 mmol/L IPTG诱导表达的蛋白量比0.5 mmol/L 诱导表达的蛋白量高,故选择1 mmol/L IPTG进行Spike蛋白的诱导表达(图1)。
通过镍离子亲和层析纯化Spike蛋白,20 mmol/L 咪唑缓冲液洗杂,100 mmol/L咪唑缓冲液洗脱目的蛋白。对纯化后的Spike蛋白进行 SDS-PAGE、Western-blot鉴定, SDS-PAGE结果显示纯化的Spike蛋白大小正确,约为23 ku,且纯度较高,大约为95%(图2-A)。针对His标签的单克隆抗体免疫印迹分析显示,在大小为23 ku处出现了特异性的条带(图2-B)。进一步通过BCA蛋白定量试剂盒检测,确定了获得的纯化蛋白浓度为1.5 mg/mL。

2.2 单克隆抗体的筛选
2.2.1 小鼠免疫及血清效价的测定 Spike蛋白与弗氏佐剂充分乳化后皮下多点注射BALB/c小鼠,四免后利用断尾采集小鼠血清,通过ELISA方法检测血清效价。因小鼠个体的差异,血清效价不同,与其他3只小鼠相比,1号小鼠效价较高,达到 1 ∶512 000,故选择1号小鼠进行超免与细胞融合(图3)。
2.2.2 阳性单克隆杂交瘤细胞的筛选 先利用ELISA方法初步筛选融合后的细胞,得到17孔阳性杂交瘤细胞,再将它们转到48孔板,待细胞密度达70%左右,通过ELISA、IPMA方法进行复筛,得到8株杂交瘤细胞,并对其进行亚克隆,最终利用ELISA方法筛选出3株阳性单克隆杂交瘤细胞,分别命名为1A5、2B4和12E6。利用IPMA对3株阳性单克隆杂交瘤细胞进行进一步鉴定,以3株阳性单克隆杂交瘤细胞的上清分别作为一抗,二抗为1 ∶500稀释的羊抗鼠IgG-HRP,AEC显色后在倒置显微镜下观察显色结果,显示2B4和12E6单克隆杂交瘤细胞的上清可以与GAstV发生特异性反应(图4)。


2.3 单克隆抗体的鉴定
2.3.1 Western-blot鉴定 Spike蛋白进行SDS-PAGE后转膜、封闭,再用5%脱脂奶将3株单克隆抗体(1 ∶500)分别稀释后作为一抗,通过Western-blot鉴定其与Spike蛋白的反应性。3株单克隆抗体均与Spike蛋白反应,且反应性较强(图5)。
2.3.2 IFA鉴定 利用间接免疫荧光实验(IFA)鉴定单克隆抗体与GAstV的反应性,预冷甲醇将接种GAstV的LMH细胞板固定,以1 ∶300倍稀释的3株单抗分别作为一抗,以多少倍稀释的山羊抗鼠IgG Alexa Fluor 488作为二抗。结果显示,与阴性和阳性血清比较,2B4、12E6与GAstV发生特异性反应(图6)。

2.3.3 效价与亚型的鉴定 利用ELISA方法检测3株单克隆抗体的效价:CBS溶液包被Spike蛋白,以2倍倍比稀释的腹水作为一抗,3株单克隆抗体均与Spike蛋白反应性良好,并且效价均在 1 ∶25 600 以上(图7-A)。利用亚型鉴定试剂盒测定3株单克隆抗体,根据D450 nm值判定单抗亚型,结果显示12E6 、 2B4单抗为IgG2b亚类,1A5单抗为 IgG2a亚类;3株单抗的轻链均为κ链(图7-B)。
2.3.4 抗原表位的鉴定 利用多肽扫描方式筛选单克隆抗体的抗原表位,ELISA筛选的结果表明,单克隆抗体1A5识别的表位为:(EP16)ELRNRLNIADGDYVI;单克隆抗体2B4和12E6识别的表位为:(EP21)AGDSNPGETFQNFKM;它们均为Spike蛋白上的线性B细胞表位(图8-A)。利用Dot-blot方法对单克隆抗体进行进一步的表位鉴定,结果表明,与阳性血清对比,单克隆抗体1A5和2B4分别识别(EP16)ELRNRLNIADGDYVI和(EP21)AGDSNPGETFQNFKM,与ELISA鉴定结果一致(图8-B)。
2.3.5 抗原表位的空间分布 利用SWISS-MODEL软件以TAstV-2 Spike蛋白(PDB:3TS3)的晶体结构为模板进行同源建模,获得Spike蛋白的三维结构,其以同源二聚体形式存在(图9-A)。




之后使用PYMOL软件绘制B细胞表位EP16,EP21在Spike蛋白结构上的位置。由图9-B可见,抗原表位(EP16)ELRNRLNIADGDYVI位于Spike蛋白结构的侧面(红色),而抗原表位(EP21)AGDSNPGETFQNFKM位于 Spike蛋白单体的顶部(黄色)。
3 讨论
鹅星状病毒主要感染雏鹅,其特征为痛风、肾脏出血和肿胀,发病率较高。据统计,该病已经造成12亿~15亿元的经济损失。常规的PCR检测方法受环境、技术的限制,在养鹅企业很难得到应用,因此建立快速、简便的GAstV抗原诊断技术对于该病的防控十分重要[12]。而基于单克隆抗体的胶体金免疫层析检测技术具有快速、简便、不依赖任何设备的特点,同时具有良好的特异性和敏感性,非常适合疫病的现场即时检测[13,14]。在本研究中,我们制备了3株针对Spike蛋白的特异性单克隆抗体,为后期研发针对GAstV的胶体金试纸条等抗原检测方法提供了材料。
线性B细胞表位可以为疫苗设计和诊断方法开发提供潜在候选位点[15]。Ren等制备了针对 His-P2-ACTD 蛋白的单克隆抗体,并鉴定出3个线性表位,首次开发了基于单抗的夹心ELISA方法用于检测GAstV。Xu等利用水稻胚乳表达的猪瘟病毒(CSFV) E2蛋白免疫小鼠,获得了相应的单克隆抗体,发现其中2株具有中和活性,鉴定出的表位P33能够区分猪瘟病毒抗体与牛病毒性腹泻病毒(BVDV)抗体,并为新疫苗的设计和鉴别诊断提供了理想的候选肽[16]。本研究鉴定出2条线性抗原表位,为GAstV疫苗和诊断技术的开发奠定了基础。
4 结论
本研究通过小鼠免疫、融合,ELISA筛选,亚克隆以及 IPMA验证成功制备了3株单克隆抗体,其中2株可以与病毒发生反应;并通过多肽扫描技术,鉴定出2条分布于Spike蛋白的抗原表位;为建立快速、简便的GAstV检测方法奠定了基础。
