MYB转录因子调控植物花青素生物合成研究进展
2022-12-13梁玉镯陈新娜陈东亮李彦慧黄丛林
梁玉镯, 陈新娜, 陈东亮, 王 森, 李彦慧, 黄丛林
(1.河北农业大学园林与旅游学院,河北保定 071000; 2.北京市农林科学院草业花卉与景观生态研究所,北京 100097;3.北京市功能花卉工程技术研究中心,北京 100097)
花青素是一种类黄酮类水溶性天然色素,是植物呈现红色、紫色及蓝色等色彩的主要呈色色素[1-2]。除此之外,花青素还广泛参与了植物抵御盐[3]、干旱[4-5]、低温[6-7]等非生物胁迫以及火疫病病菌(Erwiniaamylovora)[8]、黄萎病病菌(Verticilliumdahliae)[9]、虫害[10]等生物胁迫的抗逆反应,因此花青素对于植物而言具有重要的生物学意义。对人而言,花青素也具有很高的利用价值,有抗氧化、增强血管弹性、预防癌症、提高视力等多种功效,因此,植物花青素被广泛用作医药、保健品、食品添加剂等。
目前,人们对植物花青素的生物合成途径已经研究得比较清楚,涉及许多结构基因的表达,而这些基因又在不同层面受到不同基因的表达调控[11]。MYB是植物中最大的转录因子家族之一,广泛参与植物的细胞形态建成、次生代谢物生物合成、分生组织形成、抵御生物及非生物胁迫等众多生理生化进程[12]。大量研究发现,MYB类转录因子在植物花青素代谢中发挥着非常重要的调控作用,是目前已知的花青素生物合成途径中最重要的调控因子。本文主要概述了植物花青素生物合成途径,并对参与花青素生物合成途径调控的MYB种类及其调控方式等进行了综述,以期为进一步阐述植物花青素生物合成调控及花色形成机制奠定基础。
1 植物花青素的生物合成
花青素是许多植物中最主要的呈色色素。目前已知的植物花青素有500多种,其基本结构由2个苯环(A—与B—)组成,并通过1个三碳的单位连接形成碳骨架C6—C3—C6(图1)。自然界中天然的花青素主要包括天竺葵色素(pelargonidin)、矢车菊色素(cyanidin)和飞燕草色素(delphindin)三大类[13],这3种色素又经过糖基化、甲基化、酰基化等修饰,进一步形成各种结构更加稳定、颜色更加丰富的花色素苷。植物细胞中花色素苷的种类及含量共同决定了其呈现的颜色。
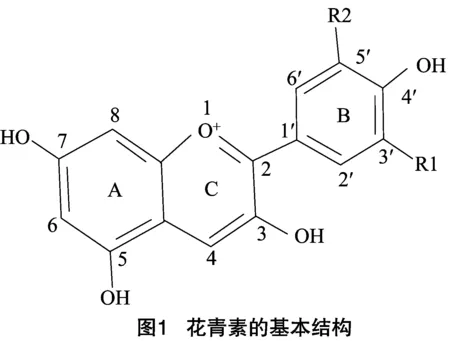
1.1 花青素的生物合成途径
植物中花青素的生物合成通路已经被研究得比较清楚[14-15],主要分为3个阶段(图2)[16-20]。第1阶段开始于苯丙氨酸,通过苯丙氨酸解氨酶(phenyl alanine ammonialyase,PAL)催化产生肉桂酸,再经肉桂酸羟化酶(cinnamic 4-hydroxy-lase,C4H)生成香豆酸,最后在4-香豆酰CoA连接酶(4-coumarate coenzyme A ligase,4CL)的作用下,香豆酸转变为4-香豆酰-CoA,该阶段是大多数次生代谢所共有的。第2阶段是类黄酮代谢的重要反应,丙二酰-CoA和第1阶段的产物4-香豆酰-CoA通过查尔酮合成酶(chalcone synthase,CHS)作用产生查尔酮,再经查尔酮异构酶(chalcone isomerase,CHI)的催化合成黄酮醇槲皮素(naringenin),然后黄烷酮-3-羟化酶(flavanon 3-hydroxylase,F3H)催化合成二氢黄酮醇(dihydrokaempferol,DHK)。DHK又可进一步分别被类黄酮-3′-羟化酶(flavonoid 3′-hydroxylase,F3′H)、类黄酮-3′,5′-羟化酶(flavonoid 3′5′-hydroxylase,F3′5′H)催化生成二氢槲皮素(dihydroquercetin,DHQ)、二氢杨梅素(dihydromyricetin,DHM)。在第3阶段,DHK、DHM及DHQ在二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase,DFR)、花青素合成酶(anthocyanidin aynthase,ANS)的依次催化下,分别形成天竺葵色素、飞燕草色素及矢车菊色素。然后在糖基转移酶的作用下,形成天竺葵色素苷、飞燕草色素苷及矢车菊色素苷。矢车菊色素苷、飞燕草色素苷又经过不同程度的甲氧基化,进一步形成芍药色素苷(peonidin)、矮牵牛色素苷(petunidin)和锦葵色素苷(malvidin)。自然界中游离的花青素并不稳定,需要经过糖基化、甲基化、酰基化等修饰形成各种花色素苷,才能稳定存在,同时使其具有更加丰富的颜色。
1.2 花青素合成途径中的结构基因
目前,植物花青素生物合成的主要结构基因都已经被分离鉴定[14,17-18],其生物学功能也比较清楚[19]。CHS、CHI都是花青素合成途径上游的关键酶,CHS催化查尔酮的形成,处于初生代谢和次生代谢的连接处,而CHI是查尔酮转变为黄烷酮的关键酶,最早从法国豌豆(PisumsativumL.)中克隆获得[20]。大量研究发现,CHS、CHI基因的表达水平与花青素含量呈正相关。例如,在拟南芥(ArabidopsisthalianaL.)tt4、tt5突变体中分别导入玉米(ZeamaysL.)CHS(C2)、CHI(CHI1)基因后,发现拟南芥突变体中花青素含量都显著提高[21]。将小苍兰(Freesiahybrida)CHS1基因导入白花矮牵牛(Petuniahybrida)中,可以促进矮牵牛中花青素的合成,花色由白色转变为粉色[22];而通过反义手段抑制CHS的表达会阻碍花青素的合成,使颜色褪去而呈白色[23-24]。Lim等将洋葱(Alliumcepa)CHI导入番茄(Lycopersiconesculentum)中发现,番茄果皮中的花青素含量增加到原来的400倍, 果肉中的花青素含量也增加了260倍[25]。

F3H是催化4,5,7-三羟基黄烷酮产生花青素合成前体物质DHK的核心酶,F3′H、F3′5′H又分别催化DHK转变为DHM、DHQ。DHK、DHQ、DHM则进一步在DFR、ANS等酶的催化下形成不同的花青素。因此,F3′H、F3′5′H往往被认为是决定花色的关键基因,如果其活性缺失,可能会导致花色无法形成红色或蓝色。月季(Rosachinensis)、香石竹(DianthuscaryophyllusL.)和菊花(Chrysanthemummorifolium)由于F3′5′H活性缺失,从而不能形成飞燕草色素,使其缺少蓝色或紫色花[26];相反的,飞燕草色素含量比较高的大多数飞燕草属植物的F3′5′H活性较高,花色多呈现为蓝色或紫色,但因其不含F3′H而无法形成矢车菊色素,从而造成其缺失红色或粉色花[27]。
DFR、ANS是DHK、DHM和DHQ分别形成天竺葵色素、飞燕草色素及矢车菊色素所共同需要的酶。DFR最初是从玉米、金鱼草(AntirrhinummajusL.)中克隆出来的[28],后来又相继从油菜(BrassicacampestrisL.)[29]、马铃薯(SolanumtuberosumL.)[30]等其他植物中分离出来,研究者逐渐明确了其在花青素合成中的作用,即催化DHK、DHM和DHQ形成无色的原花青素。无色的原花青素进一步由ANS催化转化为有色的花青素,这是花青素生物合成途径的第1个有色化合物,而ANS也被视为花青素合成途径末端的核心酶。目前研究者已经从紫苏(PerillafrutescensL.)[31]、桑椹(Fructusmori)[32]、夏堇(Toreniafournieri)[33]等多种植物中分离出了ANS类基因,它门对植物果实、叶片、花等显现丰富颜色具有重要作用。研究发现,ANS仅在金钟连翘(Forsythiaintermedia)的萼片中表达,在花瓣和花药中不表达,使得花瓣中未产生花青素[34],而当龙胆(Gentianascabra)中ANS基因发生突变时,其花色褪变为白色[35]。
花青素虽然显现出颜色,但是并不稳定。花青素形成后会进一步经过糖基化、甲基化、酰基化等修饰,形成结构更加稳定、颜色更加丰富的花色素苷。糖基化是花青素修饰中最常见的方式,可以增强花青素的稳定性与水溶性[36-37]。大部分植物花青素合成后的第1步是C3位经花青素3-O-葡萄糖基转移酶(3GT)的催化进行糖基化[38],此外,一些植物的C5位、C7位也存在糖基化修饰,但一般C3位的糖基化优先于C5位的糖基化发生[39]。花青素分子上的羟基或糖苷基上的羧基又可以通过芳香酸或脂肪酸的作用发生酰基化,所以一般认为花青素酰基化修饰晚于糖基化修饰。酰基化修饰可以进一步增强花青素的水溶性,使花青素保持原有的颜色。此外,当发生芳香族酰基化修饰时,还会改变花青素的吸收波长,使其呈色向蓝色增加的方向移动[40-41]。甲基化修饰可以稳定花青素的B环结构,通常发生在花色素分子的C3′、C5′位羟基上[41],由于花色素分子C3′、C5′位上的羟基被甲氧基替换,发生甲氧基化,可使花青素显现红色。通常甲基化修饰发生在糖基化修饰之后、酰基化修饰之前,但拟南芥中因为只有F3′H,使其只能合成矢车菊色素,所以不存在甲基化修饰。
2 植物花青素生物合成途径中MYB的调控作用
花青素合成结构基因以直接参与的方式调控花青素的形成,而其表达又受到转录水平中转录因子的调控,大量研究发现,MYB转录因子是植物花青素合成结构基因中最重要的调控因子。MYB是高等植物中数量较大的基因家族之一[42],已在多种植物中被分离鉴定[43-44]。MYB转录因子含有2个保守区域,分别是N端的DNA结合结构域和C端的调控区域。N端的DNA结合结构域由不完整的重复片段R1、R2和R3(每个R序列由大约51~53个氨基酸组成)组成[45],根据结合域所包含的R片段的数量,MYB转录因子家族被分为R1-MYB、R2R3-MYB、R3-MYB和R4-MYB 4个亚家族[46]。R1-MYB类转录因子在植物对逆境的响应中发挥了重要作用[47-49],并且研究发现,R1-MYB类转录因子CCA1与拟南芥光信号传导有关[48]。拟南芥、水稻(OryzasativaL.)等大部分植物中均含有5个R3-MYB转录因子[49-50],该蛋白主要广泛参与植物细胞调控和细胞分化过程[51-52]。R4-MYB蛋白的含量较少,一般在植物中不含有或仅含有1个[53-55],目前对该蛋白的研究比较缺乏。
R2R3-MYB转录因子在MYB家族中的占比最高,有研究发现,在拟南芥已报道的近200个MYB转录因子中,R2R3-MYB类就有126个[53-54];在已报道的水稻近200个MYB中,R2R3-MYB 有109个[53],这类蛋白在N端含有2个MYB结构域(R2、R3),并广泛参与植物次生代谢物的合成,应对各种胁迫的抗逆反应等过程[55]。R2R3-MYB类转录因子是目前已知的花青素生物合成途径中最重要的调控因子,它通过调控花青素生物合成结构基因的表达,决定着花青素的种类及含量,最终影响花、果及叶片等的颜色。依据 R2R3-MYB 蛋白氨基酸序列的不同保守性,R2R3-MYB 家族又进一步被划分为25个亚族[56],并且部分亚族已被证明与花青素生物合成密切相关。例如在模式植物拟南芥中,第5亚族AtMYB123参与了拟南芥种皮中原花青素的积累[57],第6亚族AtMYB75、AtMYB90、AtMYB113和AtMYB114调控着营养组织中花青素的合成[58],而第7亚族AtMYB11、AtMYB12和AtMYB111对拟南芥各器官中花青素的合成都有调控作用[59]。此外,第4亚族的大多数成员为拟南芥花青素合成途径中的负调控因子[60]。
2.1 MYB正向调控花青素的合成
大部分参与花青素生物合成调控的MYB转录因子属于R2R3-MYB类,并且大部分MYB对于花青素的生物合成起到促进作用。最早被报道的参与花青素合成调控的MYB类转录因子是调控玉米糊粉层的ZmC1,之后研究者又从玉米中分离出ZmC1的同源基因ZmPI,该基因在玉米的其他器官中调控着花青素的合成[61]。MYB转录因子是通过调节花青素合成途径中结构基因的表达进而发挥作用的,几乎所有植物器官中的花青素都受到MYB转录因子的正调控。番茄中AN1的过量表达会导致结构基因CHS、CHI与DFR的表达量上调,致使番茄果实中的花青素大量积累[62],而转录因子Rosea1会促进金鱼草花瓣中结构基因F3H、DFR、ANS和UFGT的表达[63]。紫甘蓝(BrassicaoleraceaL.)BoMYB2和紫色花椰菜(BrassicaoleraceaL.)Pr通过激活下游结构基因DFR、ANS与UFGT的表达量上调,决定着其叶片的着色[64-65],而甘薯(Ipomoeabatatas)块茎中花青素的积累是通过IbMYB1调控CHS、CHI、F3H、DFR、ANS和UFGT的表达而获得的[66]。
有研究发现,转录因子MYB在花青素合成调控中发挥作用时具有一定的组织特异性,在不同器官中发挥主导作用的MYB可能不同。红色蝴蝶兰(Phalaenopsisaphrodite)中3个R2R3-MYB转录因子PaMYB2、PaMYB11、PaMYB12分别正向调控花萼/花瓣、花萼/花瓣上的斑点及脉络中花青素的积累[67]。MdMYB1、MdMYBA、MdMYB10与MYB110a是调控苹果(Malusdomestica)各组织中花青素合成的关键正调控因子,其中MdMYB1、MdMYBA主要参与果皮中花青素的合成,而果实、叶片中的花青素合成受到MdMYB10的调控,果实外皮层组织中花青素的合成则与MYB110a的表达有关[68-69]。此外,研究者还从蔷薇科(Rosaceae)其他植物中获得MdMYB10的同源基因,如桃(Prunuspersica)的PpMYB10基因[70]、甜樱桃(Prunusavium)的PavMYB10基因[71]、欧洲李(PrunusdomesticaL.)的PdmMYB10基因[72]、樱桃李(Prunuscerasifera)的PcfMYB10基因[72]及梨(Pyrussorotina)的PyMYB10基因[73]等,这些MdMYB10的同源基因均通过诱导下游基因DFR的表达进而正调控果实中花青素的合成,推测MYB10可能是蔷薇科植物果实呈色的关键调控因子。
MYB通过调节花青素合成结构基因的表达而发挥作用,但是不同MYB所调控的结构基因存在差异。如AtMYB11、AtMYB12和AtMYB111在拟南芥各组织花青素合成通路中调控结构基因CHS、CHI和F3H的表达,而DFR、ANS等结构基因的表达量则与PAP1、PAP2、AtMYB113和AtMYB114的表达量呈正相关[64-65]。在拟南芥种子中过量表达PAP1基因发现,DFR表达量大大增加,而CHS表达量却没有变化,表明PAP1主要调控花青素合成下游结构基因的表达[74],进而提高花青素含量,相似的情况也发生在玫瑰(Rosarugosa)[75]、油菜[76]中。
2.2 MYB负向调控花青素的合成
部分R2R3-MYB对于花青素的合成具有抑制作用,其特征是在蛋白羧基端存在1个阻遏结构域,会抑制花青素合成相关基因的转录,进而负调控花青素的合成。拟南芥R2R3-MYB第4亚族的AtMYB3、AtMYB4、AtMYB7及AtMYB32这4个成员均在花青素生物合成中发挥着负调控作用[66]。FaMYB1是草莓(Fragariaananassa)中已知的唯一的转录抑制因子,在烟草(NicotianatabacumL.)中过量表达FaMYB1会抑制花青素合成途径中结构基因ANS、UFGT的表达[77],从而降低花瓣中花青素的含量。而金鱼草中转录负调控因子AmMYB308是通过抑制花青素上游结构基因C4H的表达进而控制花青素的积累[78]。苹果中MdMYB16、MdMYB17、MdMYB111和油桃(Prunuspersica)中PpMYB16、PpMYB111是高度同源的R2R3-MYB类转录因子,对花青素表现出明显的抑制作用[70,79]。除此之外,在葡萄(VitisviniferaL.)[80]、蓝莓(VacciniumuliginosumL.)[81]、杨树(PopulusL.)[82]、苦荞(FagopyrumtataricumL.)[83]等植物中也都发现了抑制花青素合成的R2R3-MYB转录因子。
除R2R3-MYB外,R3-MYB类蛋白也对花青素的合成起着抑制作用。与R2R3-MYB的抑制机制不同,R3-MYB主要通过与R2R3-MYB竞争MBW复合体,从而抑制R2R3-MYB对花青素合成的促进作用。比如,拟南芥中的R3-MYB转录因子CPC通过与花青素正调控因子PAP1/2竞争结合蛋白,从而抑制花青素结构基因DFR等的表达[84],TRY、ETC1对拟南芥中花青素的合成具有类似的抑制效应[85];番茄SlMYB3转录因子可以负向干扰MBW的形成,从而影响花青素合成[86]。蝴蝶兰、百合(Liliumspp.)等花卉中也存在类似的花青素负调控因子[87-88]。
有研究发现,一些MYB转录因子发生突变也可能抑制花青素合成途径。玉米中转录抑制因子ZmC1-I是由激活花青素合成的转录因子ZmC1发生突变而形成的,因ZmC1-I的转录激活区不完整,从而抑制花青素的积累[89]。有些MYB抑制因子还可以通过与激活因子竞争结合靶基因从而抑制花青素的合成。例如,拟南芥中转录负调控因子ICX1、PAP1等激活因子竞争结合CHS的启动子序列,进而导致结构基因的表达受到抑制[90]。
除上述植物外,海棠(Maluschaenomeles)[91]、菊花[92]和莴苣(LactucasativaL.)[93]等植物中也存在对花青素合成途径起负调控作用的转录因子。然而有趣的是,MYB在植物花青素合成过程中的作用并不是单一不变的,转录因子VcMYB-PA1对蓝莓生长前期花青素的合成具有促进作用,而在果实成熟期却会抑制花青素的积累[94],这也说明植物花青素生物合成及其调控网络的复杂性。
2.3 MBW复合体调控花青素的合成
MYB、bHLH和WD40可以形成MBW三元复合体,调控植物花青素生物合成的机制存在于许多植物中,是许多植物花青素生物合成途径中已知的重要的调控方式。苜蓿(Medicagotruncatula)中MYB蛋白MtPAR或者MtAP1与bHLH蛋白MtTT8和WD40蛋白MtWD40-1可以形成MBW复合体,从而激活下游结构基因ANS的表达[95],促进花青素合成。玉米ZmP1蛋白是通过与WD40类蛋白ZmPAC形成二元复合体来调节花青素苷合成结构基因DFR的表达[96],而ZmC1蛋白激活DFR的表达除需要ZmPAC外,还需要1个bHLH类蛋白ZmR或ZmB组成三元复合物[97],且三元复合物相比二元复合物多了1个激活UFGT表达的功能。研究发现,从紫粒小麦品种高原115(TriticumaestivumL.)中分离的R2R3-MYB转录因子TaMYB3-4A[98]、TaMYB3-4D[99]与ZmR共同在白色小麦胚芽瞬时表达时均能诱导花青素的合成,单独表达时则不能发挥功能。不同的是,TaMYB3-4D只在高原115的胚芽鞘和种皮大量积累,而TaMYB3-4A同时还在茎、叶片等其他组织中进行表达。
大多数植物是通过形成三元复合体调控花青素合成途径的,但组成复合物的3种转录因子以及复合物所调节的结构基因都是不确定的。拟南芥MYB转录因子TT2、PAP1或PAP2都需要与bHLH 转录因子TT8、EGL3和WD40转录因子TTG1结合形成三元复合体,从而促进花青素的合成,其中PAP1/PAP2-TT8-TTG1复合体调控花青素合成基因CHS和DFR的表达[100],而TT2-TT8-TTG1组成的复合体能够与BAN启动子结合,进而激活拟南芥种皮中花青素合成相关基因BAN的转录。此外,TT2、TT8共表达时也可以与BAN启动子结合,但是复合物的活性与TTG1的表达有关[101]。在烟草中也发现三元复合物MrMYB1-MrbHLH1-MrWD40-1的表达比二元复合物MrMYB1-MrbHLH1更能显著提高花青素的含量[102]。有研究发现,WD40本身不具有催化作用,但它可以介导MYB与bHLH之间的互作,增强MBW复合体的稳定性和活性[103]。
MBW复合体在花青素合成途径中大部分具有转录激活功能,少数会抑制花青素合成基因的转录表达。甜樱桃[104]、苹果[77]中的MYB转录因子MYB10、MYB10.1均可以分别与bHLH转录因子bHLH3或bHLH33相互作用,从而参与花青素的合成,但仅存在PaMYB10-PabHLH33二元复合体时会抑制甜樱桃花青素合成,其他复合体均可以诱导花青素合成下游结构基因的表达。此外,矮牵牛PhMYB27与bHLH转录因子AN1共表达时,也会抑制矮牵牛中花青素的积累[105]。
3 MYB及MBW上游调控因子
近年来的大量研究发现,花青素合成调控转录因子MYB及MBW复合体的形成受到MicroRNA(miRNA)以及RNA(siRNA)的调控。例如,miR858特异识别部分MYB转录因子基因,通过在转录后水平负调控其基因表达,从而调控花青素的生物合成[106],柿(Diospyroskaki)中miR858通过抑制靶基因DkMYB19或DkMYB20的表达进而抑制花青素的积累[107]。miR828也可以抑制PAP1、PAP2和MYB113等MYB类转录因子的表达,从而减少花青素的积累。然而有趣的是,PAP1/MYB75反过来又可以激活miR828的表达,miR828通过剪切TAS4产生更多siRNA,进而增强了对其靶基因的控制[100,108-109]。除此之外,其他miRNA也通过其靶基因间接参与对花青素的调控,例如Gou等研究发现,拟南芥中转录因子SPL9是miR156的靶基因,而SPL9的表达会降低MBW复合体的稳定性,从而导致花青素合成途径受到抑制[110],而Chiou等也发现,miR827通过控制靶基因NLA的表达来影响花青素的合成[111]。
Gasciolli 等研究发现,花青素的合成还可能与siRNAs有关[112]。沉默大丽花(DahliapinnataCav.)中siRNA介导的CHS转录后基因,会使花色变成纯白色[113],之后对双色矮牵牛的研究发现,双色性状同样是由CHS-A转录后的基因沉默造成的,因为发现在花瓣的2个不同颜色组织内均可以检测到CHS-A前体mRNA,然而白色区域却检测不到mRNA,但存在siRNA[114]。虽然有研究发现,miRNA、siRNA参与花青素代谢途径转录后水平的调控,但相关报道还是比较缺乏。
4 展望
植物花青素合成途径是一个极其复杂且极具变化的过程,受到一系列结构基因及各种调节因子的作用或相互作用。近年来,关于花青素合成途径的研究已经十分清晰,但花青素合成的调控机制还需要不断研究和探索,以明确更多植物的各个组织中花青素合成调控因子的单独作用和互作效应,从而充分发挥基因的调控作用。除此之外,花青素合成途径还受到环境因子温度、光照、激素等的影响,这使得花青素合成的调控机制变得更为复杂,因此,对于花青素合成的调控机制还有待更深入的探究。花青素的研究还应联系实际,利用转基因、沉默基因、基因突变等技术使调控基因可以定向表达,以提高植物的观赏价值、改良蔬菜及果实的颜色和品质,创造出更大的价值。
