盐胁迫下园林植物彩叶树响应菌根共生的比较转录组分析
2022-12-13温可馨
陈 盖, 温可馨, 司 冰
(1.唐山工业职业技术学院,河北唐山 063299; 2.渭南职业技术学院,陕西渭南 714026)
土壤是植物生长发育的重要载体,然而全球范围内超过7%的土地受到不同程度盐胁迫的影响[1]。盐胁迫是对作物生长发育及产量形成最不利的环境胁迫因子之一,其潜在的分子机制与多种生物途径和过程有关,包括渗透调节、离子泵、氧化途径以及营养障碍等代谢过程的改变[2];分子水平上,盐胁迫可限制细胞分裂、DNA扩增,甚至诱导产生基因毒性[3]。此前的研究发现,植物体具有多种信号转导通路协助植物适应盐胁迫,例如盐胁迫敏感系统(SOS)、丝裂原活化蛋白激酶(MAPK)级联、磷脂酰肌醇(PI)和脱落酸(ABA)介导的信号转导通路[4]。此外,为应对盐胁迫,分子信号传导可以激活其他转录因子(TF),TF可增强和激活基因调控信号,从而重新调节细胞离子、渗透和活性氧(ROS)的稳态[5]。
丛枝菌根(arbuscular mycorrhizal,AM)真菌是一种重要的土壤有益微生物,它可与80%以上的陆生植物形成互惠互利的共生关系,这种共生关系可促进植物生长并改变植物的形态、生理和营养水平[6],从而提高对多种非生物胁迫因素的抵抗力,包括养分贫瘠、高温、寒冷、干旱和盐胁迫[7]。在盐胁迫条件下,接种AM真菌的植物可以增强对离子稳态、渗透平衡和抗氧化酶活性的调节[8],同时也可提高光合活性以改善养分活化、营养获取和植物的水分吸收[7]。然而,以往对盐胁迫环境改善机制的研究主要集中于形态学和生理学特征,很少对接种AM真菌的植物在基因组范围内的基因表达进行探索,这限制了AM真菌在植物抗盐性方面的应用认知[9],因此,须要对盐胁迫条件下AM真菌改善机制进行进一步的分子水平分析。
彩叶树是指在整个生长季节,全部或部分叶色与自然绿色有明显区别的木本植物类群,基本特征是具备一致的变色期、较长的观赏期和整齐的落叶期[10]。目前,紫叶稠李、金叶女贞、鸡爪槭、五角枫、金叶红瑞木等10余种彩叶树种广泛引种栽植于我国各省市道路、街道两侧及公园中,是园林绿化的重要组成[11]。然而在实地栽种中,在各个地区均呈现出植株生长势弱、适应性差、病虫害严重等现象。许多彩叶树在盐渍土壤中生长不良,表现出叶片焦枯、叶色灰暗等现象[12]。在前人的研究中,接种AM真菌可有效调节100 mmol/L盐胁迫下彩叶树的渗透胁迫、氧化损伤和离子应力,从而促进植株的生长发育[13],这些结果为进一步研究彩叶树接种AM真菌的耐盐性分子机制奠定了基础。本研究中,借助Illumina HiSeqTM2500测序平台分析彩叶树鸡爪槭(Acerpalmatum)叶片组织中的全基因转录变化,以探索AM真菌诱导耐盐性的分子机制。研究结果可为更全面地了解AM真菌在耐盐性中的作用提供理论支持,并启动有效的基因工程策略。
1 材料和方法
1.1 供试时间与供试材料
试验于2021年5—8月于渭南职业技术学院试验场大棚中进行。供试彩叶树品种为鸡爪槭,购自杨凌益恒园林绿化有限公司。种子采用表面灭菌后在培养皿中的3层湿滤纸上,在 26 ℃ 环境下黑暗处理催芽4 d。
供试培养基质为体积比为2 ∶1的土壤与珍珠岩(直径<3 mm),高压蒸汽灭菌(121 ℃,1×105kPa,4 h)后,冷却备用。土壤理化性质:pH值为7.11,有机质含量为18.32 g/kg,全氮含量为 0.95 g/kg,碱解氮含量为78.26 mg/kg,速效磷含量为21.03 mg/kg,速效钾含量为110.64 mg/kg。供试NaCl为优级纯,购自上海玉博生物科技有限公司。
供试AM真菌为根内根孢囊霉(Rhizophagusintraradices),购自北京市农林科学院植物营养与资源环境研究所,直接用作接种菌剂,接种菌剂由土壤和孢子构成,孢子数>100个/g基质。
1.2 试验设计
试验采用完全随机设计,设置4个处理:CK(不接种丛枝菌根真菌,不设置盐胁迫处理)、AM(接种丛枝菌根真菌,不设置盐胁迫处理)、SS(不接种丛枝菌根真菌,设置盐胁迫)、AS(接种丛枝菌根真菌,设置盐胁迫)。每个处理重复3次。
盆栽器具为桶形,盆高为17 cm,半径为8 cm,每盆培养基质5 kg。将催芽的种子每盆1粒转移至盆栽土中,加入200 mL育苗专用营养液,并保持60%土壤持水量。接种AM真菌的处理须将20 g AM真菌菌剂与灭菌的培养基质混合,不接种处理即采用经高温灭菌处理的菌剂等量加入。培养30 d后在盐胁迫处理中加入100 mL浓度为100 mmol/L的NaCl溶液,对照中加入等量蒸馏水。胁迫处理后30 d收获植株,共培养60 d。
1.3 样品采集及测定分析
1.3.1 生物量、菌丝定殖率、丛枝侵染率及泡囊丰富度测定 培养结束后,将植株全部取出,小心清洗以获得完整根系,将根系切成1 cm的小段,采用台盼蓝染色,光学显微镜下用网格交叉记数法计算菌丝定殖率、丛枝定殖率及泡囊丰富度,具体方法参照Kormanik等描述的步骤[14]进行。生物量为鲜质量,采用电子天平称量记录。
1.3.2 转录组测定
1.3.2.1 RNA提取、cDNA文库构建和高通量测序 使用RNA prep Pure Plant Kit[天根生化科技(北京)有限公司]分离12(4×3)张叶片样品的总RNA。文库构建和RNA-Seq分析由Biomarker Biotechnology Corporation(中国,北京)进行。首先,使用NEBNext® poly(A) mRNA Magnetic Isolation Module[纽英伦生物技术(北京)有限公司]从总RNA中富集提取poly(A) mRNA,将poly(A) mRNA片段化。这些中断的片段被用作第一链和第二链cDNA 合成的模板。然后对得到的cDNA进行末端修复、磷酸化和连接到测序接头;通过PCR扩增合适的产物以构建cDNA文库。最后,使用Illumina HiSeqTM2500对12个纯化的文库进行高通量测序。
1.3.2.2 高通量测序RNA-Seq读取映射和功能注释 进行RNA-Seq分析后,通过修剪接头并去除低质量的原始序列以获得高质量的读数序列。使用HISAT2软件将读数映射到鸡爪槭参考基因组(GCA_001876935.1,Acerpalmatum2017)。使用StringTie软件对映射的读数进行组装和定量分析,作为每千个碱基的转录每百万个片段映射(FPKM)值。来自参考基因组的原始基因的非翻译区(UTR),在连续映射读取的基础下,扩展到上游和下游以合成和优化基因结构[15]。此外,通过比较基因组的原始注释信息,进行一一对比找到以前未注释的转录区域(即过滤长度大于50个氨基酸的短多肽产物和单个外显子区域后的新基因)。对于新基因,对潜在的新转录本进行功能注释,即将测序得到的转录本与公开可用的蛋白质数据库(Nr、Swiss-Prot、GO、COGs、KOG、Pfam、egg-NOG和KEGG)进行比对,使用BLASTx算法获取对比值。
1.3.2.3 差异表达基因(DEGs)分析 每个基因的表达水平由每千个碱基外显子每百万个片段映射值决定。使用DESeq软件进行成对比较中的差异表达基因分析。通过计算所有基因的错误发现率(FDR)和倍数变化对数(log2C)。结合GO注释结果进行功能描述,接着对DEGs进行KEGG Pathway富集分析,结合KEGG注释结果获取差异基因相关的生化代谢途径及生物信号转导途径。当转录本符合FDR≤0.01和log2C的绝对值≥1 时,认为该转录本存在功能富集。转录组测序委托上海美吉生物医药科技有限公司完成。
1.3.3 实时定量PCR验证差异基因准确性 将保存于-80 ℃的叶片样品快速研磨,采用转基因Ⅱ一体化引物试剂盒TransScript Ⅱ All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(北京全式金生物技术股份有限公司)提取样本总RNA,并将总RNA转化为单链cRNA。采用Primer Premier 5.0软件设计基因特异性引物(表1)。使用TransStart Top Green qPCR SuperMix(北京全式金生物技术股份有限公司)进行实时荧光定量PCR(qRT-PCR),并在Bio-Rad CFX96实时PCR检测系统(Bio-Rad,USA)上1式3份进行PCR定量复孔检测。
每个反应包含10 μL 2×TransStart Top Green qPCR SuperMix、2.0 μL cDNA样本、0.4 μL基因特异性引物、7.6 μL ddH2O,最终体积为20 μL。利用比较的方法计算每个样本的mRNA与内参基因AcerPM1的相对表达量,以2-ΔΔCT表示[16]。最后,通过 qRT-PCR和RNA-Seq分析比较SS、AS处理中基因表达的变化趋势,以评估测序结果是否可靠。基因验证委托上海美吉生物医药科技有限公司完成。

表1 qRT-PCR 引物序列信息
1.4 数据处理与统计分析
采用Excel 2013进行初步数据整理,采用SPSS 23.0软件中的单因素方差分析进行统计检测分析(α=0.05),所有图形均采用Origin 8、R语言软件绘制。
2 结果与分析
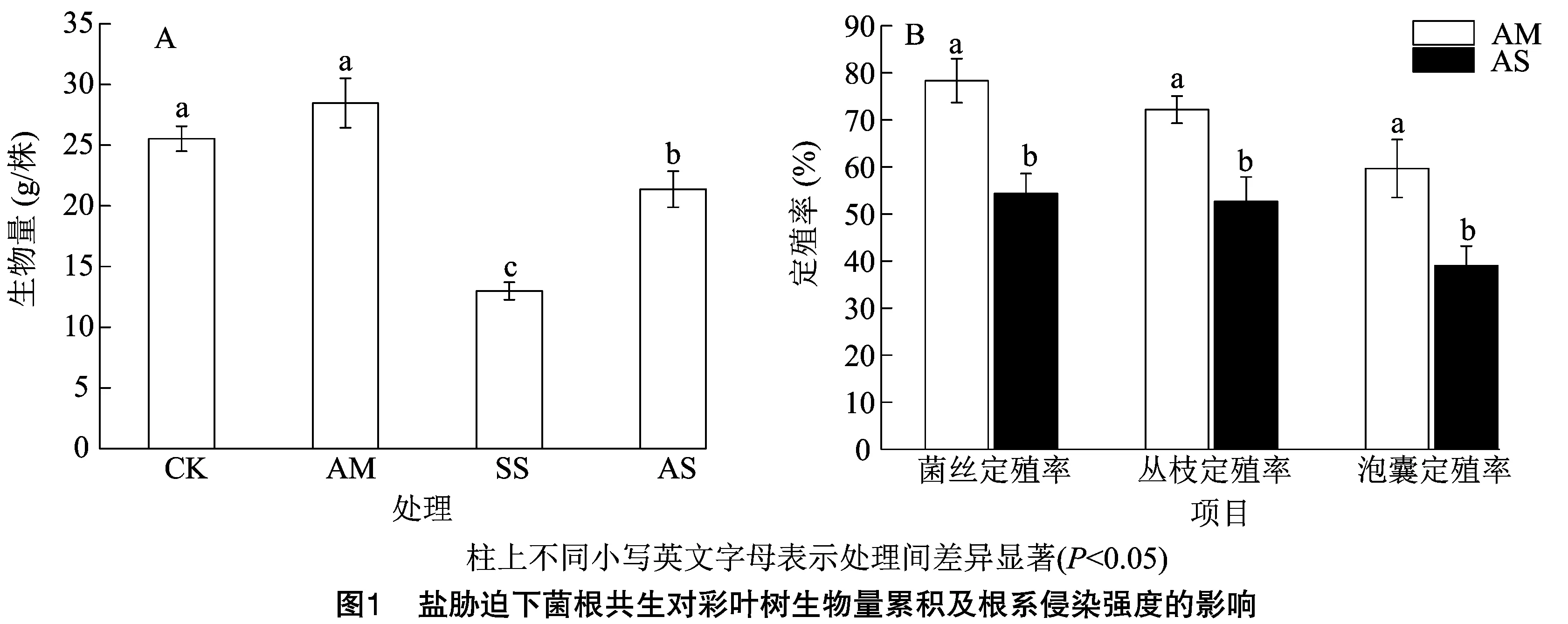
2.1 盐胁迫下菌根共生对彩叶树生物量累积及根系侵染强度的影响
由图1-A可知,在生物量中,以AM处理生物量累积最高,SS处理生物量累积最低,各处理表现为AM>CK>AS>SS,其中AM与CK处理无显著差异,二者皆显著大于SS和AS处理,且SS处理显著小于AS处理;与SS处理相比,CK、AM、AS处理分别显著提高104.31%、119.17%、64.51%。由图1-B可知,在没有接种AM真菌的处理中没有定殖情况,因此未列出;接种丛枝菌根真菌情况下,整体表现为菌丝定殖率大于丛枝定殖率,且以泡囊定殖率最低。在AM处理中,菌丝、丛枝及泡囊的定殖率分别为78.33%、72.16%、59.67%,盐处理(AS)下,菌丝、丛枝及泡囊的定殖率分别为54.33%、52.67%及39.05%;且在任一定殖率指标中,皆以AM处理显著大于AS处理。
2.2 盐胁迫及菌根共生下彩叶树转录本的原始数据分析
为了全面了解AM真菌对盐胁迫下彩叶树叶片转录组的影响,基于高通量RNA-Seq建立了12个cDNA文库。去除低质量读段、不确定碱基、过短序列以及可能污染的序列后,总共获得了高质量序列数20 600 209~29 151 214,高质量碱基数 6 159 570 306~8 818 959 652,其中Q30>93.58%,鸟嘌呤和胞嘧啶(GC)所占的比例为47.58%~48.71%。此外,注释比例表明映射到鸡爪槭基因组(GCA_001876935.1,Acerpalmatum2017)的读数比例皆较高,为81.54%~83.81%(表2)。上述结果表明该RNA-Seq测序的12组cDNA文库可用作进一步分析的测序数据。
2.3 盐胁迫及菌根共生下彩叶树原始转录本的功能注释及分类
根据RNA-Seq测序结果,基于与参比基因组(GCA_001876935.1,Acerpalmatum2017)进行对比总共鉴定出6 019个原始转录本,且都均匀分布在染色体上。功能注释见图2,在上述数据库中总共注释得到4 672个新基因。可注释到COG、GO、KEGG、KOGPfam、Swiss-Prot、egg-NOG及Nr的新基因数分别为626、1751、1181、1920、1 660、2 190、3 057 及4 644个,分别占总的新基因数的13.40%、37.48%、25.28%、41.10%、35.53%、46.88%、65.43%及99.40%。
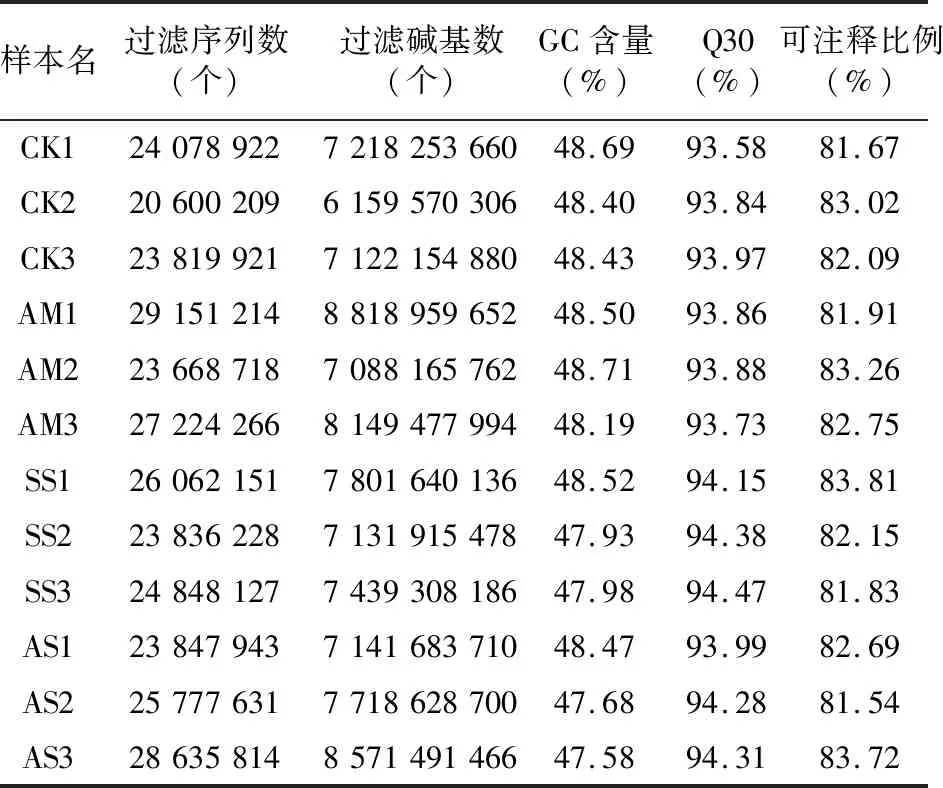
表2 盐胁迫下菌根共生下彩叶树转录本的原始数据分析

2.4 盐胁迫及菌根共生下彩叶树转录本的差异基因(DEGs)分析
由图3-A可知,当进行盐胁迫处理且无论接种丛枝菌根与否的对比组中(AM/SS、CK/SS),差异基因的下调数量整体上是上调数量的2倍。对于接种AM真菌处理中,在没有和有盐胁迫对比下(CK/AM、SS/AS),上调的DEGs数量则几乎是下调的DEGs数量的2 倍。这些结果表明,鸡爪槭中更多的DEGs响应于盐胁迫而发生下调,而更多的DEGs响应于接种AM真菌而上调。有趣的是,本研究发现41个基因在比较CK/SS处理时下调,但在比较SS/AS处理时却上调。此外,在比较SS/AS处理时,有286个基因上调,但在比较CK/SS处理时,这些基因的表达水平没有差异。因此,可以推断具有这些表达特征的DEGs可能是盐胁迫条件下响应菌根共生的关键基因。
为了进一步探索来自4个不同比较处理的DEGs之间的关系,构建了不同比较处理间DEGs的Venn图。由图3-B可知,仅在接种与不接种AM真菌条件下(CK/SS、AM/AS),共有798个DEGs,其中未接种的植物特有1 630个DEGs。这些结果表明,在接种和未接种AM真菌的植物对盐胁迫的分子反应存在明显差异。此外,为了识别盐胁迫下AM真菌特异性调控的DEGs,SS/AS与CK/AM仅共有1个共同DEGs,这表明大多数DEGs在SS和AS处理的比较可能与AM真菌调节的盐胁迫有关。因此SS/AS中的这些DEGs(455个)可用于后续基因功能表征以分析由AM真菌诱导耐盐性的可能分子机制。

2.5 盐胁迫及菌根共生下彩叶树差异基因(DEGs)的功能注释
2.5.1 盐胁迫及菌根共生下彩叶树DEGs的GO功能注释与分类 为了解释AM真菌在盐度胁迫中的改善机制,研究了在SS/AS比较中的455个DEGs的特征。对于GO分析,455个DEGs中有247个被分配到至少1个GO分类中,其主要涉及生物过程、分子功能和细胞成分(图4);DEGs显著富集(KS值≤0.05)在32个过程中产生富集(表3)。这些富集的GO term在盐度胁迫的适应性反应中的生物过程高度相关,包括蛋白质生物合成相关过程(GO:0006383、GO:0006452、GO:0006449、GO:0045901、GO:0045905、GO:0006414和GO:0006415)、ATP生物合成过程(GO:0006754)、蛋白质谷胱甘肽化(GO:0010731)、细胞分化调控(GO:0045595)、氮同化相关过程(GO:0010167、GO:0009309、GO:0009084)、呼吸电子传递链(GO:0022904)以及类胡萝卜素代谢过程(GO:0043288)。
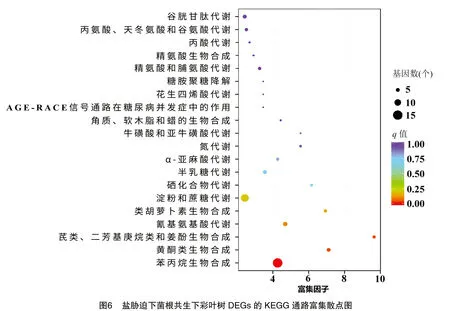
2.5.2 盐胁迫及菌根共生下彩叶树DEGs的KEGG功能注释与富集分析 基于京都基因与基因组百科全书(KEGG)分析中,455个DEGs中有98个被分配了KEGG ID并被分类为58个途径(图5)。在图6中突出显示了前 20 条富集途径(基于q值),其中,DEGs显著(q值≤0.05)富集在与次级代谢物生物合成相关的3条途径中,包括苯丙烷、黄酮类、二苯乙烯类、二芳基庚烷类和姜酚的通路代谢(图5、图6),这些通路可能与耐盐性有关。
2.6 盐胁迫及菌根共生下彩叶树DEGs的qRT-PCR验证
为了验证RNA-Seq数据的可靠性,在SS/AS的455个DEGs中随机挑选了6个DEGs进行qRT-PCR分析。通过qRT-PCR分析发现,Gene23660、Gene26140、New_Gene4379、Gene20176、Gene20188、New_Gene23129的log2FC值分别为9.66、3.26、3.39、2.71、4.64、2.54(图7),这6个基因的表达趋势与转录本的RNA-Seq分析结果高度一致。这些结果表明DEGs分析是准确可靠的。

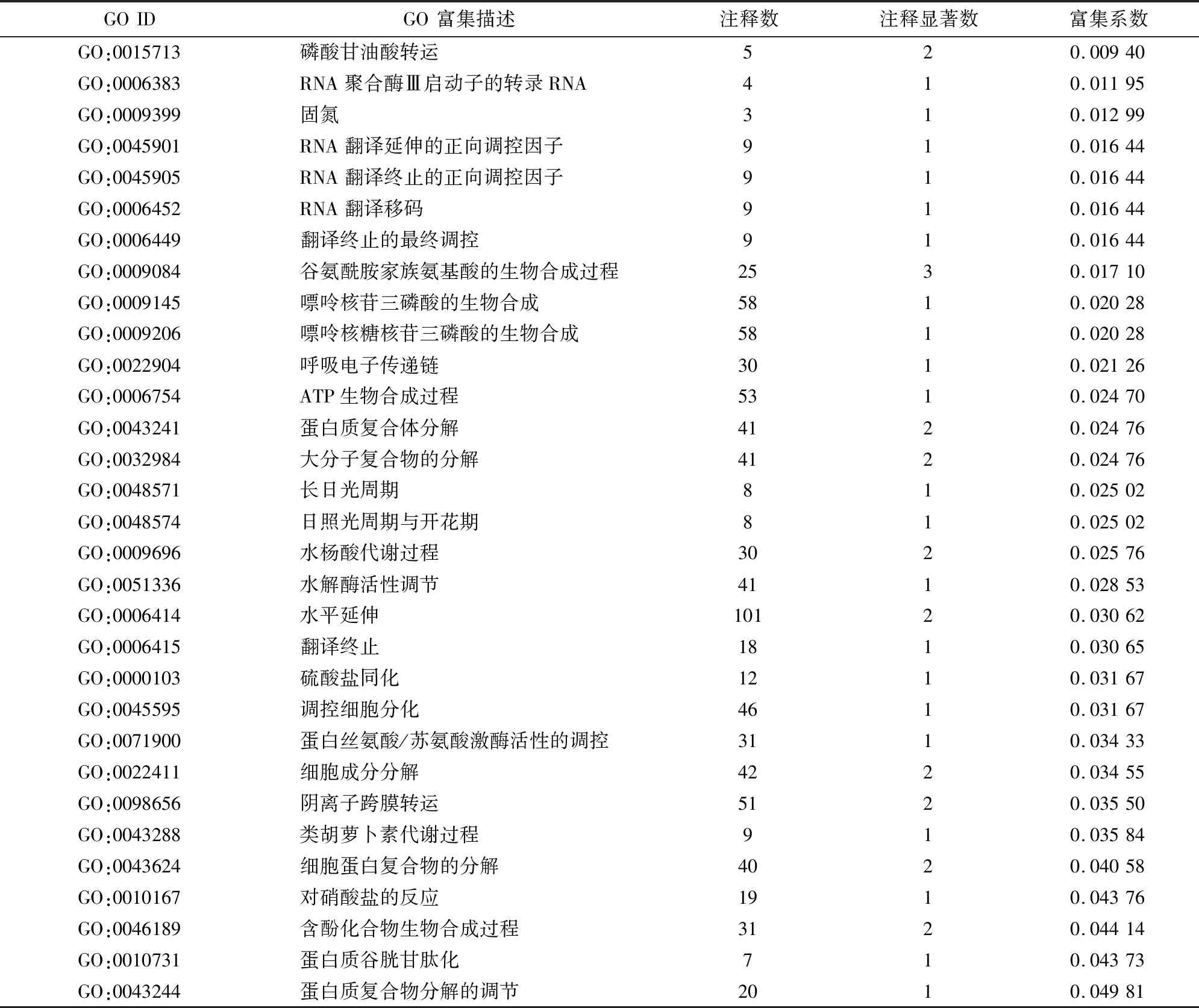
表3 盐胁迫下菌根共生下彩叶树DEGs的GO分类

3 讨论与结论
丛枝菌根真菌在土壤中广泛存在,是重要的功能性微生物组成部分[7]。关于AM真菌改善盐胁迫的研究已经在烟草、黄瓜、玉米以及小麦等多种植物中得到证实[17-19]。为了更好地了解AM真菌对植物耐盐性的潜在分子机制,在盐胁迫下给彩叶树鸡爪槭接种AM真菌,并进行比较转录组分析,建立了12个测序文库,确定了6 019个潜在基因,注释得到4 672个新基因。此外,在盐胁迫条件下由AM真菌诱导的455个差异基因显著富集在几个GO和KEGG通路中,这些通路涉及耐盐机制,包括植物细胞内部环境的改善、氮代谢相关过程以及可能的光保护机制。这些途径进一步证实AM真菌可调控离子渗透和氧化应激的影响,并改善盐度胁迫下的氮代谢和光保护机制。
3.1 盐胁迫下菌根共生涉及的细胞改善作用
首先,在盐胁迫条件下,抗氧化酶的分泌与非酶化合物的合成在清除过量ROS以维持氧化平衡和减少非生物胁迫对细胞中的影响方面起着重要作用,如过氧化物酶(POD)、谷胱甘肽过氧化物酶(GPX)、单脱氢抗坏血酸还原酶(MDHAR)、腺苷高半胱氨酸酶(AHCY)、谷胱甘S-转移酶(GST)、抗坏血酸(AsA)、谷胱甘肽(GSH)和硫氧还蛋白(TRX)等[18,20-22]。本研究发现,许多编码POD、GST、MDHAR、AHCY和TRX的DEGs发生上调表达并参与了多种抗氧化系统,包括抗坏血酸-GSH循环和过氧还蛋白/硫氧还蛋白(PrxR/Trx)途径。

前人研究表明,AM真菌可通过调节脯氨酸代谢酶活性从而改变叶脯氨酸代谢,这对调控宿主渗透压至关重要[23]。本研究发现,2个编码K+通道的基因上调AKT基因的表达,这些基因参与K+在叶部中的易位[2,24]。敏感系统信号通路通过调节质膜和液泡中的Na+转运在离子稳态中发挥重要作用,这涉及胞质Ca2+信号运输、质膜和液泡Na+/H+逆向调节以及H+-ATPase建立的H+梯度驱动过程等[25]。本研究中,参与SOS途径的相关基因发生上调,包括编码Ca2+结合蛋白(SOS3)和CBL基因家族相互作用蛋白激酶(SOS2)的DEGs。此外,CK/SS比较中发现编码V型H+转运三磷酸腺苷(ATP)酶的基因表达水平增加,编码质膜ATP酶的基因在SS/AS中也发生上调,这对于在液泡膜和质膜上建立电化学H+梯度至关重要。这表明接种AM真菌通过在更全面、更平衡的渗透调控网络中调整过量Na+传输来促进离子稳态。此外,过量的Na+通常会导致盐度胁迫下糖生植物中K+缺乏,因此,AKT基因的上调表达也可能在植物细胞中保持较高的K+/Na+发挥作用,从而适应盐胁迫[26]。
3.2 盐胁迫下菌根共生对氮代谢相关过程的调控作用
氮(N)是限制植物生长和发育的常量营养素,研究表明氮吸收、运输、还原和同化以及氨基酸代谢等代谢过程都受到盐度胁迫的影响[27]。就植物对盐渍土的适应而言,增强N代谢可能是AM真菌改善宿主发育的重要功能之一[17]。谷氨酰胺合成酶(GS)、谷氨酸脱氢酶(GDH)和谷氨酸合成酶(GOGAT)是参与N同化的关键酶[28]。在本研究中,编码GS和GDH的DEGs在盐度胁迫下发生下调表达;接种AM真菌后,编码GS、GDH和GOGAT以及NRT1/PTR家族中编码蛋白质的DEGs表达发生上调。这表明彩叶树鸡爪槭的耐盐性增强可能与接种AM真菌提高N代谢效率有关。一些研究表明,AM真菌还会导致编码与次级代谢相关的酶的基因表达水平增加,例如酚类化合物、黄酮类化合物和木质素的代谢,这些次级代谢涉及抗氧化、防御系统和耐盐调控[29]。本研究发现,455个已鉴定的DEGs在参与次级代谢产物生物合成的苯丙烷、黄酮类、二苯乙烯类、二芳基庚烷类和姜酚的等生物途径中存在显著富集,这与前人的研究结果[29]基本一致。这些结果表明,接种AM真菌可激活氮素相关次级代谢基因从而可能在增强耐盐性中起重要作用。
3.3 盐胁迫下菌根共生可能涉及的光保护机制
光合作用是受盐胁迫影响的主要过程之一,可能会导致过多的光消耗,从而导致光抑制甚至光损伤[30]。然而,植物已经进化出多种机制来保护自己免受光损伤,包括通过平衡光能的吸收和利用以及细胞环境的修复来避免光抑制[2]。本研究中,结合转录组数据结果,在盐胁迫下彩叶树鸡爪槭可能通过下调编码光捕获叶绿素a、叶绿素b结合蛋白(LHCⅡ)基因的表达水平从而降低光抑制,叶绿素是植物体中最丰富的光收集器[31]。因为LHCⅡ从PSⅡ迁移到PSⅠ的状态转变是由编码丝氨酸/苏氨酸蛋白激酶基因(STN7)的表达水平上调启动的,从而平衡光系统之间的激发能量分布[29]。
本研究中,另一个显著的变化是参与类胡萝卜素代谢过程(GO:0043288)的DEGs水平发生了改变,类胡萝卜素具有ROS清除、光保护和膜稳定性功能,类胡萝卜素代谢DEGs上调可有助于提高耐盐性[32]。光反应中,多余的光能可以从叶绿体输出并通过线粒体呼吸链消散[33],这涉及替代呼吸途径能量守恒电子传递(ETC)途径的重要旁路,该途径涉及Ⅱ型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)脱氢酶(NDs)和抗氰化物替代氧化酶(AOX)[27-28],从而在光保护中起着关键作用。本研究中,在盐胁迫下编码AOX的基因被下调,同时随着接种AM真菌编码NDB2(一种Ⅱ型NDs)的基因被上调。这些结果表明,接种AM真菌的彩叶树鸡爪槭采用多种策略来保护自己免受光损伤从而克服盐胁迫。
综上,本研究中,基于彩叶树鸡爪槭基因组分析总共鉴定出6 019个原始转录本,通过注释到COG、GO、KEGG、KOGPfam、Swiss-Prot、egg-NOG及Nr的新基因数共得到4 672个新基因,并在盐胁迫处理(SS)和盐胁迫下AM真菌接种处理(AS)的比较转录中鉴定了455个差异基因。进一步研究表明,在455个DEGs中,一些被鉴定为耐盐基因,因为它们参与植物细胞内部环境的改善、氮代谢相关过程和可能的光保护机制。本研究为后续研究功能分析的耐盐候选基因提供了理论依据。
