中药多糖防治阿尔茨海默病作用机制的研究进展
2022-12-08周妍妍
张 健,李 全,周妍妍
中药多糖防治阿尔茨海默病作用机制的研究进展
张 健,李 全*,周妍妍*
黑龙江中医药大学,黑龙江 哈尔滨 150040
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的神经退行性疾病,已成为严重威胁老年人身心健康的重要疾病之一,中药因其多靶点、多途径以及性质稳定等特点被广泛应用于治疗AD的实验研究。大量研究表明中药多糖在防治AD中起着重要作用。主要综述了防治AD的中药多糖来源、作用途径,中药多糖防治AD的作用机制(抑制β-淀粉样蛋白生成、降低Tau磷酸化水平、抑制氧化应激、抑制神经炎症、抑制细胞凋亡、调节自噬、改善能量代谢等),旨在为中药多糖类成分防治AD的临床药物开发提供参考和依据。
中药多糖;阿尔茨海默病;β-淀粉样蛋白;Tau磷酸化;氧化应激;神经炎症;细胞凋亡;自噬;能量代谢
阿尔茨海默病(Alzheimer’s disease,AD)又称老年性痴呆,是一种常见的神经退行性疾病,其发病假说主要包括β-淀粉样蛋白(amyloid β-protein,Aβ)级联假说、Tau蛋白过度磷酸化假说以及胆碱能假说等[1]。然而脑内Aβ沉积作为AD的标志性病理改变和中心环节不仅能介导Tau蛋白过度磷酸化和胆碱能系统失衡,还可引发氧化应激、神经炎症、细胞凋亡、线粒体及突触功能障碍等一系列级联反应[2-8]。但迄今为止,只有胆碱酯酶抑制剂和-甲基-天冬氨酸拮抗剂2类药物被批准用于治疗AD,并且这些药物的作用是控制症状而不是改变疾病的进程[9-11]。
多糖是一种重要的生物大分子,由20余个单糖分子脱水缩合而成,并由糖苷键连接而成的高分子碳水化合物。多糖类成分广泛分布于动物及植物中,在动物体内主要以糖原的形式存在,而在植物细胞中可分为胞内多糖和胞外多糖2类,主要以纤维素、肽聚糖和淀粉的形式存在[12-15]。多糖具有抗病毒、抗炎、抗氧化、抗肿瘤及调节免疫系统等多种生物活性且使用安全、不良反应少,被认为是食品和药品开发与利用的理想原材料[16-20]。
据2021年《中国阿尔茨海默病报告》表明,截至2019年底我国现存AD患者超过1000万,并呈现高患病率和高死亡率的“双高”特点[21]。因此,AD已经成为严重威胁老年人身心健康的重要疾病之一,逐渐成为社会无法回避的问题。前期大量学者围绕AD的各种假说机制进行深入研究,尽管已经研制出几类靶向治疗AD的化学药物,但其作用效果不甚理想,还常伴有不同程度的不良反应。中药因其多靶点、多途径以及性质稳定等特点已被广泛应用于治疗AD的实验研究,特别是具有多重活性作用的多糖类成分。因此,本文旨在对防治AD的中药多糖来源、作用途径,中药多糖类成分防治AD的作用机制(抑制Aβ生成、降低Tau磷酸化水平、抑制氧化应激、抑制神经炎症、抑制细胞凋亡、调节自噬、改善能量代谢等)进行综述,以期为防治AD的中药多糖类成分开发提供帮助。
1 中药多糖来源
由于多糖类成分通常与其他成分共存,因此其提取、纯化以及分析的方法较为复杂。常见的提取多糖方法主要有热水提取、酶辅助、微波辅助、超声辅助和超临界流体萃取等[22-24];多糖纯化的常用方法包括沉淀法、凝胶色谱法、阴离子交换色谱法、大孔树脂柱色谱法、超滤法等[25-26];多糖分离的技术主要为色谱方法与其他结构分析技术结合使用[27-29]。近10年防治AD的中药多糖类成分大多来源于药用植物如党参(Franch.) Nannf.、黄芪(Fisch.) Bge. var.(Bge.) Hsiao、当归(Oliv.) Diels、肉苁蓉Y. C. Ma、山茱萸Sieb. et Zucc.、枸杞L.、五味子(Turcz.) Baill.以及菌类植物如灵芝(Leyss. ex Fr.)、香菇(Berk.) Sing、猴头菇(Bull.) Pers.、蜜环菌(Vahl) P. Kumm.、阿里红(Vill. ex Fr.) Ames等,但来源于药用动物部位却极少。2013—2017年、2018—2022年防治AD不同来源中药多糖的使用频次见图1、2。此外,提取自海洋产物海藻、螺旋藻的中药多糖防治AD亦是当下的研究热点之一。这些中药多糖主要由葡萄糖、甘露糖、半乳糖、鼠李糖、阿拉伯糖、木糖、岩藻糖、半乳糖醛酸和葡萄糖醛酸等3~10个单糖构成,并且这些中药多糖的构成既有中性糖又有酸性糖,见表1。
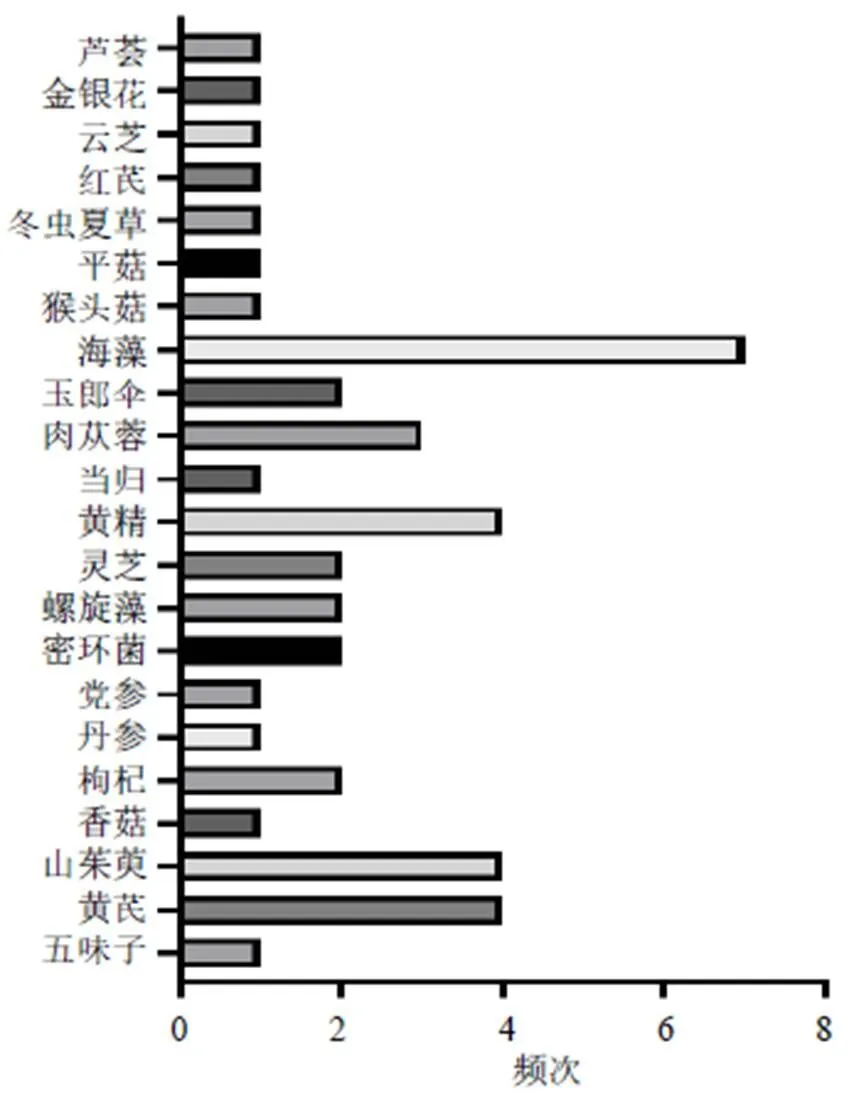
图1 2013—2017年防治AD不同来源中药多糖的使用频次
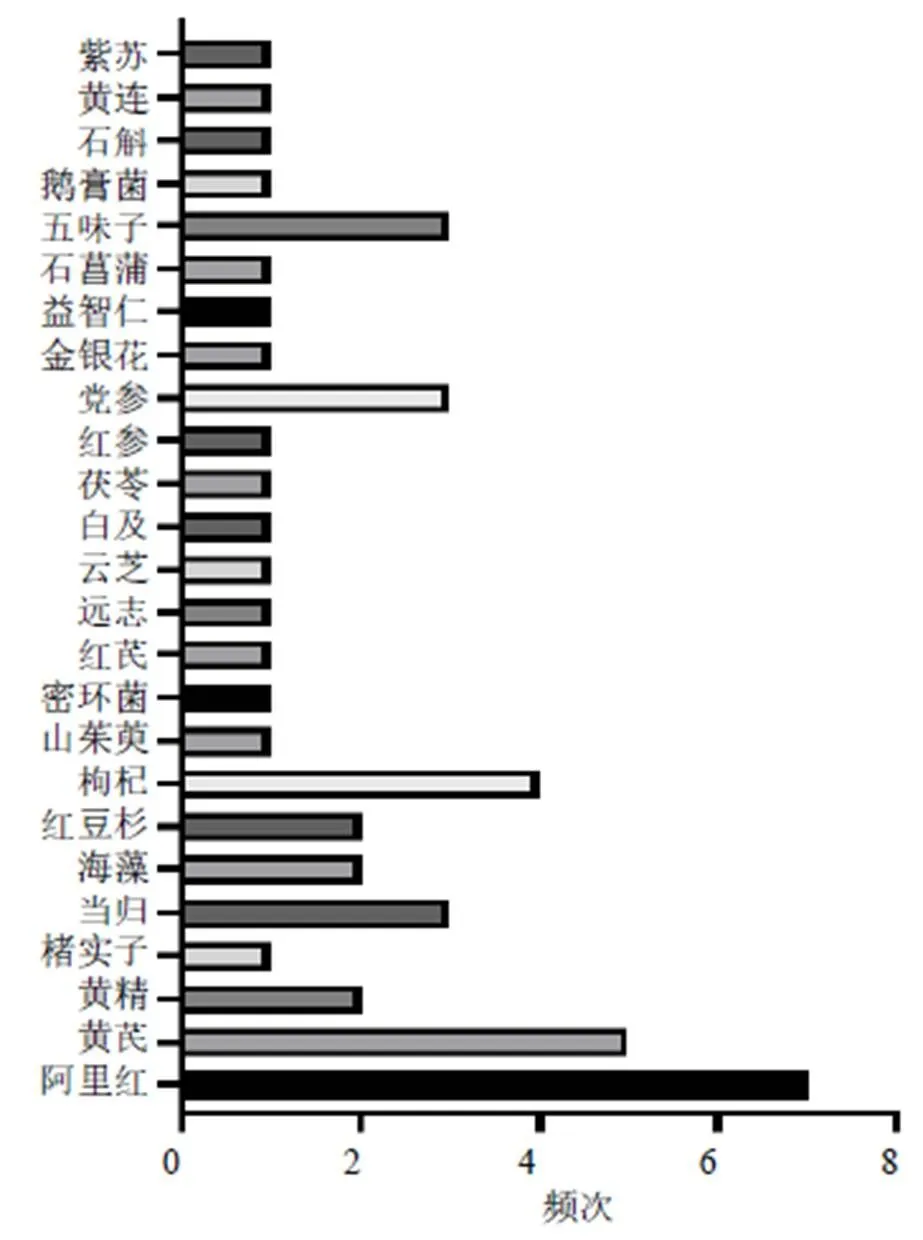
图2 2018—2022年防治AD不同来源中药多糖的使用频次
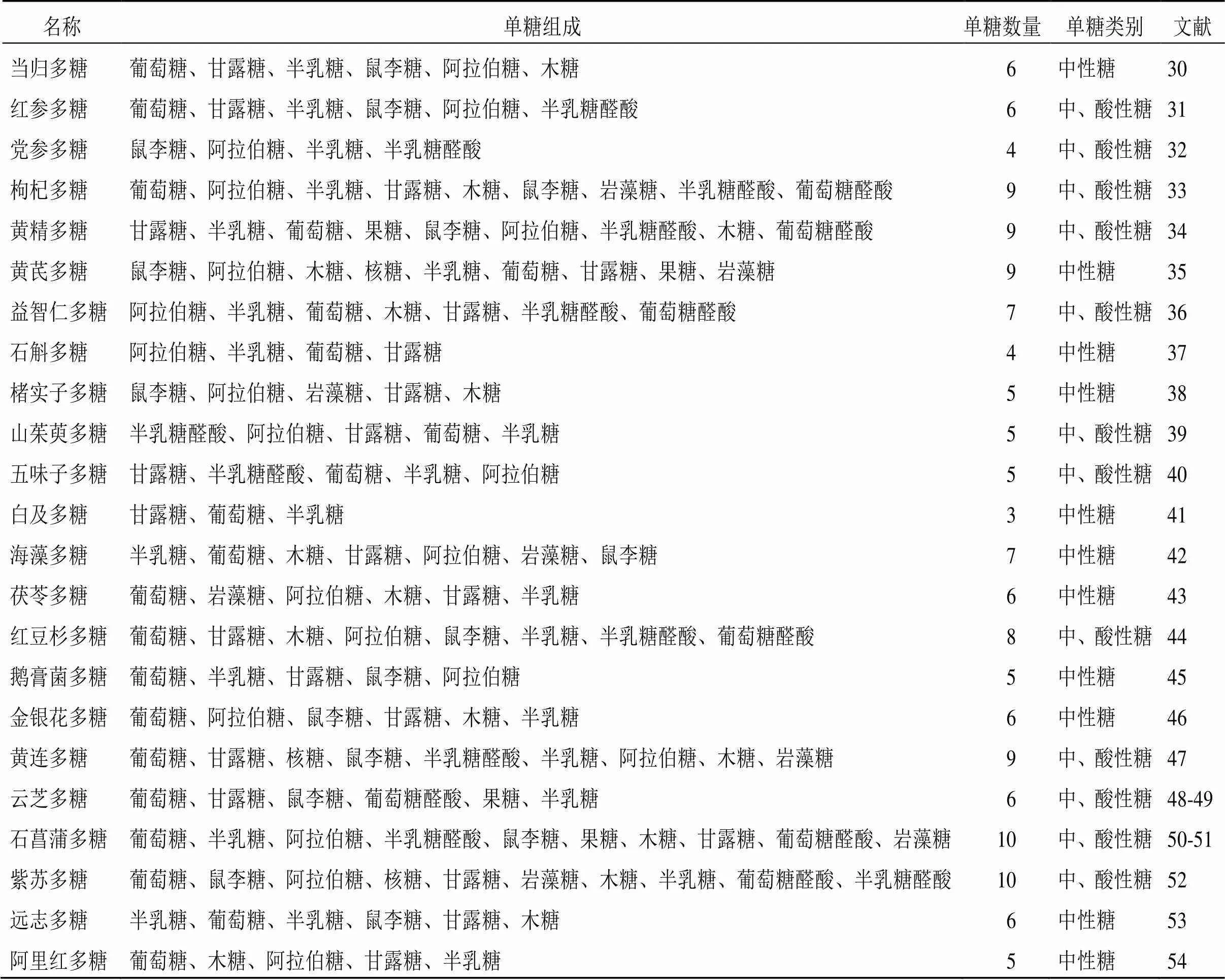
表1 防治AD的中药多糖的单糖组成
2 防治AD的中药多糖作用途径
由于AD病变部位在大脑,使得大多数小分子和大分子药物进入脑内受到诸多因素的限制,其中药物跨血脑屏障的无效运输是最大的障碍。中药多糖的相对分子质量大多在1000以上,但血脑屏障仅允许相对分子质量小于500的脂溶性物质通过被动扩散进入脑内[55]。目前,使药物通过血脑屏障进入脑内主要有2种途径:(1)与血脑屏障上的转运体特异性结合,中药多糖等大分子物质通过载体介导的转运蛋白(如ABC转运蛋白、葡萄糖转运蛋白)、受体或吸附介导的胞吞作用(细胞穿透肽、转铁蛋白受体、胰岛素受体、低密度脂蛋白受体)通过血脑屏障进入大脑;(2)通过改变给药方式使药物进入脑内,主要有高渗透压溶液暂时打开紧密连接、脑内注射或导管引导药物注射等侵入性方法,然而侵入性方法存在感染风险,因此通常优先选择通过iv或鼻内给药、聚焦超声暂时打开血脑屏障等非侵入性方法进行给药[56]。此外,在AD中Aβ沉积可破坏血脑屏障的完整性和通透性,使中药多糖等大分子物质有机会进入脑内完成药物递送并达到治疗作用。
3 中药多糖防治AD的作用机制
3.1 抑制Aβ沉积
Aβ沉积形成的斑块是AD标志性病理改变,抑制Aβ在脑内沉积主要有减少Aβ生成、加快Aβ清除与转运[57]。Aβ是由α、β、γ 3种分泌酶对淀粉样前体蛋白(amyloid precursor protein,APP)的切割所形成,其中α-分泌酶剪切APP使C末端片段(-terminal fragment,CTF)83保留在膜中并由γ-分泌酶进一步切割,进而释放易于水解的Aβ肽段,β-分泌酶剪切APP使CTF 99保留在膜中并由γ-分泌酶进一步切割形成难以水解且具有一定神经毒性作用的Aβ肽段[58]。Aβ的清除主要依靠小胶质细胞的吞噬以及脑啡肽酶、胰岛素降解酶的清除作用。β-分泌酶的标志性蛋白为β-位点淀粉样前体蛋白裂解酶1(β-site amyloid precursor protein cleaving enzyme 1,BACE1),γ-分泌酶的标志性蛋白为早老蛋白1(presenilin1,PS1),因此抑制Aβ在脑内沉积可通过降低BACE1、PS1的表达并促进脑啡肽酶和胰岛素降解酶的分泌而实现。
党参多糖能显著减少APP/PS1小鼠海马区BACE1的表达和Aβ40、Aβ42的生成,并在转染APP的小鼠脑神经瘤N2a细胞和人胚肾HEK293细胞实验中验证了这一作用[59]。Li等[60]使用纤维素阴离子交换柱纯化提取鹅膏菌多糖,发现鹅膏菌多糖可降低-半乳糖和AlCl3诱导的AD大鼠脑内BACE1的表达。此外,采用低温结合真空系统提取的白芨多糖也可减少AlCl3诱导的AD模型大鼠海马区BACE1的表达[61]。铁皮石斛多糖可促进快速老化小鼠海马组织内脑啡肽酶、胰岛素降解酶的分泌进而达到抑制Aβ42的表达[62]。Chen等[63]采用APP/PS1小鼠以及单核细胞为研究对象,探讨云芝多糖对Aβ的抑制作用,给药后APP/PS1小鼠海马区Aβ斑块明显减少,神经细胞数量增多,并增强了单核细胞对Aβ的摄取能力。阿里红多糖可显著降低APP/PS1小鼠海马区糖原合酶激酶-3α(glycogen synthase kinase-3α,GSK-3α)、APP及PS1蛋白水平并改善其空间记忆能力,提示阿里红多糖可抑制Aβ的生成,减少其在脑内的聚集[64]。海藻多糖虽然可呈剂量相关性抑制APP23转基因小鼠脑内的APP、CTF蛋白表达并减少Aβ40、Aβ42的表达,但对AD HAW、20E2模型细胞内的BACE1、PS1的表达水平无统计学意义[65]。Luo等[66]以5xFAD小鼠作为AD模型探讨黄精多糖抑制Aβ的作用机制。结果显示黄精多糖能增强5xFAD小鼠海马组织内小胶质细胞对Aβ斑块的吞噬作用,显著降低Aβ40、Aβ42的表达并改善小鼠记忆认知功能。
3.2 抑制Tau蛋白磷酸化
Tau属于微管相关蛋白家族,Tau的翻译修饰主要以磷酸化为主,正常磷酸化Tau蛋白具有稳定神经元细胞骨架、促进微管结合与组装以及轴突运输的生理功能[67]。但在AD中聚集的Aβ通过GSK-3α、GSK-3β和细胞周期蛋白依赖性激酶5(cyclin dependent kinase 5,CDK5)的活性来诱导Tau过度磷酸化,使其失去支撑细胞骨架作用,形成神经纤维缠结并导致突触功能障碍[68],因此抑制Tau过磷酸化是实现防治AD的重要途径之一。
Zhang等[69]采用HEK293/Tau细胞模型,探讨党参多糖对Tau蛋白过度磷酸化的抑制作用,发现党参多糖能够提高及HEK293/Tau细胞的存活率,在升高蛋白磷酸酶2A活性的同时降低Tau在Ser199、202和Thr205、Thr231位点的磷酸化水平。李珍等[70]研究发现阿里红多糖可升高APP/PS1小鼠海马内蛋白激酶B(protein kinase B,Akt)表达,并抑制GSK-3β、Tau表达,表明阿里红多糖可能通过抑制GSK-3β介导的Tau过度磷化从而发挥拮抗AD的作用。此外,山茱萸多糖可降低AD模型大鼠及APP/PS1小鼠海马组织内GSK-3β和磷酸化Tau的表达水平,提高其学习记忆能力[71]。
3.3 抑制氧化应激
氧化应激是指由于氧自由基产生超过抗氧化剂清除能力范围所形成失衡状态。而在AD中,沉积于脑内的Aβ可促进丙二醛、过氧化氢等活性氧物质的释放,导致线粒体膜电位下降、金属稳态失衡以及突触功能紊乱,最终导致认知功能障碍的发生,而超氧化物歧化酶(superoxide dismutase,SOD)、醌氧化还原酶1(quinone oxidoreductase 1,NQO1)、以及血红素加氧酶-1(heme oxygenase-1,HO-1)等抗氧化酶体可清除上述促氧化因子[72]。拮抗氧化应激损伤的另一个重要机制是核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)信号通路的激活,Nrf2通过与Kelch样环氧氯丙烷相关蛋白1(kelch like epichlorohydrin related protein 1,Keap1)结合对其进行负调控,并启动保守抗氧化反应元件子序列以激活细胞保护基因的转录[73]。
Qin等[74]研究发现黄芪多糖可通过激活Keap1/Nrf2通路,下调APP/PS1小鼠海马区Keap1、丙二醛的含量,显著上调Nrf2、SOD和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的表达,而在给予Nrf2抑制剂后,黄芪多糖对上述分子的调节作用被显著逆转,表明黄芪多糖可以激活Nrf2通路,改善AD小鼠的生理功能。此外,黄芪多糖还可激活Wnt/β-连环蛋白(β-catenin)信号通路降低促氧化酶体的表达水平,进而抑制氧化应激对神经元的损伤[75]。紫苏多糖同样可激活Nrf2信号通路提高小鼠海马神经元HT22细胞的活力,上调Nrf2、HO-1、SOD蛋白表达水平的同时抑制Keap1的活性[76]。此外,枸杞多糖[77]、阿里红多糖[78-80]也可活化Nrf2相关信号通路,降低活性氧、丙二醛等促氧化酶的表达水平进而发挥抗氧化作用。当归多糖可在下调促氧化酶体活性的同时促进抗氧化酶体的分泌,抑制氧化应激反应进而发挥防治AD的作用[81]。
3.4 抑制神经炎症
在中枢神经系统内胶质细胞的激活是发生免疫反应的核心,当小胶质细胞激活后可分泌各种促炎因子和趋化因子如白细胞介素-1β(interleukin-1β,IL-1β)、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),将更多的胶质细胞募集到炎症部位促进病原体的清除[82]。在AD中,小胶质细胞可识别并吞噬Aβ,但过多的Aβ生成和过度磷酸化的Tau会使这种免疫清除机制失调,这是由于Aβ本身刺激可触发小胶质细胞的极化,形成具有促炎作用的M1型小胶质细胞,并丧失清除Aβ的功能。除小胶质细胞外,脑内其他配体如Toll样受体(toll like receptor,TLR)、NOD样受体也可识别Aβ并激活先天免疫炎症小体[83]。值得注意的是,TLR2、4、6、9被认为是识别Aβ和触发免疫炎症的主要亚型,这些TLR的激活由白细胞分化抗原14(cluster of differentiation 14,CD14)、CD36受体调节,并激活髓样分子因子88(myeloid molecular factor 88,MyD88)信号通路的下游靶蛋白如核因子-κB(nuclear factor-κB,NF-κB)和干扰素调节因子的活化[84]。
石菖蒲多糖[85]、远志多糖[86]可通过降低脂多糖诱导的小胶质细胞中TLR4的活性,抑制MyD88/NF-κB通路的激活,下调其介导的促炎因子的表达水平。此外经远志多糖和TLR4抑制剂TAK242预处理的小胶质细胞并未受脂多糖的影响而显示出炎症因子的过表达,提示远志多糖抑制神经炎症的作用与TLR4介导的MyD88/NF-κB信号通路的调节有关。Shi等[87]研究发现益智仁多糖干预AD模型小鼠后,其脑内一氧化氮、前列腺素E2、TNF-α、IL-1β等炎症因子表达显著下降,并在脂多糖诱导的小胶质细胞中验证了这一作用机制。五味子多糖可下调AD模型小鼠海马区小胶质细胞标志物、TNF-α、IL-1β、IL-6等炎症因子表达,降低丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号分子磷酸化水平;为进一步验证五味子多糖抗神经炎症作用,以脂多糖诱导的BV2细胞为研究对象发现五味子多糖能够通过抑制p38 MAPK/NF-κB信号通路,抑制M1型小胶质细胞的极化,提高低密度脂蛋白相关蛋白-1(low density lipoprotein associated protein-1,LRP-1)的表达水平进而发挥保护神经的作用[88-89]。铁皮石斛多糖同样可使BV2细胞从促炎表型转变为抗炎表型,下调AD模型小鼠海马组织IL-1β、IL-6和TNF-α表达进而抑制炎症反应[90]。
3.5 抑制细胞凋亡
凋亡作为细胞的一种程序性死亡,具有维持细胞群稳态、免疫防御的作用,通常在组织细胞受损、营养缺乏等条件下发生[91]。但在AD中,由于Aβ级联反应引起的氧化、炎症损伤使线粒体功能障碍,导致神经细胞大量凋亡,最终使记忆认知水平的急剧下降。凋亡发生的步骤主要包括线粒体去极化和透化、细胞色素C(cytochrome C,Cyt C)的释放、半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)的激活、B淋巴细胞瘤-2(B lymphocyte tumor-2,Bcl-2)耗竭、凋亡相关蛋白Bax增多和Akt的失活。另外,抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt信号通路或激活MAPK、c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)通路同样可介导细胞凋亡的发生[92]。
紫苏多糖可通过激活PI3K/Akt信号通路,并抑制过氧化氢诱导的HT22细胞内MAPK/NF-κB信号通路的传导,进而下调Bax、Cyt C和Caspase-3、8、9的表达,提高腺苷二磷酸核糖聚合酶(poly ADP ribose polymerase,PARP)和Bcl-2的表达含量,这提示紫苏多糖可通过抑制细胞凋亡进而达到保护神经作用[93]。黄精多糖同样能够阻断AlCl3诱导形成的AD斑马鱼模型脑内p38 MAPK的磷酸化,上调-钙黏蛋白水平,减少凋亡细胞数量,提高其学习记忆能力[94]。Li等[95]以Aβ25-35处理后的肾上腺嗜铬细胞瘤PC12细胞探讨黄连多糖抗细胞凋亡机制,结果显示黄连多糖能够通过抑制JNK信号通路,降低Cyt C及Caspase-3的表达,提高Bcl-2/Bax值,减少细胞凋亡数量并改善线粒体功能。当归多糖可激活脑源性神经营养因子(brain derived neurotrophic factor,BDNF)/酪氨酸蛋白激酶B(tyrosine protein kinase B,TrkB)/环腺苷酸应答元件结合蛋白(cyclic adenylate response element binding protein,CREB)通路,提高Aβ25-35诱导的AD模型大鼠海马区Bcl-2/Bax的值,降低Caspase-3表达[96]。黄芪多糖可在下调Cyt C及Caspase-3、9表达的同时提高Bcl-2的含量,降低细胞凋亡数量,从而达到保护神经的作用[97-98]。Zhang等[99]采用-半乳糖与小胶质细胞共培养的方式建立AD体外模型,并探讨红豆杉多糖抑制细胞凋亡机制,结果显示,红豆杉多糖50 μg/mL能够显著提高Aβ诱导的BV2细胞Bcl-2/Bax值,降低Caspase-3的表达水平,这种变化在给予红豆杉多糖的AD模型小鼠体内得以验证。
3.6 调节自噬
自噬是清除受损蛋白质和细胞器的主要途径之一,它通过自噬囊泡将蛋白质聚集体和受损细胞器包裹并携带到溶酶体内降解来发挥作用[100]。自噬过程受自噬相关蛋白(autophagy related proteins,Atg)组成的多分子复合物级联调节,在生理条件下哺乳动物雷帕霉素(mammalian target of rapamycin,mTOR)通过抑制Unc-51样激酶(Unc-51-like kinase,ULK)复合物来阻碍自噬,但在能量缺乏时,mTOR被抑制而ULK复合物被激活从而触发自噬启动[101]。能量消耗会激活AMP活化蛋白激酶(AMP-activated protein kinase,AMPK),促进了ULK复合物的组装进而激活Atg14L复合物,促进自噬体和溶酶体融合。此外,磷酸化的PI3K可激活泛素样结合复合物(由Atg5、Atg12组成)以释放微管相关蛋白轻链3(microtubule associated protein light chain 3,LC3),介导自噬体的形成并引导它们与溶酶体的融合。而在AD中Aβ沉积和Tau蛋白过度磷酸化可导致溶酶体功能下降,阻碍了受损细胞器的降解而在胞体中积聚[102]。
黄芪多糖可促进APP/PS1小鼠海马组织自噬调控因子Beclin-1及溶酶体关联膜蛋白2(lysosome associated membrane protein 2,LAMP2)的表达,降低选择性自噬接头蛋白P62表达水平及LC3II/ LC3I值,提高自噬水平进而加快清除脑内错误折叠蛋白[64]。Wang等[103]以小鼠脑内注射脂多糖建立AD模型,探讨金银花多糖对细胞自噬的调节作用机制。结果显示,给药后AD模型小鼠的空间记忆能力显著提高,尼氏染色显示神经细胞丢失数量减少,呈剂量相关性提高Atg5、Beclin-1、脂质激酶Vps-34等蛋白表达的同时下调LC3II表达含量,表明金银花多糖可以促进自噬体的形成,发挥改善学习记忆功能的作用。红豆杉多糖可抑制PI3K/Akt/mTOR信号通路的激活,上调Aβ25-35诱导的AD模型大鼠海马区Beclin-1蛋白表达含量[104],枸杞多糖同样可抑制该通路并上调Aβ诱导HT22细胞Beclin-1及LC3I蛋白水平,降低p62、Akt及mTOR蛋白表达,逆转自噬抑制状态[105]。
3.7 改善能量代谢
线粒体被称为细胞“发电站”的细胞器,通过氧化磷酸化产生三磷酸腺苷(adenosine triphosphate,ATP)为大脑提供能量,在线粒体基质中发生的三羧酸循环,可还原氧化后的黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD),为细胞的生物学功能提供能量支持[106]。此外,过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)是线粒体供能的主要调节因子,被沉默信息调节因子3(silent information regulator 3,SIRT3)激活的PGC-1α可协调线粒体基因编码和蛋白质的转录,从而增加能量供给。但Aβ沉积和Tau蛋白过度磷酸化可破坏线粒体结构导致其合成能量受阻,造成能量代谢障碍,神经元分化受损最终促使AD发生。
Hu等[107]采用Aβ1-40诱导的PC12细胞建立AD模型,研究党参多糖改善能量代谢障碍的潜在机制。结果表明,党参多糖能通过调节CD38/NAD+信号通路,提高Aβ1-40诱导PC12细胞活力,显著上调SIRT1、SIRT3、PGC-1α、ATP、NAD+表达含量并减少活性氧、CD38的生成,这表明党参多糖可通过提高能量代谢水平进而发挥防治AD的作用。Shin等[108]发现红参多糖能改善Aβ诱导HT22细胞线粒体形态并提高线粒体呼吸率,促进神经元增殖,这提示红参多糖能够通过改善Aβ的沉积介导线粒体功能障碍达到防治AD的作用。此外,当归多糖还可通过抑制Aβ25-35诱导的AD模型大鼠海马区葡萄糖调节蛋白78(glucose regulatory protein 78,GRP78)、CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)的表达,抑制内质网应激进而改善线粒体能量代谢[109]。
3.8 其他
3.8.1 改善神经递质 乙酰胆碱的合成发生在胆碱能神经元的细胞质中,胆碱乙酰转移酶(choline acetyltransferase,ChAT)可催化胆碱和乙酰辅酶A合成乙酰胆碱[110]。当胆碱能神经元去极化时,突触小泡将乙酰胆碱释放到突触间隙中,随后被存在于突触间隙的乙酰胆碱酯酶(acetylcholinesterase,AChE)迅速灭活,转化为胆碱和乙酸盐[111]。在AD中,一方面Aβ的广泛聚集可导致神经元丢失使乙酰胆碱合成减少,另一方面AChE可与Aβ相互作用造成乙酰胆碱快速降解和胆碱能纤维的扭曲,最终促使认知功能障碍的发生。
姜倩倩等[112]采用DEAE52柱色谱法提取楮实子多糖,以Aβ25-35诱导人神经母细胞瘤SH-SY5Y细胞损伤,观察楮实子多糖神经保护作用,结果显示0.1 mol/LNaCl溶液洗脱得到的楮实子多糖能够显著抑制AD模型细胞内AChE的表达,提高细胞活力。五味子多糖[113]、茯苓多糖[114]可促进AD模型大鼠海马区乙酰胆碱、ChAT的分泌,降低AChE的表达,促神经递质分泌,改善AD的记忆认知功能障碍。
3.8.2 调节突触可塑性 突触可塑性是神经元连接强度的活动依赖性变化,反映大脑学习和记忆水平的改变[115]。线粒体对突触可塑性的调节至关重要,线粒体产生的ATP为突触前后区室的发育、膜电位的产生、突触小泡的募集和释放提供动力。长时程增强(long term enhancement,LTP)和长时程抑制(long term suppression,LTD)是反映突触可塑性变化的重要指标,同时也依赖于线粒体合成的能量供应以维持生物功能,而Aβ沉积可阻断线粒体氧化磷酸化即线粒体产生ATP的代谢途径,导致LTP减弱以及LTD的增强。
枸杞多糖可提高APP/PS1小鼠LTP,促进神经元核细胞增殖,进而改善其空间记忆及新物体识别记忆能力[116]。党参多糖可提高APP/PS1小鼠海马组织突触后致密蛋白95(postsynaptic density 95,PSD95)、突触相关蛋白Synaptotagmin的表达水平,提示党参多糖可调节突触可塑性,提高小鼠学习记忆功能[117]。中药多糖类成分防治AD的作用机制见表2和图3。
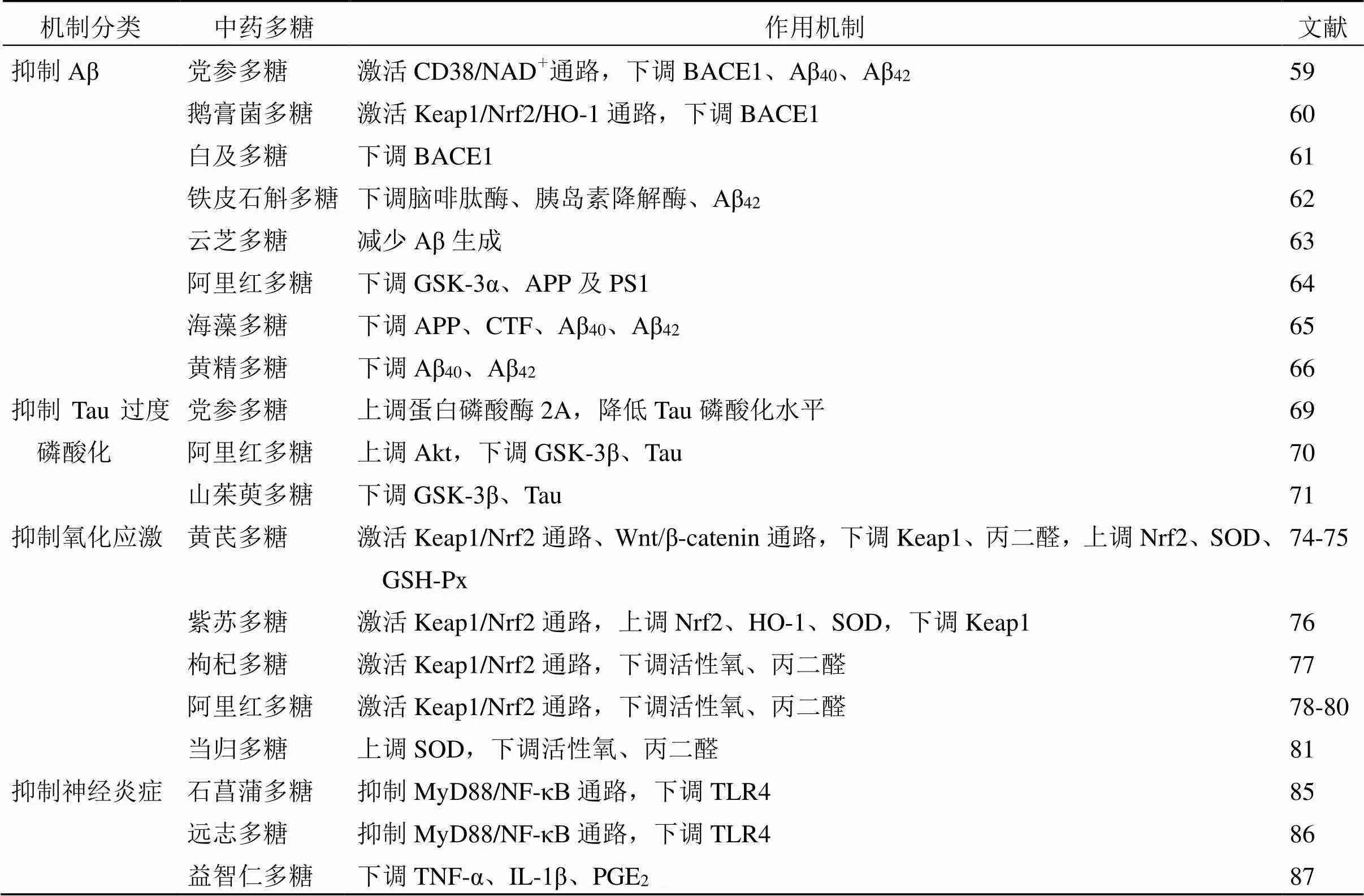
表2 中药多糖防治AD的作用机制
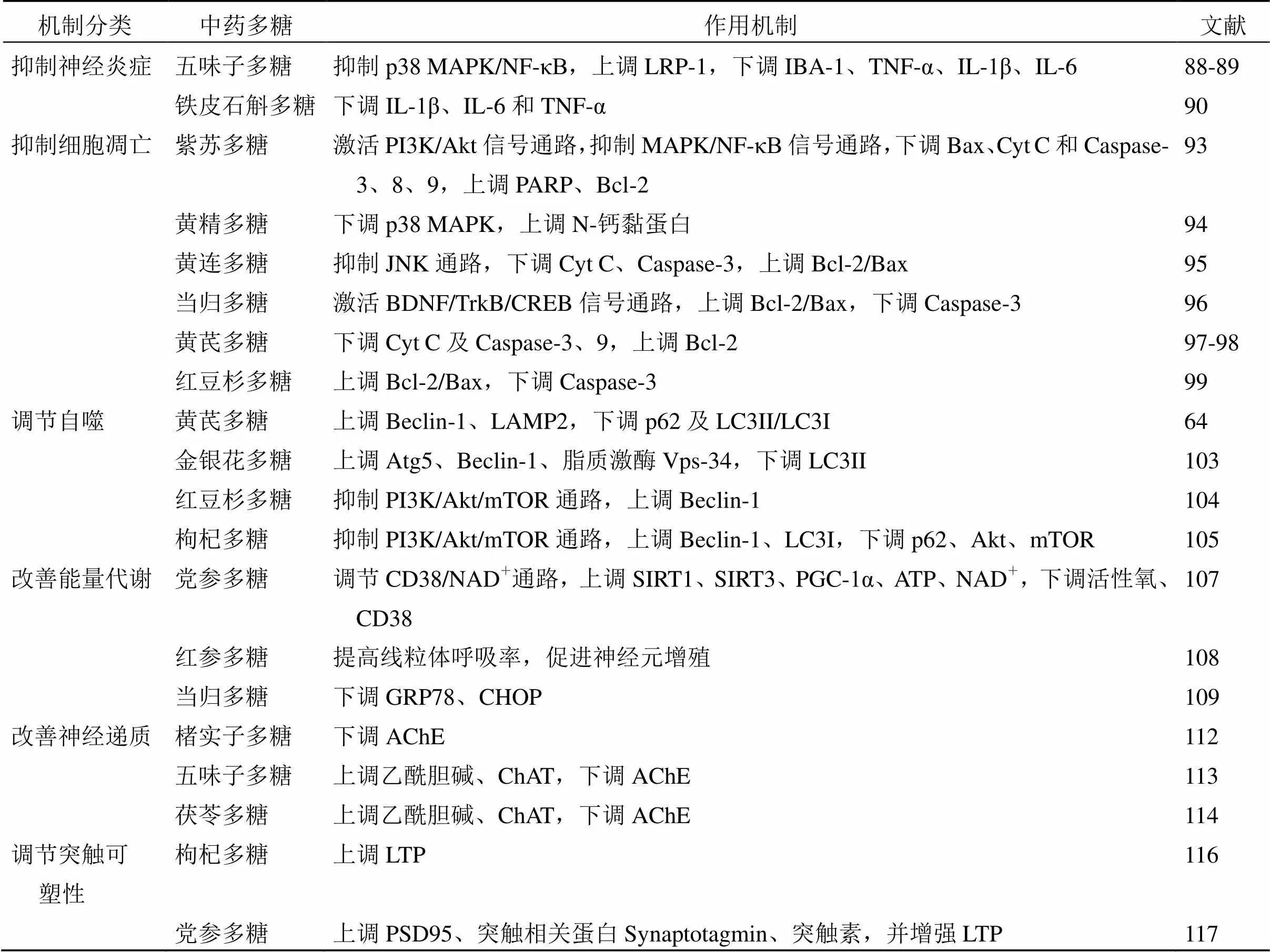
续表2
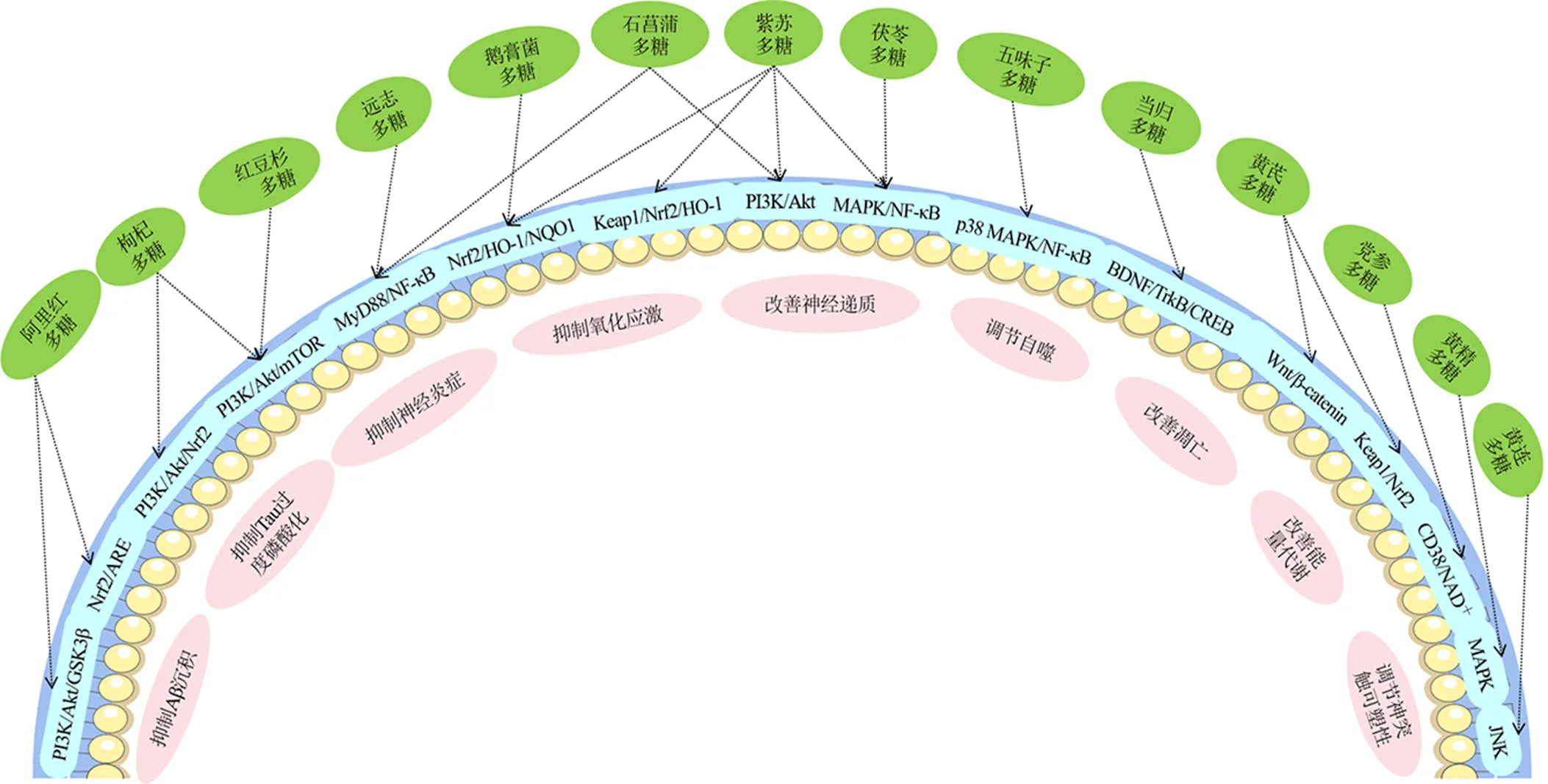
图3 中药多糖调节相关信号通路防治AD机制
4 结语
AD作为一种机制复杂的神经退行性疾病,年龄是其最大的诱发因素的之一,特别是我国人口老龄化日益严重,如何有效运用中医药防治AD,延缓其病理进程,改善患者的生活质量是当前面临的难题。中药多糖类成分是一种大分子物质,制备简便,易于提取,具有多重活性作用,已被广泛应用于防治AD的实验研究中,其作用效果获得了广泛的认可。
通过查阅、整理并分析近5年国内外中药多糖类成分防治AD作用机制相关文献,共涉及25味中药,其中以阿里红、黄芪、当归、枸杞、五味子频次较多,作用机制主要集中在减少Aβ生成、降低Tau磷酸化水平、抗氧化、抗神经炎症、抗细胞凋亡、调节自噬、改善能量代谢等方面。此外,近5年英文文献的相关研究内容以细胞、动物实验相互验证偏多,而中文文献的相关研究更偏向于单一的动物实验,并且这些中药多糖类成分能够呈剂量相关性改善AD,然而中药多糖并不是通过单一的作用途径和靶点改善AD,如枸杞多糖、石菖蒲多糖、黄芪多糖、阿里红多糖等可通过调节多条信号通路下游的靶蛋白,延缓AD的发病进程。
然而目前仍然存在一些问题亟待解决,尽管中药多糖类成分在基础实验中已被证明了能够改善AD的相关症状和病理进程,但为临床提供的指导作用较小。其次,由于大分子物质很难通过血脑屏障进入脑内,因此这些中药多糖进入脑内途径的机制需进一步阐明。此外,这些多糖类成分的提取主要来源于补益类中药,其他类别的中药占比较少,研究方法和作用机制也较为常规。一些来自海洋和菌科的中药具有一定的毒性,如何选择合适的提取方法,在降低对人体不良反应的同时又不影响生物活性显得尤为重要。最后,当前中药多糖防治AD的作用机制尚未完全明确,因此可以结合生物信息学等相关技术,进一步挖掘中药多糖类成分的潜在作用机制。
利益冲突 所有作者均声明不存在利益冲突
[1] Soria Lopez J A, González H M, Léger G C. Alzheimer’s disease [J]., 2019, 167: 231-255.
[2] Serý O, Povová J, Míšek I,. Molecular mechanisms of neuropathological changes in Alzheimer’s disease: A review [J]., 2013, 51(1): 1-9.
[3] Graff-Radford J, Yong K X X, Apostolova L G,. New insights into atypical Alzheimer’s disease in the era of biomarkers [J]., 2021, 20(3): 222-234.
[4] Khan S, Barve K H, Kumar M S. Recent advancements in pathogenesis, diagnostics and treatment of Alzheimer’s disease [J]., 2020, 18(11): 1106-1125.
[5] Metaxas A, Kempf S J. Neurofibrillary tangles in Alzheimer’s disease: Elucidation of the molecular mechanism by immunohistochemistry and tau protein phospho-proteomics [J]., 2016, 11(10): 1579-1581.
[6] Lleó A, Núñez-Llaves R, Alcolea D,. Changes in synaptic proteins precede neurodegeneration markers in preclinical Alzheimer’s disease cerebrospinal fluid [J]., 2019, 18(3): 546-560.
[7] Tarawneh R, D’Angelo G, Crimmins D,. Diagnostic and prognostic utility of the synaptic marker neurogranin in alzheimer disease [J]., 2016, 73(5): 561-571.
[8] Anand P, Singh B. A review on cholinesterase inhibitors for Alzheimer’s disease [J]., 2013, 36(4): 375-399.
[9] Eldufani J, Blaise G. The role of acetylcholinesterase inhibitors such as neostigmine and rivastigmine on chronic pain and cognitive function in aging: A review of recent clinical applications [J]., 2019, 5: 175-183.
[10] Prajapati V D, Maheriya P M, Jani G K,. Carrageenan: A natural seaweed polysaccharide and its applications [J]., 2014, 105: 97-112.
[11] Briggs R, Kennelly S P, O’Neill D. Drug treatments in Alzheimer’s disease [J]., 2016, 16(3): 247-253.
[12] Chen F, Huang G L. Preparation and immunological activity of polysaccharides and their derivatives [J]., 2018, 112: 211-216.
[13] Liu Y, Sun Y Y, Huang G L. Preparation and antioxidant activities of important traditional plant polysaccharides [J]., 2018, 111: 780-786.
[14] Chen L, Huang G L. The antiviral activity of polysaccharides and their derivatives [J]., 2018, 115: 77-82.
[15] Huang H L, Huang G L. Extraction, separation, modification, structural characterization, and antioxidant activity of plant polysaccharides [J]., 2020, 96(5): 1209-1222.
[16] Cui H Y, Wang C L, Wang Y R,.polysaccharide (PN-S) enhances the immunity of immunosuppressed mice [J]., 2015, 13(10): 760-766.
[17] Ceole L F, Companhoni M V P, Sanches Lopes S M,. Anti-activity of polysaccharide fractions fromleaves [J]., 2020, 34(11): 1558-1562.
[18] Jin M L, Zhao K, Huang Q S,. Structural features and biological activities of the polysaccharides from[J]., 2014, 64: 257-266.
[19] Cheng H, Huang G L. Extraction, characterisation and antioxidant activity ofpolysaccharide [J]., 2018, 114: 415-419.
[20] Liu M, Gong Z, Liu H,. Structural characterization and anti-tumor activityof a water-soluble polysaccharide from dark brick tea [J]., 2022, 205: 615-625.
[21] Ren R J, Yin P, Wang Z H,. China Alzheimer’s disease report 2021 [J]., 2021, 20(4):317-337.
[22] Yan J K, Wang W Q, Wu J Y. Recent advances inpolysaccharides: Mycelial fermentation, isolation, structure, and bioactivities: A review [J]., 2014, 6: 33-47.
[23] Yin X L, You Q H, Su X Y. A comparison study on extraction of polysaccharides fromby response surface methodology [J]., 2014, 102: 419-422.
[24] Wang J L, Zhang J, Wang X F,. A comparison study on microwave-assisted extraction ofpolysaccharides with conventional method: Molecule structure and antioxidant activities evaluation [J]., 2009, 45(5): 483-492.
[25] Chen Y, Yao F K, Ming K,. Polysaccharides from traditional Chinese medicines: Extraction, purification, modification, and biological activity [J]., 2016, 21(12): E1705.
[26] Zeng P J, Li J, Chen Y L,. The structures and biological functions of polysaccharides from traditional Chinese herbs [J]., 2019, 163: 423-444.
[27] Sun L, Wu D, Ning X,. Α-amylase-assisted extraction of polysaccharides from[J]., 2015, 75: 152-157.
[28] Wang Q J, Fang Y Z. Analysis of sugars in traditional Chinese drugs [J]., 2004, 812(1/2): 309-324.
[29] Preethi S, Mary S A. Screening of natural polysaccharides extracted from the fruits ofas a pharmaceutical adjuvant [J]., 2016, 92: 347-356.
[30] Zhao L, Wang Y, Shen H L,. Structural characterization and radioprotection of bone marrow hematopoiesis of two novel polysaccharides from the root of(Oliv.) Diels [J]., 2012, 83(8): 1712-1720.
[31] 英欣. 红参多糖的分离纯化及结构分析 [D]. 长春: 东北师范大学, 2018.
[32] He J Y, Ma N, Zhu S,. The genus(Campanulaceae): A review of phytochemistry, bioactivity and quality control [J]., 2015, 69(1): 1-21.
[33] Tian X J, Liang T S, Liu Y L,. Extraction, structural characterization, and biological functions ofpolysaccharides: A review [J]., 2019, 9(9): E389.
[34] Cui X W, Wang S Y, Cao H,. A review: The bioactivities and pharmacological applications ofpolysaccharides [J]., 2018, 23(5): E1170.
[35] Li S S, Qi Y L, Ren D D,. The structure features and improving effects of polysaccharide fromon antibiotic-associated diarrhea [J].(), 2019, 9(1): E8.
[36] 杨鑫. 益智仁多糖的结构特征和免疫调节活性研究 [D]. 海口: 海南大学, 2020.
[37] Guo L H, Qi J X, Du D,. Current advances ofpolysaccharides in dermatology: A literature review [J]., 2020, 58(1): 664-673.
[38] 姜倩倩, 梁少瑜, 李仲秋, 等. 构树果实: 楮实子的资源分布、古今用药、化学成分及药理作用 [J]. 河南科技大学学报: 医学版, 2018, 36(3): 236-240.
[39] Tan J Q, Cui P S, Ge S Q,. Ultrasound assisted aqueous two-phase extraction of polysaccharides fromfruit: Modeling, optimization, purification, and characterization [J]., 2022, 84: 105966.
[40] 张红梅, 李方怿, 赵春霞, 等. 五味子多糖的分离、纯化及结构表征 [J]. 天津中医药, 2022, 39(4): 509-515.
[41] Yang R Y, Wang D Y, Li H L,. Preparation and characterization ofpolysaccharide/ polylactic acid composite [J]., 2019, 24(11): E2104.
[42] Xu S Y, Huang X S, Cheong K L. Recent advances in marine algae polysaccharides: Isolation, structure, and activities [J]., 2017, 15(12): E388.
[43] Li X L, He Y L, Zeng P J,. Molecular basis forpolysaccharide used as an antitumour drug in China [J]., 2019, 23(1): 4-20.
[44] Wu M B, Zhang F F, Yu Z P,. Chemical characterization andantitumor activity of a single-component polysaccharide fromvar.[J]., 2015, 133: 294-301.
[45] Surayot U, Wangtueai S, You S G,. Extraction, structural characterisation, and immunomodulatory properties of ediblesub species(Corner and Bas) mucilage polysaccharide as a potential of functional food [J]., 2021, 7(9): 683.
[46] Zhou X N, Lu Q Q, Kang X Z,. Protective role of a new polysaccharide extracted fromThunb. in mice with ulcerative colitis induced by dextran sulphate sodium [J]., 2021, 2021: 8878633.
[47] 张亚丽, 高简, 苗祥贞, 等. 黄连多糖中单糖组成的HPLC-MSn法快速识别 [J]. 世界中医药, 2017, 12(11): 2775-2778.
[48] 孙小文. 云芝多糖提取、纯化、单糖组成分析及体外抗氧化活性的研究 [D]. 哈尔滨: 黑龙江中医药大学, 2014.
[49] Jing Y S, Zhang S L, Li M S,. Research progress on the extraction, structure, and bioactivities of polysaccharides from[J]., 2022, 11(14): 2126.
[50] Wang J, Zhang Y X, Xu X H,. ASP2-1, a polysaccharide fromSchott, inhibits osteoclastogenesis via modulation of NFATC1 and attenuates LPS-induced bone loss in mice [J]., 2020, 165(Pt B): 2219-2230.
[51] Zhang W X, Song D, Xu D,. Characterization of polysaccharides with antioxidant and immunological activities from[J]., 2015, 133: 154-162.
[52] 张红娇. 紫苏多糖的分离纯化、结构表征及应用研究 [D]. 太原: 中北大学, 2022.
[53] Xin T, Zhang F B, Jiang Q Y,. Extraction, purification and antitumor activity of a water-soluble polysaccharide from the roots of[J]., 2012, 90(2): 1127-1131.
[54] 依力奴尔·艾尼瓦尔. 维药阿里红多糖的分离纯化其体外抗氧化活性研究 [D]. 乌鲁木齐: 新疆医科大学, 2017.
[55] Xie J B, Shen Z Y, Anraku Y,. Nanomaterial-based blood-brain-barrier (BBB) crossing strategies [J]., 2019, 224: 119491.
[56] Wong K H, Riaz M K, Xie Y N,. Review of current strategies for delivering Alzheimer’s disease drugs across the blood-brain barrier [J]., 2019, 20(2): 381.
[57] Zhang H Q, Wei W, Zhao M,. Interaction between Aβ and tau in the pathogenesis of Alzheimer’s disease [J]., 2021, 17(9): 2181-2192.
[58] Gouras G K, Olsson T T, Hansson O. Β-Amyloid peptides and amyloid plaques in Alzheimer’s disease [J]., 2015, 12(1): 3-11.
[59] Wan L, Zhang Q, Luo H B,.polysaccharide attenuates Aβ toxicity and cognitive defects in APP/PS1 mice [J]., 2020, 12(13): 13422-13436.
[60] Li Z P, Chen X, Zhang Y F,. Protective roles ofpolysaccharides against Alzheimer’s disease via Nrf2 pathway [J]., 2019, 121: 29-37.
[61] Lin Y W, Fang C H, Liang Y J,. Modified low-temperature extraction method for isolation ofpolysaccharide as antioxidant for the prevention of Alzheimer’s disease [J]., 2021, 22(23): 12760.
[62] Feng C Z, Cao L, Luo D,.polysaccharides attenuate cognitive impairment in senescence-accelerated mouse prone 8 mice via modulation of microglial activation [J]., 2019, 1704: 1-10.
[63] Chen S H, He C Y, Shen Y Y,. Polysaccharide krestin prevents Alzheimer’s disease-type pathology and cognitive deficits by enhancing monocyte amyloid-β processing [J]., 2022, 38(3): 290-302.
[64] 李珍, 阿依江·哈拜克, 丛媛媛, 等. 阿里红多糖对阿尔茨海默症小鼠认知功能的作用机制研究 [J]. 中国临床药理学杂志, 2022, 38(10): 1097-1100.
[65] Liu Y H, Wang J L, Hsiung G Y R,. Trehalose inhibits Aβ generation and plaque formation in Alzheimer’s disease [J]., 2020, 57(7): 3150-3157.
[66] Luo S L, Zhang X, Huang S,. A monomeric polysaccharide fromimproves cognitive functions in a model of Alzheimer’s disease by reshaping the gut microbiota [J]., 2022, 213: 404-415.
[67] Laurent C, Buée L, Blum D. Tau and neuroinflammation: What impact for Alzheimer’s disease and tauopathies? [J]., 2018, 41(1): 21-33.
[68] Leyns C E G, Holtzman D M. Glial contributions to neurodegeneration in tauopathies [J]., 2017, 12(1): 50.
[69] Zhang Q, Xia Y Y, Luo H B,.polysaccharide attenuates tau hyperphosphorylation and cognitive impairments in hTau infected mice [J]., 2018, 11: 437.
[70] 李珍, 丛媛媛, 阿依江·哈拜克, 等. 阿里红多糖组分对APP/PS1双转基因模型小鼠海马区AKT/GSK3β/Tau/P-tau蛋白表达的影响 [J]. 天然产物研究与开发, 2020, 32(2): 288-295.
[71] 苏亚楠, 程开, 窦鹏挥, 等. 山茱萸多糖对阿尔茨海默病模型大鼠学习记忆及海马糖原合成酶激酶-3β表达的影响 [J]. 中国老年学杂志, 2018, 38(11): 2700-2702.
[72] Chen Z C, Zhong C J. Oxidative stress in Alzheimer’s disease [J]., 2014, 30(2): 271-281.
[73] Ma Q. Role of nrf2 in oxidative stress and toxicity [J]., 2013, 53: 401-426.
[74] Qin X D, Hua J, Lin S J,.polysaccharide alleviates cognitive impairment and β-amyloid accumulation in APP/PS1 mice via Nrf2 pathway [J]., 2020, 531(3): 431-437.
[75] 苏国华, 刘立海, 陈慧丽, 等. 黄芪多糖对AD大鼠模型氧化应激反应与Wnt信号通路的影响 [J]. 中国煤炭工业医学杂志, 2020, 23(1): 21-26.
[76] Osakabe N, Yasuda A, Natsume M,. Rosmarinic acid, a major polyphenolic component of, reduces lipopolysaccharide (LPS)-induced liver injury in-galactosamine (-GalN)-sensitized mice [J]., 2002, 33(6): 798-806.
[77] 刘潇然. 枸杞多糖对Aβ42诱导的SH-SY5Y细胞氧化损伤及其干预LPS刺激的BV-2细胞炎症反应的作用研究 [D]. 银川: 宁夏大学, 2018.
[78] 杨倩, 邓明珠. 阿里红多糖干预对β淀粉样蛋白1-42诱导的阿尔茨海默病大鼠脑内氧化应激状态及记忆功能的影响 [J]. 中国医药, 2022, 17(1): 107-111.
[79] 苏丽燕·赛力木江, 依木然·马瑞士, 丛媛媛, 等. 阿里红多糖通过激活Nrf2/ARE通路改善阿尔茨海默病大鼠海马及脑皮层的氧化应激损伤 [J]. 天然产物研究与开发, 2021, 33(1): 89-96.
[80] 阿依江·哈拜克, 木卡德斯·哈力克, 帕丽达·阿不力孜. 阿里红多糖对APP/PS1双转基因小鼠神经损伤的保护作用 [J]. 中药药理与临床, 2019, 35(3): 59-66.
[81] 王虎平, 吴红彦, 李海龙, 等. 当归多糖对阿尔茨海默病模型大鼠学习记忆及β-淀粉样蛋白代谢的影响 [J]. 中国中医药信息杂志, 2018, 25(4): 51-55.
[82] Woodburn S C, Bollinger J L, Wohleb E S. The semantics of microglia activation: Neuroinflammation, homeostasis, and stress [J]., 2021, 18(1): 258.
[83] Dhapola R, Hota S S, Sarma P,. Recent advances in molecular pathways and therapeutic implications targeting neuroinflammation for Alzheimer’s disease [J]., 2021, 29(6): 1669-1681.
[84] Anwar S, Rivest S. Alzheimer’s disease: Microglia targets and their modulation to promote amyloid phagocytosis and mitigate neuroinflammation [J]., 2020, 24(4): 331-344.
[85] Zhong J, Qiu X, Yu Q,. A novel polysaccharide fromprotects against LPS-induced neuroinflammation and neurotoxicity by inhibiting TLR4-mediated MyD88/NF-κB and PI3K/Akt signaling pathways [J]., 2020, 163: 464-475.
[86] Chen H Y, Zhong J, Li J X,. PTP70-2, a novel polysaccharide from, prevents neuroinflammation and protects neurons by suppressing the TLR4-mediated MyD88/NF-κB signaling pathway [J]., 2022, 194: 546-555.
[87] Shi W T, Zhong J, Zhang Q,. Structural characterization and antineuroinflammatory activity of a novel heteropolysaccharide obtained from the fruits of[J]., 2020, 229: 115405.
[88] Xu M J, Yan T X, Fan K Y,. Polysaccharide ofameliorates cognitive decline in a mouse model of Alzheimer’s disease [J]., 2019, 237: 354-365.
[89] Xu M J, Wang J Y, Zhang X Y,. Polysaccharide fromacts via LRP-1 to reverse microglia activation through suppression of the NF-κB and MAPK signaling [J]., 2020, 256: 112798.
[90] Wang K P, Yang X W, Wu Z J,.polysaccharide protected CCl4-induced liver fibrosis through intestinal homeostasis and the LPS-TLR4-NF-κB signaling pathway [J]., 2020, 11: 240.
[91] Elmore S. Apoptosis: A review of programmed cell death [J]., 2007, 35(4): 495-516.
[92] He B, Chen W, Zeng J S,. microRNA-326 decreases tau phosphorylation and neuron apoptosis through inhibition of the JNK signaling pathway by targeting VAV1 in Alzheimer’s disease [J]., 2020, 235(1): 480-493.
[93] Byun E B, Cho E J, Kim Y E,. Neuroprotective effect of polysaccharide separated fromBritton var.Kudo against H2O2-induced oxidative stress in HT22 hippocampus cells [J]., 2018, 82(8): 1344-1358.
[94] 陈毅飞, 刘凯菲, 吴世敏, 等. 黄精多糖对阿尔茨海默病模型斑马鱼p38 MAPK/N-cadherin的影响 [J]. 中国药理学与毒理学杂志, 2021, 35(9): 659-660.
[95] Li Y J, Wang B M, Liu C,. Inhibiting c-Jun-terminal kinase (JNK)-mediated apoptotic signaling pathway in PC12 cells by a polysaccharide (CCP) fromagainst amyloid-β (Aβ)-induced neurotoxicity [J]., 2019, 134: 565-574.
[96] Du Q, Zhu X Y, Si J R.polysaccharide ameliorates memory impairment in Alzheimer’s disease rat through activating BDNF/TrkB/CREB pathway [J]., 2020, 245(1): 1-10.
[97] 屈文英, 解建国, 梁安心, 等. 黄芪多糖对阿尔茨海默病大鼠神经细胞活性、认知功能及Caspase-9表达水平的影响 [J]. 卒中与神经疾病, 2021, 28(5): 543-549.
[98] 贾宁, 张泽, 韩锟. 黄芪多糖对APP/PS1转基因小鼠认知功能的自噬及凋亡的改善作用机制研究 [J]. 中国临床药理学杂志, 2020, 36(20): 3328-3331.
[99] Zhang S W, Li L L, Hu J T,. Polysaccharide ofvar.Cheng et L. K. Fu attenuates neurotoxicity and cognitive dysfunction in mice with Alzheimer’s disease [J]., 2020, 58(1): 959-968.
[100] Levine B, Kroemer G. Autophagy in the pathogenesis of disease [J]., 2008, 132(1): 27-42.
[101] Guo F, Liu X Y, Cai H B,. Autophagy in neurodegenerative diseases: Pathogenesis and therapy [J]., 2018, 28(1): 3-13.
[102] Reddy P H, Oliver D M. Amyloid beta and phosphorylated tau-induced defective autophagy and mitophagy in Alzheimer’s disease [J]., 2019, 8(5): E488.
[103] Wang J D, Liu P, Huang X B,. Validation of the protective effects ofpolysaccharide on lipopolysaccharide-induced learning and memory impairments via regulation of autophagy based on network pharmacology [J]., 2021, 10(2): 1089-1100.
[104] 陈华群, 王灵俊, 王锦燕, 等. 红豆杉多糖对阿尔茨海默病大鼠的保护作用及其可能机制 [J]. 中国临床药学杂志, 2020, 29(4): 261-266.
[105] 李海宁, 马婷婷, 王妍柏, 等. 枸杞多糖通过PI3K/ Akt/mTOR通路调节自噬减轻β淀粉样蛋白1-40对HT22细胞的损伤 [J]. 宁夏医学杂志, 2019, 41(10): 872-875.
[106] Kerr J S, Adriaanse B A, Greig N H,. Mitophagy and Alzheimer’s disease: Cellular and molecular mechanisms [J]., 2017, 40(3): 151-166.
[107] Hu Y R, Xing S L, Chen C,.polysaccharides alleviate Aβ1-40-induced PC12 cells energy dysmetabolism via CD38/NAD+signaling pathway [J]., 2021, 18(3): 208-221.
[108] Shin S J, Nam Y, Park Y H,. Therapeutic effects of non-saponin fraction with rich polysaccharide from Korean red ginseng on aging and Alzheimer’s disease [J]., 2021, 164: 233-248.
[109] 车敏, 安方玉, 王燕, 等. 当归多糖对阿尔茨海默病模型大鼠海马神经元内质网应激的影响 [J]. 中医临床研究, 2021, 13(2): 7-11.
[110] Hampel H, Mesulam M M, Cuello A C,. The cholinergic system in the pathophysiology and treatment of Alzheimer’s disease [J]., 2018, 141(7): 1917-1933.
[111] Ferreira-Vieira T H, Guimaraes I M, Silva F R,. Alzheimer’s disease: Targeting the cholinergic system [J]., 2016, 14(1): 101-115.
[112] 姜倩倩, 梁少瑜, 李新萍, 等. 楮实子多糖的制备、分离及其对Aβ25-35诱导的SH-SY5Y细胞损伤和AChE的抑制作用 [J]. 深圳中西医结合杂志, 2021, 31(17): 1-4.
[113] Liu Y Y, Liu Z Y, Wei M Y,. Pharmacodynamic and urinary metabolomics studies on the mechanism ofpolysaccharide in the treatment of Alzheimer’s disease [J]., 2019, 10(1): 432-447.
[114] Zhou X B, Zhang Y X, Jiang Y Q,.polysaccharide attenuates damage of nervus in Alzheimer’s disease rat model induced by-galactose and aluminum trichloride [J]., 2021, 32(8): 727-737.
[115] Cardozo P L, de Lima I B Q, Maciel E M A,. Synaptic elimination in neurological disorders [J]., 2019, 17(11): 1071-1095.
[116] Zhou Y, Duan Y H, Huang S C,. Polysaccharides fromameliorate amyloid pathology and cognitive functions in APP/PS1 transgenic mice [J]., 2020, 144: 1004-1012.
[117] 万璐. p53苏木化异常修饰促进衰老与阿尔茨海默症发病机理研究[D]. 武汉: 华中科技大学, 2021.
ResearchprogressonmechanismoftraditionalChinesemedicinepolysaccharides in preventing and treating Alzheimer’s disease
ZHANG Jian, LIQuan, ZHOU Yan-yan
Heilongjiang University of Traditional Chinese Medicine, Harbin 150040, China
Alzheimer’s disease (AD) is a common neurodegenerative disease, which has become one of the important diseases seriously threatening the physical and mental health of the elderly. Traditional Chinese medicine has been widely used in experimental research on the treatment of AD because of its multi-target, multi-channel and stable nature. A large number of studies have shown that traditional Chinese medicine polysaccharides play an important role in the prevention and treatment of AD. This paper mainly reviewed the source and action way of traditional Chinese medicine polysaccharide for prevention and treatment of AD, and the action mechanism of traditional Chinese medicine polysaccharide for prevention and treatment of AD (inhibition of amyloid β-protein production, reduction of Tau phosphorylation level, inhibition of oxidative stress, inhibition of neuroinflammation, inhibition of cell apoptosis, regulation of autophagy, improvement of energy metabolism, etc.), aiming to provide reference and basis for the clinical drug development of traditional Chinese medicine polysaccharides in the prevention and treatment of AD.
traditional Chinese medicine polysaccharide; Alzheimer’s disease; amyloid β-protein; Tau phosphorylation; oxidative stress; neuroinflammation; cell apoptosis; autophagy; energy metabolism
R282.710.5
A
0253 - 2670(2022)23 - 7553 - 13
10.7501/j.issn.0253-2670.2022.23.027
2022-08-02
国家自然科学基金资助项目(81774197);国家自然科学基金资助项目(81803984)
张 健(1996—),男,硕士,研究方向为中医药防治老年性疾病。E-mail: 904407928@qq.com
通信作者:周妍妍(1977—),女,教授,博士生导师,主要从事中医药防治老年性疾病研究。E-mail: 13339319259@163.com
李 全(1978—),男,副教授,硕士生导师,主要从事中医药防治老年性疾病研究。E-mail: liquan_hljucm@163.com
[责任编辑 崔艳丽]
