绵羊肺炎支原体感染对贵州不同品种山羊肺脏和血液Toll样受体基因转录水平的影响
2022-12-07朱二鹏张双翔程振涛
杨 鹏,杨 源,岳 筠,陈 静,王 慧,朱二鹏,张双翔*,文 明,2,程振涛,2*
(1.贵州大学动物科学学院,贵州贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵州贵阳 550025;3.贵州省动物疫病预防控制中心,贵州贵阳 550008)
Toll样受体(Toll-like receptors,TLRs)是机体内一类重要的免疫相关分子,属于模式识别受体(pattern-recognition receptors,PRRs)家族,其成员至少有10个,广泛分布于T、B淋巴细胞等免疫细胞,可通过特异性识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)引起机体的一系列信号级联反应,最终在机体内发挥其免疫防御作用,是沟通特异性免疫与非特异性免疫的桥梁[1-2]。研究发现支原体的脂蛋白可通过上调TLR1、TLR2、TLR4、TLR6激活NF-κB通路,引起过度的免疫反应,最终介导病变组织炎症反应的发生[3-4]。Xu H等[5]研究证明小鼠缺乏TLR7可抑制促炎因子的产生,诱导小鼠肺部抗炎因子的产生,从而减轻病原对肺部组织损伤。Bernard M A等[6]研究发现TLR8信号传导触发TNF-α的释放,最终导致炎症的发生。越来越多的研究证实TLRs与炎症发生发展存在密切的关系。近年来有研究表明,TLRs转录水平与动物疫病可能存在相关关系。黄丽等[7]研究发现呼肠孤病毒感染鸡后TLRs在不同组织器官的表达量存在差异。姚玉昌等[8]研究发现TLR4转录水平能很好地反映羊对O型口蹄疫病毒的免疫能力。江孝俊等[9]研究发现TLR2和TLR4在小鼠乳腺炎病例中转录水平存在差异。绵羊肺炎支原体(Mycoplasmaovipneumoniae,Mo)感染绵羊和山羊可引起严重的纤维素性肺炎和胸膜炎[10]。课题组前期研究发现,不同品种羊对Mo的易感性表现不一,这种差异是否与TLRs基因转录水平有关,尚缺乏研究资料。本研究以贵州省内4个主要品种山羊为研究对象,应用Mo进行人工感染,对不同品种羊感染后血液、肺脏中TLRs基因转录水平差异进行分析,为探讨TLRs信号通路参与Mo诱导不同品种山羊炎症反应相关机理研究提供科学资料。
1 材料与方法
1.1 材料
1.1.1 主要试剂 RNAprep Prue血液总RNA提取试剂盒、血液/细胞/组织基因组DNA提取试剂盒,天根生化科技有限公司产品;RNAiso Plus组织总RNA提取试剂盒、Premix ExTaqTM(Probe qPCR)、PrimeScriptTMRT Master Mix,宝生物工程(大连)有限公司产品;其他试剂均为国产分析纯。
1.1.2 试验用动物与菌株信息 贵州白山羊、贵州黑山羊、黔北麻羊和波尔山羊,3月龄,体重10 kg~15 kg,购自各品种羊贵州省规模养殖基地。绵羊肺炎支原体(Mycoplasmaovipneumoniae)GZ-QX株,由贵州省动物疫病与兽医公共卫生重点实验室分离保存。
1.1.3 主要仪器 多功能梯度PCR仪(VeritiTM96-Well Thermai Cycyer),美国ABI公司产品;电泳仪(DYY-8C),北京六一生物科技有限公司产品;全自动数码凝胶成像系统(Tanon-1600),上海天能科技有限公司产品;荧光定量PCR仪(CFX Connect),美国Bio-Rad公司产品。
1.2 方法
1.2.1 不同品种山羊人工感染试验 Mo阴性的贵州白山羊、贵州黑山羊、黔北麻羊和波尔山羊各5头,分别设置感染组和对照组(感染组:3头/组;对照组:2头/组)。感染组每只山羊气管注射4 mL(1×108CCU/mL)Mo菌液进行感染,对照组注射同等剂量的培养基。2组山羊在饲养条件保持一致的条件下进行隔离饲养。采集0、48、96 h各试验羊抗凝血液样本45份、黔北麻羊528 h抗凝血液3份、波尔山羊528 h抗凝血液5份,并采集死亡或处死羊的肺脏样本20份,分析试验羊感染Mo后TLRs基因转录水平的变化。
1.2.2 试验羊Mo核酸检测 参考GenBank中登录的MoHsp70基因(登录号:HM047293.1)设计1对特异性引物,由生工生物工程(上海)有限公司合成,引物序列为 Mo-F:5′TCGTGCTAACCAAAGAGACTAC3′,Mo-R:5′CAAGTGCGGCTGCTGTTGGTTC3′,预期扩增大小为225 bp。取感染死亡或人工处死的试验羊肺脏样本,按试剂盒提取样本DNA;以提取的样本DNA为模板、Mo-F/R为引物构建25 μL PCR反应体系(2×TaqPCR Master Mix 12.5 μL,上、下游引物各1 μL,DNA模板2 μL,ddH2O 8.5 μL),按照反应程序(预变性94 ℃ 5 min;94 ℃ 30 s,56 ℃ 45 s,72 ℃ 30 s,共35个循环;72 ℃延伸10 min)进行PCR扩增,取7 μL PCR产物进行12 g/L琼脂糖凝胶电泳,使用凝胶成像仪观察目的基因扩增情况。并用ELISA检测试验羊Mo感染情况。
1.2.3 不同品种山羊TLRs基因转录水平检测
1.2.3.1 引物设计与合成 参考GenBank中已公布的羊TLR1-10基因序列设计特异性引物和探针(5′端加入6-FAM发光基团,3′端加入BHQ1淬灭基团),并由生工生物工程(上海)股份有限公司合成,引物序列信息见表1。

表1 引物序列信息
1.2.3.2 Mo感染羊TLRs基因转录水平定量检测 使用RNA提取试剂盒对试验样本总RNA进行提取,并将提取的RNA样本(1 μg)进行反转录合成cDNA;以研究小组成员已建立用于检测羊TLRs基因的TaqMan RT-qPCR方法[11],试验羊cDNA为模板构建20 μL qPCR反应体系(体系为Mix 10 μL,F/R各0.5 μL,Probe 0.4 μL,cDNA 1 μL,ddH2O 7.6 μL),按照反应条件(95 ℃预变性30 s;95 ℃变性10 s,退火20 s,共40个循环)进行目的基因转录水平检测。每个样本设置3个重复,以β-actin为内参基因,采用标准曲线法对目的基因mRNA的相对表达水平进行分析。
1.2.4 统计学分析 数据表示为3次独立重复试验的平均值±标准差;应用SPSS20.0软件分析同一品种山羊肺脏和血液样本中TLRs基因mRNA表达量的组间差异,以及不同品种山羊感染后肺脏和血液样本中相同TLRs基因mRNA表达量的差异。P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果
2.1 感染羊临床死亡统计结果
贵州白山羊在感染Mo后96 h时已全部死亡,贵州黑山羊在感染Mo后144 h时已全部死亡,黔北麻羊在感染Mo后144 h时死亡2只,在感染后528 h统一处死剩余试验羊(1只感染组黔北麻羊、2只对照组黔北麻羊,3只感染组波尔山羊、2只对照组波尔山羊)。
2.2 试验羊Mo核酸检测结果
以试验羊肺脏组织样本DNA为模板,应用PCR检测试验羊肺脏Mo扩增情况。结果显示,各品种山羊感染组肺脏样本中均检测出1条与预期225 bp大小相符的特异性条带,而各品种对照组山羊肺脏组织中未出现条带(图1),提示Mo成功感染试验羊。

M.DNA 标准DL 2 000;1.阴性对照;2~4.贵州黑山羊感染组;5~6.贵州黑山羊对照组;7~9.贵州白山羊感染组;10~11.贵州白山羊对照组;12~14.黔北麻羊感染组;15~16.黔北麻羊对照组;17~19:波尔山羊感染组;20~21.波尔山羊对照组;22.阳性对照
2.3 同种山羊不同TLRs基因转录水平差异性分析结果
应用TaqMan RT-qPCR检测试验羊肺脏和血液中TLRs基因转录水平。结果显示,贵州黑山羊肺脏中TLR1/4/5/6/8/9/10基因转录水平极显著高于对照组(P<0.01),TLR2基因转录水平显著高于对照组(P<0.05),TLR3/7基因转录水平高于对照组但差异不显著(P>0.05)(图2A);血液中TLR2/4/6/7/8/10基因转录水平极显著高于对照组(P<0.01),其余TLRs基因转录水平高于对照组但差异不显著(P>0.05)(图2B)。贵州白山羊肺脏中TLR1/4/5/6/8/9基因转录水平极显著高于对照组(P<0.01),TLR2/10基因转录水平显著高于对照组(P<0.05),TLR3/7/10转录水平高于对照组但差异不显著(P>0.05)(图2C);血液中TLR2/4/6/7/8基因转录水平极显著高于对照组(P<0.01),其余TLRs基因转录水平高于对照组但差异不显著(P>0.05)(图2D)。黔北麻羊肺脏中TLR4/5/7/8/10基因转录水平显著高于对照组(P<0.05),其余TLRs基因转录水平高于对照组但差异不显著(P>0.05)(图2E);血液中TLR4/6/7/8/9基因转录水平与对照组间差异极显著(P<0.01),其余TLRs基因转录水平高于对照组但差异不显著(P>0.05)(图2F)。波尔山羊肺脏中TLR4/5/7/8/10基因转录水平极显著高于对照组(P<0.01),其余TLRs基因转录水平高于对照组但差异不显著(P>0.05)(图2G);血液中TLR4/6/8/10基因转录水平极显著高于对照组(P<0.01),其余TLRs基因转录水平高于对照组但差异不显著(P>0.05)(图2H)。通过分析发现,同一品种山羊在感染Mo后肺脏样本和血液样本中TLRsmRNA表达量均出现不同程度的上升,提示TLRs参与山羊的Mo感染过程。

A.贵州黑山羊144 h肺脏;B.贵州黑山羊144 h血液;C.贵州白山羊96 h肺脏;D.贵州白山羊96 h血液;E.黔北麻羊528 h肺脏;F.黔北麻羊528 h血液;G.波尔山羊528 h肺脏;H.波尔山羊528 h血液
2.4 不同种山羊肺脏样本中TLRs基因转录水平差异性分析结果
应用TaqMan RT-qPCR对试验羊肺脏样本进行TLRs基因转录水平检测后,计算每个山羊品种不同TLRs基因转录水平的差异倍数,并对种间表达差异进行显著性分析。结果显示(图3),感染后贵州白山羊肺脏TLR1基因转录水平的上调倍数显著高于贵州黑山羊、黔北麻羊和波尔山羊(P<0.05),其余各组间并无显著性差异(P>0.05);感染后黔北麻羊波尔山羊肺脏TLR2基因转录水平的上调倍数极显著高于贵州黑山羊和贵州白山羊(P<0.01);感染后肺脏TLR3基因转录水平的差异倍数在各品种山羊间差异不显著(P>0.05);波尔山羊肺脏TLR4基因转录水平的差异倍数极显著高于其余品种山羊(P<0.01),其余3种羊间以黔北麻羊差异倍数最高;感染后肺脏TLR5基因转录水平差异倍数存在显著差异(P<0.05),呈现出波尔山羊>黔北麻羊>贵州黑山羊>贵州白山羊;感染后肺脏TLR6基因转录水平差异倍数贵州黑山羊和贵州白山羊极显著高于黔北麻羊和波尔山羊(P<0.01);感染后波尔山羊肺脏TLR7/9基因转录水平上调倍数极显著高于贵州黑山羊、黔北麻羊和波尔山羊(P<0.01),其余各组间并无显著差异(P>0.05);感染后各品种山羊肺脏TLR8/10基因转录水平上调倍数贵州白山羊>贵州黑山羊>黔北麻羊波尔山羊,且贵州白山羊显著高于其余品种山羊(P<0.05)。本研究发现试验羊感染Mo后不同品种山羊间肺脏样本中TLRs基因转录水平上调倍数存在差异,肺脏样本中TLR1/6/8/10基因转录水平上调倍数与试验羊临床死亡呈正相关,而肺脏样本中TLR2/4/5/7/9基因转录水平上调倍数与试验羊临床死亡现象呈负相关,提示TLRs基因转录水平倍数差异可能与不同羊对Mo的易感不同有关。

差异倍数=感染组相对表达量/对照组相对表达量;小写字母相同表示差异不显著(P>0.05);小写字母不相同表示差异显著(P<0.05);大写字母不相同表示差异极显著(P<0.01)
2.5 不同种山羊血液样本中TLRs基因转录水平差异性分析结果
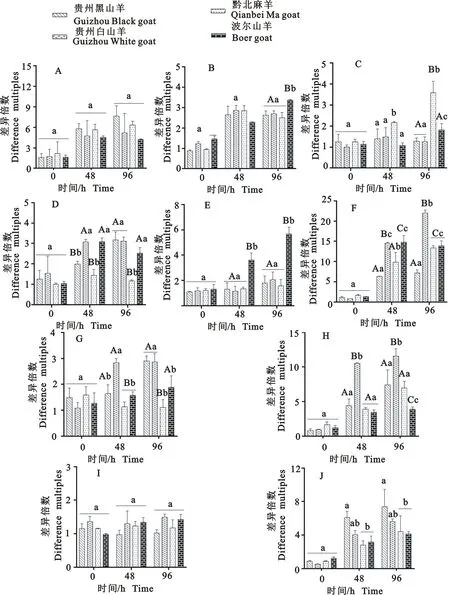
应用TaqMan RT-qPCR对试验羊感染Mo后0、48、96 h血液样本进行TLRs基因转录水平定量检测后,计算每个山羊品种不同TLRs基因转录水平的差异倍数,并对种间表达差异进行显著性分析。结果显示,感染后各品种山羊间0 h血液中TLRs基因转录水平差异倍数差异不显著(P>0.05);感染后4个品种山羊间血液中TLR1/9基因转录水平差异倍数在48 h和96 h差异不显著(P>0.05)(图4A、图4I);感染后96 h波尔山羊血液TLR2基因转录水平差异倍数极显著高于贵州黑山羊、贵州白山羊和黔北麻羊(P<0.01),而在48 h各品种山羊间差异不显著(P>0.05)(图4B);感染后48 h和96 h黔北麻羊血液TLR3基因转录水平差异倍数显著高于贵州黑山羊、贵州白山羊和波尔山羊(P<0.05)(图4C);感染后48 h贵州白山羊和波尔山羊血液TLR4基因转录水平差异倍数显著高于贵州黑山羊和黔北麻羊(P<0.05),感染后96 h贵州黑山羊和贵州白山羊血液TLR4基因转录水平差异倍数显著高于黔北麻羊和波尔山羊(P<0.05)(图4D);感染后48 h和96 h波尔山羊血液TLR5基因转录水平差异倍数极显著高于贵州黑山羊、贵州白山羊和黔北麻羊(P<0.01)(图4E);感染后48 h贵州白山羊和波尔山羊血液TLR6基因转录水平差异倍数极显著高于贵州黑山羊和黔北麻羊(P<0.01),感染后96 h贵州白山羊血液TLR6基因转录水平差异倍数极显著高于贵州黑山羊、黔北麻羊和波尔山羊(P<0.01)(图4F);感染后48 h贵州白山羊血液TLR7基因转录水平差异倍数极显著高于贵州黑山羊、黔北麻羊和波尔山羊(P<0.01),感染后96 h贵州黑山羊和贵州白山羊血液TLR7基因转录水平差异倍数显著高于黔北麻羊和波尔山羊(P<0.05)(图4G);感染后48 h和96 h贵州白山羊血液TLR8基因转录水平差异倍数极显著高于贵州黑山羊、黔北麻羊和波尔山羊(P<0.01)(图4H);感染后48 h和96 h贵州黑山羊和贵州白山羊血液TLR10基因转录水平差异倍数高于黔北麻羊和波尔山羊(P<0.05)(图4J)。分析发现,不同品种山羊之间血液样本中TLRs基因的表达量存在差异,血液中TLR2/4/5/6/7/8/10基因转录水平上调倍数在感染死亡山羊与感染未死亡山羊间呈现出明显的差异,且TLR4/6/7/8/10基因转录水平上调倍数与试验羊临床死亡呈正相关,TLR2/5呈负相关;因此提示TLRs基因转录水平可能与不同品种羊对Mo的易感差异有关。
A.TLR1;B.TLR2;C.TLR3;D.TLR4;E.TLR5;F.TLR6;G.TLR7;H,TLR8;I.TLR9;J.TLR10;小写字母相同表示差异不显著(P>0.05);小写字母不相同表示差异显著(P<0.05);大写字母不相同表示差异极显著(P<0.01)
3 讨论
Toll样受体(TLRs)作为天然免疫的模式识别受体,激活后可识别PAMPs和DAMPs,刺激机体先天性免疫应答并提高获得性免疫应答,从而保护机体不受病原微生物侵害,但TLRs的信号传导也会导致机体产生持续性炎症反应而损伤机体[12-15]。甘源等[16]用猪肺炎支原体(Mhp)感染不同品种猪时发现各品种间同一部位的病变存在差异,本研究发现不同品种山羊感染后也出现不同症状,其中贵州白山羊试验组最先出现流脓性鼻涕、流泪和呼吸困难等症状,其次为贵州黑山羊和黔北麻羊,最后波尔山羊也出现相应症状[17];还有研究发现抗病性不同的小鼠感染后TLRs会出现差异表达,研究发现TLR2基因表达可加重大鼠肺部感染的发生发展,并进一步促进肺部病变,还发现抑制肺组织TLR2和TLR4 mRNA的表达进而减轻重症急性胰腺炎肺损伤程度[18],还有研究发现抗病性强的小鼠体内TLR9转录水平越高[19]。以上研究结果提示,不同动物或者同一动物不同品系在感染病原后呈现的临床症状可能存在一定差异。本研究也发现,不同品种山羊在感染Mo后,导致局部及全身TLRs基因转录水平的变化,引起了山羊局部肺脏的炎症及全身性的炎症表现,贵州白山羊首先临床症状最为明显,其次是贵州黑山羊和黔北麻羊,而波尔山羊只出现轻微临床症状,提示不同品种山羊对Mo的易感性存在一定差异,但该差异是否与不同品种山羊TLRs基因转录水平有关,尚缺乏相关资料;本研究通过Mo人工感染,分析感染后不同品种山羊TLRs基因转录水平差异,以期补充TLRs基因转录水平与Mo感染差异的相关研究资料。
现有研究表明TLR2/4基因在不同品种猪间存在基因多态性差异,这种差异引起了基因结构域改变,使TLR2/4基因功能发生变化,间接影响了机体健康[20-21]。本课题组前期发现,不同品种山羊之间TLR2基因也存在多态性差异,这种差异影响不同品种山羊TLR2基因结构域[22]。相关研究发现TLRs基因转录水平与机体的抗病性密切相关,王建立等[23]研究发现TLRs基因的转录水平与猪抵抗病毒性感染存在相关性,TLR2和TLR4基因表达调控仔猪的免疫应答功能。研究发现TLR2/4基因表达减少能改善大鼠肺部功能、减轻氧化应激反应和炎症因子的表达,对肺组织病理损伤有明显改善[24]。赵一萍等[25]发现蒙古马不同组织器官TLR1、TLR2、TLR4和TLR6 mRNA水基因平存在差异,影响不同组织器官对病原产生不同反应,本研究发现试验羊在感染Mo后其肺脏和血液中TLR1/2/4/5/6/7/8/10基因表达量显著高于对照组,这可能因为Mo感染激活TLRs信号通路,导致TLR1/2/4/5/6/7/8/10基因显著表达识别PAMPs和DAMPs,激活机体免疫应答而保护机体,越来越多的研究证明TLRs基因转录水平可能与疫病易感性存在相关关系。
动物疫病的发生可能与TLRs存在密切的联系,唐梦君等[26]研究发现TLR1基因表达可刺激机体免疫应答,进而保护机体不受细菌侵害,与本文发现不同品种山羊感染Mo后TLR1基因转录水平显著上调的结果相似,TLR1基因转录水平上升激活下级信号通路,从而发挥抗感染的作用,本研究还发现早期死亡贵州白山羊肺脏中TLR1/6/8/10基因转录水平差异倍数显著高于其余品种山羊,与试验羊临床死亡现象呈正相关,这可能因为Mo感染导致TLR1/6/8/10基因显著表达,刺激机体分泌大量炎性因子加速肺脏炎症发展,所以山羊快速死亡,而在波尔山羊体内TLR1/6/8/10基因表达差异倍数显著低于贵州白山羊,导致波尔山羊分泌炎性因子较贵州白山羊少,故而表现出不同的临床差异;而TLR2/4/5/7/9基因表达差异倍数与试验羊临床死亡现象呈负相关,这可能是由于感染死亡山羊TLR2/4/5/7/9基因表达上调量较未死亡山羊少,导致激活机体免疫应答程度出现差异,继而在不同品种山羊间表现出易感性的差异。研究发现TLR6基因可与TLR2基因协同作用以激活机体免疫[27-28],TLR2/9基因表达与小鼠结肠炎存在紧密的联系,这可能与TLR2/4基因可通过识别革兰氏阴性菌LPS从而激活机体免疫有关,本文也发现试验羊感染Mo后TLR2/4基因在不同品种间出现差异表达,TLR2/4基因表达差异可能导致不同品种羊的免疫存在强弱差异,从而在不同品种山羊间表现出不同症状。本研究还发现随感染时间的变化血液样本中TLR4/6/7/8/10基因表达差异倍数显著高于黔北麻羊和波尔山羊,与试验羊临床死亡现象呈正相关,而TLR2/5基因表达差异倍数试验羊临床死亡现象呈负相关,TLRs基因表达差异倍数在肺脏和血液中出现差异,具体机制尚未可知。综合临床试验结果发现早期死亡的贵州黑山羊、贵州白山羊和黔北麻羊与感染未死亡的波尔山羊间在肺脏和血液中存在TLR1/2/4/5/6/7/8/10基因转录水平的差异,提示TLR1/2/4/5/6/7/8/10基因转录水平可能与不同品种山羊对Mo存在易感差异有密切的关系,TLR4/6/7/8/10基因表达与山羊感染Mo呈正相关,而TLR2/5基因表达与山羊感染Mo呈负相关。
