TiO2及金属(Cu、Ni)掺杂催化材料水解制氢反应机理的理论研究
2022-12-07李来才
陈 晓, 李来才
(1.四川文理学院 化学化工学院, 达州 635000; 2. 四川文理学院 国家城市污水处理及资源化工程技术研究中心 川东分中心,达州 635000; 3. 四川师范大学 化学与材料科学学院, 成都 610066 )
1 引 言
日本研究者Fujishima发现TiO2在光催化水解制氢中能够有助于光能向化学能的转化后,光催化水解制氢研究成为新热点[1]. 光催化太阳能水解制氢的前景广阔,相关研究报道与日俱增,但目前还没有有效的光催化剂能够直接利用可见光催化水解产生氢气,相关研究显示光催化水解制氢仍然与电化学领域紧密相关[2-4]. 近年来关于水解制氢的研究集中在催化剂的优化制备以及光催化剂和电催化剂催化制氢效果的研究,以及如何提高半导体光催化材料对可见光的利用率,但对催化活性和水解制氢催化反应动力学的研究很少见报道. 已有研究表明金属(Cu、Ni) 掺杂能够有效改善TiO2材料水解制氢的催化活性[5,6]. 因此我们对本征及金属(Cu、Ni)掺杂TiO2材料水解制氢的催化活性和反应动力学进行研究.
锐钛矿型TiO2的(101)晶面是其稳定晶面,也是主要暴露面. 有研究表明TiO2(101)晶面在光还原反应的析氢过程中能够产生和传输更多的电子[7,8],因此我们主要研究了本征及掺杂TiO2(101)晶面上的水解制氢反应机理.一般析氢反应机理有两种:Volmer-Heyrovsky机理和Volmer-Tafel机理. 我们从(101)晶面的稳定水分子吸附构型出发,分别设计了两条反应路径Ⅰ和Ⅱ. 晶面上的一分子水首先发生解离后可以经过路径Ⅰ发生Volmer-Heyrovsky过程生成氢气,也可以通过路径Ⅱ与另一分子水解离产生的氢原子发生Volmer-Tafel过程生成氢气. 我们研究了系列催化剂模型的水解制氢反应动力学过程,计算了不同过程催化反应活化能,同时研究了催化剂对应的电子激发态的催化活性.
2 计算方法
研究中所采用的DFT计算通过Materials studio 软件的Dmol3模块完成[9]. 选取锐钛矿型TiO2(101)晶面(见图1). TiO2(101)晶面的晶胞参数是a=10.886 Å,b=11.328 Å,c=25.000 Å;α=β=90.000 °,γ=110.296 °. 在构建的锐钛矿型TiO2(101)超晶胞晶面模型的基础上,晶胞的金属掺杂主要采用间隙方式掺杂,分别表示为Cu/TiO2和Ni/TiO2,对应的总掺杂浓度为2.7 %[10,11]. 实验相关函数通过GGA-PBE[12,13]描述,核电子使用ECP进行描述[14,15]. 综合考虑计算时间和计算精度的平衡,选择双精度极化基组DNP来描述原子轨道基组;截断半径为4.5 Å,布里渊区网格设置为1×1×1. 自洽迭代收敛的能量标准设为1.0×10-5Ha. 能量的收敛标准定为1.0×10-5Ha,力的误差设为0.002 Ha/Å. 过渡态的搜寻方法是LST/QST[16].

图1 TiO2晶面俯视图为(101)晶面
3 结果和分析
如图1所示锐钛矿型TiO2(101)超晶胞表面存在有不同类型的原子,其中三类原子都裸露在晶面最上层,分别是五配位的Ti原子和二配位和三配位的O原子,在后续描述中用Ti(5) 、O(2)和O(3)指代晶面上的这三类原子.
3.1 水解制氢反应机理
我们构建了稳定的双分子吸附模型,并设计了两条反应路径Ⅰ和Ⅱ,反应过程各物质构型如图2所示. 其中反应路径Ⅰ的机理为:M1→TS1→M2→TS2→P. 其中一个水分子先在晶面上发生裂解生成羟基和氢原子,再和晶面未裂解的水发生反应生成氢气. 以Ni/TiO2(101)晶面为例,在M1中两个水分子吸附在晶面的Ti(5)原子上,吸附距离Oa-Ti(5)为0.2231 nm,Ob-Ti(5)为0.2315 nm.过渡态TS1中Hc原子被晶面上的O(3)原子吸引,水分子中的键角∠Hc-Ob-Hd增大为118.060°. Hc-Ob键开始断裂,键长由中间体M1中的0.0979 nm增长为0.1265 nm. Hc原子向晶面迁移. Ob-Ti(5)键长变短为0.2062 nm. 从中间体M1到过渡态TS1的活化能为1.11 eV. 在中间体M2中Hc-O(3)键长为0.0987 nm,Hc原子与原来水分子中的Ob原子距离为0.1982 nm,原来的Hc-Ob键已经完全断裂Ob-Ti(5)键长进一步变短为0.1881 nm,此时该水分子已经裂解生成氢原子和羟基. 接下来过渡态TS2中Hc原子与晶面上的O(3)原子距离变为0.1836 nm,Hc-O(3)键发生断裂,原来中间体M2水分子中的Hb-Oa键长从0.0992 nm变为0.2121 nm,Hb-Oa键已经断裂,Hb和Hc正在靠近. 从中间体M2到过渡态TS2的活化能为6.41 eV,该过程活化能很高是反应的速控步骤.

图2 水解制氢反应过程各物质构型图
反应路径Ⅱ的机理为:M1→TS1→M2→ TS3→M3→TS4→P. 其中两个水分子分别先后在晶面上发生裂解生成两个羟基和两个氢原子,两个氢原子再结合生成氢气. 路径Ⅱ的第一步反应过程M1→TS1→M2与路径Ⅰ相同,在经过过渡态TS1生成中间体M2后,接下来路径Ⅱ经过过渡态TS3生成中间体M3. 在过渡态TS3中Hb原子同样被晶面上的O(3)原子吸引,键角∠Ha-Oa-Hb增大为133.230°. Hb-Oa键长由中间体M2中的0.0992 nm增长为0.1193 nm,Hb-Oa键有断裂趋势,水分子中的Hb原子向晶面迁移. 从中间体M2到过渡态TS3的活化能为1.41 eV. 在中间体M3中Hb-O(3)键长为0.0983 nm,Hb原子与原来水分子中的Oa原子距离为0.2238 nm,原来的Hb-Oa键已经完全断裂,Oa-Ti(5)键长进一步变短为0.1836 nm,此时晶面上原来的两个水分子已经全部裂解,氢原子被晶面的O(3)原子吸附,O(3)原子向上凸起,晶面发生微小形变. 之后在过渡态TS4中Hb-O(3)键长变为0.1577 nm,Hc-O(3)键长为0.1673 nm,Hb和Hc原子向彼此靠近. 在从中间体M3到过渡态TS4的过程中活化能为5.21 eV,这一过程活化能很高,是反应的速控步骤.
在纯TiO2和Cu掺杂TiO2的(101)晶面水分子通过同样的两条反应路径Ⅰ和Ⅱ,形成类似于图2的中间体和过渡态构型,发生裂解后生成氢气. 其中水分子的解离过程都容易在三种催化剂表面发生,两条反应路径Ⅰ和Ⅱ的速控步骤都是最后氢气的形成过程. 三种催化剂催化水解反应相关的能量变化列于表1中,对比数据结果显示所构建的两条反应路径Ⅰ和Ⅱ的速控步骤活化能都很高. 但反应路径Ⅱ的活化能低于路径Ⅰ,表明水解制氢过程更容易通过路径Ⅱ发生. 反应的氢气生成过程活化能都偏高,通过金属掺杂能够有效降低速控步骤活化能,有利于反应的进行.
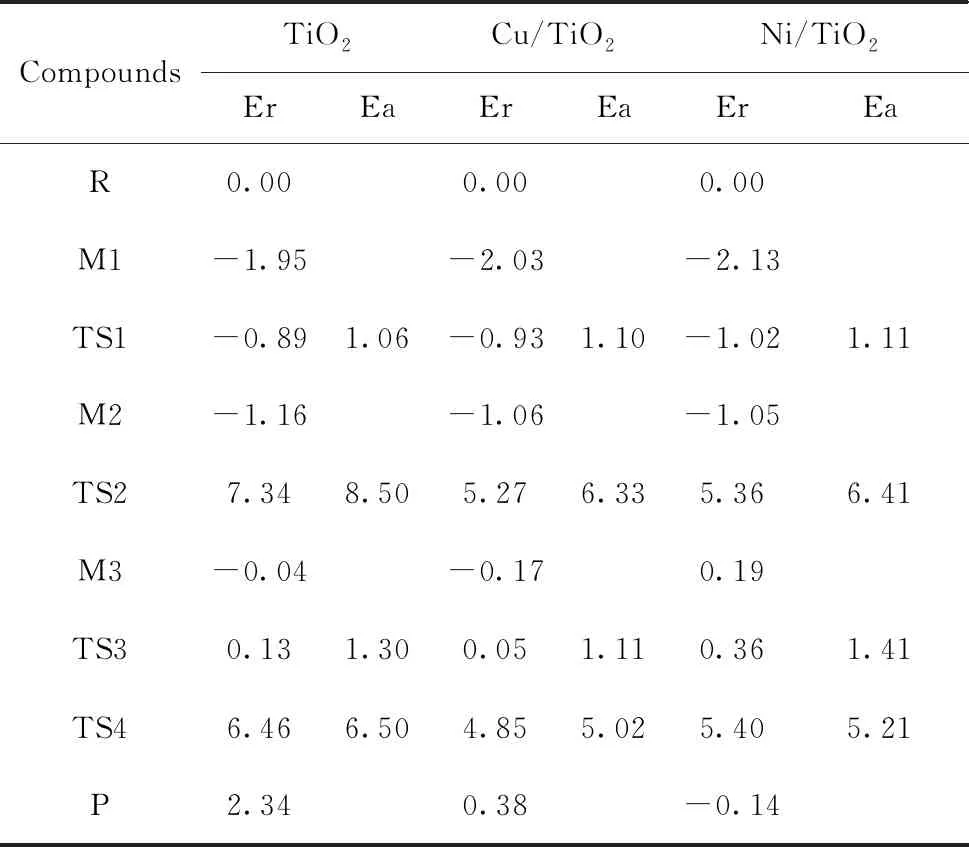
表1 水解制氢反应过程各物质能量(eV)
3.2 光照对反应的影响
通过对反应路径Ⅰ、Ⅱ中的各化合物进行优化,得到激发态时的水解反应制氢路径Ⅰ*和Ⅱ*. 图3为光照条件下三种催化剂催化反应过程中各物质能级变化示意图. 图3的能级变化表明在光照条件下反应路径Ⅰ*、Ⅱ*的速控步骤仍然是最后的氢气生成过程,反应路径Ⅱ*的活化能低于路径Ⅰ*. 与无光照条件对比TiO2、Cu/TiO2、Ni/TiO2三种催化剂反应路径Ⅰ*的速控步骤M2*→TS2*→P*的活化能分别为7.06 eV、5.63 eV和5.89 eV,比基态对应的步骤的活化能各减小了1.44 eV、0.70 eV和0.52 eV;反应路径Ⅱ*的速控步骤M3*→TS4*→P*的活化能分别为5.65 eV、4.57 eV和4.84 eV,比基态对应的步骤的活化能各减小了0.85 eV、0.45 eV和0.37 eV. 光照有助于降低反应的活化能.
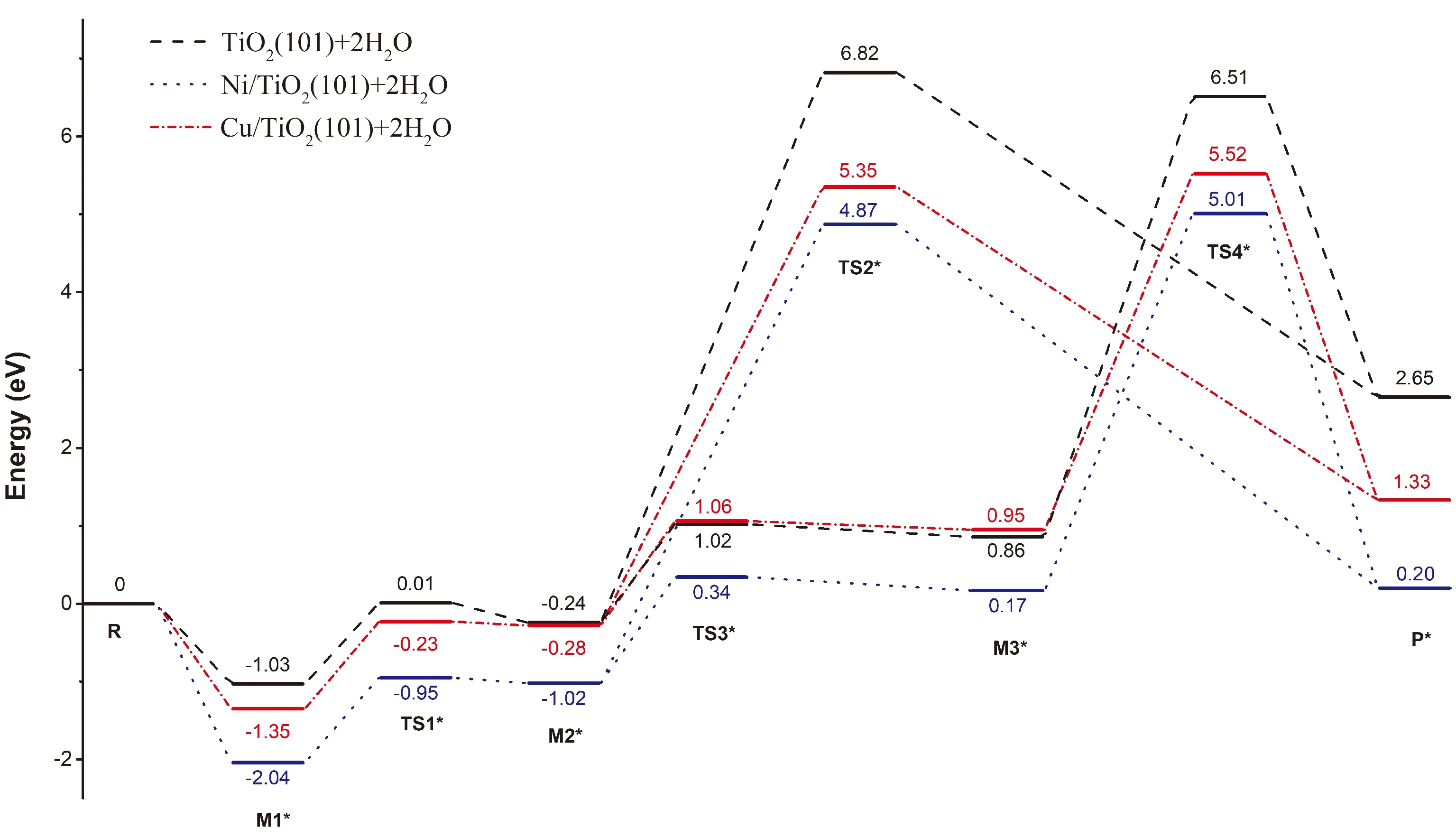
图 3 反应能级示意图
4 结 论
对于本征和掺杂TiO2催化剂(101)晶面水解制氢的催化机理研究结果显示,水解制氢反应中,通过析氢反应的Volmer-Heyrovsky机理和Volmer-Tafel机理构建的两条反应路径Ⅰ和Ⅱ的速控步骤活化能都很高. 反应路径Ⅱ的活化能低于路径Ⅰ,表明水解制氢过程更容易通过Volmer-Tafel机理发生. 反应的氢气生成过程活化能都偏高,通过金属掺杂能够有效降低速控步骤活化能. 电子激发态结果显示光照有助于降低反应的活化能. 研究发现金属(Cu、Ni)间隙掺杂二氧化钛都有助于降低催化水解制氢反应的活化能,且Cu的掺杂效果要好于Ni,这与实验研究的结果相同[5,6].
