灵武长枣果实发育过程中阿拉伯半乳糖蛋白组织化学分布
2022-12-06章英才陶珊珊
王 静 章英才 陶珊珊
(宁夏大学生命科学学院,银川 750021)
阿拉伯半乳糖蛋白(Arabinogalactan proteins,简称AGPs)广泛分布于植物的根、茎、叶、花、果实和种子,是一类结构复杂的大分子,由多糖支链和蛋白质核心链组成[1-3],糖基部分通常占整个AGPs分子的90%以上,主要由阿拉伯糖和半乳糖构成,属于富含羟脯氨酸的糖蛋白(HRGPs)家族[4]。作为细胞内非常重要的糖蛋白,AGPs 参与了植物营养生长[5]、生殖生长和发育[6]的各个环节。以往的研究集中于认识这些大分子糖蛋白在植物营养生长的功能和有性生殖中对于雌雄配子的发育[3]、成熟花粉粒在柱头上萌发以及花粉管在体内和体外生长的影响[4],集中于研究AGPs 在根形态建成、细胞增殖与程序性死亡、雌雄配子体的发育、花药发育与花粉管生长、体细胞胚胎发生以及植物激素信号传导等方面的功能[7-8],但对植物果实发育中AGPs 的研究较少[9],且主要集中在宁夏枸杞(Lycium barbarum)等。现有资料表明,宁夏枸杞多糖是一种以-O-连接的糖和蛋白质结合的阿拉伯半乳聚糖AGPs 糖蛋白,枸杞果实的多糖具有典型的AGPs糖蛋白特征[10-11]。根据宁夏枸杞多糖的化学组成和糖链结构特征,认为枸杞多糖属于type Ⅱ类 型 的 阿 拉 伯 半 乳 聚 糖 蛋 白AGPs[12]。Redgwell 等[10]认为宁夏枸杞果实的细胞壁多糖具有典型的阿拉伯半乳聚糖蛋白特征,AGPs 大量地分布在果肉细胞的细胞膜和细胞质内的质体膜上[11]。此外,AGPs 糖链组成主要以阿拉伯糖和半乳糖为主,枸杞糖蛋白被证实是枸杞子中提高免疫活性和抗衰老的药用有效成分[12]。值得注意的是,果实内的AGPs 具有免疫调节的功能,能激活动物的免疫系统或补体系统[11-12],这与已报道的长枣多糖的药理功能[13]相一致,也与灵武长枣(Ziziphus jujuba‘Lingwu Changzao’)不同发育时期的果实里精制多糖的10 种单糖中阿拉伯糖、半乳糖含量较高的研究结果[13]一致。因此,果实AGPs多糖蛋白积累在灵武长枣品质形成中占有十分重要的地位。
AGPs 可能分布在植物各种组织和细胞的细胞壁、质膜、细胞器和胞外基质等部位[14]。一般来说,对AGPs 的鉴定常采用人工合成的苯基偶氮染色剂βGlcY(β-D-glucosyl-Yariv reagent)与AGPs 发生特有的反应,形成棕红色絮状沉淀,βGlcY 是鉴定AGPs 的常用染色剂[2]。βGlcY 不仅可用来对组织和器官中的AGPs 进行分布与定位[14-15]、定量分析[14],还可以通过与AGPs 结合而研究其功能[15]。近年来与AGPs 进行特异性反应的单克隆或多克隆抗体,成为研究AGPs 的重要手段[3]。由于单克隆抗体的特异性较高,绝大多数识别的是AGPs 的糖基部位,成为研究AGPs 分布与特性的良好工具[6]。Bao 等 通 过Western blot 分 析 证 实JIM8、JIM13、MAC204、JIM94 为抗枸杞果实AGPs 的抗体,并对果实AGPs进行了免疫组化定位[11];Leszc⁃zuk 等通过JIM13、JIM15、MAC207 抗体研究了低温对雏菊(Bellis perennis)胚珠和花药发育过程中AGPs 分布变化的影响[16];利用特异性抗体对细胞中抗原的时空分布进行精准定位的免疫定位技术,是研究结构与功能极其复杂且呈动态变化的AGPs的理想选择。目前,通过βGlcY试剂对AGPs染色、单克隆抗体与AGPs 反应,以及通过分子生物学与生物化学方法等手段,可以对不同植物中不同部位AGPs 的分布和表达进行定位[3,17]。这为灵武长枣果实内AGPs 的组织化学和免疫细胞化学定位提供了很好地借鉴和支撑。
灵武长枣是鼠李科(Rhamnaceae)枣属(Ziziphus)栽培作物,原产于宁夏灵武市,为药食同源鲜食枣品种,其中长枣多糖(糖蛋白)是灵武长枣果实中最重要的药用生物活性成分之一,是筛选优良品种资源的关键因素[13]。近年来,在灵武长枣果实采后贮藏保鲜、生理变化及关键技术、品种选育、栽培技术等方面有了较多的研究成果[18],而有关果实多糖重要组成AGPs 糖蛋白的分布和与果实品质影响的研究尚鲜见报道。因此,本研究以灵武长枣不同发育时期的果实为研究材料,应用组织化学和免疫荧光定位技术,揭示AGPs 糖蛋白在果实发育过程中的分布特征,为进一步研究该成分在亚细胞分布及其在品质调控方面的功能提供依据。
1 材料与方法
1.1 试验材料
以位于宁夏灵武市的宁夏红枣工程技术研究中心试验基地6年生灵武长枣为供试材料,采用随机设计,3次重复,每次重复选择生长发育良好、树势适中、长势和花期相似、栽培管理水平一致的5~10 株植株。用毛线于2021 年6 月10 日标记同一天开放的花朵,每个重复标记3 000朵。
在灵武长枣开花坐果到果实成熟的发育过程中共设计4 次试验,具体分别在果实膨大前期(2021 年7 月10 日)、果实快速膨大期(2021 年8 月9 日)、果实着色期(2021 年9 月8 日)、果实完熟期(2021年9月28日),每次试验时间均设定于09:00—11:00 进行,按所标记植株从树冠的东、西、南、北4 个方位以及上、中、下、里、外各个方向选择标记花朵的枝条上果实作为试验对象,采摘后用冰壶4 ℃冷藏带回实验室。
熔点为35~37 ℃的石蜡Steedman’s wax 由聚乙二醇-400二硬脂酸酯和1-十六烷醇(均购自Sig⁃ma-Aldrich)按9∶1 质量分数,在50 ℃左右温箱熔化并充分混匀而成;βGlcY 和βManY 购自Biosup⁃plies Australia Pty Ltd.;AGPs 单克隆抗体MAC204购自美国乔治亚大学,其相应二抗Anti-mouse-IgG-FITC购自Sigma公司。
1.2 试验方法
1.2.1 糖蛋白βGlcY试剂定位
1.2.1.1 石蜡切片
选取不同发育时期的果实,用解剖刀将材料切成带外果皮的0.6 cm×0.4 cm×0.5 cm 的小块,立即放入4% 多聚甲醛-0.5% 戊二醛的PBS(10 mmol·L-1,pH=7.4)固定液中,盖紧瓶盖后注射器多次抽气至样品沉落瓶底,在室温下固定12 h 或过夜。样品用PBS 磷酸缓冲液(10 mmol·L-1,pH=7.4)清洗3 次,每次15 min。在4 ℃下依次用体积分数30%、50%、70%、90%的乙醇梯度脱水,每次60 min,100%乙醇3~4 次,60 min/次。样品在恒温箱中37 ℃用V(纯乙醇)∶V(石蜡)=1∶1 渗透过夜,次日更换V(纯乙醇)∶V(石蜡)=1∶3 渗透2.5 h,再用纯石蜡继续渗透3 次,每次2 h。将样品用纯石蜡在牛皮纸盒中包埋,常温凝固后即可。将样品蜡块固着在小木块上,在25 ℃左右环境中,用LEI⁃CA RM 2255切片机切片,厚度为10 μm,光面朝下放在较低温的瓷盘中。先在涂有0.2%聚乙烯亚胺的载玻片上加一两滴蒸馏水,用镊子将蜡带光滑面朝下轻放在载玻片水滴中,按顺序排好,在25 ℃左右室温下可自然展片,切片自然展片后将多余的水吸去,晾干一周后备用。
1.2.1.2 βGlcY和βManY标记
将粘有蜡带的载玻片切片放入装有纯乙醇的染色缸中,中间换2 次纯乙醇,30 min/次,切片完全脱蜡后,依次放入体积分数为90%、70%、50%乙醇的染色缸中逐级复水,每级10 min。直接在载玻片上滴1 滴配置好的Yariv reagent(1 mg·mL-1溶解于0.15 mol·L-1的NaCl)染色60 min。对照组采用βManY(1 mg·mL-1溶解于0.15 mol·L-1的NaCl),即阴性对照切片用βManY 代替βGlcY;然后用dd H2O冲洗2~3次,每次1 min。稍微晾干后,取体积分数为100%甘油少许滴在切片上封片。吸去多余的封片剂后用指甲油将盖玻片的四周封固,OLYMPUS IX73显微镜下观察拍照。
1.2.2 糖蛋白免疫荧光定位
糖蛋白免疫荧光定位参照Bao 等[11]、Xu 等[19]的方法,略有改动。
1.2.2.1 石蜡切片
4 个发育时期果实用解剖刀切成带外果皮的0.6 cm×0.4 cm×0.5 cm 的小块,立即放入含有体积分数3.7%甲醛的2F4 固定液中,盖紧瓶盖后注射器抽气至样品下沉瓶底,室温固定4 h。更换固定液3 次,每次30 min。然后用PBS 磷酸缓冲液(10 mmol·L-1,pH=7.0)清洗3 次,每次15 min。样品在4 ℃下用为0.05% Toluidine blue(甲苯铵蓝)染色15 min。后续乙醇梯度脱水、浸蜡、包埋、蜡块的固着、整修、切片、贴片和展片与前述石蜡切片步骤相似。
1.2.2.2 免疫荧光标记
将贴片后的载玻片放入装有纯乙醇的染色缸中,中间换2 次纯乙醇,30 min/次,切片即可全部脱蜡。切片依次放入体积分数为90%、70%、50%乙醇的染色缸中逐级复水,每级10 min。将载玻片上切片在PBS(10 mmol·L-1,pH=7.4)培养皿中浸泡10 min,然后用含50 mmol·L-1甘氨酸的PBS溶液封闭30 min,PBS(10 mmol·L-1,pH=7.4)浸泡10 min,然后用质量体积浓度为2% BSA 的PBS(10 mmol·L-1,pH=7.4)溶液室温封闭10 min,PBS(10 mmol·L-1,pH=7.4)浸泡10 min。然后用PBS(含质量体积浓度1%BSA)以1∶100比例稀释后的AGPs 单克隆抗体MAC204,4 ℃下孵育过夜(阴性对照切片采用含质量体积浓度1% BSA 的PBS 溶液代替一抗孵育),次日用PBS淋洗浸泡3次,每次10 min,以去除多余抗体,再用PBS(含质量体积浓度1%BSA)以1∶300 比例稀释后的Anti-mouse-IgG-FITC 二抗36 ℃黑暗条件下孵育1 h。标记后,PBS 淋洗浸泡3 次,每次10 min,除去未标记的二抗,用质量体积浓度为0.01% Toluidine blue 染色10 min,以去除植物本身的自发荧光。切片用PBS(10 mmol·L-1,pH=7.4)淋洗(浸泡)10 min,稍微晾干后,取甘油少许滴在切片上,用盖玻片封片,避免产生气泡,吸去多余的封片剂后用指甲油将盖玻片的四周封固,尽快在OLYMPUS IX73 荧光显微镜下观察并拍照。
2 结果与分析
2.1 膨大前期果实AGPs的βGlcY定位
由于βGlcY 与AGPs 发生特有的反应,形成棕红色絮状沉淀。膨大前期果实外果皮由单层外壁角质化的细胞组成,AGPs 形成的棕红色沉淀在细胞壁和细胞内部均有分布,紧邻外果皮的数层排列较为紧密以及内部相邻数层排列较疏松大型中果皮细胞内外均分布AGPs 形成的棕红色沉淀(见图1:A~B)。大小不同的中果皮维管束分布较多,直到内果皮处,维管束主要以圆形或椭圆形为主,维管束或单个发育或多个维管束背靠背式发育,木质部和韧皮部没有固定的分布方向(见图1:A~D);木质部导管或管胞木质化程度较低,韧皮部比较发达,由排列较为紧密的筛管、伴胞及韧皮薄壁细胞组成,在维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞的细胞壁和细胞内部均分布有AGPs 形成的棕红色沉淀(见图1:A~E)。中间部分的中果皮薄壁细胞排列较疏松,形成大小不等的空腔,维管束数量和外部的中果皮相差不大,除了空腔之外,大部分薄壁细胞和组成维管束的各细胞都分布有AGPs 形成的棕红色沉淀(见图1:A~E)。βManY 在果实相应部位均没有棕红色沉淀(见图1:F)。
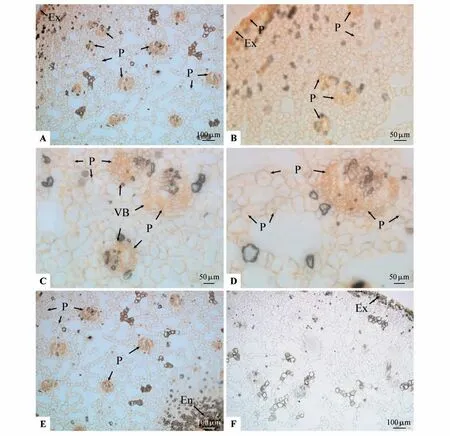
图1 膨大前期果实AGPs的βGlcY定位A~B.外果皮及内部组织AGPs定位;C.近外果皮维管束及周围组织AGPs定位;D.中部中果皮维管束及周围组织AGPs定位;E.近内果皮的中果皮维管束及周围组织AGPs定位;F.外果皮及内部组织,示βManY处理后均没有棕红色沉淀;P.AGPs形成的棕红色沉淀;VB.维管束;Ex.外果皮;En.内果皮;下同Fig.1 βGlcY distribution of AGPs during the early bulking period A-B.AGPs distribution in exocarp and internal tissues;C.AGPs distribution in vascular bundles and surrounding tissues close to exocarp;D.AGPs distribution in vascular bundles and surrounding tissues in mid mesocarp;E.AGPs distribution in vascular bundles and surrounding tissues of meso⁃carp near endocarp;F.Exocarp and internal tissues,showed no brown red precipitate after treatment with βManY;P. AGPs brown red precipitate;VB.Vascular bundle;Ex.Exocarp;En.Endocarp;The same as below
2.2 快速膨大期果实AGPs的βGlcY定位
快速膨大期果实外果皮壁明显增厚,AGPs 形成的棕红色沉淀在细胞壁和细胞内部均有分布,外果皮内由数层排列较为紧密的中果皮小细胞组成,AGPs 形成的棕红色沉淀均明显分布于细胞壁和细胞内部(见图2:A)。内部数层大型卵圆形薄壁细胞AGPs 形成的棕红色沉淀均主要分布于细胞壁上,大部分细胞内部无分布(见图2:A)。维管束主要分布在中果皮的中部和内部(见图2:A~D);由于果实快速膨大,中果皮的空腔随着果实的发育有不同程度的增大,单位面积维管束的数量随着果实体积的快速增大逐渐减少;维管束或单个存在,或二到三个维管束的木质部彼此相互连接,木质部导管呈辐射状紧密排列在维管束内侧,而韧皮部排列在维管束外侧与木质部并生成束;在维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞内外均分布有AGPs 形成的棕红色沉淀(见图2:B~E)。除了空腔之外,维管束周围的中果皮薄壁细胞的细胞壁都分布有AGPs 形成的棕红色沉淀,细胞内部分布较少,部分细胞出现破裂现象(见图2:B~E)。维管束导管分子数量逐渐增多,韧皮部的筛管、伴胞清晰,薄壁细胞丰富,近内果皮维管束数量较少(见图2:E),在近内果皮维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞内外均分布有AGPs 形成的棕红色沉淀,而维管束周围薄壁细胞的部分细胞内外也都分布AGPs形成的棕红色沉淀(见图2:E)。βManY在维管束及薄壁细胞等部位均没有棕红色沉淀(见图2:F)。
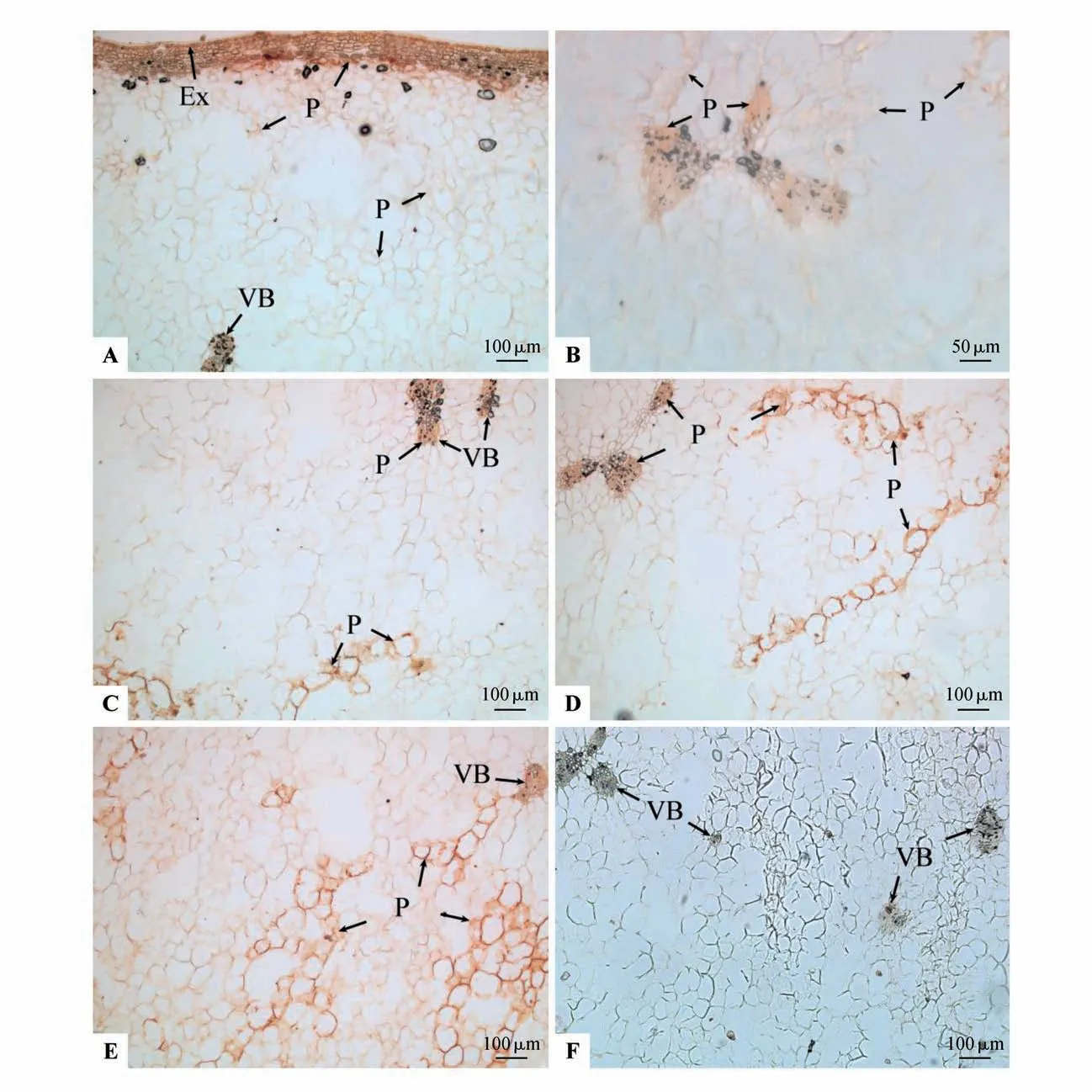
图2 快速膨大期果实AGPs的βGlcY定位A~E.按果实结构由外到内的顺序排列;A.外果皮及内部组织AGPs定位;B.近外果皮维管束及周围组织AGPs定位;C~D.中部中果皮维管束及周围组织AGPs 定位;E.近内果皮的中果皮维管束及周围组织AGPs 定位;F.中果皮维管束及周围组织,示βManY 处理后均没有棕红色沉淀Fig.2 βGlcY distribution of AGPs during the rapid enlargement period A-E.According to the order of fruit structure from outside to inside;A.AGPs distribution in exocarp and internal tissues;B.AGPs distribution in vas⁃cular bundles and surrounding tissues close to exocarp;C-D.AGPs distribution in vascular bundles and surrounding tissues in mid mesocarp;E.AGPs distribution in vascular bundles and surrounding tissues of mesocarp near endocarp;F.Vascular bundles and surrounding tissues of meso⁃carp,showed no brown red precipitate after treatment with βManY
2.3 着色期果实AGPs的βGlcY定位
着色期果实外果皮壁依然较厚,外果皮内由数层排列较为紧密的中果皮小细胞组成,AGPs 形成的棕红色沉淀在细胞壁和细胞内部均有分布(见图3:A)。内部数层大型卵圆形薄壁细胞间隙拉大拉长排列松散,围成空腔的薄壁细胞拉长,而且由于部分细胞的破裂,果实的中果皮空腔数量增多,空腔的体积进一步增大,除空腔之外,AGPs形成的棕红色沉淀均主要在薄壁细胞的细胞壁上,而细胞内部均较少分布,AGPs 形成的棕红色沉淀有所减少(见图3:A~B)。同一视野中分布的维管束数目逐渐明显变少,外部中果皮维管束数量相对较多(见图3:A),果实内部中果皮维管束数量较少(见图3:B~E);维管束的排列与快速膨大期相似,主要有多个维管束相连进而形成多分支结构,木质部和韧皮部细胞发育成熟,除空腔之外,在维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞均分布有AGPs 形成的棕红色沉淀(见图3:A~E)。维管束周围薄壁细胞的细胞壁均分布有AGPs 形成的棕红色沉淀,但大部分薄壁细胞内部无分布(见图3:B~E)。βManY 在维管束及薄壁细胞等部位均没有棕红色沉淀(见图3:F)。
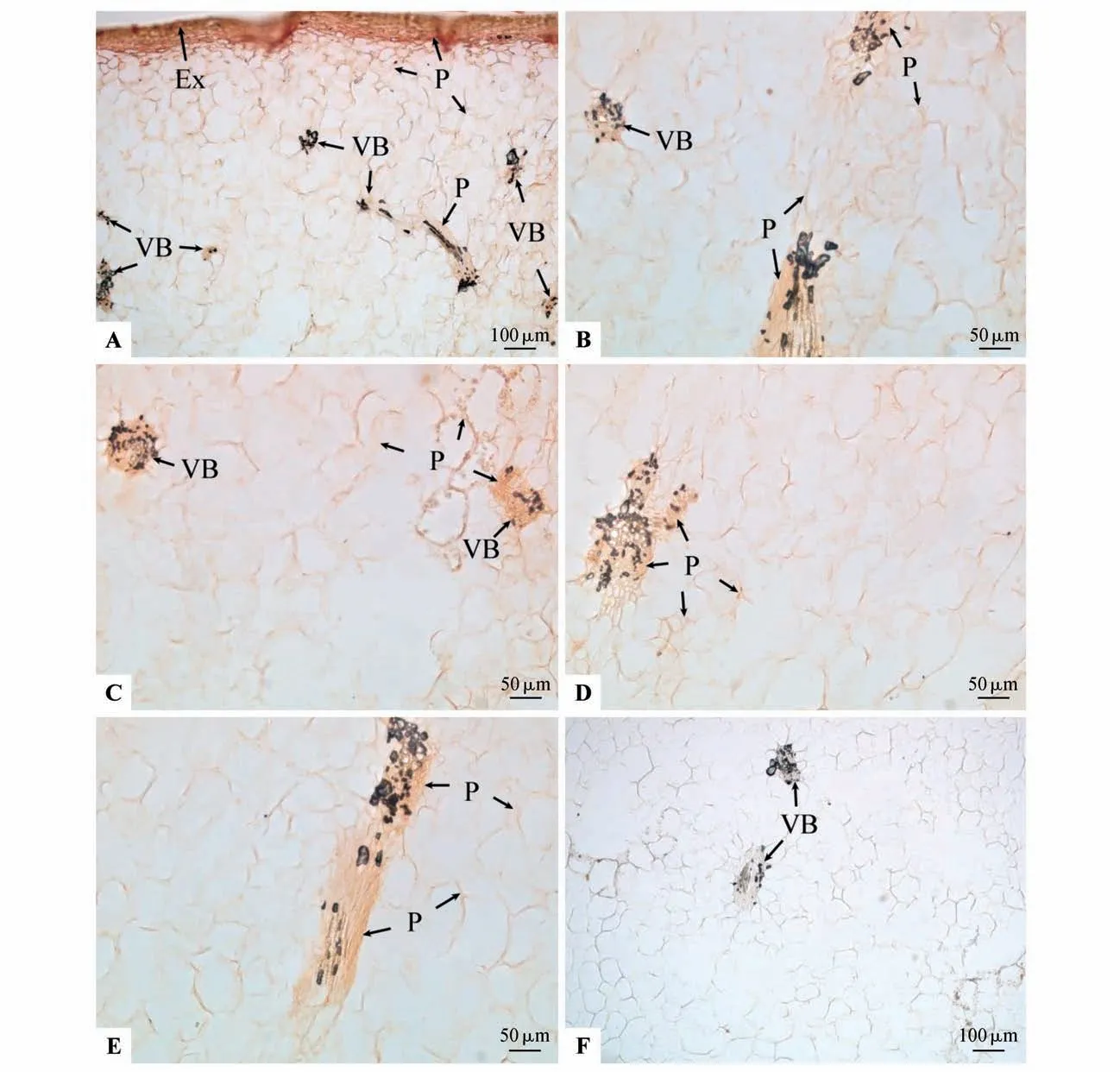
图3 着色期果实AGPs的βGlcY定位Fig.3 βGlcY distribution of AGPs during the the coloring period
2.4 完熟期果实AGPs的βGlcY定位
完熟期果实外果皮壁及紧邻细胞特点与着色期相似,外果皮及内部数层排列较为紧密的中果皮小细胞的细胞壁和细胞内部均分布有AGPs 形成的棕红色沉淀(见图4:A)。相邻的内部较大型的中果皮薄壁细胞间隙拉大排列松散,单列或数列排成网状结构,由于很多细胞的破裂,形成更大的空腔,分布于整个中果皮外部及内部组织,除空腔之外,AGPs 形成的棕红色沉淀均主要在薄壁细胞的细胞壁上,而细胞内部均较少分布,AGPs 形成的棕红色沉淀明显减少(见图4:A~E)。同一视野下维管束数量更少,尤其中果皮最内部的维管束数目减少明显(见图4:C~E),但维管束结构和排列与之前着色期相比亦无明显变化,多个维管束相连形成多分支结构较普遍,导管数目较多,韧皮部薄壁细胞明显,有时相邻维管束链接成线,除空腔之外,在中果皮中部及内部维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞均分布有AGPs 形成的棕红色沉淀(见图4:A~E)。中果皮中部和内部维管束周围薄壁细胞的细胞壁均分布有AGPs 形成的棕红色沉淀,但大部分薄壁细胞内部无分布(见图4:B~E)。βManY 在维管束及薄壁细胞等部位均没有棕红色沉淀(见图4:F)。
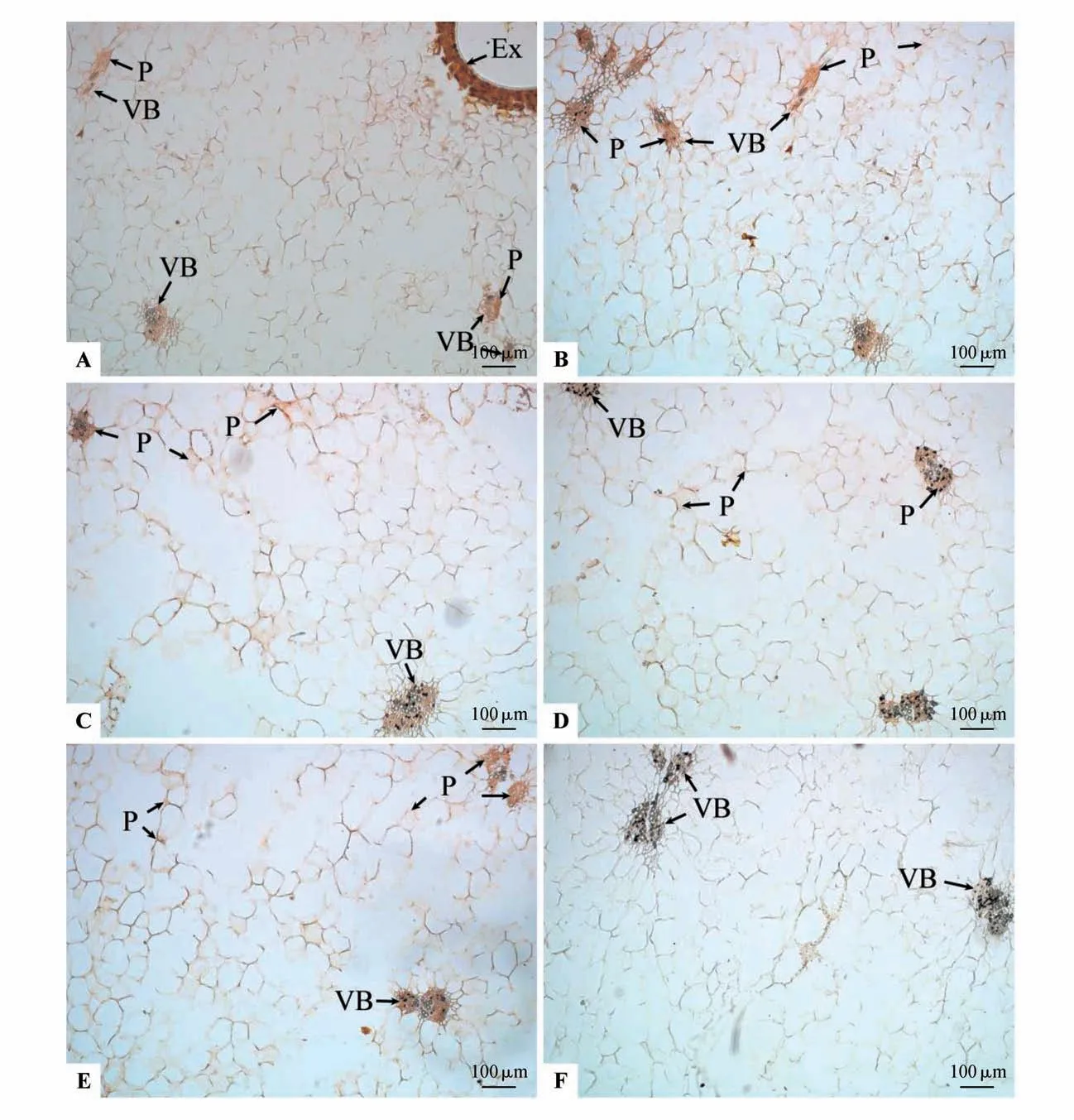
图4 完熟期果实AGPs的βGlcY定位Fig.4 βGlcY distribution of AGPs during the maturation period
2.5 膨大前期果实AGPs免疫荧光分布
膨大前期果实外果皮、紧邻外果皮的数层排列较为紧密以及内部相邻数层排列较疏松大型中果皮细胞的细胞壁和细胞内部均分布有MAC204 抗体识别的抗原绿色荧光信号(见图5:A1~B2)。在维管束的维管束鞘、木质部、韧皮部、形成层所有细胞的细胞壁和细胞内部均分布有MAC204 抗体识别的抗原(见图5:A1~C2)。中间部分的中果皮薄壁细胞排列较疏松,除了空腔之外,大部分薄壁细胞和组成维管束的各细胞都分布有MAC204 抗体识别的抗原(见图5:A1~C2)。而靠近内果皮的中果皮细胞排列紧密,内果皮附近的维管束分布数量较多且集中,除空腔之外,在靠近内果皮的大部分薄壁细胞以及维管束鞘、木质部、韧皮部、形成层的所有细胞均分布有MAC204 抗体识别的抗原绿色荧光(见图5:D1~D2)。
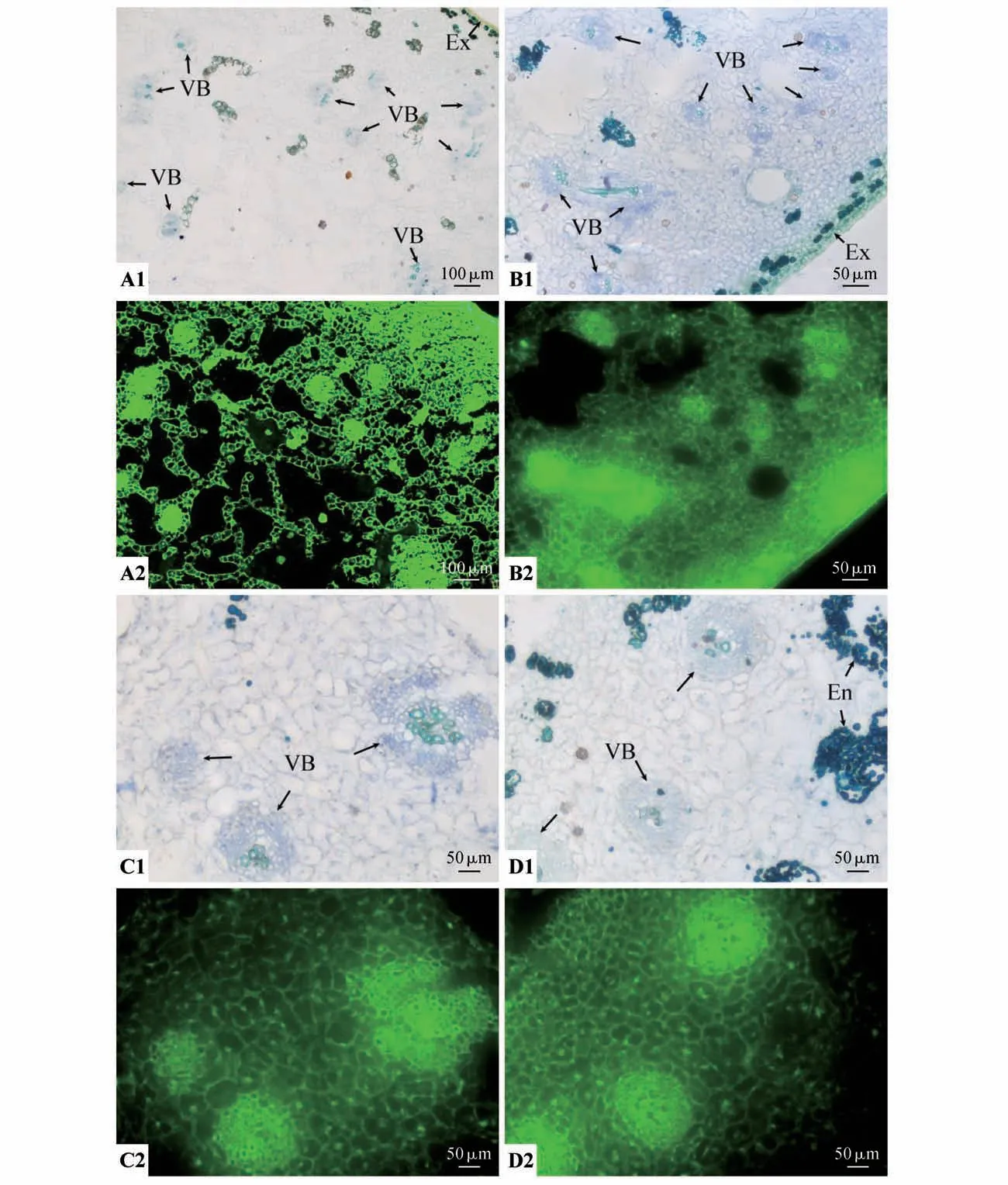
图5 膨大前期果实MAC204抗体的免疫荧光分布A1,B1.外果皮及内部组织结构;A2,B2.外果皮及内部组织免疫荧光分布;C1.中部中果皮维管束及周围组织结构;C2.中部中果皮维管束及周围组织免疫荧光分布;D1.近内果皮的中果皮维管束及周围组织结构;D2.近内果皮的中果皮维管束及周围组织免疫荧光分布;A1~D1为明场图;A2~D2分别为对应的荧光图Fig.5 Immunofluorescence distribution of MAC204 antibody during the early bulking period A1,B1.Structures of exocarp and internal tissues;A2,B2.Immunofluorescence distribution of exocarp and internal tissues;C1.Structures of vascu⁃lar bundles and surrounding tissues in mid mesocarp;C2.Immunofluorescence distribution of vascular bundles and surrounding tissues in mid meso⁃carp;D1.Structures of vascular bundles and surrounding tissues of mesocarp near endocarp;D2.Immunofluorescence distribution of vascular bun⁃dles and surrounding tissues of mesocarp near endocarp;A1-D1 show the bright field;A2-D2 show the corresponding fluorography,respectively
2.6 快速膨大期果实AGPs免疫荧光分布
快速膨大期果实MAC204 抗体识别的抗原绿色荧光在外果皮细胞壁和细胞内部均有分布,外果皮内数层排列较为紧密的中果皮小细胞细胞壁和细胞内部均明显分布MAC204 抗体识别的抗原(见图6:A1~A2)。内部数层大型卵圆形薄壁细胞MAC204抗体识别的抗原均主要分布于细胞壁上,部分细胞内部无分布(见图6:A1~A2)。维管束主要分布在中果皮的中部和内部,在维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞内外均分布有MAC204抗体识别的抗原(见图6:A1~B2)。除了空腔之外,维管束周围的中果皮薄壁细胞的细胞壁都分布有MAC204 抗体识别的抗原,部分细胞内部无分布(见图6:A1~B2)。近内果皮维管束数量较少,在近内果皮维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞内外均分布有MAC204抗体识别的抗原,近内果皮维管束周围大部分薄壁细胞的细胞内外都分布有MAC204 抗体识别的抗原,薄壁细胞出现破裂现象(见图6:C1~D2)。
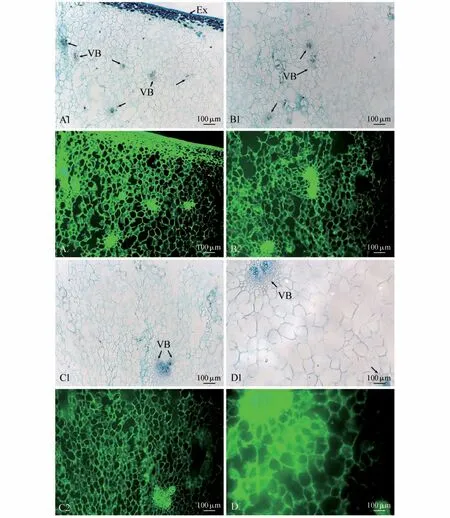
图6 快速膨大期果实MAC204抗体的免疫荧光分布A1-D1,A2-D2.按果实结构由外到内的顺序排列;A1.外果皮及内部组织结构;A2.外果皮及内部组织免疫荧光分布;B1.近外果皮维管束及周围组织结构;B2.近外果皮维管束及周围组织免疫荧光分布;C1.中部中果皮维管束及周围组织结构;C2.中部中果皮维管束及周围组织免疫荧光分布;D1.近内果皮的中果皮维管束及周围组织结构;D2.近内果皮的中果皮维管束及周围组织免疫荧光分布;下同Fig.6 Immunofluorescence distribution of MAC204 antibody during the rapid enlargement period A1-D1,A2-D2.According to the order of fruit structure from outside to inside;A1.Structures of exocarp and internal tissues;A2.Immunofluores⁃cence distribution of exocarp and internal tissues;B1.Structures of vascular bundles and surrounding tissues near exocarp;B2.Immunofluorescence distribution of vascular bundles and surrounding tissues near exocarp;C1.Structures of vascular bundles and surrounding tissues in mid mesocarp;C2.Immunofluorescence distribution of vascular bundles and surrounding tissues in mid mesocarp;D1.Structures of vascular bundles and surround⁃ing tissues of mesocarp near endocarp;D2.Immunofluorescence distribution of vascular bundles and surrounding tissues of mesocarp near endo⁃carp;The same as below
2.7 着色期果实AGPs免疫荧光分布
着色期果实外果皮及内部数层排列较为紧密的中果皮小细胞细胞壁和细胞内部均有MAC204抗体识别的抗原绿色荧光信号分布(见图7:A1~A2)。除空腔之外,内部数层大型卵圆形薄壁细胞MAC204 抗体识别的抗原绿色荧光信号均主要在薄壁细胞的细胞壁上,而细胞内部均较少分布,荧光有所减少(见图7:A1~B2)。多个维管束相连进而形成了多分支结构,除空腔之外,在维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞均分布有MAC204 抗体识别的抗原(见图7:A1~D2)。维管束周围薄壁细胞的细胞壁均分布有MAC204 抗体识别的抗原,但大部分薄壁细胞内部无荧光信号(见图7:A1~D2)。
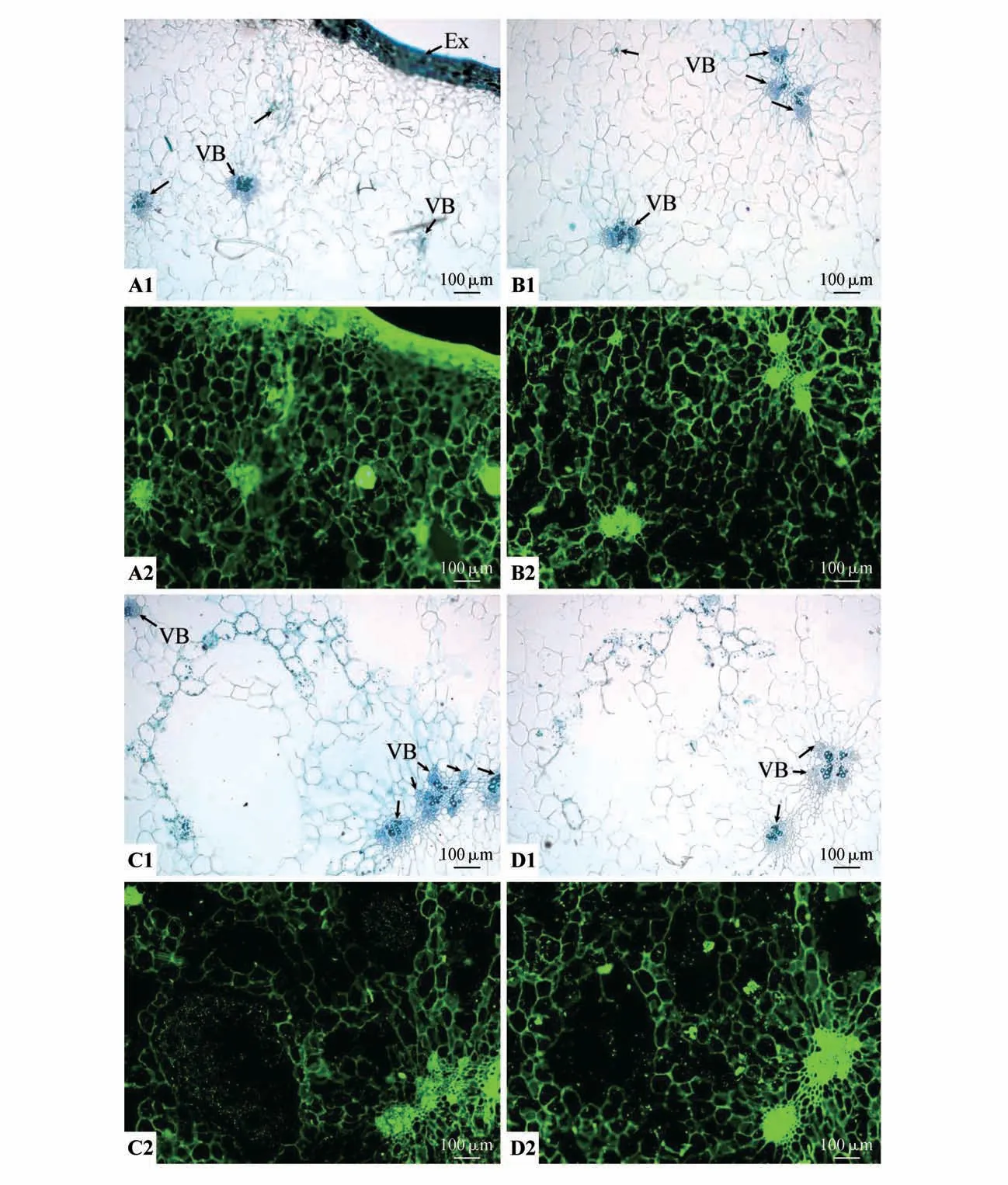
图7 着色期果实MAC204抗体的免疫荧光分布Fig.7 Immunofluorescence distribution of MAC204 antibody during the coloring period
2.8 完熟期果实AGPs免疫荧光分布
完熟期果实外果皮及内部数层排列较为紧密的中果皮小细胞的细胞壁和细胞内部均分布有MAC204 抗体识别的抗原绿色荧光信号(见图8:A1~A2)。相邻的内部较大型的中果皮薄壁细胞MAC204 抗体识别的抗原绿色荧光信号均主要在薄壁细胞的细胞壁上,而细胞内部均较少分布,与之前时期相比荧光明显减少,很多细胞破裂明显(见图8:A1~D2)。维管束数目减少明显,维管束排列与之前着色期相比亦无明显变化,在中果皮中部及内部维管束的维管束鞘、木质部、韧皮部、形成层的所有细胞均分布有MAC204 抗体识别的抗原(见图8:B1~D2)。中果皮中部和内部维管束周围薄壁细胞的细胞壁均分布有MAC204 抗体识别的抗原,但大部分薄壁细胞内部无绿色荧光信号(见图8:B1~D2)。
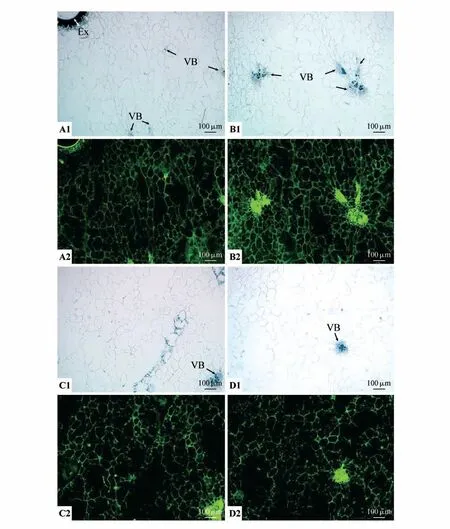
图8 完熟期果实MAC204抗体的免疫荧光分布Fig.8 Immunofluorescence distribution of MAC204 antibody during the maturation period
3 讨论
由于βGlcY 是一种特异性结合和沉淀AGPs的合成红棕色染料,可以与AGPs 发生特有的反应,故而应用于植物组织中AGPs 的定位和定量检测。Trifunović 等[14]利 用βGlcY 溶 液 对 百 金 花(Centaurium erythraea)根的徒手横切片染色处理,βGlcY 对根表皮细胞和维管组织中AGPs 强烈的染色形成红棕色沉淀,证实了βGlcY 特异性地染色并沉淀AGPs,以此为基础测定了不同组织中AGPs 的含量。除此之外,现有研究更多的是利用βGlcY 能与AGPs 发生特异结合的特性,对AGPs进行分离纯化[10-11]、研究AGPs 的功能及定量检测[15],而AGPs 的定位和分布更多采用的是免疫学的方法或技术。本试验利用βGlcY 对AGPs 特异结合和沉淀,创新应用Steedman’s wax低熔点多酯蜡切片,较系统地揭示了不同发育时期果实AGPs的分布特征,为AGPs的定位尝试了新途径。
AGPs 是细胞内非常重要的糖蛋白,在雌雄配子体发育、花药发育与花粉管生长、体细胞胚胎发生等方面AGPs的研究非常深入[7-8],而果实发育中AGPs 的研究较少[9-11]。细胞壁由纤维素微纤丝与半纤维素交联成网状结构埋于无定形状态的果胶质中,还包括少量的AGPs 等细胞壁结构蛋白[20]。因此,细胞壁不仅决定植物细胞整体形态的重要骨架,更重要的是通过AGPs 参与多种生命活动[20]。本试验研究表明,灵武长枣不同发育时期果实外果皮及内部数层排列较为紧密的中果皮小细胞,以及维管束的维管束鞘、木质部和韧皮部所有细胞的细胞壁和细胞内部始终分布有βGlcYAGPs形成的棕红色沉淀和MAC204抗体识别的抗原。我们认为:第一,外果皮及相邻的内部数层排列紧密的中果皮小细胞的细胞壁和细胞内部持续高含量AGPs 的分布,为果实正常发育提供了保护屏障。AGPs 可能参与了细胞分裂及生长过程中纤维素等细胞壁物质的组装[21]。第二,AGPs 可能参与了木质部细胞的生长发育,以及纤维素、半纤维素和木质素等细胞壁物质的沉积增厚等过程。研究表明,作为一种细胞间相互作用的AGPs 分子,尽管木质素并不是维管组织分化必需的成分,但却发挥了维管束发育过程中细胞之间信息传递的功能,介导了木质部导管的分化[22],AGPs 的时空表达与木质素分化相关,并且可作为形成初生木质部起始细胞的标志[23]。第三,维管束韧皮部为果实的生长发育和营养物质的积累提供了保障。果实膨大前期至快速膨大期,需要大量的营养物质来满足组织的发育和器官的建成,因而韧皮部及维管束鞘周围细胞中分布有大量βGlcYAGPs形成的棕红色沉淀和MAC204抗体识别的抗原,AGPs 可能从韧皮部运输到维管束鞘周围细胞中,作为一种营养物质为果实的持续快速生长提供了物质保障[4]。研究表明,烟草(Nicotiana taba⁃cum)花粉管在花柱生长的过程中,AGPs 从引导组织向花粉管转移,花柱组织AGPs 与花粉管的生长密切相关,为花粉管的生长提供营养支持[4]。果实维管束韧皮部及附近周围细胞中持续高含量AGPs 的存在,以及它们主要在细胞壁和细胞质中的分布特点,表明韧皮部中丰富的AGPs 可能为果实发育提供营养支持,AGPs 高含量的糖基是提供营养支持的物质基础。果实维管组织中存在大量的AGPs,为其参与果实维管组织的形成提供了一个有利的佐证,因此推测AGPs 参与了灵武长枣果实维管束发育过程的形态建成。
AGPs 不仅是果实细胞壁多糖的组分,而且可能参与了果实多糖形成和积累。研究表明,宁夏枸杞多糖属于AGPs,是包括AGPs 在内的一种异质性多糖[10,12];宁夏枸杞果实第一次快速生长期,MAC204抗体识别的荧光信号在外果皮细胞最强,中果皮薄壁细胞边缘、维管束以及内果皮细胞都具有较强的荧光;从缓慢生长期到第二次快速生长期,荧光主要分布在外果皮上,随着果实发育整体AGPs 荧光强度减弱,AGPs 可能参与了宁夏枸杞发育后期果实多糖的积累[11]。与宁夏枸杞研究结果相似,本研究发现,灵武长枣果实内部的中果皮大型卵圆形薄壁细胞的细胞壁和细胞内在膨大前期均有βGlcY-AGPs 形成的棕红色沉淀和MAC204抗体识别的抗原分布,果实细胞结构相对完整,而快速膨大期、着色期和完熟期果实βGlcYAGPs形成的棕红色沉淀和MAC204抗体识别的抗原均主要分布于细胞壁上,大部分细胞内部无分布;随着果实发育成熟,AGPs 分布逐渐减少,细胞壁从结构疏松进一步发展到后期细胞壁的逐渐解体消失,而同时果实多糖含量却显著增高至最高[13],说明AGPs 可能参与了灵武长枣发育后期果实多糖的积累。本课题组以往研究还发现,着色期至完熟期果实韧皮薄壁细胞不同形态的囊泡比较丰富,内质网、线粒体等细胞器的数目增多[24]。因此,根据中果皮薄壁细胞在果实发育后期,发生的质膜内陷形成大量囊泡和细胞壁的解体等结构变化,以及灵武长枣果实发育后期βGlcY-AGPs 形成的棕红色沉淀和MAC204 抗体识别的抗原分布逐渐减少,而果实多糖含量却显著增高至最高的研究结果[13],推测果实多糖在AGPs 参与下可能由薄壁细胞壁解体或细胞分解形成,可能通过囊泡运输形式从薄壁细胞壁卸出,并向果肉库薄壁细胞或其它部位积累运输。Leszczuk 等[9]认为,苹果(Malus pumila)在成熟软化过程中观察到的细胞壁-质膜连续体的破坏,既与AGPs 和果胶含量的大幅下降有关,也与它们的排列重塑有关,AGPs和果胶是影响果实结构的重要动态成分;果实成熟软化的过程与细胞壁的重塑有关,主要是AGPs含量和果胶多糖的降低以及它们在细胞壁表面的排列方式的改变。但是,阐明调节AGPs 分布变化的机制以及与其他细胞外基质成分的关系,需要进一步的探索,这将有助于更好地阐明AGPs 在果实品质中的功能。
因此,各时期灵武长枣果实AGPs 的分布存在一定的差异,AGPs 可能参与了果实维管束发育过程的形态建成、为果实发育提供保护和营养支持及多糖物质积累。研究结果为果实AGPs 相关研究提供了借鉴和参考,但揭示调节AGPs 分布变化的机制及其与AGPs 功能的关系,需要进一步通过分子生物学、分析化学、超微细胞化学等方面的研究,为阐明AGPs 分布、基因表达、分子结构与其功能和果实品质调控间的关系奠定基础。
