黄芩苷介导RIPK1/RIPK3/MLKL信号通路对RPE细胞调控作用的研究
2022-12-03王珍李潆吕海江王露郑博李亚静
王珍,李潆,吕海江,王露,郑博,李亚静
年龄相关性黄斑变性(age-related macular degeneration,AMD)作为一种复杂多因素的视网膜变性疾病,是目前临床上老年人致盲的主要病因[1-2]。越来越多的研究[3-4]发现,由受体相互作用蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)、受体相互作用蛋白激酶3(receptorinteracting protein kinase 3,RIPK3)和混合系列蛋白激酶结构域样蛋白(mixed lineage kinase domainlike,MLKL)所构成的RIPK1/RIPK3/MLKL 信号通路,可能通过介导视网膜色素上皮(retinal pigment epithelium,RPE)细胞的坏死性凋亡在干性年龄相关性黄斑变性(dry age-related macular degeneration,dAMD)中发挥作用[5-6]。黄芩苷是中药黄芩的主要活性成分,具有抗炎、抗病毒、抗菌、抗氧化等多种作用[7-8],可通过多种途径抑制RPE 细胞的损伤凋亡,进而保护RPE 细胞[9-10]。但是,黄芩苷在保护RPE细胞以及对dAMD起到积极干预作用的具体机制错综复杂,本实验以RIPK1/RIPK3/MLKL 信号通路为研究切入点,明确该信号通路参与RPE 细胞的坏死性凋亡以及黄芩苷对RPE 细胞的调控作用,报道如下。
1 材料与方法
1.1 药品、试剂与仪器
RPE 细 胞ARPE-19(美 国American Tissue Culture Collection 公司),细胞计数试剂-8(cell counting kit-8,CCK-8)试剂盒、4'6-二脒基-2-苯基吲哚(4'6-Diamidino-2-Phenylindole,DAPI,中国上海碧云天生物技术研究所,C0037、C1002),胎牛血清(美国犹他州大学,SH30070.03),黄芩苷(中国Selleck生物科技有限公司,S2269),蛋白印迹膜再生液(北京佰奥莱博生物科技有限公司,ZN1923),RIPK1抗体、RIPK3抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、山羊抗兔IgG 抗体(艾博抗贸易有限公司,ab300617、ab226297、ab8245、ab205718),高迁移率族蛋白B1(high mobility group box 1,HMGB1)抗体(美国Cell Signaling Technology公司,6893)。
水套式CO2培养箱(赛默飞世尔科技公司,Forma 3111),超净化工作台(苏州净化设备有限公司,SW-CJ-2FD),微孔板式多功能酶标仪(德国伯托公司,LB941),Western Blot 系统(伯乐生命医学产品有限公司,转印槽:Trans-Blot;电泳槽:Criterion™)。
1.2 细胞培养
标准培养条件下,在含有青霉素(浓度为100 U/mL)、链霉素(浓度为100 µg/mL)、10%胎牛血清的培养基中培养ARPE-19 细胞,在37℃含5%CO2和95%湿度的空气中孵育。当细胞融合至85%时,弃去旧培养基,洗涤消化后收集细胞。离心后以1∶3 的比例进行传代,2 d 进行1 次换液,稳定传代后取2~4 代用于实验。
1.3 分组与处理
将ARPE-19 细胞分为3 个组:(1)对照组(control group,CG),正常培养48 h;(2)模型组(model group,MG),先正常培养24 h 后,给予含1 mg/mL 碘酸钠的完全培养基刺激24 h;(3)黄芩苷组(baicalin group,BG),黄芩苷浓度设定为,0.1、1.0、10.0、25.0、50.0、100.0、200.0 µmol/L,含有以上不同浓度黄芩苷的培养基孵育24 h 后,给予含1 mg/mL碘酸钠的完全培养基刺激24 h。按照上述分组处理方式处理后,再继续培养24、48、72 h。
1.4 CCK-8法检测ARPE-19细胞活力
在96 孔板中接种ARPE-19 细胞悬液,在培养箱中预培养,分组处理细胞后,每孔加10 µL 的CCK-8 溶液,在培养箱内避光孵育2 h,以酶标仪测定450 nm处的光密度(optical density,OD)值。
1.5 免疫荧光法观察细胞形态
吸出各组对数生长期的ARPE-19细胞培养液,进行DAPI 染色,洗涤后封片,在倒置荧光显微镜下观察各组细胞的形态。
1.6 Western Blot 法检测各组细胞RIPK1、RIPK3、HMGB1蛋白的表达水平
从ARPE-19 细胞中分别提取总蛋白20 µg,经凝胶、电泳和转膜后用5%脱脂奶粉室温封闭1 h,与RIPK1 抗体(稀释比例1∶1,000)、RIPK3 抗体(稀释比例1∶5,000)、HMGB1 抗体(稀释比例1∶1,000)、GAPDH 抗体(稀释比例1∶1,000)一抗(均为鼠抗)在4℃下孵育过夜后,洗涤3 次,与二抗(山羊抗兔,稀释比例1∶5,000)孵育1 h,再次洗涤3 次后进行显影。用酶标仪测定光密度(optical density,OD)值,根据标准曲线计算出蛋白浓度。
1.7 统计学方法
采用Graphpad Prism 5 统计软件对数据进行分析,计量资料数据采用均数±标准差()表示,符合正态分布且方差齐的计量资料,方差分析(ANOVA)进行多组变量间的相互比较,两两比较采用LSD-t检验。当P<0.05时,认为差异有统计学意义。
2 结果
2.1 黄芩苷安全浓度范围测定
8组间不同浓度黄芪苷处理ARPE-19细胞24 h后的细胞活力比较,差异有统计学意义(F=36.120,P=0.000)。两两比较:与0 µmol/L 组比较,0.1、1.0、10.0、25.0 µmol/L 组的细胞活力差异无统计学意义(均P>0.05),50.0、100.0、200.0µmol/L 组的细胞活力均降低,差异有统计学意义(t50.0=3.236,P=0.032;t100.0=6.165,P=0.004;t200.0=7.840,P=0.001)。与25.0 µmol/L 组比较,1.0、10.0、50.0 µmol/L 组的细胞活力差异无统计学意义(均P>0.05),0.1µmol/L组的细 胞活力升高(t=4.848,P=0.008),100.0、200.0 µmol/L 组的细胞活力降低(t100.0=9.714,P=0.001;t200.0=9.485,P=0.001),差异均有统计学意义。因此,黄芩苷的安全浓度范围为0~25.0µmol/L(表1)。
表1 不同浓度黄芩苷对ARPE-19细胞活性的影响(,n=3)

表1 不同浓度黄芩苷对ARPE-19细胞活性的影响(,n=3)
注:* 与0 µmol/L 组比较,P<0.05;# 与25.0 µmol/L 组比较,P<0.05
2.2 黄芩苷对ARPE-19细胞的最佳有效浓度
6 组间细胞活力比较,差异有统计学意义(F=75.789,P=0.000)。两两比较,与CG 组比较,其余各组细胞活力均下降,差异有统计学意义(tMG=12.769,t0.1=12.137,t1.0=10.542,均P=0.000;t10.0=8.188,P=0.001;t25.0=5.237,P=0.006);与MG 组比较,黄芩苷1.0、10.0、25.0µmol/L 浓度组细胞活力均上升,差异有统计学意义(t1.0=4.869,P=0.008;t10.0=8.824,P=0.001;t25.0=9.854,P=0.001),0.1 µmol/L 浓度组细胞活力差异无统计学意义(P>0.05)。当黄芩苷浓度为25.0 µmol/L 时,细胞活性最高,与0.1、1.0、10.0µmol/L 浓度组比较,差异均有统计学意义(t0.1=8.987,P=0.001;t1.0=6.809,P=0.002;t10.0=3.320,P=0.029),故本实验选择25.0µmol/L 黄芩苷进行后续试验(表2)。
表2 黄芪苷对ARPE-19细胞的最佳有效浓度(,n=3)

表2 黄芪苷对ARPE-19细胞的最佳有效浓度(,n=3)
注:* 与CG 组比较,P<0.05;# 与MG 组比较,P<0.05;&与25.0µmol/L组比较,P<0.05;CG 对照组;MG 模型组;BG 黄芩苷组
2.3 黄芩苷对ARPE-19细胞的最佳给药时间
3 组间不同给药时间的细胞活力比较,差异有统计学意义(F24h=46.332,F48h=82.269,F72h=210.724,均P=0.000)。两两比较,(1)24 h:与CG 组比较,MG 组细胞活力下降(t=8.118,P=0.001);与MG 组比较,BG 组细胞 活力升 高(t=8.632,P=0.001),差异均有统计学意义。(2)48 h:与CG 组比较,MG 组细胞活力下降(t=12.330,P=0.000);与MG组比较,BG组细胞活力升高(t=12.148,P=0.000),差异均有统计学意义。(3)72 h:与CG组比较,MG组细胞活力下降(t=26.873,P=0.000);与MG 组比较,BG组细胞活力升高(t=10.539,P=0.000),差异均有统计学意义(表3)。上述数据表明,与MG 组比较,在不同的给药时间BG 组的细胞活力均有提高,故最短的24 h为最佳给药时间。
表3 黄芩苷对ARPE-19细胞的最佳给药时间(,n=3)
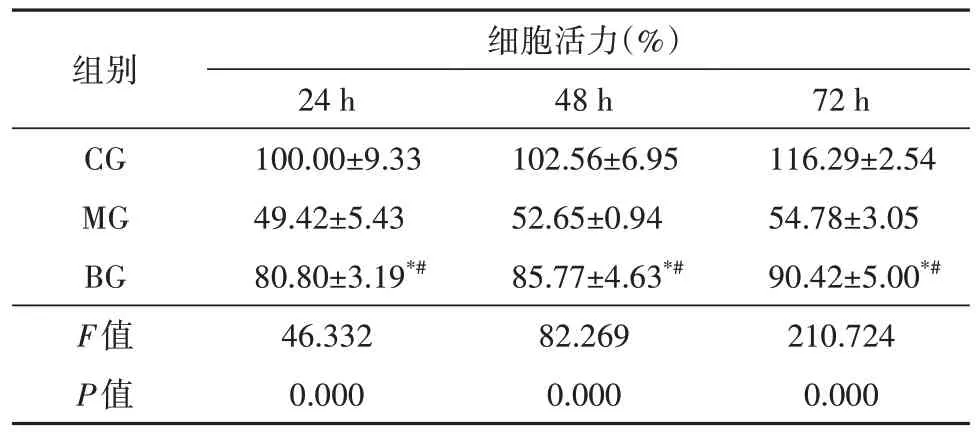
表3 黄芩苷对ARPE-19细胞的最佳给药时间(,n=3)
注:*与CG 相比,P<0.05;#与MG 相比,P<0.05;CG 对照组;MG模型组;BG 黄芩苷组
2.4 黄芩苷对ARPE-19细胞形态的影响
在24 h、48 h 或72 h 时,CG 组ARPE-19 细胞核均呈强荧光,细胞质无荧光;MG组ARPE-19细胞核均呈现核浓缩,染色加深,部分细胞表现为核碎裂;BG 组ARPE-19 细胞核均呈现强荧光,核碎裂现象减少(图1)。

图1 黄芩苷对ARPE-19细胞形态的影响(免疫荧光染色,×400)
2.5 黄芩苷对ARPE-19 细胞RIPK1/RIPK3/MLKL信号通路的影响
检测黄芩苷给药24 h 后的ARPE-19 细胞RIPK1、RIPK3 和HMGB1 蛋白的表达水平,结果显示,3 组间RIPK1、RIPK3、HMGB1 表达水平比较,差异有统计学意义(FRIPK1=34.303,FRIPK3=31.690,FHMGB1=11.148,均P=0.000)。两两比较,(1)RIPK1:与CG组比较,MG 组RIPK1 表达水平升高(t=7.352,P=0.002);与MG组比较,BG组RIPK1表达水平下降(t=7.012,P=0.002),差异均有统计学意义。(2)RIPK3:与CG 组比较,MG 组RIPK3 表达水平升高(t=6.926,P=0.002);与MG 组比较,BG 组RIPK3 表达水平下降(t=6.085,P=0.004),差异均有统计学意义。(3)HMGB1:与CG 组比较,MG 组HMGB1 表达水平升 高(t=3.785,P=0.019);与MG 组比较,BG 组HMGB1表达水平下降(t=3.386,P=0.028),差异均有统计学意义(图2、表4)。
表4 黄芩苷对ARPE-19细胞RIPK1/RIPK3/MLKL信号通路的影响(,n=3)

表4 黄芩苷对ARPE-19细胞RIPK1/RIPK3/MLKL信号通路的影响(,n=3)
注:*与CG组比较,P<0.05;#MG组比较,P<0.05;RIPK1受体相互作用蛋白激酶1;RIPK3 受体相互作用蛋白激酶3;HMGB1 高迁移率族蛋白B1;CG 对照组;MG 模型组;BG 黄芩苷组

图2 黄芩苷对ARPE-19细胞RIPK1/RIPK3/MLKL信号通路的影响
3 讨论
目前,AMD 的发病机制尚不十分明确,可能与氧化应激、光损伤、炎症、遗传基因等因素相关[11]。AMD 可分为干性和湿性2 种类型,湿性AMD(wet age-related macular degeneration,wAMD)临床表现严重,但dAMD 发病率更高[12]。dAMD 早期在视网膜下出现一种称为玻璃膜疣的沉积,晚期则出现RPE细胞广泛变性的地图样萎缩,导致严重的视野丧失[13]。现阶段,对于dAMD 则无有效的预防或治疗手段[14]。虽然目前dAMD 的发病机制尚未完全阐明,但有研究[15]发现RPE 细胞的凋亡致使其他正常细胞生理功能缺失,可能导致dAMD 视网膜形成玻璃膜疣沉积,从而增加形成dAMD 的风险。RPE 细胞位于视网膜和脉络膜之间,由表面极化的色素上皮细胞组成,具有多种重要的生理功能[16]。现已有研究[17-20]证实,RPE 细胞的凋亡与dAMD 的发生发展密切相关。
黄芩是一种常见的药用植物,是治疗肺部疾病、黄疸、高血压等最常用的中药[21-22]。近期,越来越多的研究[23-24]发现,黄芩苷对急、慢性炎症有抑制作用和抗过敏作用[25],能通过抗血管生成、抗凋亡、等途径对视网膜病变、AMD 等眼部疾病发挥积极的治疗作用。本研究首先应用不同浓度黄芩苷处理ARPE-19 细胞,通过CCK-8 检测细胞增殖活力,确定了黄芩苷的安全浓度范围为0~25.0µmol/L;然后通过CCK-8 进一步检测各组细胞增殖活力,选择了25.0 µmol/L 的黄芩苷浓度为ARPE-19 细胞干预的最佳有效浓度;最后通过评价各组24 h、48 h、72 h不同时间点的细胞增殖活力,确定选择24 h 作为最佳给药时间。
有研究[5]在AMD患者和模型小鼠中检测到RPE细胞膜通透性降低、RIPK1 和RIPK3 激活、HMGB1释放,且能观察到细胞肿胀、空泡等细胞坏死性凋亡的特征。也有研究[6]证明,在不同AMD 动物模型中,RIPK1 抑制剂能保护RPE 细胞免受坏死性凋亡的影响,维持了视网膜的视觉功能,是临床dAMD治疗候选药物之一。坏死性凋亡是一种由RIPK1 和RIPK3 以及MLKL 介导的促炎细胞死亡形式,可介导HMGB1 的释放,HMGB1 释放的减少提示MLKL通路受到了抑制[26]。本课题组通过前期预实验发现在碘酸钠诱导的人ARPE-19 细胞凋亡模型中,RIPK1、RIPK3、pRIPK3、MLKL、pMLKL、HMGB1 的蛋白表达水平较CG 组升高。由此可见,RIPK1/RIPK3/MLKL 信号通路的激活可能导致了RPE 细胞的坏死性凋亡,并且与RPE 细胞的坏死性凋亡一起参与并促进了dAMD的发生发展。本实验通过免疫荧光法观察细胞形态,结果显示BG 组ARPE-19 细胞核均呈现强荧光,核碎裂现象减少,提示黄芩苷能有效维持ARPE-19 细胞核稳定,抑制细胞增殖,从而保护RPE 细胞。本实验通过Western Blot 实验,经黄芩苷给药24 h 后,发现RIPK1、RIPK3 和HMGB1蛋白表达水平均下调,提示黄芩苷可抑制细胞增殖和相关蛋白表达,从而抑制细胞坏死性凋亡。这些结果表明,在细胞实验中,黄芩苷可抑制ARPE-19 细胞的增殖、维持细胞核的稳定性,下调RIPK1、RIPK3 和HMGB1 蛋白表达,提示黄芩苷可能是新的RIPK1/RIPK3/MLKL 信号通路抑制剂,可以为dAMD的干预以及治疗提供新的策略。
综上所述,本研究结果显示,RIPK1/RIPK3/MLKL 信号通路介导参与了RPE 细胞的坏死性凋亡。黄芩苷通过调控RIPK1/RIPK3/MLKL 信号通路抑制碘酸钠诱导的细胞坏死性凋亡,对RPE 细胞起到保护作用,从而对dAMD 起到积极的干预作用。本研究可为dAMD 的治疗提供新的思路和理论依据,但本实验样本量有限,还需后期扩大样本量进一步验证、研究。
