蝴蝶兰组织培养再生体系的建立
2022-12-01张清凤李啟菊马梅见
张清凤 赵 洁 普 春 李啟菊 马梅见
(昭通市农业科学院,云南昭通 657000)
蝴蝶兰又称蝶兰,为热带多年生名贵花卉,花色品种多,形态美妙,花大色艳,花期持久,一般可达2~3个月,最长可达半年,在热带兰种中素有“兰花皇后”的美称[1-2]。蝴蝶兰是一种高档商品兰花,适于家庭摆设或装扮花篮等。
蝴蝶兰属于单茎性气生兰,过去一般依靠摘心发出叶芽进行繁殖,但该方法对植株损害很大,现在较少采用[2]。蝴蝶兰植株极少发育侧枝,比其他种类的兰花更难进行常规无性繁殖[3]。应用植物组织培养技术进行蝴蝶兰快速繁殖可以缩短繁育周期,获得大量成株,并且可以保持优良性状,维护种质资源,从大量的繁殖后代中获得一定数量的突变体[4]。目前,蝴蝶兰快繁途径主要有:利用各种外植体诱导类原球茎,进而诱导分生苗实现快繁[5-6],不经愈伤组织直接诱导丛生芽[5,7]。
本文对蝴蝶兰组织培养过程中的一系列关键技术进行研究,以期筛选出蝴蝶兰组织培养的最优技术参数,建立蝴蝶兰离体培养再生体系。
1 材料与方法
1.1 试验材料
蝴蝶兰茎尖较难剥离,且易伤植株,因而本试验选用蝴蝶兰的叶片及根尖作为外植体来诱导原球茎。
1.2 试验方法
1.2.1 培养基筛选。为了筛选诱导原球茎较好的培养基,研究人员开展了培养基筛选试验。试验设9个处理,具体见表1。取蝴蝶兰幼嫩叶片进行原球茎诱导,培养温度为24℃,光照强度为1 000 lx,光照时长为12 h/d,培养时间为40 d。

表1 培养基设计 单位:(mg·L-1)
1.2.2 不同外植体对原球茎形成的影响。以H培养基为基本培养基,各选取叶片、根尖外植体60个,研究不同外植体对原球茎形成的影响。培养温度为24℃,光照强度为1 000 lx,光照时长为12 h/d,培养时间为40 d。
1.2.3 温度和光照条件对原球茎形成率的影响。以叶片作为外植体,设置不同温度和光照条件,研究温度和光照条件对原球茎形成率的影响。试验设6个处理,具体见表2。培养时间为40 d。

表2 温度和光照条件设计
1.2.4 活性炭与抗坏血酸对抑制褐变的作用。采用活性炭与抗坏血酸抑制褐变的产生,设6个处理,具体见表3。培养温度为24℃,光照强度为1 000lx,光照时长为12 h/d,培养时间为40 d。

表3 抑制褐变处理设计 单位:(g·L-1)
1.2.5 不同浓度6-BA对原球茎增殖的影响。在蝴蝶兰组织培养中,要达到快速繁殖的目的,必须加快原球茎增殖速度。在原球茎球体阶段进行增殖是最理想的方法。在原球茎形成以后,分别转移到添加1.0、2.0、3.0 mg/L 6-BA的培养基中进行增殖。培养温度为24℃,光照强度为1 000 lx,光照时长为12 h/d,培养时间为60 d。
1.2.6 6-BA、NAA对试管苗生成的影响。蝴蝶兰原球茎转化成试管苗所用的培养基是H培养基,分别添加不同浓度的6-BA和NAA,研究6-BA、NAA对试管苗生成的影响。试验设9个处理,具体见表4。培养温度为24℃,光照强度为2 000 lx,光照时长为12 h/d,培养时间为40 d。

表4 不同浓度6-BA、NAA设计 单位:(mg·L-1)
1.2.7 不同浓度NAA对蝴蝶兰生根的影响。采用H培养基,分别添加 0.1、0.5、1.0 mg/L NAA,研究其对蝴蝶兰生根的影响。培养温度为24℃,光照强度为2 000 lx,光照时长为12 h/d,培养时间为40 d。
2 结果与分析
2.1 培养基筛选
由表5可看出:处理H1诱导出的原球茎最多,形成球状体的外植体百分比最高,为46.7%;处理MS1次之,形成球状体的外植体百分比为36.7%;处理VW1排第三,形成球状体的外植体百分比为30.0%。

表5 不同培养基对蝴蝶兰叶片原球茎状球体形成率的影响
2.2 不同外植体对原球茎形成的影响
如表6所示,叶片的原球茎形成率为56.67%,根尖的原球茎形成率为7.50%,说明用叶片作外植体诱导原球茎的效果好于根尖。

表6 不同外植体对原球茎形成的影响
2.3 温度和光照条件对原球茎形成率的影响
如表7所示,处理B2为最优处理,即在温度为24℃、光照强度1 000 lx、光照时长12 h/d的培养条件下,外植体易诱导形成原球茎球状体,原球茎形成率达到了46.7%。

表7 温度和光照条件对蝴蝶兰原球茎形成率的影响
2.4 活性炭与抗坏血酸抑制褐变效果比较
蝴蝶兰外植体接种后容易褐变,培养体褐变后基本上就死亡了。因此,抑制褐变产生也是培养成功的关键。如表8所示,活性炭和抗坏血酸对抑制褐变产生都有一定的作用。处理T1、T2、T3抑制效果较好,产生褐变外植体的百分比为20%~30%,远低于处理S1、S2、S3,且处理 T1、T2、T3组培苗长势也比较好。

表8 活性炭与抗坏血酸抑制褐变效果比较
2.5 6-BA对原球茎增殖的影响
试验发现:当6-BA浓度为1.0 mg/L时,原球茎长势较差,数目较少,且一部分分化成小苗;当6-BA浓度为3.0 mg/L时,原球茎增殖数目较多,但其中有许多发生了变异;当6-BA浓度为2.0 mg/L时,原球茎长势较为旺盛,且无变异,分化成小苗的也较少。
2.6 6-BA、NAA对试管苗生成的影响
如表9所示:处理3形成试管苗的百分比最多,达88%;处理9次之,形成试管苗的百分比达76%;处理7最少,形成试管苗的百分比达10%。
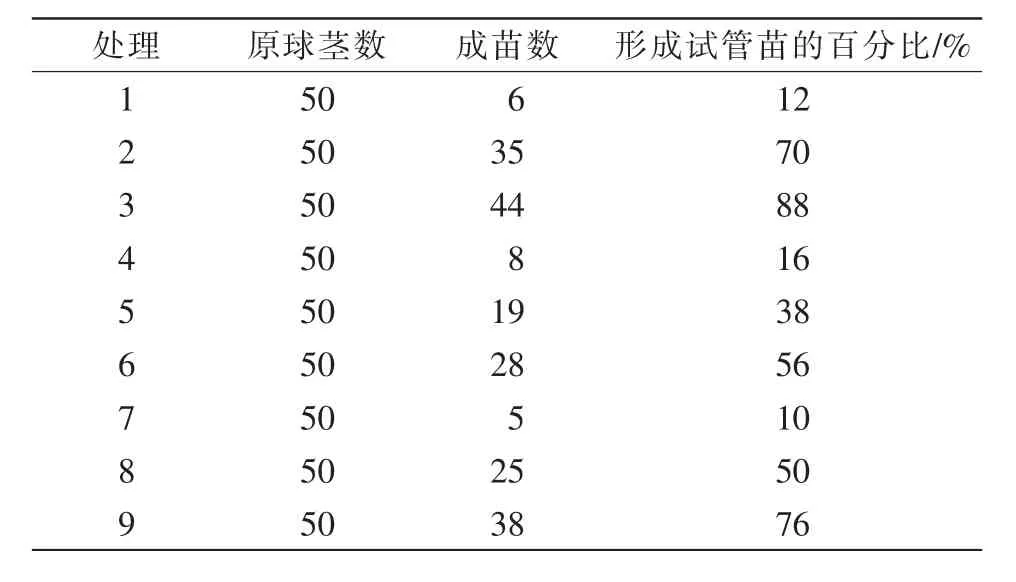
表9 6-BA、NAA对试管苗生成的影响
2.7 不同浓度NAA对蝴蝶兰生根的影响
如表10所示,当NAA浓度为1.0 mg/L时,蝴蝶兰生根数量最多,生根率达100%。

表10 不同浓度NAA对蝴蝶兰生根的影响
3 结论与讨论
在蝴蝶兰组织培养中,H培养基对蝴蝶兰叶片原球茎的诱导效果好于其他培养基。叶片诱导原球茎的效果好于根尖诱导的原球茎。温度24℃、光照强度1 000 lx、光照时长12 h/d的培养条件较适合原球茎生长。在培养过程中加入适量活性炭不仅能有效地抑制褐变产生,而且可起到壮苗作用。在原球茎增殖中,6-BA浓度为2.0 mg/L时增殖效果好。当6-BA浓度为0.5 mg/L、NAA浓度为0.1 mg/L时,形成的试管苗数量最多。当NAA浓度为1.0mg/L时,生根数最多。
在蝴蝶兰组织培养中,切块较大的外植体组织培养成功的概率大于切块小的外植体。幼嫩的根尖、叶片更容易诱导出原球茎,且褐变率较少,同时,在外植体培养初期进行1周的暗培养也可以减少褐变发生。在切块细小、稀疏的培养瓶内,群体生长较慢,而在切块较大且密集的培养瓶内,群体生长旺盛,表现出一定的群体生长效应[3]。另外,在培养过程中加入适量的椰乳、香蕉可增加培养的成功率。蝴蝶兰的实验室资源保存以原球茎继代培养方式为宜,但时间不能太长,最多2~3年,之后要进行原球茎的重新诱导,以免产生变异植株。
