植物MYC1基因拟南芥表达载体构建及鉴定分析
2022-11-29耿庆鎏曹树青
耿庆鎏, 宋 慧, 胡 敏, 曹树青
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
植物在生长发育过程中,为适应复杂多变的自然环境进化出响应不同环境胁迫的生理代谢反应系统,这些系统使植物及时响应环境变化,保障植物的正常生长发育[1]。植物面对的环境胁迫分为生物胁迫(例如真菌、细菌感染,动物啃食)和非生物胁迫(例如寒冷、干旱、营养缺乏、重金属毒害、土地盐碱化)[2]。近年来,环境污染、气候变化等问题日益突出,植物在生长发育过程中更容易受到环境胁迫影响,因此为保障人类粮食生产和食品安全,植物抗逆境研究尤为重要[3]。
铁元素是土壤中含量最高的4种元素之一[4],作为植物需求量最大的微量元素,铁元素是许多蛋白酶的组成成分,在植物的生理代谢反应(如光合作用、呼吸作用)中起氧化还原反应的功能[5]。植物缺铁一般发生在pH>7的碱性或石灰质土壤上[6],由于碱性土壤条件下游离态的铁元素减少,铁元素难以被植物吸收,使植物出现缺铁反应。植物缺铁反应表现为因叶绿素减少引起的叶片失绿,严重时可影响植物生长发育,并且当植物中铁元素过高也会导致植物体内产生过量活性氧造成细胞损伤甚至坏死,植物体内的铁元素含量也受到严格控制[7],因此研究植物的铁吸收及体内铁稳态具有重要意义。
有研究表明,植物BHLH转录因子家族MYC1基因可能介导不同植物非生物胁迫反应[8],本研究以植物MYC1基因为研究对象,构建拟南芥ProMYC1-GUS植株材料,研究该基因在植物缺铁胁迫中的响应机制,为今后的植物非生物胁迫研究和生物技术的应用提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 植物材料
本实验所用植物材料为模式植物拟南芥(Arabidopsisthaliana),哥伦比亚生态型(Columbia,col),购于美国拟南芥种质资源中心(TAIR),由合肥工业大学植物逆境分子生物学实验室培养繁殖。
1.1.2 质粒载体与菌株
重组载体构建所用质粒pART27-GUS、转基因植物材料构建用菌株农杆菌GV3101、大肠杆菌DH5α,均购买于北京全式金生物技术有限公司。
1.1.3 试验用试剂
Ps酶(TaKaRa);San Taq mix、壮观霉素、庆大霉素、卡纳霉素、琼脂糖、酵母粉、蛋白胨、MES(生工生物工程(上海)股份有限公司);胶回收试剂盒、质粒小提试剂盒(TransGen);T4连接酶、限制性内切酶(New England Biolabs);MS(Murashige Skoog)培养基(Sangon Biotech);氯化钠、琼脂、蔗糖、氯化汞、CTAB、氯仿、异戊醇、无水乙醇、苯酚(中国医药集团有限公司);goldview、Silwet L77(北京索莱宝科技有限公司);GUSBlue组织染色试剂盒(北京华越洋生物科技有限公司)。
1.2 实验方法
1.2.1 野生型拟南芥种植
营养土经120 ℃、20 min高温灭菌后与珍珠盐、蛭石以3∶1∶9比例混合拌匀,分装至植物培养用花钵,花钵置于托盘中。向托盘加入适量营养液,营养土完全浸润,每钵播种拟南芥种子5~7颗,花钵由保鲜膜包裹放置于植物培养室,22 ℃、16 h光照/8 h黑暗条件下培养,拟南芥发芽后3 d去掉保鲜膜。
1.2.2 重组载体构建
在TAIR网站(https://www.arabidopsis.org/)查询拟南芥MYC1基因启动子区域序列,通过Primer premier 5.0软件设计该序列上下游引物并合成。上游引物为:
5’-GGGGTACCGAAACATTGTTATTTACTTTGGGACA-3’,
下游引物为:
5’-CCGCTCGAGATCTAGATATCGTGAAGAACTGAATT-3’。
限制性内切酶为KpnⅠ、XhoⅠ,由生工生物工程(上海)股份有限公司合成。
以拟南芥野生型植株基因组DNA为模板对其启动子区域进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,反应结束后,扩增片段进行琼脂糖电泳并回收,回收片段与待连接空载质粒共同进行限制性内切酶双酶切,37 ℃、2 h酶切后片段与质粒回收后16 ℃连接过夜。连接产物全部加入预先制备大肠杆菌DH5α感受态细胞,混匀,热激法转化,均匀涂布于壮观霉素抗性筛选LB固体培养基,37 ℃培养过夜,挑选单菌落PCR鉴定,阳性克隆送测序(生工生物工程(上海)股份有限公司),测序序列与基因启动子区域序列比对成功,重组载体构建成功。
1.2.3 电击法农杆菌转化
电击杯冰上预冷,2 μL重组载体质粒加入预先制备农杆菌GV3101感受态细胞混匀,将感受态细胞转移至电击杯中,放入电转仪。电转仪参数设置为电压1 800 V,电脉冲25 μF,启动电脉冲,待电击结束后电击杯中菌液转移至500 μL LB液体培养基,28 ℃、200 r/min振荡培养4~6 h,均匀涂布于壮观霉素和庆大霉素抗性筛选LB固体培养基,28 ℃培养48 h,挑选单菌落PCR鉴定,阳性克隆菌株甘油保菌-20 ℃保存待用。
1.2.4 浸花法拟南芥侵染
吸取100 μL已鉴定ProMYC1-GUS农杆菌菌液接种于3 mL壮观霉素和庆大霉素抗性LB液体培养基,28 ℃、200 r/min振荡培养活化。取2 mL菌液接种于100 mL壮观霉素和庆大霉素抗性LB液体培养基,28 ℃、200 r/min振荡培养至菌液OD600为1.0~1.3,4 000 r/min离心8 min,取上清液保留菌体,用侵染缓冲液重悬洗涤菌体,重复2次,最后用侵染缓冲液将菌液稀释至OD600为0.5~0.6,并加入终体积分数为0.02%~0.03%的SilwetL-77,混匀待用。选取6周左右,生长发育正常野生型拟南芥植株,提前剪除果荚和已授粉花,花苞浸泡于菌液15~20 s,所有植株完全浸润后保鲜膜包裹并黑暗处理过夜,除去保鲜膜。1周后再次侵染,2周左右收种,烘干后4 ℃春化待用。
1.2.5 转基因阳性植株筛选
配制1/2MS固体培养基,高温灭菌(120 ℃,20 min)后待其冷却至50~60 ℃,加入终质量浓度为50 μg/mL卡纳霉素,混匀后倒入灭菌培养皿,冷却待用。超净台内0.1%氯化汞溶液洗涤侵染植株子代种子1次,无菌水洗涤3次。将洗涤后种子均匀洒在卡纳霉素1/2MS固体培养基,封口膜密封后4 ℃春化3 d,光照培养14 d,选取体型较大,叶子较绿,根系较深植株转移至营养土继续生长,2周后提取基因组DNA,PCR鉴定,去除鉴定阴性植株,4周后单株收种,子代种子点在卡纳霉素1/2MS固体培养基进行抗性分离,筛选纯合体。
1.2.6 GUS染色
将已获得的ProMYC1-GUS阳性植株纯合体种子点在MS固体培养基,4 ℃春化3 d,光照培养7 d后将萌发幼苗转移至MS固体培养基和缺铁MS固体培养基,分为对照组和实验组。培养3 d后用GUS染色液将ProMYC1-GUS阳性植株幼苗染色处理,37 ℃、6 h,75%乙醇溶液脱色后观察。
2 结果与分析
2.1 目的启动子区域片段克隆
为获得目的基因启动子区域DNA片段,以野生型拟南芥基因组DNA为模板,PCR扩增(95 ℃,5 min预变性;95 ℃,30 s变性,55 ℃,30 s退火,72 ℃,2 min延伸,34个循环;72 ℃,5 min,50μL体系),琼脂糖电泳检测结果如图1所示。
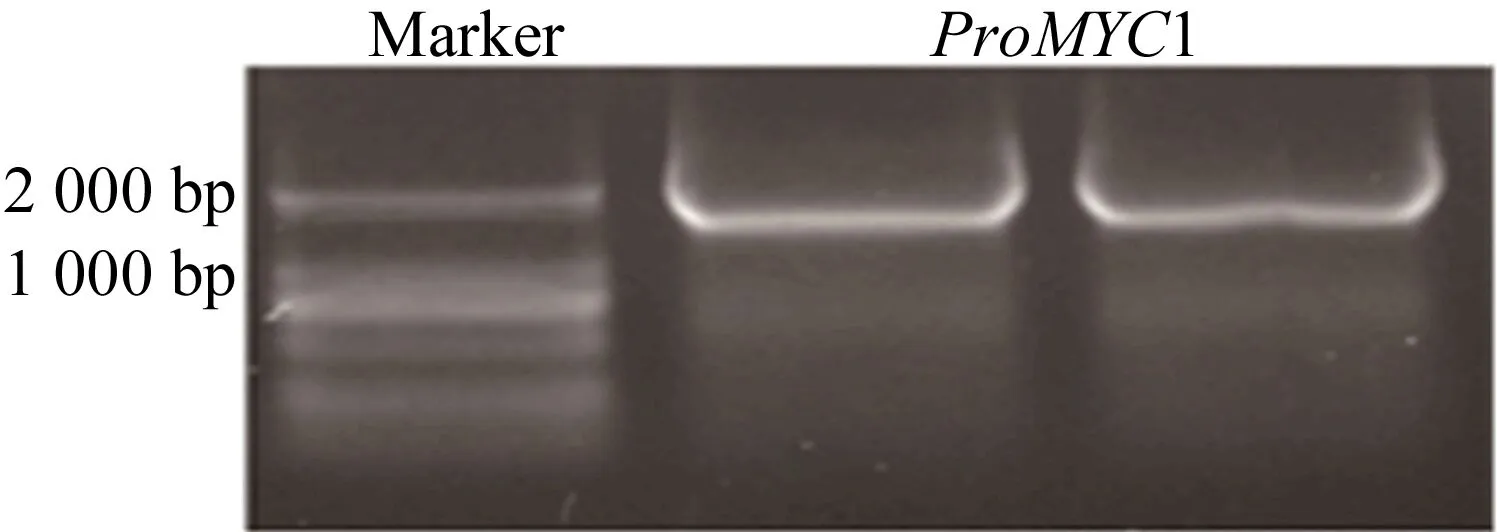
图1 拟南芥MYC1基因启动子片段的克隆
由图1可知,获得的目的片段大小在2 000 bp左右,与引物设计预期片段大小相同。
2.2 目的片段与质粒双酶切连接
34 μL目的片段回收产物与pART27-GUS质粒置于1.5 mL离心管中加入4 μL CutSmart缓冲液,KpnⅠ和XhoⅠ各添加1 μL,混匀离心后37 ℃金属浴酶切2 h。酶切后片段和质粒琼脂糖电泳结果如图2所示。
从图2可以看出,酶切后条带清晰,大小正常,未见拖带、弥散、分层等异常结果,回收酶切片段与质粒。使用T4-DNA连接酶连接体系(酶切片段6.5 μL,酶切质粒2 μL,T4-DNA连接酶缓冲液1 μL,T4-DNA连接酶0.5 μL)连接回收产物,混匀离心后16 ℃金属浴连接16 h,获得连接产物。
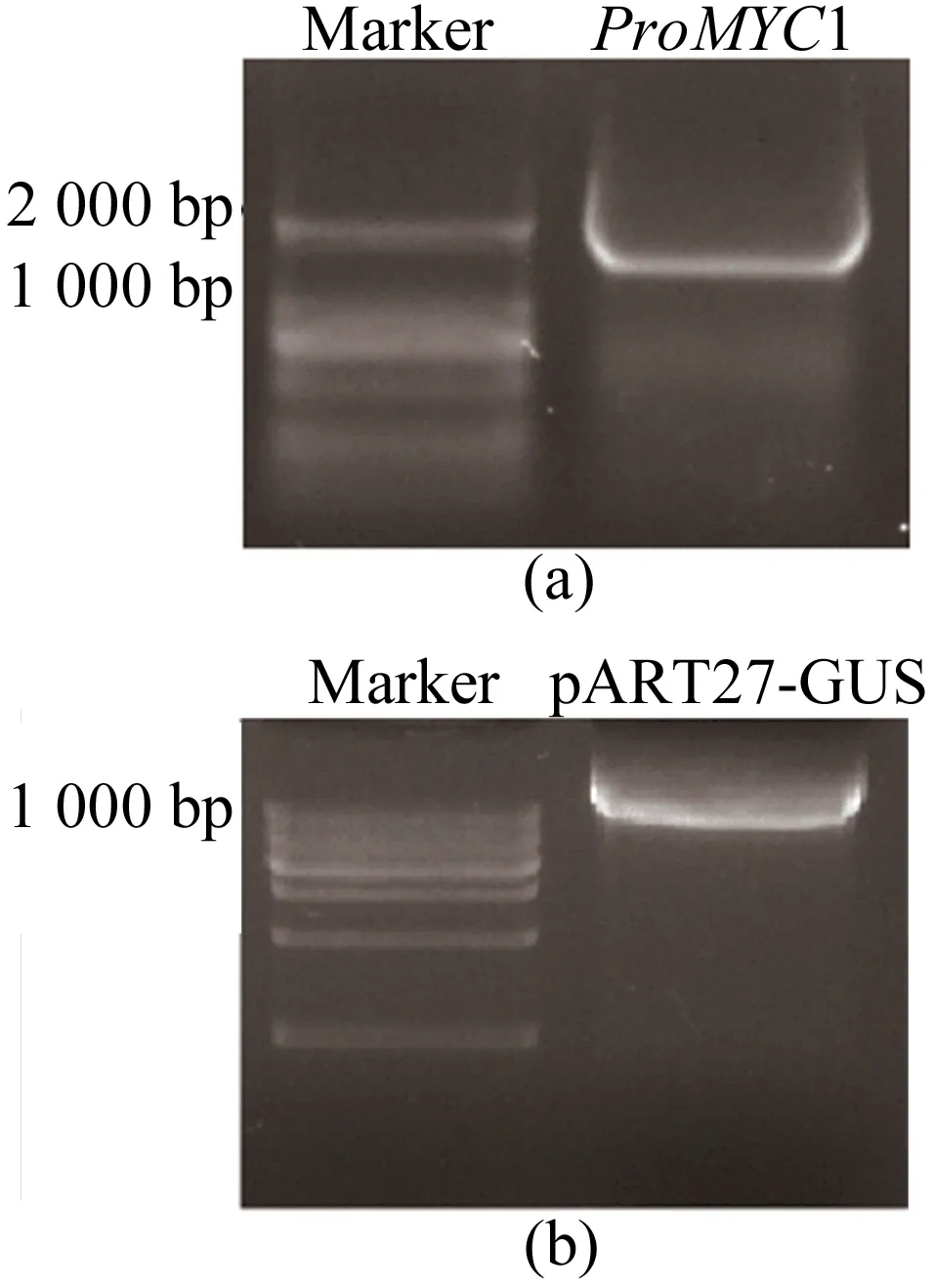
图2 启动子片段与质粒双酶切
2.3 重组载体大肠杆菌转化和阳性克隆鉴定
将10 μL连接产物加入50 μL预先制备的大肠杆菌DH5α感受态细胞,冰浴30 min,42 ℃热激1 min,再冰浴2 min,加入500 μL无抗性LB液体培养基,37 ℃、200 r/min振荡培养1 h,均匀涂布于壮观霉素抗性筛选LB固体培养基,37 ℃培养过夜后挑取单菌落培养并进行PCR鉴定,琼脂糖电泳结果如图3所示,图3中,1~12代表大肠杆菌的PCR产物。

图3 大肠杆菌菌落PCR验证
从图3可以看出,2~7号泳道有明显亮带,并且与Marker比对,条带大小与目的片段大小一致,选取2号、3号单菌落进行测序并于目的片段序列比对,2号、3号为阳性克隆。
2.4 重组载体农杆菌转化与侵染
将5 μL 2号大肠杆菌测序质粒加入50 μL预先制备的农杆菌GV3101感受态细胞,电击法转化后挑取单菌落进行PCR鉴定,琼脂糖电泳结果如图4所示,图4中,1~12代表农杆菌的PCR产物。
从图4可以看出,所有泳道均有明显亮带,大小正确,均为阳性克隆农杆菌单菌落。选取1号农杆菌单菌落接菌,侵染4盆,共计20棵拟南芥野生型植株。

图4 农杆菌菌落PCR验证
2.5 ProMYC1-GUS阳性植株筛选与鉴定
浸花法侵染拟南芥野生型植株子代种子,洒在卡纳抗生素抗性1/2MS固体培养基光照培养,2周后观察种子萌发生长发育情况,如图5所示,图5中框选植株生长发育较为正常,移至营养土继续生长,2周后提取植株基因组DNA进行PCR鉴定。

图5 转基因阳性植株抗性筛选
第1代转基因植株成熟收种后继续播种,子代植株分株单独收种,第3代子代种子每种取20~25颗点在卡纳抗生素抗性1/2MS固体培养基上,光照培养2周后观察种子萌发生长发育情况如图6所示。
由图6可知,3组正常生长发育,而1、2、4组部分幼苗发黄,由遗传分离定律可知,3组为纯和阳性转基因组。

图6 转基因植株抗性分离筛选
2.6 缺铁胁迫转基因材料GUS染色
为探究植物MYC1基因在缺铁胁迫下基因表达的变化对植物缺铁的响应,MS培养基正常生长7 d后ProMYC1-GUS转基因植株移至MS和缺铁MS固体培养基,3 d后对其GUS染色,通过观察颜色反应的GUS基因表达量的不同,分析MYC1基因在缺铁胁迫下转录水平表达量的变化。GUS染色结果如图7所示,从图7可以看出,缺铁诱导条件下ProMYC1-GUS转基因植株相较于对照组染色程度明显降低,说明植物MYC1基因在缺铁胁迫下表达被抑制,表达量明显下降,该基因可能作为负调控因子介导植物缺铁胁迫反应。

图7 ProMYC1-GUS转基因植株GUS染色
3 结 论
由于植物在自然界中和人类生产活动中扮演着非常重要且不可替代的角色,植物胁迫响应的研究与人类生活息息相关,通过对植物胁迫响应基因的功能研究帮助人类揭示植物逆境响应反应网络和信号通路,并且以此为基础解决环境保护、生态治理以及农业生产上的实际问题。
GUS基因作为一种常见的报告基因通过水解底物产生的颜色反应来指示目的基因转录水平,由于其几乎不存在于高等植物中,并且表达稳定、结果分析简单,经常作为一种融合基因标记来检测植物基因在组织中的表达量[9]。有报道指出,拟南芥MYC1基因介导植物激素信号调控的非生物胁迫生理过程[10]。本研究通过构建拟南芥ProMYC1-GUS转基因材料和缺铁诱导条件下GUS染色,分析该基因诱导前后表达量的变化,结果表明MYC1基因在缺铁条件下被抑制表达,进一步验证了该基因与植物非生物胁迫(缺铁胁迫)有关,为MYC1基因介导非生物胁迫的进一步研究打下基础。
