一例胰腺纤维钙化性糖尿病的诊疗和基因检测分析
2022-11-29沈敏顾愹应长江张梅杨涛陈阳
沈敏,顾愹,应长江,张梅,杨涛,陈阳
遗传资源
一例胰腺纤维钙化性糖尿病的诊疗和基因检测分析
沈敏1,顾愹1,应长江2,张梅1,杨涛1,陈阳1
1. 南京医科大学第一附属医院内分泌科,南京 210029 2.徐州医科大学附属医院内分泌科,徐州 221000
胰腺纤维钙化性糖尿病(fibrocalculous pancreatic diabetes, FCPD)是一类罕见的、胰腺内、外分泌功能同时发生障碍的特殊类型糖尿病。本文报道了1例FCPD患者的临床资料,该患者自幼年起反复出现腹痛,25岁时诊断为糖尿病,腹部CT见胰腺钙化,基因检测发现基因有2个纯合突变(c.194+2T>C和-191-24G>A)。基因检测分析发现其父母为杂合变异,其弟弟为纯合变异,但尚未观察到FCPD的典型表现。结合该病例及国内90例FCPD患者的临床特点汇总分析,建议对体型消瘦、无酮症倾向但胰岛功能较差的分型不明确糖尿病患者,需要考虑FCPD可能性,重视胰腺影像学及基因检测,尽早进行鉴别诊断。本文提高了对FCPD的认识和管理,为该疾病后续致病机制的深入研究与药物干预靶点的筛选充实了临床资料。
胰腺纤维钙化;糖尿病;基因;鉴别诊断
胰腺纤维钙化性糖尿病(fibrocalculous pancreatic diabetes, FCPD)是一类罕见的胰源性糖尿病,在热带发展中国家较为常见,主要表现为胰腺内、外分泌功能同时发生障碍,但其具体的发病机制尚不清楚[1]。由于FCPD的漏诊误诊率高,因此及时诊断、治疗对患者的预后具有显著意义。目前国内关于FCPD的相关文献较少,涉及基因检测诊断的报道仅有1例[2],基因检测率与国外报道相比严重偏低,且突变基因与国外报道存在差异。本文主要报道了1例来自中国北温带地区FCPD患者的临床表现、诊治经过及基因检测结果,并结合国内已报道的90例FCPD患者[2~21]及国外FCPD相关研究进行分析,以提高对本病的认识,尤其是对基因检测的重视,也为该疾病后续的遗传学研究及药物靶点筛选提供新的临床资料。
1 对象与方法
1.1 对象及临床资料收集
患者张某,男,25岁,江苏人,因“反复腹痛20年,口干多饮多尿、消瘦半年余”于2016年10月至南京医科大学第一附属医院内分泌门诊就诊。收集患者的病史、体格检查、实验室检查、影像学检查等临床资料,定期随访,并对患者及其父母、弟弟进行基因检测。患者及其父母、弟弟均签署知情同意书,本研究已通过南京医科大学第一附属医院伦理委员会审查。
1.2 外周血DNA提取
采集患者和患者父母、弟弟EDTA抗凝外周血2 mL,采用血液基因组DNA提取试剂盒(天根生化科技北京有限公司)提取样本DNA。
1.3 基因DNA测序及验证
使用Nanodrop 2000对DNA进行质检,合格后取3 μg并使用标准文库构建试剂盒(北京迈基诺基因科技股份有限公司)进行基因组文库构建。使用Nanodrop 2000和琼脂糖凝胶电泳对文库进行质检,合格后进行目标区域捕获,使用Illumina Next 500 测序平台对捕获的序列进行测序。测序完成后利用BWA软件将过滤后的序列比对到NCBI数据库人类基因组参考序列(hg19)上,利用GATK软件分析得出单核苷酸变异(single nucleotide variation,SNV)和插入缺失突变(inserts and deletions, INDEL)的相关信息。然后通过ANNOVAR软件对所有的SNP和INDEL进行注释。经过分析筛选得到的获选变异位点利用PCR和Sanger测序验证。PCR产物经过Sanger测序并在ABI 3130 Genetic Analyzer (Applied Biosystems,美国)上进行分析,并再在直系家庭成员中进行共分离验证。
2 结果与分析
2.1 患者的临床表现
患者自幼年起无明显诱因下反复出现中腹持续性隐痛,每次持续1周左右,可自行缓解,未予药物治疗。2016年3月起患者无明显诱因下出现口干、多饮、多尿伴半年内体重下降5 kg至当地医院就诊,查空腹血糖18.5 mmol/L,糖化血红蛋白(HbA1c) 13.1%,无酮症酸中毒,混合食物耐量实验及C肽同步释放试验,结果显示:血糖(0 min~60 min~120 min):15.23~16.9~8.53 mmol/L;C肽(0 min~60 min~ 120 min):0.69~1.16~0.95 ng/mL;胰岛自身抗体:IAA、ICA均阴性,当地医院考虑诊断为“糖尿病”。出院后予门冬胰岛素30注射液早10 IU晚7 IU皮下注射治疗。胰岛素治疗期间,患者仍间断出现腹痛,发作性质程度较前相仿,无明显诱因、节律,不伴放射痛,无腹肌紧张,无腹泻便秘、嗳气反酸、恶心呕吐、黄疸等症状,食纳可,二便如常,半年内体重下降5 kg。家族史:否认三代以内直系亲属糖尿病家族史。个人史:出生成长于江苏,否认热带地区旅居史,否认木薯食用史,否认吸烟饮酒史。体格检查:身高1.74 m,体重52 kg,BMI 17.17 kg/m2。
为进一步明确糖尿病分型与鉴别诊断,查血常规(白细胞:5.81×109/L,红细胞:5.28×109/L,血红蛋白:156 g/L)、血脂(高密度脂蛋白:1.03 mmol/L,低密度脂蛋白:1.28 mmol/L,胆固醇:2.51 mmol/L,甘油三酯:0.85 mmol/L)、血钙(2.36 mmol/L)、甲状旁腺激素(24.8 pg/mL),肝功能(丙氨酸氨基转移酶:49.5 U/L,天门冬氨酸氨基转移酶:37.4 U/L)、CA-199(12.1 U/mL)、淀粉酶(<30 U/L)均无明显异常。定期监测胰岛功能、胰岛自身抗体、糖化血红蛋白,并根据相关检测结果调整治疗方案(图1,图2)。2019年11月因患者反复出现腹痛不适,进行上腹部CT检查显示:肝左叶囊肿征,胰腺萎缩并多发斑点状钙化灶;胰管扩张(图3)。
2.2 基因检测结果分析
对患者进行基因检测发现,存在与疾病表型相关的高度可疑变异:患者丝氨酸蛋白酶抑制剂Kazal I型(serine peptidase inhibitor Kazal type 1,)基因有2个纯合突变,分别为c.194+2T>C与-191- 24G>A。是蛋白酶抑制剂,可抑制胰酶激活而起保护作用,是FCPD的易感基因。经验证分析,患者2个突变均遗传自父母,其父母这2个位点均为杂合变异,而患者弟弟为纯合变异(图4)。c.194+2T>C突变指外显子边界+2 bp处发生了T到C的突变,可导致氨基酸剪接突变,可能导致该基因功能丧失,为已知的致病性变异。-191-24G>A突变指起始密码子区-24 bp处发生了G到A的突变,可导致氨基酸的改变,虽已有该位点与慢性胰腺炎相关的文献报道,但临床意义尚不明确。剪切位点突变常影响蛋白质构象与功能,本例患者2个位点均为剪切突变,暂时无法预测蛋白质三维结构,尚需进一步实验验证。
2.3 诊治与随访
患者青年男性,体型消瘦,起病急,但无酮症酸中毒,胰岛自身抗体除IAA短暂阳性(考虑与胰岛素注射史相关)外,其余抗体均为阴性,且胰岛β细胞功能在较长一段时间内保持相对稳定,无快速下降趋势,因此暂不支持“1型糖尿病”诊断。联合影像学检查及基因检测结果,结合文献资料,首先考虑诊断为:胰腺纤维钙化性糖尿病。基于胰岛功能评估结果,继续予患者瑞格列奈治疗,同时鉴于肠促胰素类药物和胰腺炎之间可能存在的关联,嘱其停用沙格列汀,加用胰酶补充治疗,随访期间患者血糖控制良好。

图1 患者诊疗过程
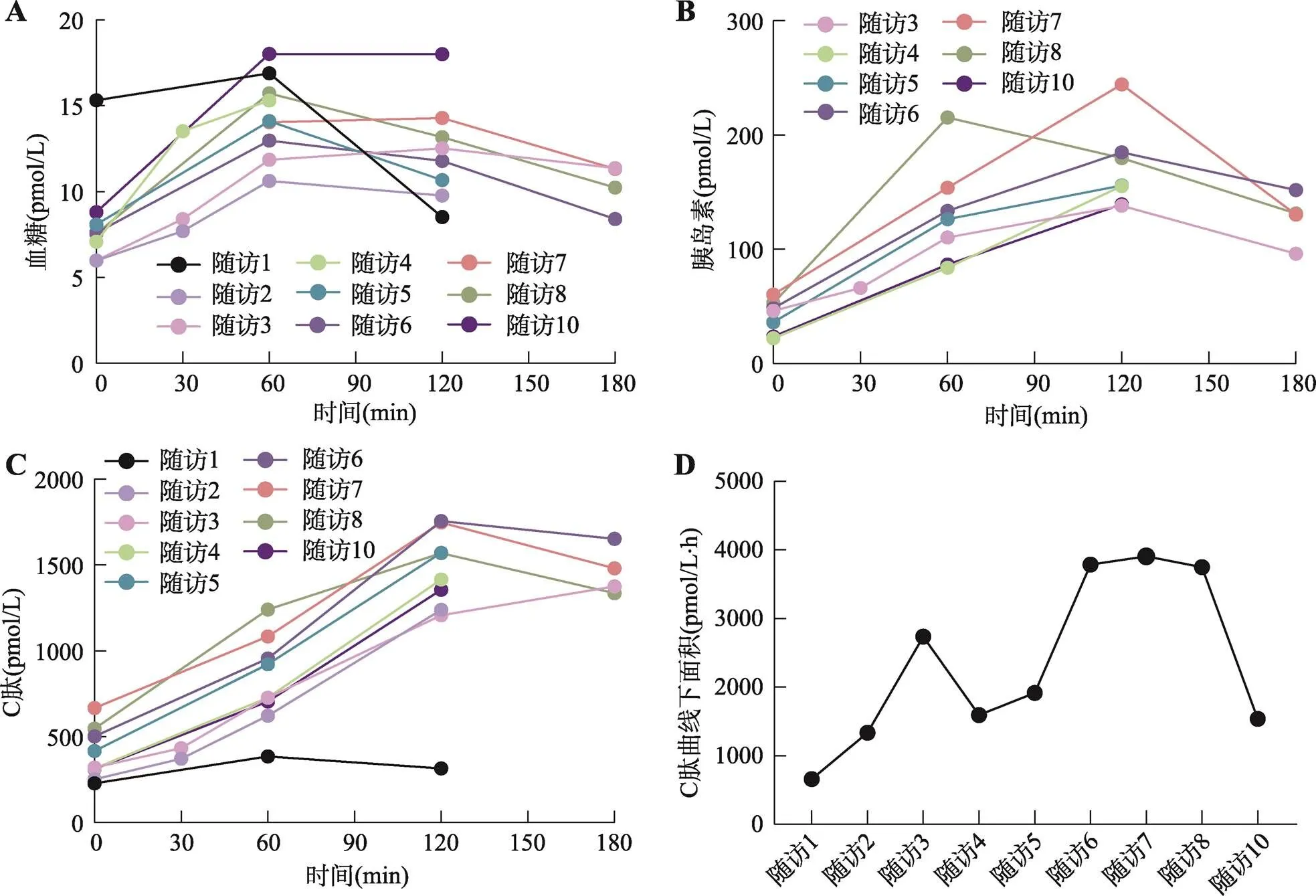
图2 胰岛功能随访检查结果
A:血糖检测结果;B:胰岛素检测结果;C:C肽检测结果;D:C肽曲线下面积分析患者胰岛功能变化结果。随访1~10日期参见图1所示。

图3 患者上腹部CT检查影像结果
红色圈出部分为胰腺钙化,检查日期2019年11月29日。
对患者父母及弟弟进行随访(表1):其父母为杂合变异,目前均存在糖耐量异常,其中父亲存在超重;其弟弟为纯合变异,目前血糖正常但存在胰岛素抵抗,考虑胰岛功能障碍为肥胖引起。尽管患者亲属均存在一定程度的代谢异常,但结合临床表现及影像学检查,暂不支持其存在FCPD的表型。FCPD患者糖尿病的发病年龄通常在20~30岁之间,且糖尿病在贫血和营养不良的患者中比较严重,而在营养良好的患者中相对较轻,这可能是本例患者亲属暂未出现FCPD典型表型的原因。
3 讨论
FCPD特征是胰腺实质的不可逆破坏和纤维化,导致胰腺外分泌功能不全和进行性内分泌功能衰竭,最终出现糖尿病。FCPD患病率较低,且易漏诊误诊,其特殊的临床及病理特征常导致患者预后不良,需进行多学科综合管理以改善患者生存质量,因此早期诊断、鉴别分型在诊治过程中尤为重要。但由于中国报道的病例较少,临床经验欠缺,因此表2总结比较了国内报道的90例FCPD患者与国外报道患者的临床特点。

图4 患者及其家庭成员基因检测结果
A: c.194+2T>C突变;B: -191-24G>A突变;C: 突变位点示意图。

表1 患者直系家庭成员临床资料
从流行病学角度看,一半以上的FCPD病例发生在热带地区,偶发在亚热带地区。Papita等[22]报道2006~2010年印度南部FCPD的患病率为0.2%。我国报道的病例主要集中分布在四川、广西、广东,内蒙古、浙江等地也有散发病例(本例患者出生并长期居住于江苏徐州)。我国FCPD发病率较低,但在热带、亚热带地区仍需提高警惕。
在致病机制研究方面,目前对FCPD的发病机制仍知之甚少,一些可能的诱因或病因包括:(1)营养不良;(2)食用木薯;(3)其他环境因素:慢性感染和微量元素缺乏(如维生素C、D);(4)自身免疫;(5)遗传因素:国外多项研究报道,FCPD与遗传因素有关,包括、、基因等[23]。本例患者基因检测报告了基因的2个纯合突变,其弟弟也携带同样2个位点的纯合突变,虽尚未发展为糖尿病,但仍需密切随访,早期干预可能有助于延缓糖尿病发病。冯姗姗等[2]报道了1例基因2号外显子c.139C>T杂合突变的FCPD患者,这是既往我国报道的仅有的1例进行基因检测的FCPD患者。Chowdhury等[24]在孟加拉国人的研究中发现:HLA-DQB1*0302在FCPD的发生中起一定作用。本例患者HLA检测结果为:HLA-A*2402;3201,DRB1*0701;1301,与文献报道不同。鉴于中国人群与其他人群遗传易感性的差异,在中国人群中FCPD易感基因有待进一步研究,提高对基因检测的重视可能有益于提高FCPD的检出率。此外,遗传学研究有助于进一步解析FCPD的致病机制,为药物干预靶点的筛选及新的治疗方案的探索提供线索及依据。

表2 国内外报道FCPD临床特点比较
在临床鉴别诊断方面,FCPD尚无明确的诊断标准,目前较为公认的标准为:(1)发生于热带国家或地区;(2)符合世界卫生组织制定的糖尿病诊断标准;(3)影像学检查存在慢性胰腺炎的证据,可见胰腺钙化或存在以下4点中的3点:①自儿童时期慢性腹痛;②胰腺形态异常:如超声、CT或内镜逆行胰导管造影(ERCP)提示胰管扩张;③脂肪泻;④粪便糜蛋白酶试验提示胰腺功能异常;(4)排除其他原因如:肝胆疾病、酒精中毒、原发性甲状旁腺功能亢进导致的胰腺炎[25]。因FCPD临床表现各异,并不符合所有经典描述,因此误诊漏诊率较高[26]。英国最近的一项研究表明,超过85%的胰源性糖尿病患者被误诊。中国报道的90例FCPD患者中4例被误诊为1型糖尿病(type 1 diabetes mellitus, T1DM), 10余例患者被误诊为2型糖尿病(T2DM)。本例报道也是在明确糖尿病诊断3年,多次随访后才确诊为FCPD。中国可疑T1DM遗传学研究[27]发现,中国人群3种胰岛自身抗体均阴性的可疑T1DM患者中22.0%为单基因糖尿病。这就意味着临床诊断的T1DM患者中单基因糖尿病的患病率约为6%,远高于欧洲人群的比例(1%)。这也提示在目前的临床诊疗中糖尿病的准确分型尚是一大难题,基因检测在精准诊断中的重要性应得到重视。
FCPD与T1DM的鉴别诊断要点还包括:(1)FCPD不易发生酮症,而T1DM有明显的酮症倾向,这可能是由于两者残存胰岛功能存在差异;(2)T1DM有胰岛自身免疫的证据,而FCPD胰岛自身抗体常为阴性,中国报道的90例FCPD患者中仅1例存在胰岛自身抗体(GADA)阳性;(3)影像学检查存在胰腺形态改变是FCPD标志。Ghosh等[28]评估了FCPD与T2DM、对照组之间胰腺内外分泌功能的差异发现:(1)FCPD患者基础C肽和胰高血糖素低,葡萄糖负荷后胰高血糖素没有变化;(2)与T2DM和对照组相比,空腹和葡萄糖刺激后FCPD的GLP-1增加了1.5~2倍,而DPP-IV没有差异;(3)与T2DM和对照组相比,FCPD患者粪便糜蛋白酶水平较低。这为FCPD与T2DM的鉴别诊断提供了一定依据。
FCPD的治疗需要多学科的综合管理,包括:营养管理、疼痛管理、外分泌功能管理、糖尿病管理。营养管理是治疗的基石,不应限制患者热量的摄入,且必须保证膳食的均衡。同时应避免进食对胰腺有潜在毒性的物质(如木薯),停止吸烟饮酒。腹痛是FCPD的常见症状,非阿片类镇痛剂是疼痛管理的理想用药。内镜介入去除结石和碎石术可能对缓解腹痛有帮助。严重的疼痛可能需要手术进行导管减压、引流。胰酶补充或替代疗法是保证营养物质充分吸收,防止蛋白质、维生素等营养不良的必要手段。维生素特别是脂溶性维生素的补充也是必要的。大部分FCPD需要胰岛素治疗,仅少部分可通过口服降糖药控制。中国报道的90例FCPD患者中仅8例使用口服降糖药,其余均需胰岛素治疗。考虑到FCPD的病理生理特点,选择口服降糖药时尽量避免使用α-葡萄糖苷酶抑制剂、GLP-1激动剂、DPP4抑制剂等存在消化系统不良反应的药物。
FCPD患者同样会出现糖尿病相关慢性并发症。Barman等[29]对277例 FCPD患者和T2DM患者进行比较发现:两组患者在视网膜病变、肾病或神经病变发生率方面没有显著差异;而FCPD患者大血管并发症发病率显著降低。通常认为FCPD预后不良,除糖尿病并发症外,严重感染、胰腺癌也是FCDP患者死亡的主要原因[30]。因此,对于FCPD患者,除了做好糖尿病相关随访,还应重视患者的营养管理、疼痛管理、外分泌功能管理,加强对胰腺癌相关指标(如血CA199,影像学检查等)的监测,必要时尽快手术解除胰腺结石,避免引起感染或发展为胰腺癌。
综上所述,FCPD的发病机制尚不明确,早期诊断、密切随访对FCPD至关重要。FCPD临床表现各异,往往并不典型,因此对于可疑患者,影像学检查成为FCPD诊断的重要依据。同时,也应重视基因检测在鉴别诊断中的作用。
[1] Bhat JA, Bhat MH, Misgar RA, Bashir MI, Wani AI, Masoodi SR, Ashraf H, Sood M. The clinical spectrum of fibrocalculous pancreatic diabetes in kashmir valley and comparative study of the clinical profile of fibrocalculous pancreatic diabetes and type 2 diabetes mellitus., 2019, 23(5): 580–584.
[2] Feng SS, Wang S. Diagnosis and treatment of a case of fibrocalculous pancreatic diabetes., 2021, 61(21): 84–87.
冯姗姗, 王肃. 1例胰腺纤维钙化性糖尿病的诊断及治疗. 山东医药, 2021, 61(21): 84–87.
[3] Chi HY, Wang AH, Liu YJ, Zhou YP. Fibrocalculous pancreatic diabetes: one case report and literature review., 2014, (8): 701–704.
迟海燕, 王爱红, 刘彦君, 周玉萍. 胰腺纤维钙化性糖尿病一例并文献复习. 中华内分泌代谢杂志, 2014, (8): 701–704.
[4] Yang SL, Chen M, Li N, Xu L, Luo YL, Zhang MN, Bu L, Lin ZW, Li H, Qu S. Fibrocalculous pancreatic diabetes: one case report and literature review., 2017, 37 (5): 355–357.
杨绍玲, 陈铭, 李楠, 徐璐, 罗伊丽, 张曼娜, 卜乐, 林紫薇, 李鸿, 曲伸. 胰腺纤维钙化性糖尿病1例并文献复习. 国际内分泌代谢杂志, 2017, 37(5): 355–357.
[5] Pan JX, Jiang F, Sun MY, Lin F. Fibrocalculous pancreatic diabetes: one case report and literature review., 2017, 25(6): 563–564.
潘金兴, 姜锋, 孙铭遥, 林帆. 胰腺纤维钙化性糖尿病一例报告及文献复习. 中国糖尿病杂志, 2017, 25(6): 563–564.
[6] Cha XY, Wei CS, Lai PB. Analysis of clinical characteristics of 16 cases with fibrocalculous pancreatic diabetes and literature review., 2020, 42(4): 14–17.
查小云, 魏长顺, 赖鹏斌. 胰腺纤维钙化性糖尿病16例临床特点分析并文献复习.福建医药杂志, 2020, 42(4): 14–17.
[7] Liu XM, Ouyang LL, Xian Su, Wang WQ. Two cases of calcareous pancreatitis of family resulted diabetes mellitus., 2001, 18(3): 236.
刘晓梅, 欧阳玲莉, 冼苏, 王文清. 家族性钙化性胰腺炎致糖尿病二例. 临床内科杂志, 2001, 18(3): 236.
[8] Chen YL, Chen GF, Liu C. Fibrocalculous pancreatic diabetes: a case report and literature review., 2021, 37(2): 165–167.
陈彦乐, 陈国芳, 刘超. 胰腺纤维钙化性糖尿病一例并文献复习. 中华内分泌代谢杂志, 2021, 37(2): 165–167.
[9] Li YR, Yu ZQ, Pan HL, Hong Y. Clinical and laboratory study on tropical pancreatic diabetes., 1998, 15(2): 11–13.
黎英荣, 于志清, 潘海林, 洪英. 热带胰腺性糖尿病的临床特点及实验室研究. 广西医科大学学报, 1998, 15(2): 11–13.
[10] Wang J, Tian HM, Liang JZ. Pancreaticolithiasis and fibrocalcific diabetes mellitus., 1995, 10(4): 403–404.
王静, 田浩明, 梁荩忠. 胰石症与胰腺纤维钙化性糖尿病. 华西医学, 1995, 10(4): 403–404.
[11] Jia Q, Zhang Y, Ma KN. Fibrocalcuous pancreatic diabetes: 8 cases report., 2001, 9(3): 39–40.
贾奇, 张音, 马克宁. 胰腺纤维化结石性糖尿病(附8例报告). 辽宁实用糖尿病杂志, 2001, 9(3): 39–40.
[12] Li YJ, Su HY. Fibrocalculous pancreatic diabetes: one case report., 2014, 22(12): 1136–1137.
李勇杰, 苏宏业. 胰腺纤维钙化性糖尿病一例报告. 中国糖尿病杂志, 2014, 22(12): 1136–1137.
[13] Shi Y. Pancreatic fibrotic calculous diabetes mellitus: a case report and literature review., 2003, 11(6): 449–451.
施勇. 胰腺纤维化结石性糖尿病(附1例报告并文献复习). 肝胆外科杂志, 2003, 11(6): 449–451
[14] Chen JZ, Li J, Zhu KX. Fibrocalculous pancreatic diabetes misdiagnosed as type 1 diabetes for years: a case report and literature review., 2020, 41(7): 752–754.
陈炯镇, 李佳, 朱凯旋. 胰腺纤维钙化性糖尿病长期误诊为1型糖尿病1例报告并文献复习. 解放军医学院学报, 2020, 41(7): 752–754.
[15] Wang JW, Yu BJ, Chen P. Chen YT. Fibrocalcuous pancreatic diabetes: a case report., 2020, 27(16): 38–39.
王金委, 俞碧君, 陈平, 陈盈婷. 胰腺纤维钙化性糖尿病1例. 中国乡村医药, 2020, 27(16): 38–39.
[16] Li WG, Deng YH, Mai KY. Fibrocalcuous pancreatic diabetes complicated with osteoporosis: a case report., 2020, 21(10): 844.
李万根, 邓煜辉, 麦坤仪. 胰腺纤维钙化性糖尿病并骨质疏松症1例. 广东医学, 2020, 21(10): 844.
[17] Liu B, Yu RP, Luo JH, Long BD. Fibrocalcuous pancreatic diabetes misdiagnosed as type 1 diabetes., 2011, 24(10): 70–71.
刘波, 于瑞萍, 罗建华, 龙本丹. 胰腺纤维钙化性糖尿病误诊为1型糖尿病. 临床误诊误治, 2011, 24(10): 70–71.
[18] Wang YQ, Wu FX, Liang QF, Zhao YD, Wu JP. Fibrocalcuous pancreatic diabetes: a case report., 2021, 31(2): 147–149.
王云卿, 吴飞翔, 梁秋芳, 赵延栋, 吴君平. 胰腺纤维钙化性糖尿病一例报道. 浙江中西医结合杂志, 2021, 31(2): 147–149.
[19] Deng YY, Zhang JL, Qiu L. Pancreatic fibrotic calculous diabetes mellitus: a case report and literature review., 2015, 30(12): 1433–1434.
邓英英, 张晶露, 邱琳. 胰腺纤维钙化性糖尿病2例并文献复习. 临床荟萃, 2015, 30(12): 1433–1434.
[20] Ye SZ, Qian GX. Fibrocalculous pancreatic diabetes: 10 cases report., 1991, 7(4): 198–200.
叶绍珍, 钱光相. 胰纤维化结石性糖尿病(附10例报告). 中华内分泌代谢杂志, 1991, 7(4): 198–200.
[21] Pei Y, Pang P, Wang HZ, Han XF, Wang XL, Du J, Yang GQ, Lv ZH, Mu YM, Lu JM, Dou JT. Three cases of fibrocalculous pancreatic diabetes and review of literatures., 2012, 4(12): 713–717.
裴育, 庞萍, 王海珍, 韩晓菲, 王先令, 杜锦, 杨国庆, 吕朝晖, 母义明, 陆菊明, 窦京涛. 胰腺纤维钙化性糖尿病三例报告及文献复习. 中华糖尿病杂志, 2012, 4(12): 713–717.
[22] Papita R, Nazir A, Anbalagan VP, Anjana RM, Pitchumoni C, Chari S, Mohan V. Secular trends of fibrocalculous pancreatic diabetes and diabetes secondary to alcoholic chronic pancreatitis at a tertiary care diabetes centre in South India., 2012, 13(2): 205–209.
[23] Kolly A, Shivaprasad C, Pulikkal AA, Atluri S, Sarathi V, Dwarakanath CS. High prevalence of serine protease inhibitor Kazal type 1 gene variations detected by whole gene sequencing in patients with fibrocalculous Pancreatic Diabetes., 2017, 21(4): 510–514.
[24] Chowdhury ZM, McDermott MF, Davey S, Hassan Z, Sinnott PJ, Hemmatpour SK, Sherwin S, Ali L, Aganna E, Allotey RA, North BV, Cassell PG, Azad Khan AK, Hitman GA. Genetic susceptibility to fibrocalculous pancreatic diabetes in Bangladeshi subjects: a family study., 2002, 3(1): 5–8.
[25] Mohan V, Nagalotimath SJ, Yajnik CS, Tripathy BB. Fibrocalculous pancreatic diabetes., 1998, 14(2): 153–170.
[26] Kibirige D, Kibudde S, Mutebi E. Fibrocalculous pancreatic diabetes in a young Ugandan patient, a rare form of secondary diabetes., 2012, 5(1): 622–624.
[27] Li MH, Wang SH, Xu KF, Chen Y, Fu Q, Gu Y, Shi Y, Zhang M, Sun M, Chen H, Han XQ, Li YX, Tang ZK, Cai LJ, Li ZQ, Shi YY, Yang T, Polychronakos C. High prevalence of a monogenic cause in Han Chinese diagnosed with type 1 diabetes, partly driven by nonsyndromic recessive WFS1 mutations., 2020, 69(1): 121–126.
[28] Ghosh I, Mukhopadhyay P, Das K, Anne M B, Ali Mondal S, Basu M, Nargis T, Pandit K, Chakrabarti P, Ghosh S. Incretins in fibrocalculous pancreatic diabetes: a unique subtype of pancreatogenic diabetes., 2021, 13(6): 506–511.
[29] Barman KK, Premalatha G, Mohan V. Tropical chronic pancreatitis., 2003, 79(937): 606–615.
[30] Chari ST, Mohan V, Pitchumoni CS, Viswanathan M, Madanagopalan N, Lowenfels AB. Risk of pancreatic carcinoma in tropical calcifying pancreatitis: an epidemiologic study., 1994, 9(1): 62–66.
Diagnosis, treatment and genetic analysis of a case with fibrocalculous pancreatic diabetes
Min Shen1, Yong Gu1, Changjiang Ying2, Mei Zhang1, Tao Yang1, Yang Chen1
Fibrocalculous pancreatic diabetes (FCPD) is a rare type of diabetes mellitus with both impaired endocrine and exocrine functions of the pancreas. In this report, we presented a case with FCPD, who had recurrent abdominal pain since early childhood and was diagnosed with diabetes mellitus at the age of 25, with pancreatic calcification on abdominal computed tomography (CT) scan. Genetic testing revealed two homozygous mutations in thegene (c.194+2T>C and -191-24G>A). Both the homozygous variants were shared by his unaffected sibling, and the heterozygous variants had been verified on their unaffected parents. Based on this case and 90 other reported cases in China, we retrospectively analyzed the clinical characteristics of FCPD. It is recommended that unclassified diabetic patients with a lean body type, no ketosis tendency but poor islet function should be considered for the possibility of FCPD. Pancreatic imaging and genetic testing may be beneficial for the differential diagnosis. This study improves our understanding and management of FCPD, and also enriches clinical evidence for subsequent research on pathogenic mechanisms and drug target screening.
pancreatic fibrocalcification; diabetes;; differential diagnosis
2022-06-21;
2022-09-01;
2022-09-07
国家自然科学基金项目(编号:81900708),江苏省研究生科研与实践创新计划项目(编号:JX10213850)和SDF·甜蜜医生培育项目(编号:2021SD02)资助[Supported by the National Natural Science Foundation of China (No. 81900708), Postgraduate Research & Practice Innovation Program of Jiangsu Province (No. JX10213850), and Sinocare Diabetes Foundation (No. 2021SD02)]
沈敏,在读博士研究生,专业方向:内分泌与代谢病方向。E-mail: drshenmin@163.com
陈阳,博士,主治医师,研究方向:内分泌与代谢病方向。E-mail: drchenyang@njmu.edu.cn
10.16288/j.yczz.22-210
(责任编委: 孟卓贤)
