内质网分子伴侣GRP94对伪狂犬病毒增殖的调节作用
2022-11-28倪敏舒庄腾寒
倪敏舒,陈 丽,鲍 熹,徐 悦,庄腾寒,冯 磊,3,4,*
(1.江苏大学 药学院,江苏 镇江 212013; 2.江苏省农业科学院 动物免疫工程研究所,国家兽用生物制品工程技术研究中心,江苏 南京 210014; 3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009; 4.江苏省食品质量安全重点实验室 省部共建国家重点实验室培育基地,江苏 南京 210014)
伪狂犬病毒(Pseudorabiesvirus,PRV)又名奥叶兹基氏病病毒(Aujeszky’sdiseasevirus,ADV),是一种猪疱疹病毒。PRV遗传物质为线性双链DNA基因组,包裹在二十面体的衣壳内形成核衣壳,衣壳嵌入一种称为被膜的蛋白质基质中,外部再包裹一层含多种糖蛋白的病毒囊膜。定位于病毒囊膜上的糖蛋白包括gB、gC、gD、gE、gG、gH、gI、gK、gL、gM和gN等。PRV入侵细胞和增殖过程中会导致感染细胞产生应激反应。研究表明,病毒或许会通过调控应激反应使自身增殖受益[1-2],内质网应激(ER stress)就是其中一种重要机制。病毒蛋白在内质网中大量表达,破坏内质网平衡,导致错误折叠和未折叠蛋白在内质网中迅速积累,内质网面临巨大压力,随后细胞处于应激状态[3]。未折叠蛋白反应(unfolded protein response,UPR)是细胞为了恢复内质网稳态所做出的适应性反应。通过内质网分子伴侣蛋白与UPR 3个传感分子断开连接,随后激活相应3条反应通路[4-5]。这3条通路分别以促进蛋白质折叠、抑制蛋白质合成和增强内质网相关降解的方式缓解内质网应激[6-8]。内质网分子伴侣主要负责协助蛋白质折叠、装配和运输,且不参与目标蛋白的组成。分子伴侣包括热休克蛋白家族(GRP78、GRP94等)和多种钙结合蛋白[9]。在众多内质网分子伴侣中,GRP78、GRP94目前研究较多,在UPR中扮演关键角色。目前已发现,GRP78在内质网应激和病毒增殖中的重要作用,猪圆环病毒2型的eIF-2α去磷酸化过程被抑制后,PCV2的复制也明显被抑制,提示PCV2通过eIF-2α的去磷酸化恢复细胞翻译水平,加强自身增殖[10]。GRP94具有与GRP78相似的应激条件,它们都可以与错误折叠的蛋白质形成稳定复合物,以缓解内质网压力[9-11]。本研究探究了GRP94对PRV增殖的调节作用,进一步明确了GRP94在PRV感染过程的可能作用机制。
1 材料与方法
1.1 细胞、毒株与载体
BHK-21细胞和PRV(gE-)种毒均由江苏省农业科学院动物免疫工程研究所保藏。质粒载体pCas9-IRES-eGFP、plenti-CMV-MCS-EF1α-eGFP、pUC-sgRNA-cloning均由国家兽用生物制品工程技术研究中心细胞工程实验室构建保存。经密码子优化和添加Kozak序列的GRP94编码序列克隆载体pUC57-GRP94由南京擎科公司构建合成。
1.2 设备
二氧化碳培养箱(Thermo),-80 ℃超低温冰箱(Thermo),倒置显微镜(OLYMPUS),高、低速离心机(Eppendorf),PCR仪(Biometra),核酸电泳仪与全自动凝胶成像分析系统(Biometra)。
1.3 试剂
DMEM培养基、新生牛血清(newborn calf serum,NBS)购自赛默飞世尔科技(中国)有限公司公司;DNA连接酶和NheⅠ、EcoRⅠ、NotⅠ内切酶购于Takara Bio有限公司;质粒DNA抽提试剂盒与转染试剂购于QIAGEN公司;使用的兔单克隆抗体如下:anti-GRP78、anti-GRP94、anti-flag购自Abcam公司;anti-p-eIF2α、anti-ATF6、anti-eIF2α购自CST公司;anti-GAPDH购自Proteintech公司;荧光标记羊抗兔IgG购于武汉博士德生物工程有限公司。
1.4 GRP94的sgRNA识别位点设计
利用CRISPR在线设计工具对GRP94基因的外显子设计2对sgRNA,sgRNA序列信息见表1。引物经退火处理,与BbsⅠ酶切处理的pUC-sgRNA-cloning载体进行连接反应,克隆成功的pUC-sgRNA1和pUC-sgRNA2用于后续转染实验。

表1 sgRNA序列
1.5 BHK-21细胞的转染和分选单细胞克隆
含有1.2 μg的pCAS-IRES-Egfp、pUC-sgRNA1和pUC-sgRNA2与转染试剂混合形成转染复合物,转染BHK-21细胞。24 h后用流式细胞仪分选,将带有绿色荧光的细胞分选至96孔板中形成单细胞克隆,逐级扩大培养。
1.6 单细胞克隆鉴定
用刮刀刮取微量正常生长的单细胞克隆,提取细胞克隆基因组。针对GRP94基因序列设计鉴定引物,上游引物序列:5′-TACTGAGGGTCGTGAGCGTT-3′,下游引物序列:5′-AACGCTCACGACCCTCAGTA-3′。PCR反应程序:98 ℃ 10 min;98 ℃45 s,57 ℃ 45 s,72 ℃ 5 min,30 个循环。PCR产物送生工生物工程(上海)股份有限公司测序。
1.7 慢病毒表达载体的构建、包装与阳性细胞的筛选
质粒pUC57-GRP94经过NotⅠ和NheⅠ双酶切后连接至plenti载体,获得plenti-CMV-GRP94-EF1α-eGFP。将plenti-CMV-GRP94-EF1α-eGFP、pMD2G、psPAX2质粒共转染293T细胞,在37 ℃、5% CO2培养箱培育48 h后观察绿色荧光蛋白的表达水平,收集上清重组慢病毒液感染BHK-21细胞,培养24 h后观察BHK21细胞形态,48 h后更换新鲜培养基并且加入40 μg·mL-1嘌呤霉素进行药物筛选。待形成单个抗性集落后,提高嘌呤霉素作用浓度至最终质量浓度为120 μg·mL-1,获得GRP94基因过表达的重组BHK-21细胞株。
1.8 病毒滴度的测定
BHK-21细胞在96孔板培养48 h后,弃去上清,加入10倍连续梯度稀释的PRV病毒样品,每孔100 μL;于37 ℃、5.0%二氧化碳培养箱中培养。观察细胞病变过程,4 d后病变不再增多,记录最终结果,按Reed-Muench两氏法计算病毒滴度,结果以lg(TCID50)·mL-1表示。
1.9 蛋白免疫印迹反应
收集细胞,用PBS洗涤后用细胞裂解液在冰上裂解后离心取上清液,加5×蛋白上样缓冲液制成蛋白样。然后进行电泳、转膜,封闭后孵育一抗,4 ℃过夜,用TBS洗涤3次,每次10 min;孵育二抗,常温孵育2 h,TBS洗涤3次,每次10 min。用增强化学发光法(ECL)观察蛋白表达。
1.10 PRV糖蛋白瞬时表达
PRV的gB、gC、gD、gH、gI、gL、gM和gN蛋白编码序列由南京擎科生物科技有限公司合成。将各糖蛋白目的基因酶切后与pcDNA3.1(-)真核表达载体相连,构建8个重组表达质粒。按Lipofectamine TM 3000的说明书配制转染复合物转染至BHK-21细胞。24 h后去除细胞上清液,用刮刀刮下细胞,经PBS反复冲洗收集细胞沉淀,于-80 ℃冰箱保存,用于免疫印迹法检测PRV结构蛋白的重组表达与后续免疫共沉淀检测。
1.11 免疫共沉淀
收集目的细胞,用PBS缓冲液洗涤后加入含有蛋白酶抑制剂的RIPA缓冲液,充分混匀,冰上裂解15 min后,高速离心10 min,收集上清液。将抗体用TBS缓冲液稀释到推荐的稀释比例,配置抗体工作液,加入到事先经过适当洗涤的Protein A+G磁珠中,室温混合翻转孵育1 h,磁力架分离磁珠,TBS缓冲液轻吹重悬洗涤3次,每次5 min,用磁力架回收磁珠。将细胞裂解液加入事先结合了抗体的Protein A+G中,室温旋转孵育2 h。孵育结束后,磁力架分离10 s,去除上清液。直接向磁珠中加入蛋白上样缓冲液,100 ℃煮沸10 min,磁力架分离10 s后取上清进行蛋白免疫印迹反应。
2 结果与分析
2.1 重组BHK-21-GRP94细胞的构建
如图1所示,含有GRP94完整表达盒的重组慢病毒感染BHK-21细胞,经嘌呤霉素筛选获得GRP94过表达的稳转细胞株,命名为BHK-21-GRP94。该细胞株生长旺盛,形态正常;与GRP94重组蛋白共表达的GFP荧光阳性率高,说明该GRP94基因过表达细胞株满足后续实验要求。
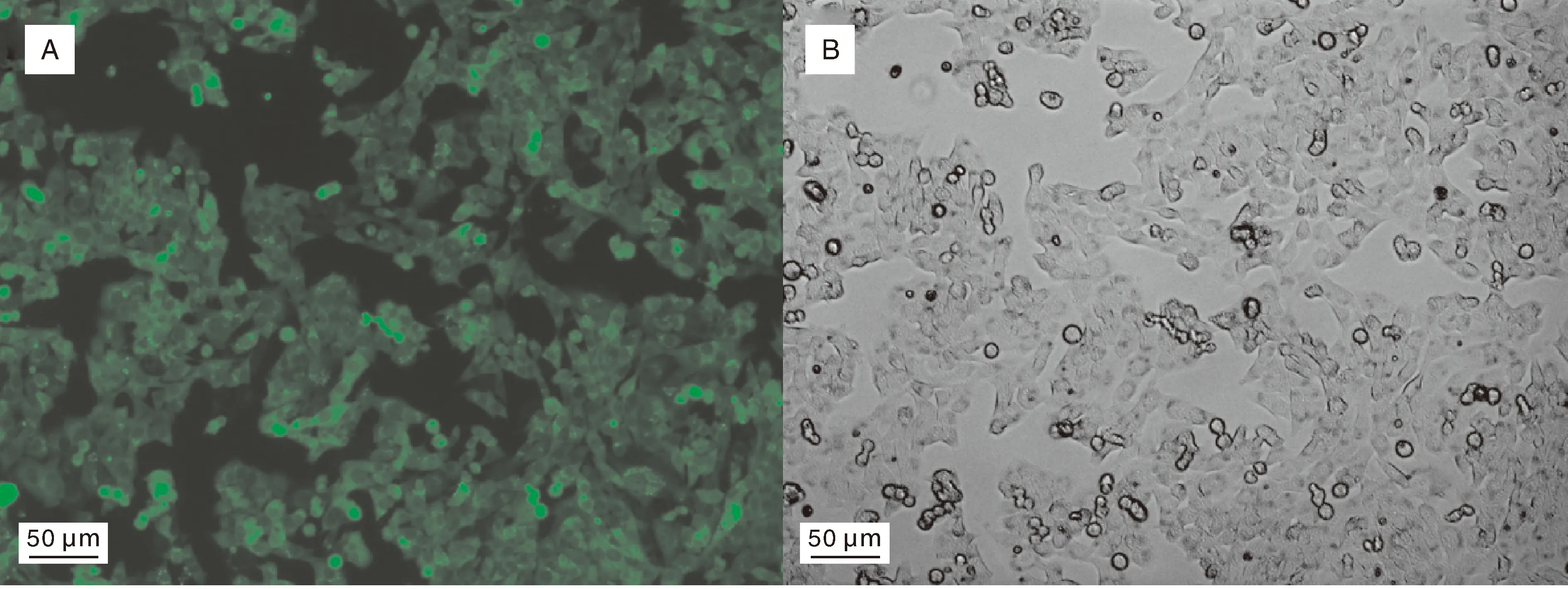
A,荧光场;B,自然光场。A, Fluorescence; B, Natural light.图1 GRP94基因过表达细胞形态Fig.1 Morphology of GRP94 overexpressing cell lines
2.2 BHK-21-GRP94-KO细胞的构建与鉴定
采用CRISPR/Cas9系统和流式细胞仪分选(fluorescence activated cell sorting,FACS)获得GRP94蛋白编码序列敲除的备选BHK-21细胞克隆6株,经PCR鉴定,细胞克隆1和细胞克隆3的PCR扩增产物与BHK-21原始细胞相比小了2 797 bp(图2)。其中,克隆1的PCR产物测序结果如图3所示,BHK-21细胞的GRP94基因产生大片段敲除,缺失片段与所设计的sgRNA靶点相符。该单克隆细胞扩大培养并冻存保种,命名为BHK-21-GRP94-KO细胞。

泳道1~6,阳性细胞单克隆;泳道C,阴性细胞。Lane 1-6, PCR products from different single cell clones; Lane C, Negative cells.图2 细胞单克隆的PCR产物电泳鉴定Fig.2 PCR products of single cell clones

上方序列为泳道C回收测序结果;下方序列为泳道1回收测序结果。Upper sequence was PCR product sequence of lane C; Lower sequence was PCR product sequence of lane 1.图3 单克隆细胞PCR产物与GRP94基因序列的比对结果Fig.3 Comparison of GRP94 gene sequence with PCR product of single cell clones
2.3 不同BHK-21细胞的GRP94表达
以BHK-21原始细胞为对照,提取BHK-21-GRP94和BHK-21-GRP94-KO细胞的胞内总蛋白,用蛋白质免疫印迹法检测各细胞的GRP94表达水平。结果(图4)表明,BHK-21-GRP94中GRP94表达量显著高于BHK-21细胞,BHK-21-GRP94-KO细胞中的GRP94表达量显著下降。

*和**分别表示在P<0.1和P<0.05水平差异显著。下同。* and ** meant significant differences at the levels of P<0.1 and P<0.05, respectively. The same as below.图4 不同BHK-21细胞中GRP94的表达Fig.4 Detection of GRP94 expression in different BHK-21 cells
2.4 PRV在不同BHK-21细胞中的增殖比较
在BHK-21、BHK-21-GRP94和BHK-21-GRP94-KO细胞中分别感染PRV,病毒增殖结果如图5所示。结果表明,PRV病毒在BHK-21-GRP94细胞中增殖效价显著高于BHK-21细胞的病毒增殖效价,BHK-21-GRP94-KO细胞中PRV病毒增殖结果未见明显改变。

***表示在P<0.001水平差异显著。下同。*** meant significant difference at the level of P<0.001. The same as below.图5 不同细胞增殖PRV的毒价比较Fig.5 Viral titers of PRV cultured in different cells
2.5 GRP94蛋白对UPR通路的影响
为探索GRP94对PRV病毒感染细胞后产生ER应激的影响,利用蛋白免疫印迹检测感染PRV病毒后的3种BHK-21细胞内UPR相关蛋白的表达水平,结果如图6所示。以健康对照BHK-21细胞(Mock-infection)为阴性对照,TG处理的BHK-21细胞为阳性对照,PRV感染BHK-21细胞后,ER应激的标志分子GRP78表达水平与对照细胞相比显著提高;GRP94的表达水平也高于对照组。此外,eIF-2α转录因子的磷酸化水平随病毒增殖时间延长而逐渐提升,同时切割后的ATF6(C-ATF6)导致的ATF6通路激活也被检测出,说明感染PRV可导致BHK-21细胞的ER应激和后续UPR通路激活。同时,GRP94基因敲除细胞株在感染PRV后,GRP78表达量与BHK-21原始细胞感染PRV组别相比显著上调;而GRP94过表达的细胞在感染PRV后,GRP78的表达水平始终维持在较低水平。该结果表明,GRP78和GRP94在感染PRV后可能存在相互的功能代偿。

图6 不同BHK-21细胞感染PRV后UPR相关蛋白的表达Fig.6 Expression of UPR related protein in different BHK-21 cells infected with PRV
2.6 GRP94与PRV结构蛋白的互作
PRV病毒的结构蛋白Gb、gC、gD、gH、gI、gM、gN、gL在BHK-21细胞中瞬时表达,在anti-flag单克隆抗体的免疫沉淀复合物中检测GRP78和GRP94以判断分子伴侣蛋白与病毒结构蛋白是否存在互作。结果如图7和图8所示,gN仅与GRP78产生互作,gB、gD、gI与GRP78、GRP94均可以产生互作,gC、gH、gM、gL未与GRP78和GRP94产生互作。同时在anti-GRP78和anti-GRP94单克隆抗体的免疫沉淀反应中进行flag标签的检测验证,实验结果与上述结果一致。

图7 免疫共沉淀检测GRP94、GRP78与PRV病毒gB、gD、gN、gIFig.7 Immunoprecipitation tests of GRP78, GRP94 and gB, gD, gN, gI

图8 免疫共沉淀检测GRP94、GRP78与PRV病毒gC、gH、gL、gMFig.8 Immunoprecipitation tests of GRP78, GRP94 and gC, gH, gL, gM
以上结果表明,GRP78和GRP94均能与多种病毒膜糖蛋白相互作用,这种蛋白复合物滞留在内质网腔中,造成内质网肿胀并且进一步诱导内质网应激。GRP78所能结合的病毒蛋白相对于GRP94来说更加丰富,并且涵盖了GRP94所能结合的病毒蛋白。这或许提示了GRP78具有的功能与GRP94相似,且更加全面,GRP94缺失之后的功能代偿可能由GRP78来执行。
3 结论与讨论
内质网分子伴侣GRP78和GRP94定位于内质网和核膜中,当细胞内环境受到破坏,导致内质网应激时,GRPs基因表达,缓解内质网应激[12]。葡萄糖调节蛋白对于病毒增殖的影响已有初步证实,尤其是对GRP78而言,BHK-21中过表达GRP78基因后,坦布苏病毒(TMUV)的增殖得到加强,在GRP78受到抑制后,病毒增殖也相应减弱[13]。GRP94和GRP78的基因转录调控区有一个由28个碱基对组成的共同结构域,该结构域对GRP78和GRP94的高水平表达至关重要,且2个基因在转录水平上的调控机制非常相似[14]。在维护细胞稳态方面,GRP78和GRP94具有诸多相似的功能,可以和新翻译的蛋白质相结合,促进组装、折叠、运输[15-17],可以和部分糖基化的病毒糖蛋白及其突变体形成复合物[17-19],以及通过与钙离子的结合能力,调控内质网蛋白质的转运[20]。虽然他们两者之间具有相当密切的联系,但关于GRP94的研究较为匮乏,尤其是GRP94在病毒增殖调控方面。
本研究中,过表达GRP94细胞增殖PRV效价明显提高,表明GRP94可能参与病毒蛋白的折叠和组装。意外的是,GRP94敲除细胞株中PRV增殖滴度并未下降,基本保持不变。PRV病毒感染细胞株后的蛋白免疫印迹检测发现,GRP94敲除细胞株的GRP78表达量显著上升,上调的GRP78水平可能弥补了病毒增殖过程中GRP94的缺失。相对于GRP78,GRP94的基本功能需要在特定蛋白质的相互作用需要时才会表现出来[21],通过CRISPR/Cas9系统敲除GRP94基因的细胞依旧能正常生长[22],曾尝试敲除GRP78基因,但是挑选出的细胞克隆难以存活。这些证据都提示了GRP78相对于GRP94来说,蛋白功能更加丰富且对于宿主细胞而言是必需的。相关文献提出了类似的GRP78和GRP94在功能上相互协作,在抗体的表达折叠过程中GRP78和GRP94依次作用,发挥伴侣蛋白的功能[23-24]。在线虫中,也曾发现9个内质网伴侣蛋白之间存在相互代偿和相互调节的机制,其中便包括GRP78和GRP94[25]。
免疫共沉淀结果显示,GRP78和GRP94均可以和病毒蛋白互作。大量的蛋白复合物堆积在内质网腔内,造成内质网应激;与此同时,GRP94拥有促进蛋白质折叠的功能,与病毒蛋白结合后,加速病毒蛋白的折叠和组装,有利于病毒增殖。GRP94所能结合的病毒蛋白均能与GRP78相结合,进一步提示了GRP78与GRP94具有相似的蛋白功能,宿主细胞可能通过上调GRP78表达水平代偿因GRP94敲除而缺失的相关功能。
