小核仁RNA宿主基因5对骨髓间充质干细胞成骨分化和凋亡的影响*
2022-11-25蒋海涛郑纪伟李芳张恺秦莹夏江澜孙晋虎
蒋海涛,郑纪伟,李芳,张恺,秦莹,夏江澜,孙晋虎
(徐州医科大学口腔医学院,江苏 徐州 221018)
骨质疏松症是一种代谢性和系统性的骨骼疾病,常见于老年人和绝经后妇女[1]。该病可累及颌骨,表现为颌骨骨量减少,微建筑骨结构破坏,骨脆性增加。研究表明,骨质疏松症患者与牙周炎患者的附着丧失和牙槽骨骨丢失高度相关,因此认为改善骨质疏松是牙周炎防治的一个关键因素[2]。研究表明,骨质疏松症对口腔种植体近中和远中的边缘骨丢失有显著影响[3],因此其也是种植体周围炎的潜在影响因素。所以控制骨质疏松对临床维持颌骨高度、改善种植修复条件、防治牙周病、提高患者生活质量具有重要意义。既往研究[4-5]表明,骨髓间充质干细胞的异常分化导致骨平衡紊乱,最终导致骨质疏松症。长链非编码RNA(long noncoding RNA, lncRNA)功能紊乱目前已得到相当多的关注,越来越多的研究揭示了lncRNA 在包括骨质疏松症在内的多种疾病中的作用越来越大[6-7]。小核仁RNA 宿主基因5(small nucleolar RNA host gene 5,SNHG5)是一个位于6q15染色体上,长度为524 nt 的lncRNA。已有研究发现SNHG5在恶性肿瘤中发挥作用[8-10],而在成骨机制中的作用研究较少,有待进一步揭示。本研究试图揭示SNHG5对骨髓间充质干细胞分化和凋亡的调控作用,有待其成为颌骨骨质疏松治疗的全新靶点。
1 材料与方法
1.1 材料
人骨髓间充质干细胞(hBMSCs)(中国赛业生物科技有限公司),α-Minimum Essential 培养基(美国HyClone 公司),胰蛋白酶、磷酸盐缓冲液(PBS)、胎牛血清、链霉素、青霉素(美国Gibco 公司),β-甘油磷酸、地塞米松、抗坏血酸、茜素红、4%多聚甲醛、4',6-二脒基-2-苯基吲哚(美国Sigma 公司),TRIzol(美国 Invitrogen 公司),Prime Script RT Master Mix 试剂盒(日本TaKaRa 公司),SYBR Green 实时荧光定量PCR 预混液(日本Osaka 公司),OCN、OSX、COL1A1、GAPDH 一抗(英国Abcam 公司),碱性磷酸酶(ALP)活性检测试剂盒(南京建成生物工程研究所),原位凋亡检测试剂盒(日本TaKaRa 公司),Caspase-3 活性检测试剂盒(上海Best Bio 公司)。
1.2 研究方法
1.2.1 细胞培养和成骨分化诱导 在α-Minimum Essential 培养基中加入10% 胎牛血清、链霉素100 mg/L、青霉素100 u/L,在37°C、5%二氧化碳培养箱中培养人骨髓间充质干细胞。每3 天或每4 天更换1 次培养基,当细胞达到80%~90%融合时,培养基中加入 1 0 mmol/L β-甘油磷酸、100 nmoL 地塞米松及200 μmol/L 抗坏血酸。成骨分化诱导14 d,每3 天更换成骨诱导培养基。
1.2.2 细胞转染及分组 使用Lipofectamine 2000试剂盒进行细胞转染,转染前24 h 对细胞进行转接,接种密度约为每孔1×105个细胞。转染过程:吸去培养皿中的培养基,用PBS 或者无血清培养基清洗1 次,更换无血清培养基,准备转染制备液(A 液:用 2 00 μL Opti-MEM 稀释 4 μg 质粒;B 液:用 2 00 μL Opti-MEM 稀释 1 0 μL Lipofectamine 2000),分别将A液、B 液轻轻混匀,静置5 min,吸取B 液加入至A 液中,轻轻混匀,室温静置20 min,加入转染试剂到每个孔的培养基中,6 h 后更换成完全培养基。继续培养24 h 后观察转染效率。分组:转染 短 发 夹 RNA(SH-SNHG5#1,SH-SNHG5#2,SH-SNHG5#3)用于抑制SNHG5表达,转染sh-RNA(sh-NC)作为阴性对照。转染sh-NC 为对照组,转染SH-SNHG5#1 为实验组。
1.2.3 Western blotting 检测 OCN、OSX 及 COL1A1蛋白相对表达量 用裂解缓冲液获得总蛋白后,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,并电转移到聚偏氟乙烯膜。随后,将膜密封在5%脱脂牛奶中1 h,4°C 下用特异性一抗过夜,然后二抗孵育,并使用GE 增强化学发光法检测系统进行测量。以GAPDH 作为对照,检测成骨诱导前后及转染后第14 天OCN、OSX 及COL1A1 蛋白相对表达量。
1.2.4 实时荧光定量聚合酶链反应(qRT-PCR)检测SNHG5、OCN、OSX、COL1A1 mRNA 相对表达量 TRIzol 试剂提取hBMSCs 总RNA,根据说明书,使用Prime Script RT Master Mix 试剂盒进行逆转录。然后使用SYBR Green 实时荧光定量预混液在ABI Prism 7900HT 荧光定量PCR 仪中进行逆转录聚合酶链反应。反应体系:退火反应液14 μL,M-MLV酶缓冲液 4 μL,RNA 酶抑制剂 1 μL,M-MLV 逆转录酶1 μL;反应条件:42℃预变性60 min,95℃变性 5 min,4 ℃退火 5 min。qRT-PCR 扩增体系为:5×SYBR GreenI PCR 缓冲液10 μL,正向引物(10 pmol/μL)1 μL,反向引物(10 pmol/μL)1 μL,dNTPs(10 mmol/L)1 μL, T aq 酶(3 u/μL)1 μL,cDNA 5 μL,ddH2O 31 μL;反应条件:93℃预变性3 min,93℃变性 3 0 s,55℃退火 4 5 s,72℃延伸 4 5 s,共40 个循环。采用2-ΔΔCt法计算成骨诱导前后SNHG5 和OCN mRNA 相对表达量,以及转染后第14 天 O CN、 O SX、 C OL1A1 mRNA 相 对 表 达 量 。GAPDH 和U6 分别作为内参对照,每个实验至少重复3 次。引物序列见表1。

表1 qRT-PCR引物序列
1.2.5 ALP 活性测定 对常规培养以及转染后的各组hBMSCs 进行成骨分化诱导,随后接种于24 孔板(1×105个细胞/孔)。去除培养基,用PBS 洗涤3 次,4% 多聚甲醛 固 定 3 0 min 后,再 次 清洗,每孔加入配制好的ALP 显色剂避光染色30 min,PBS 冲洗后用倒置光学显微镜观察。为了检测ALP 活性的定量表达,先用PBS 清洗细胞,每孔加入 1 00 μL 1% 曲拉通X-100,置于冰上裂解30 min,混匀后收集细胞裂解液。离心10 min(4℃,12 000 r/min),取上清液即为待测液。根据ALP 活性检测试剂盒说明书,待测液加入96 孔板,设置空白对照孔、标准品孔和待测液孔,按试剂盒说明书加入缓冲液和基质液,37℃避光孵育15 min 后,于酶标仪405 nm 波长处测定吸光度值。实验重复3 次,最后根据ALP 酶活性定义,计算待测液ALP 活性。
1.2.6 茜素红染色 hBMSCs 用4%多聚甲醛溶液固定,用2%茜素红染色,吸去固定液,用1×PBS 冲洗细胞2 次,光学显微镜下观察拍照。为定量hBMSCs 的矿化,本实验从hBMSCs 中分离茜素红,用氯化十六烷基吡啶缓冲液孵育1 h,在562 nm 波长处检测茜素红OD 值,绘制标准曲线,计算成骨诱导前后及转染后第14 天茜素红的浓度。
1.2.7 流式细胞术检测细胞凋亡 取处于对数生长期的第4 代细胞,分为对照组(sh-NC 组)、实验组(sh-SNHG5#1/2/3 组)。将两组细胞按2×105个/孔的密度接种于6 孔培养板中,加入培养基至2 mL,过夜培养48 h 后,待细胞融合度达到80%~90%时,停止培养。PBS 冲洗3 遍后胰酶消化离心收集细胞沉淀,加入适量的PBS 重悬细胞,再次离心后收集细胞沉淀。加入预冷的70%乙醇(无水乙醇∶PBS = 7∶3)4℃过夜固定,加入 1 00 μL RNaseA 溶液重悬细胞,放在37℃水浴锅中加热30 min,加入400 μL 碘化丙咤(PI)染色液,40℃避光孵育30 min,孵育结束后PBS 洗2 次。采用流式细胞仪进行检测:流式细胞仪激化光波长用488 nm,用波长>560 nm 的通带滤器检测PI 荧,用一波长为515 nm 的通带滤器检测FITC 荧光,计算转染后第14 天细胞凋亡率。
1.2.8 酶联免疫吸附试验检测Caspase-3 活性 用90 μL 裂解缓冲液裂解 h BMSCs,然后用 1 0 μL Ac-DEVD-ρNA 处理细胞裂解液。室温孵育2 h 后,经酶标仪测定405 nm 波长处的吸光度值,实验重复3 次,检测转染后第14 天Caspase-3 活性。
1.3 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差()表示,两组比较用t检验;成骨诱导前后、转染不同质粒后的比较用随机区组设计的方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 成骨诱导前后各成骨蛋白相对表达量的比较
Western blotting 检测结果显示,成骨诱导前、诱导后第7 天、诱导后第14 天的OCN、OSX 及COL1A1 蛋白相对表达量比较,经随机区组设计的方差分析,差异有统计学意义(P<0.05),进一步两两比较,经LSD-t检验,诱导后第14 天高于诱导后第7 天和成骨诱导前(P<0.05),诱导后第7 天高于成骨诱导前(P<0.05)。见图1 和表2。
表2 成骨诱导前后OCN、OSX、COL1A1蛋白相对表达量比较 ()
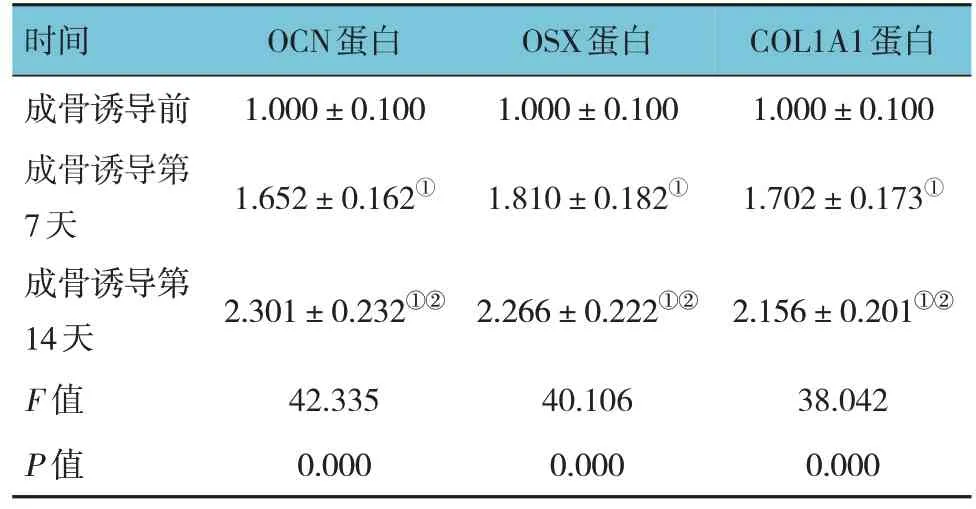
表2 成骨诱导前后OCN、OSX、COL1A1蛋白相对表达量比较 ()
注:①与成骨诱导前比较,P <0.05;②与成骨诱导第7天比较,P <0.05。
OCN蛋白1.000±0.100 1.652±0.162①时间成骨诱导前成骨诱导第7天成骨诱导第14天F 值P 值OSX蛋白1.000±0.100 1.810±0.182①COL1A1蛋白1.000±0.100 1.702±0.173①2.301±0.232①②2.266±0.222①②2.156±0.201①②38.042 0.000 42.335 0.000 40.106 0.000

图1 成骨诱导前后各成骨蛋白的表达
2.2 成骨诱导前后ALP活性和茜素红浓度比较
成骨诱导前、成骨诱导第7 天、成骨诱导第14 天ALP 活性和茜素红浓度比较,经随机区组设计的方差分析,差异有统计学意义(P<0.05)。进一步两两比较,经LSD-t检验,诱导后第14 天的ALP 活性和茜素红浓度大于成骨诱导第7 天和成骨诱导前(P<0.05),成骨诱导第 7 天大于成骨诱导前(P<0.05)(见表3)。成骨诱导第14 天茜素红染色深度明显提高,表明ALP 活性上升,钙盐沉积增多,成骨活性增强(见图2、3)。
表3 成骨诱导前后ALP活性及茜素红浓度比较 ()
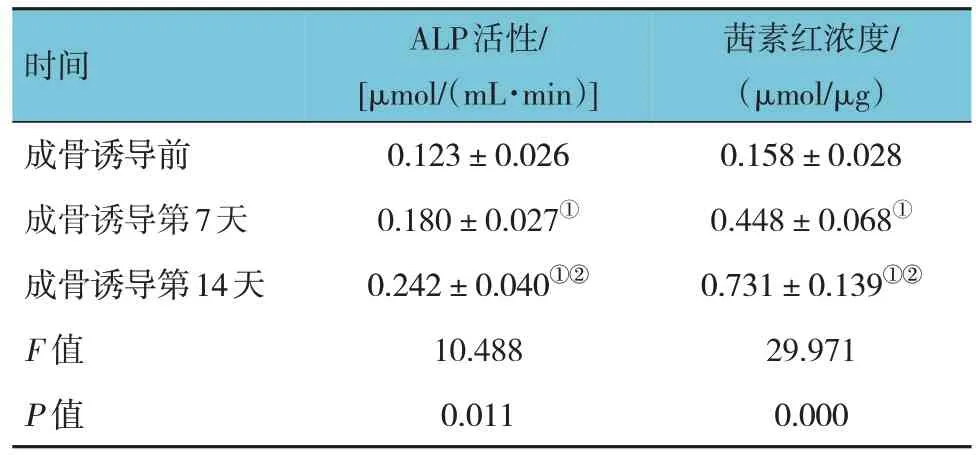
表3 成骨诱导前后ALP活性及茜素红浓度比较 ()
注:①与成骨诱导前比较,P <0.05;②与成骨诱导第7天比较,P <0.05。
茜素红浓度/(μmol/μg)0.158±0.028 0.448±0.068①0.731±0.139①②29.971 0.000时间成骨诱导前成骨诱导第7天成骨诱导第14天F 值P 值ALP活性/[μmol/(mL·min)]0.123±0.026 0.180±0.027①0.242±0.040①②10.488 0.011
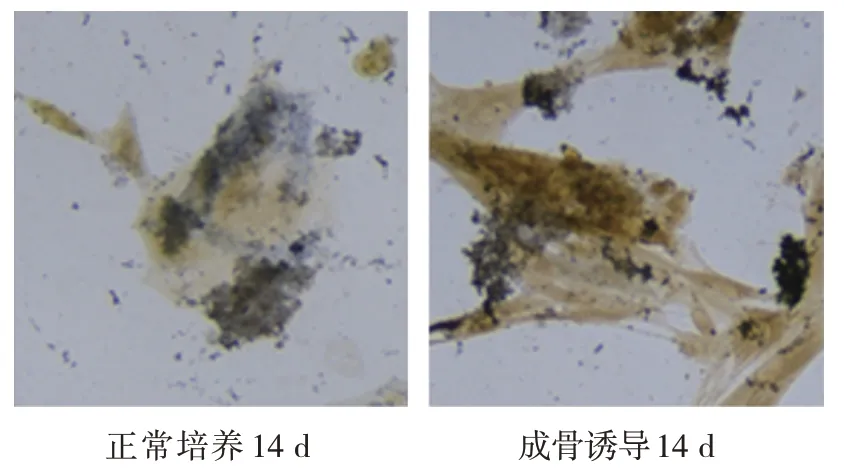
图2 成骨诱导前后ALP染色结果 (×20)

图3 成骨诱导前后茜素红染色结果 (×20)
2.3 成骨诱导前后SNHG5和OCN mRNA相对表达量比较
qRT-PCR 检测结果显示,成骨诱导前、成骨诱导第1 天、成骨诱导第3 天、成骨诱导第5 天、成骨诱导第7 天、成骨诱导第14 天SNHG5、OCN mRNA 相对表达量比较,经随机区组设计的方差分析,差异有统计学意义(P<0.05)。SNHG5 和OCN mRNA 相对表达量随时间推移逐渐升高。见表 4 和图 4。
表4 成骨诱导前后SNHG5和OCN mRNA相对表达量比较 ()

表4 成骨诱导前后SNHG5和OCN mRNA相对表达量比较 ()
时间成骨诱导前成骨诱导第1天成骨诱导第3天成骨诱导第5天成骨诱导第7天成骨诱导第14天F 值P 值SNHG5 mRNA 1.000±0.173 1.201±0.275 1.716±0.281 2.080±0.511 2.478±0.389 2.951±0.466 12.399 0.000 OCN mRNA 1.000±0.151 1.297±0.229 1.755±0.302 2.071±0.380 2.455±0.417 2.922±0.634 10.443 0.000

图4 SNHG5和OCN mRNA相对表达量随时间变化趋势
2.4 转染不同质粒后各组SNHG5 mRNA 相对表达量比较
转染不同质粒后,sh-NC 组、sh-SNHG5#1 组、sh-SNHG5#2 组 及 sh-SNHG5#3 组 的 SNHG5 mRNA相对表达量比较,经随机区组设计的方差分析,差异有统计学意义(P<0.05)。进一步两两比较,经 LSD-t检验, sh-SNHG5#1 组、sh-SNHG5#2 组 及sh-SNHG5#3 组的SNHG5 的相对表达量低于sh-NC组 (P<0.05)。结果表明转染 sh-SNHG5#1/2/3 均可降低骨髓间充质干细胞SNHG5 表达,其中以转染sh-SNHG5#1 最为显著。见表5。
表5 转染不同质粒后SNHG5 mRNA相对表达量比较()

表5 转染不同质粒后SNHG5 mRNA相对表达量比较()
注 :†与sh-NC组比较,P <0.05。
组别sh-NC组sh-SNHG5#1组sh-SNHG5#2组sh-SNHG5#3组F 值P 值SNHG5 mRNA 0.999±0.157 0.180±0.031†0.221±0.042†0.290±0.070†56.044 0.000
2.5 转染后第14 天OCN、OSX、COL1A1 蛋白相对表达量比较
两组细胞转染质粒后第14 天OCN、OSX、COL1A1 蛋白相对表达量比较,经t检验,差异有统计学意义(P<0.05),实验组低于对照组。见图5和表6。

图5 转染不同质粒后各成骨相关蛋白的相对表达量
表6 转染不同质粒后两组各成骨标志物蛋白相对表达量比较 ()

表6 转染不同质粒后两组各成骨标志物蛋白相对表达量比较 ()
组别对照组实验组t 值P 值OCN蛋白1.000±0.100 0.380±0.035 10.118 0.000 OSX蛋白1.000±0.100 0.323±0.035 11.005 0.000 COL1A1蛋白1.000±0.100 0.415±0.039 9.434 0.000
2.6 转染质粒后第14天OCN、OSX、COL1A1 mRNA相对表达量比较
两组细胞转染质粒后第14 天OCN、OSX 及COL1A1 mRNA 相对表达量比较,经t检验,差异有统计学意义(P<0.05),实验组低于对照组。见表7。
表7 两组转染质粒后第14天OCN、OSX、COL1A1mRNA相对表达量比较 ()

表7 两组转染质粒后第14天OCN、OSX、COL1A1mRNA相对表达量比较 ()
组别对照组实验组t 值P 值OCN mRNA 1.001±0.228 0.344±0.069 4.766 0.004 OSX mRNA 0.999±0.216 0.402±0.074 4.521 0.005 COL1A1 mRNA 1.000±0.169 0.384±0.093 5.529 0.003
2.7 细胞转染质粒后ALP活性和茜素红浓度比较
细胞转染后第14 天两组ALP 活性比较,经t检验,差异有统计学意义(P<0.05),实验组低于对照组(见表8)。ALP 染色结果显示,转染sh-SNHG5#1后第14 天,实验组ALP 染色明显浅于对照组,结果表明ALP 活性降低,实验组骨向分化程度低于对照组(见图6)。细胞转染后第14 天两组茜素红浓度比较,经t检验,差异有统计学意义(P<0.05),实验组低于对照组(见表8)。结果表明下调SNHG5 可以明显抑制BMSCs 的骨向分化。茜素红染色结果显示,转染sh-SNHG5#1 后第14 天,实验组细胞染色明显浅于对照组(见图7)。表明实验组钙离子沉积较少,骨向分化程度低,矿化水平明显低于对照组。

图6 转染质粒后ALP染色结果 (×20)

图7 转染质粒后茜素红染色结果 (×20)
表8 细胞转染质粒后两组ALP活性及茜素红浓度比较()
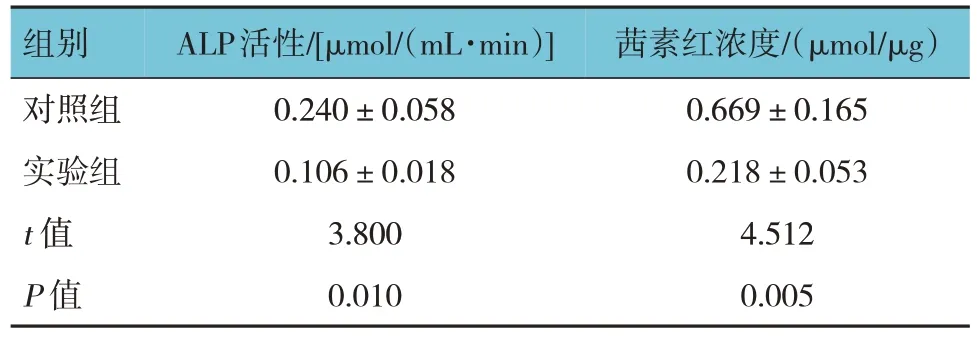
表8 细胞转染质粒后两组ALP活性及茜素红浓度比较()
组别对照组实验组t 值P 值ALP活性/[μmol/(mL·min)]0.240±0.058 0.106±0.018 3.800 0.010茜素红浓度/(μmol/μg)0.669±0.165 0.218±0.053 4.512 0.005
2.8 两组细胞凋亡率和Caspase-3活性比较
流式细胞术实验结果显示,两组细胞凋亡率和Caspase-3 活性比较,经t检验分析,差异有统计学意义(P<0.05),实验组高于对照组(见表 9)。SNHG5基因下调后,早期及晚期凋亡细胞的数量明显增加。见图8。
表9 两组细胞凋亡率和Caspase-3活性比较()
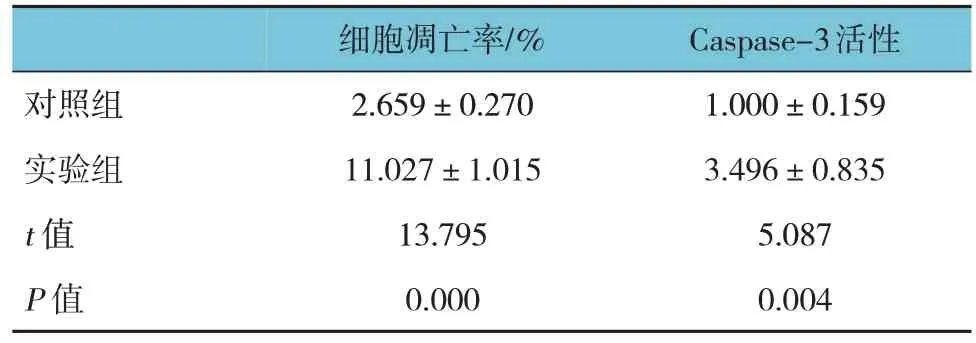
表9 两组细胞凋亡率和Caspase-3活性比较()
对照组实验组t 值P 值细胞凋亡率/%2.659±0.270 11.027±1.015 13.795 0.000 Caspase-3活性1.000±0.159 3.496±0.835 5.087 0.004

图8 流式细胞图
3 讨论
随着全球人口老龄化的加剧,骨质疏松症的发病率不可避免地增长,骨质疏松症成为一个严峻的公共卫生问题。骨质疏松症在口腔颌面不仅仅体现为牙周附着能力的丧失,加重牙周病的发展,导致早期牙齿缺失,同时由于骨质疏松的发生,骨量的降低及骨结合能力下降,对口腔种植体的早期稳定性带来了巨大的挑战,极大影响种植手术预后效果,颌骨骨质疏松成为了口腔颌面部功能修复的一大障碍[1-2]。机械应力、激素波动、营养缺乏及炎症是导致骨质疏松的主要危险因素[3-4]。
治疗颌骨骨质疏松的方法主要是药物治疗,包含骨吸收抑制剂(激素治疗法、选择性雌激素受体调节治疗、二磷酸盐治疗)、骨矿化剂(钙剂、维生素D、锶制剂)和骨形成促进剂(甲状旁腺素)的应用。其中二磷酸盐作为最常见的治疗药物,其可能导致严重的颌骨坏死,从而破坏口腔健康,影响口腔正常功能,所以干细胞疗法及生物疗法的研究显得越发重要。
骨髓间充质干细胞具有自我更新功能和分化能力,在骨质疏松症的进展中起着至关重要的作用。因此,阐明骨髓间充质干细胞成骨的潜在机制有助于提高骨质疏松症的临床治疗水平。骨髓间充质干细胞是多种成熟细胞的前体细胞,具有自我更新、高增殖及多向分化能力。骨髓间充质干细胞可以分化为多种间充质细胞谱系,包括肌细胞、成骨细胞、脂肪细胞及软骨细胞。骨髓间充质干细胞在骨质疏松症的发展中具有重要意义,因此,了解骨髓间充质干细胞成骨分化的调控机制,有助于发现治疗骨质疏松的有效方法。
LncRNAs 被认为是非编码RNA 分子的重要组成部分,多个研究表明,lncRNAs 可作为诱饵分子、信号调节蛋白、引导蛋白及支架蛋白参与多种生物活性,如细胞增殖、凋亡、迁移、侵袭、分化等[11-12],在包括骨质疏松症在内的各种疾病中发挥着十分重要的作用[6]。其中,一些参与肿瘤进展的lncRNA 也可能参与骨质疏松症。例如:lncRNA H19[13]、lncRNA KCNQ1OT1[14]、SNHG1 等[15]。 SNHG1 的 过 度表达通过促进神经前体细胞表达发育性下调蛋白4(NEDD4)与p-p38 之间的相互作用,从而降低BMSCs 的分化能力,且其表达随着成骨进展不断降低。
SNHG5是一个位于6q15染色体、长度为524个核苷酸的lncRNA。SNHG5 的功能已经在很多疾病中得到了探索。SNHG5可通过miR-181a-5p/TGFBR3轴促进软骨细胞增殖,抑制骨关节炎进展[16],LncRNA SNHG5 通过激活miR-132-3p 正向调控直肠癌细胞的分化过程,miR-132-3p 与SNHG5 表达呈负相关,SNHG5 可以直接结合到miR-132-3p 的3'-UTR 区域并抑制其表达[17]。而研究发现miR-132-3p可通过靶向骨形成蛋白2(BMP-2)抑制骨髓源性干细胞(BMSC)成骨分化,抑制miR-132-3p 可显著提高BMSCs 的成骨能力[18]。SNHG5 可能通过miR-132-3p 参与成骨分化过程。然而SNHG5 对于成骨机制相关的研究较少,尚无有力证据。
本研究通过检测成骨诱导后SNHG5 的表达,发现在hBMSCs 成骨分化过程中,相关成骨标志物(OCN、OSX、COL1A1)蛋白的相对表达量均上调,与此同时,SNHG5 mRNA 相对表达量也显著提高;而通过短发夹RNA 抑制SNHG5 的表达后,再行成骨诱导,成骨相关蛋白相对表达量相较于对照组显著下降,ALP 活性明显降低,矿化水平也大大下降,充分证实了降低SNHG5 表达后,hBMSCs 成骨活性被抑制。这可能与miR-132-3p 等成骨相关miRNA 水平的变化有关,需要进一步探究。与此同时,SNHG5 下调导致凋亡细胞比例上升且Caspase-3活性明显提升,证明了SNHG5 下调促进了hBMSCs的凋亡,这与SNHG5 的下调诱导软骨细胞[15]及肺癌细胞[17]凋亡有相同的趋势。本研究结果表明,通过对患者临床标本检测SNHG5 可用于指导临床上骨质疏松的治疗。然而骨质疏松受很多因素的影响,成骨分化作为其中的重要一环,仍受到其他因素(如激素水平改变等)的影响及制约,而本实验只是对SNHG5 参与hBMSCs 成骨分化及细胞凋亡的初步探究,尚不完善。因此,未来需要侧重于骨质疏松患者临床标本(如血浆等)中SNHG5 的研究,SNHG5 可能成为全新的骨质疏松症的检测指标,为不同治疗策略和高危人群早期诊断带来更有意义的临床价值。同样,SNHG5 有可能成为治疗骨质疏松的靶基因,对于后续实验的推进有着极大的价值,从而推动基因治疗骨质疏松症的进程。
综上所述,SNHG5 参与调控骨髓间充质干细胞成骨分化和凋亡,可能是一种很有前途的治疗骨质疏松症的新靶点。然而,SNHG5 在骨质疏松症中的价值需要进一步探讨,激活下游通路中的蛋白表达可能成为后续的研究方向,并需要临床和体内实验进一步证明,进而为临床上治疗颌面部骨质疏松与颌骨缺损提供新思路及新选择。
