低温无水保活对缢蛏活性氧代谢、糖原及乳酸的影响
2022-11-24方佳琪
方佳琪,张 敏,2,3*
低温无水保活对缢蛏活性氧代谢、糖原及乳酸的影响
方佳琪1,张 敏1,2,3*
(1. 上海海洋大学食品学院,上海 201306;2. 食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306;3. 上海冷链装备性能与节能评价专业技术服务平台,上海 201306)
为探究无水保活期间双壳贝类活性氧代谢、糖原及乳酸的变化,以缢蛏()为试验材料,将缢蛏分别在4 ℃、10 ℃和15 ℃下无水保活,测定其存活率、超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化氢酶(catalase,CAT)活性、还原性谷胱甘肽(glutathione,GSH)含量、丙二醛(malondialdehyde,MDA)含量、过氧化氢(hydrogen peroxide,H2O2)含量、糖原及乳酸含量。结果显示,保活前3 d各组缢蛏均维持90 %以上的存活率;保活7 d后4 ℃组存活率仍可达到84 %,高于10 ℃组的67 %,15 ℃组存活率最低,仅为52 %。在整个无水保活期间,4 ℃组缢蛏SOD活性、CAT活性以及GSH含量均显著高于同时期其他各组(<0.05);在保活后期,相较于其他处理组,4 ℃组缢蛏有着显著最低的MDA含量和H2O2含量 (<0.05);此外,保活1~3 d时10 ℃组缢蛏体内糖原含量下降幅度仅有3.7 %,为各组最低;随着保活时间的延长,各组缢蛏体内的糖原含量持续减少,乳酸含量则不断增加,且同时期4 ℃组缢蛏比其他各组糖原消耗量更少,乳酸积累的速率也更慢。以上结果表明,在缢蛏短途运输(2 d)时,10 ℃和15 ℃能维持缢蛏较高的存活率,是较适宜的保活温度;而4 ℃在保活后期能有效地诱导了缢蛏机体SOD活性、CAT活性和GSH含量的增加,同时抑制MDA和H2O2的含量,并减缓糖原的消耗和乳酸积累的速率,具有更好的保活效果,更利于缢蛏的长途运输(7 d)。
缢蛏;无水保活;温度;活性氧代谢;糖原;乳酸
缢蛏()俗称蛏子,是一种典型的滩涂双壳贝类,广泛分布于我国沿海地区,因其养殖周期短,同时也是我国海水池塘养殖的重要经济贝类[1-2]。在我国,缢蛏以鲜销为主,但缢蛏产地与其销售地之间有一定距离,且由于缢蛏组织肉较为松软,长时间暴露于空气中易受微生物污染而腐败,再加上在运输过程中受到温度和运输方法等因素的制约[3],导致缢蛏在整个贸易链中会受到强烈的应激反应,存活率大幅降低,造成重大的经济损失[4]。因此,开展对缢蛏运输中保活技术的研究具有重要的商业意义和现实意义。
随着市场需求的进一步增加,为降低运输过程中贝类的死亡率,无水保活技术由于其成本低、无污染、装载能力强的特点[5],受到了众多学者的广泛关注。有研究发现,无水保活能维持波纹巴非蛤()[6]基本营养成分的含量,并有效降低四角蛤蜊()[7]的死亡率。温度是贝类在无水保活过程中的重要影响因素之一[8]。保活温度的变化会对贝类造成不利影响,一方面,当保活温度较高时,贝类体内代谢加速,根本原因是其耗氧量与温度成正相关,即温度越高耗氧量越大,从而引起贝类能量需求的增加,产生一系列氧化应激反应[9];另一方面,当保活温度过低时,贝类的低温耐受能力不足以维持其正常的生理活动,从而受到强烈的冷应激,严重时会导致细胞损伤[10]。郑惠娜等[11]在对文蛤(Linnaeus)的无水保活研究中对比了常温无水保活、4 ℃无水保活以及冰块降温保活三种方法,结果表明,4 ℃无水保活效果最佳,文蛤全部死亡时间为10 d,满足长距离运输的时间要求。苏艳玲[12]研究发现,20 ℃的贮藏条件下至第4 天时,菲律宾蛤仔()的存活率仅为20 %,比5 ℃条件低40 %左右,且pH值、糖原含量相较于5 ℃下降得更快,保活效果不理想。因此,贝类运输过程中适宜的温度是无水保活的关键。
虽然双壳贝类低温无水保活的研究逐渐受到关注,但关于实际运输过程中适宜保活温度条件的探究少有报道。基于此,本研究以缢蛏为研究对象,模拟了目前我国生鲜电商常用运输温度(4 ℃、10 ℃和15 ℃)条件,并探讨该条件下缢蛏存活率、抗氧化酶活性、脂质过氧化物以及能量代谢指标的变化规律,旨在为缢蛏的低温无水保活运输提供科学依据。
1 材料与方法
1.1 供试材料
缢蛏,平均壳长为(6.4±0.5) cm,平均壳宽为(2.4±0.2) cm,平均体质量为(18±0.6) g,于2020年12月采捕自上海市浦东新区南汇新城镇芦潮港附近水域,活体于1 h内由冷藏车运至实验室。在清洗干净表面泥沙等杂物后,随机选取规格相近且双壳均无破损的缢蛏作为试验材料。
1.2 试剂与仪器
1.2.1 试剂 糖原(Glycogen)测定试剂盒,货号A043-1-1;乳酸(LD)测试盒,货号A019-2-1;丙二醛(MDA)测试盒,货号A003-1;过氧化氢(H2O2)测试盒,货号A064-1-1;总超氧化物歧化酶(T-SOD)测试盒,货号A001-1;过氧化氢酶(CAT)测定试剂盒,货号A007-2;谷胱甘肽(GSH)测试盒,货号A006-1-1;总蛋白定量测试盒,货号A045-3。上述测试盒均由南京建成生物工程研究所研制。
试验用人工海水盐为海洋生物专用生态海水盐,江西盐通科技有限公司。
1.2.2 仪器 BPS-100CA 型恒温恒湿箱,上海一恒科学仪器有限公司;BJ2100D 型数字孔式电子天平,上海圣科仪器设备有限公司;AUW320 型分析天平,上海亚津电子科技有限公司; FSH-2A 型匀浆机,江苏金怡仪器科技有限公司;H-2050R 型离心机,湖南湘仪离心机仪器有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 试验设计 试验开始前,在一个大塑料箱中配制盐度为(18±0.5) ‰的人工海水,并使用增氧泵不断向海水中充气,以增加水中溶解氧含量,使溶氧量维持在4.0 mg·L-1以上。将所有洗净后的缢蛏分装在两个相同大小的塑料筐中,使其同时浸没于大塑料箱中的人工海水,贝水比约为1∶3[13],缢蛏维持生命活动最适宜的温度在20 ℃左右[14],为此在整个暂养过程中始终使大塑料箱中水温维持在(20±1) ℃。
试验设置4、10和15 ℃共3个保活温度组,每个温度组3个平行,每个平行共100只缢蛏。暂养结束后,将缢蛏从大塑料箱中取出,转移至各个装有吸水海绵的小塑料箱中,使其平铺放置,同时将浸有人工海水的双层纱布覆盖在贝体表面,将小塑料箱转移至预先设定好各保活温度的恒温恒湿箱中,开始无水保活过程。为减轻缢蛏在降温过程中受到的冷胁迫,采取梯度缓慢降温方式,降温幅度为2.5 ℃·h-1, 每降温一次需让缢蛏在该温度下停留至少6 h来适应当前温度环境,同时为使箱体内有较高的相对湿度,每隔24 h向纱布上喷淋人工海水。整个保活过程中,每天进行存活率的测定;在保活第0 天、保活第1 天、保活第3 天、保活第5天、以及保活第7 天分别取样进行各指标的测定。
1.3.2 样品采集 从每个平行组随机取3只缢蛏放置于冰盘上,提取其鳃组织,在分析天平上准确称重并转移至离心管中。按重量体积比为1∶9(g∶mL)加入0.86 %已预冷的生理盐水,冰浴条件下使用匀浆机(10 000 r·min-1)匀浆约3 min。匀浆液经离心机(8 000 r·min-1)离心20 min, 所得上清液进行总蛋白定量以及各指标的测定。
1.3.3 存活率的测定 采用目测法[4],轻轻触碰缢蛏肉体后,观察缢蛏贝壳能否自由闭合或水管能否自由伸缩,若可以则为活贝,不能则为死贝。存活率为活缢蛏占缢蛏总数的百分比。
1.3.4 糖原、乳酸含量的测定 糖原含量的测定采用蒽酮比色法。糖原在浓硫酸的作用下脱水生成糖醛衍生物,再与蒽酮反应生成蓝色化合物,与标准葡萄糖溶液比色定量,计算结果以mg·g-1表示;乳酸含量的测定采用分光光度法。乳酸脱氢酶(LDH)催化乳酸产生丙酮酸,其中吩嗪硫酸甲酯(PMS)递氢使氯化硝基四氮唑蓝(NBT)还原为紫色物质,该物质在530 nm处与乳酸含量成线性关系,计算结果以mmol·g-1表示。
1.3.5 SOD和CAT活性的测定 SOD活性的测定采用羟胺法。通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子(superoxide anion, O2-·),后者氧化羟胺生成亚硝酸盐,在显色剂的作用下呈紫红色,于550 nm处有最大光吸收。定义每毫克组织蛋白在1 mL反应液中SOD抑制率达50 %时所对应的SOD量为一个SOD活力单位(U);CAT活性的测定采用紫外比色法。CAT在一定条件下能直接分解H2O2,使其浓度逐渐降低,对应的吸光度也逐渐下降。定义每毫克组织蛋白中CAT每秒钟分解吸光度为0.50~0.55的底物中的H2O2相对量为一个CAT活力单位(U)。
1.3.6 MDA、H2O2和GSH含量的测定 MDA含量的测定采用TBA法。MDA可与硫代巴比妥酸(TBA)缩合生成红色物质,在532 nm处有最大吸收峰,计算结果以nmol·mg-1表示;H2O2含量的测定采用分光光度法。H2O2与钼酸作用生成一种络合物并在405 nm处可测其生成量,计算结果以mmol·g-1表示;GSH含量的测定采用比色法。GSH和二硫代二硝基苯甲酸作用生成稳定的黄色物质,在420 nm处有最大吸收峰,计算结果以mg·g-1表示。
1.4 数据处理分析
应用SPSS19.0软件对试验结果进行单因素方差分析(one-way ANOVA)及Duncan多重比较,显著性水平为<0.05。
2 结果与分析
2.1 低温无水保活对缢蛏存活率的影响
如图1所示,缢蛏3个温度组保活2 d内存活率均在95%以上,其中在4 ℃条件下没有出现缢蛏死亡现象。随着保活时间的延长,各组存活率均持续下降,但每个温度组下降的幅度有所不同,在保活第4 天之后,15 ℃组存活率呈现出急剧下降的趋势,4 ℃组存活率则缓慢下降。综合3个保活温度来看,4 ℃下缢蛏的存活率最高,在保活第7天时存活率仍高达84%,保活效果最好;10 ℃组存活率次之,为67%,而在15 ℃条件下存活率最低,仅为52%,表明有大量缢蛏死亡,保活效果差。
2.2 低温无水保活对缢蛏MDA含量的影响
MDA是细胞膜脂质过氧化反应的主要产物之一[14]。如图2所示,对比3个不同温度组,4 ℃组和10 ℃组MDA含量呈先升后降的趋势,并在保活中后期再次升高,其中4 ℃组MDA含量在保活第1 天快速升高且达到峰值,为15.78 nmol·mg-1,较第0 天增长了135.3%;10 ℃组MDA含量的回升趋势相较于4 ℃组提早了2 d,并在保活第7天时达到峰值,且与4 ℃组有显著性差异(< 0.05);而15 ℃组MDA含量在整个无水保活过程中持续上升,且随着保活时间的延长,上升的幅度进一步增大,在第7 天时达到了18.72 nmol·mg-1,是第0 天的2.79倍。

图1 低温无水保活对缢蛏存活率的影响
Figure 1 Effects of low-temperature waterless preservation on the survival rate of

图中不同小写字母表示不同温度组间的差异显著(P < 0.05),下同。
Figure 2 Effects of low-temperature waterless preservation on MDA content of
2.3 低温无水保活对缢蛏H2O2含量的影响
H2O2是一种常见的活性氧,过量时会引起氧化应激和细胞损伤[8]。如图3所示,在整个无水保活过程中,各温度组H2O2含量在保活后期相较于第0天均有不同程度的升高。对比3个温度组,4 ℃组H2O2含量呈现出先升后降再缓慢升高的趋势,在第1 天达到峰值,为171.10 mmol·g-1;10 ℃组变化趋势整体与4 ℃相近,但在保活中后期H2O2含量比4 ℃高,且在第5 天和第7 天与4 ℃组有显著性差异(< 0.05);15 ℃组H2O2含量变化趋势与MDA含量相类似,均持续升高,并在第7 天达到峰值,为185.96 mmol·g-1,较第0 天增长了122.24%,且在整个保活中后期其H2O2含量与其余两组差异显著(< 0.05)。
2.4 低温无水保活对缢蛏SOD活性的影响
SOD是一种重要的抗氧化酶,能够将机体内的超氧阴离子自由基转化为H2O2和O2,有效减轻活性氧引起的氧化损伤,其活性变化如图4所示。保活开始前,缢蛏体内SOD活性处于较低水平,为9.51 U·mg-1。保活第1 天时,3个不同温度处理组的SOD活性变化各不相同,其中4 ℃条件下缢蛏SOD活性大幅升高,达到了27.27 U·mg-1,是前一天的2.87倍,10 ℃组也较保活第0天上升了67.4%,而15 ℃组仅上升了16.2%,SOD活性增加不明显。随着保活时间的延长,4 ℃组SOD活性呈缓慢下降趋势并逐渐趋于稳定;而10 ℃组和15 ℃组SOD活性从保活第3天开始就始终处于低水平,且无显著性差异(> 0.05)。整个无水保活过程中,4 ℃组SOD活性显著高于其他两组(< 0.05)。
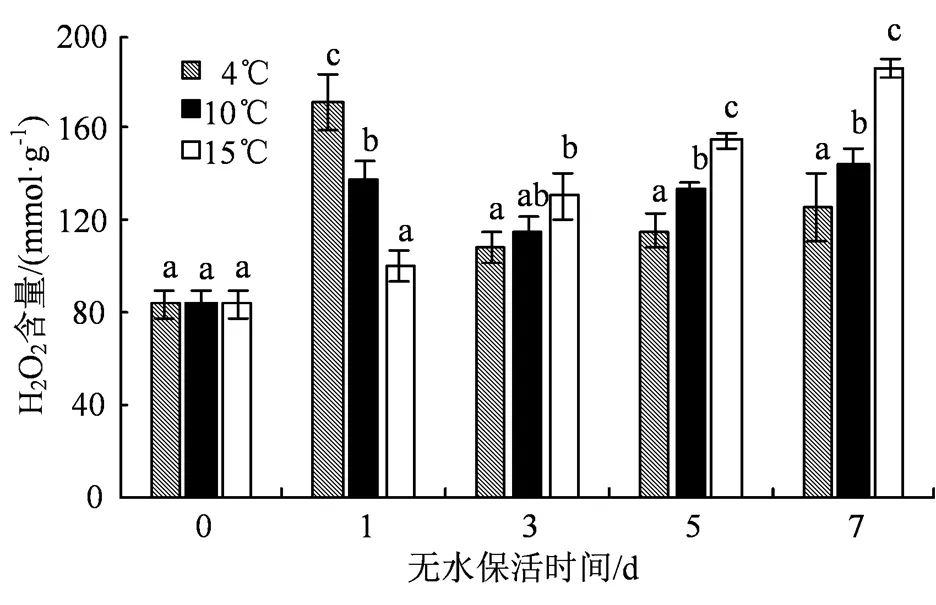
图3 低温无水保活对缢蛏H2O2含量的影响
Figure 3 Effects of low-temperature waterless preservation on H2O2content of
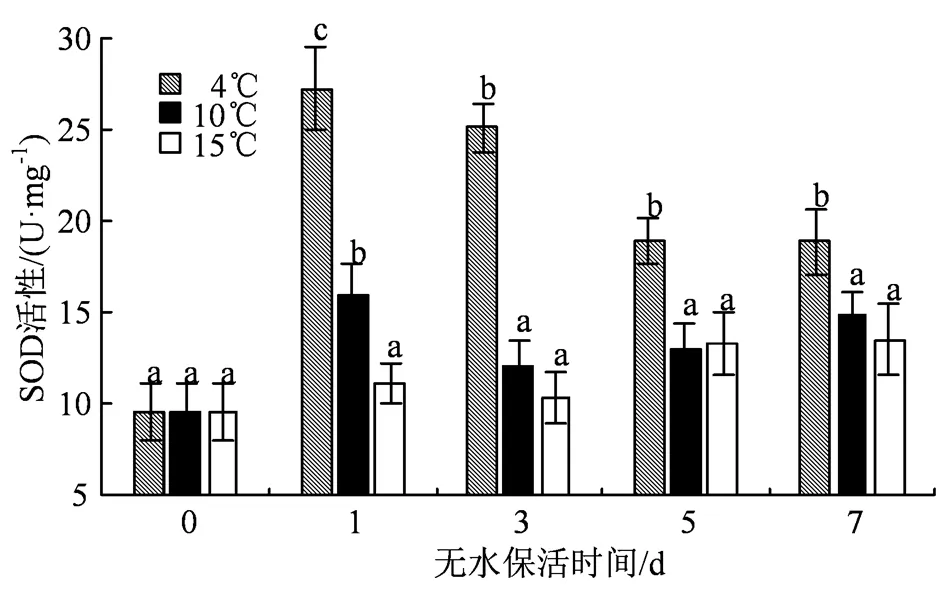
图4 低温无水保活对缢蛏SOD活性的影响
Figure 4 Effects of low-temperature waterless preservation on SOD activity of
2.5 低温无水保活对缢蛏CAT活性的影响
CAT是重要的活性氧清除酶,能够直接将 H2O2分解成H2O[8],其活性变化如图5所示。保活第1 天时,4 ℃组CAT活性急剧升高,为22.27 U·mg-1,是前一天的3.6倍;到了保活第7 天,4 ℃组CAT活性也维持在较高水平,相较于保活第0 天升高了101.7%。在整个无水保活过程中,4 ℃组和10 ℃组缢蛏CAT活性呈现出先升高后降低的趋势;15 ℃组则变化不大,其中保活第1、第3和第5 天时CAT活性比保活开始前略有下降,均处于低水平。在保活前期,3个温度组之间CAT活性均有显著性差异(<0.05);而到了保活后期,4 ℃组CAT活性显著高于其他两组(< 0.05)。
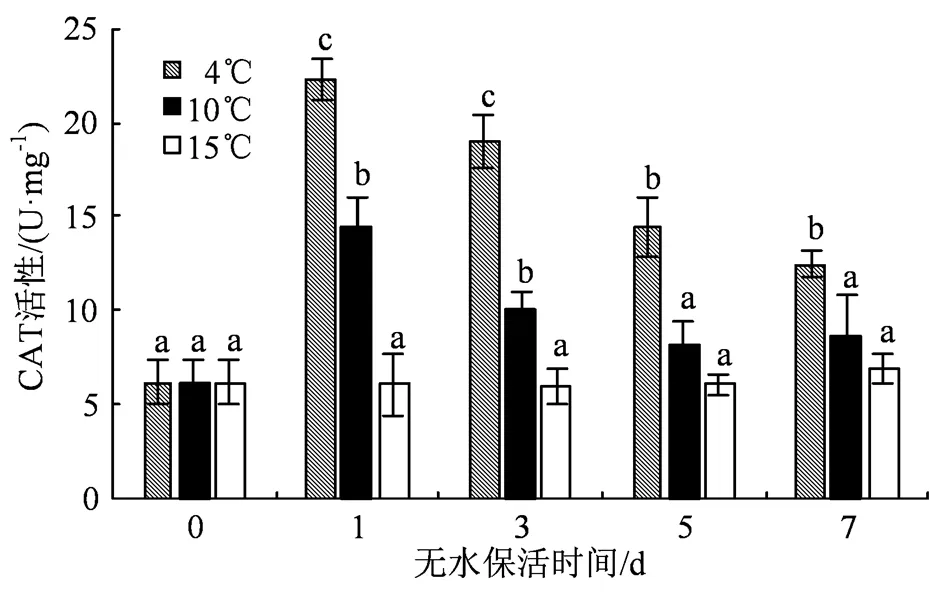
图5 低温无水保活对缢蛏CAT活性的影响
Figure 5 Effects of low-temperature waterless preservation on CAT activity of
2.6 低温无水保活对缢蛏GSH含量的影响
GSH是一类低分子抗氧化剂,可作为谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)催化反应的底物,起到清除活性氧的作用[15],其含量变化如图6所示。与SOD、CAT活性类似的是,从整个无水保活过程来看,4 ℃组、10 ℃组GSH含量均呈现出先升高后降低的趋势,其中4 ℃组GSH含量在保活后期趋于稳定,在第7 天时达到了16.39 mg·g-1,为第0 天的1.64倍;10 ℃组则持续缓慢降低。此外,15 ℃组GSH含量变化不大。对比3个不同温度组,4 ℃组的GSH含量在第1 天时急剧上升并达到峰值,为20.01 mg·g-1,且在之后几天其GSH含量显著高于其他两组 (< 0.05)。
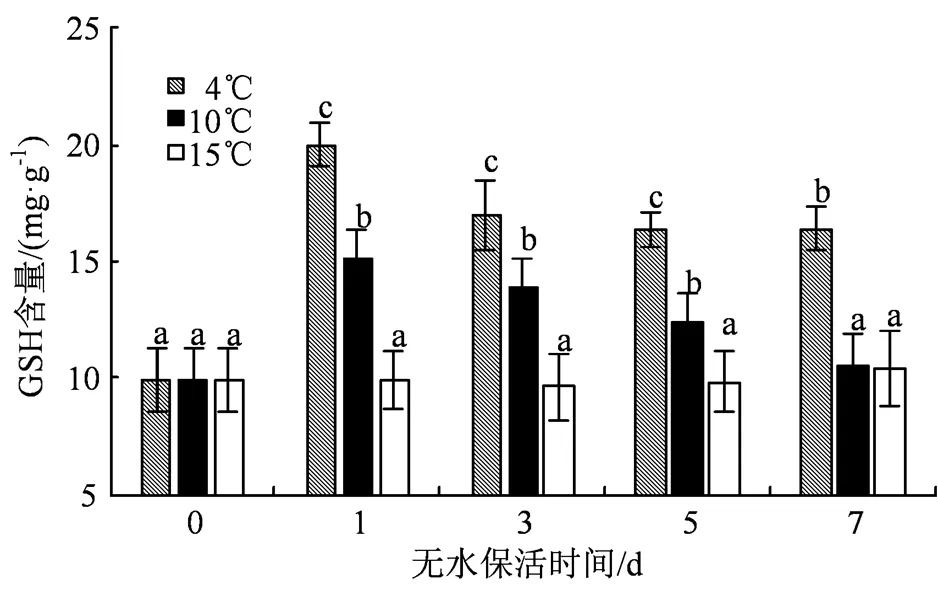
图6 低温无水保活对缢蛏GSH含量的影响
Figure 6 Effects of low-temperature waterless preservation on GSH content of
2.7 低温无水保活对缢蛏糖原含量的影响
糖原是双壳贝类的主要能量来源[16],其含量变化如图7所示。在保活第0天时,3个温度组糖原含量均为峰值,达30.64 mg·g-1。随着保活时间的延长,糖原含量均呈现出持续下降的趋势,其中第5 天时10 ℃组糖原含量从26.32 mg·g-1降至21.08 mg·g-1,降幅高于4 ℃组和15 ℃组;保活第7 天时,15 ℃组糖原含量仅为18.72 mg·g-1,较第0 天下降了38.9%。综合3个温度组来看,4 ℃组糖原含量下降得最慢,且在整个保活过程中,4 ℃组糖原含量始终显著高于其他两组(< 0.05)。

图7 低温无水保活对缢蛏糖原含量的影响
Figure 7 Effects of low-temperature waterless preservation on the glycogen content of

图8 低温无水保活对缢蛏乳酸含量的影响
Figure 8 Effects of low-temperature waterless preservation on the lactic acid content of
2.8 低温无水保活对缢蛏乳酸含量的影响
乳酸是双壳贝类无氧呼吸和糖原代谢的产 物[17],其含量变化如图8所示。对比3个温度组,15 ℃组乳酸含量均显著高于其他两组(< 0.05);除保活第1天外,10 ℃组乳酸含量显著高于4 ℃组(< 0.05)。从整个无水保活过程来看,3个温度组的缢蛏乳酸含量均呈现出持续上升的趋势,并在保活第7 天时达到峰值。其中15 ℃组缢蛏乳酸含量由第0 天的1.10 mmol·g-1上升至第7 天的2.67 mmol·g-1,上升幅度为142.2%,而4 ℃组仅上升了45.6%。在保活后期,15 ℃组乳酸积累速率进一步加快,其含量加速上升,而4 ℃组乳酸含量则一直保持平稳缓慢上升的趋势。
3 讨论与结论
细胞脂质过氧化是反映氧化损伤的标志。逆境条件下,过量的自由基攻击细胞膜上多不饱和脂肪酸(PUFA),改变膜通透性,从而导致细胞结构和功能完整性的巨大损害[18]。MDA作为脂质过氧化反应的主要产物之一,其含量可以间接反映细胞受自由基攻击的严重程度。本研究中,4 ℃和10 ℃组MDA含量在保活过程中均呈现出先升后降再升高的趋势,而15 ℃组则持续升高,在保活1~3 d时4 ℃组MDA含量显著高于10 ℃和15 ℃组(< 0.05),表明在保活前期,由于从暂养温度(20 ℃)降至保活温度(4 ℃)幅度过大,4 ℃组缢蛏还未适应低温环境,细胞损伤比降温幅度较小的10 ℃组更严重;而在保活5~7 d时4 ℃组MDA含量显著低于15 ℃组(< 0.05),表明在保活后期,15 ℃组由于温度较高,机体耗氧量较大,积累了大量活性氧,细胞脂质过氧化严重,表现出MDA含量的快速升高。Machado等[19]在罗氏南极鱼()的氧化应激研究中发现,0 ℃组MDA含量随应激时间延长先升高后降低,而较高温度组MDA含量则不断上升,与本研究结果类似。H2O2是一种氧化性很强的物质,在机体活性氧代谢中对细胞产生毒害作用,因此H2O2含量也代表了机体活性氧水平[20]。本研究中,3个温度组H2O2含量在变化趋势与MDA含量有一致性,表明H2O2在机体活性氧代谢过程中参与破坏细胞膜,从而引起脂质过氧化反应,生成MDA。4 ℃组H2O2含量在保活初期大幅上升,可能的原因是SOD将O2-·催化分解的H2O2还未被CAT及时清除;而随着保活时间的延长H2O2含量又呈现下降趋势,表明在保活中后期,CAT和GSH协同清除H2O2使其含量不再上升,从而维持在细胞毒性较低的水平。
SOD和CAT作为重要的抗氧化酶,其活性高低代表着机体的抗氧化能力和免疫水平[8]。作为GPX催化反应的底物,GSH可协同SOD、CAT清除体内过量活性氧,保护机体生理功能,提高免疫水平。因此,GSH含量也可反映出机体受逆境胁迫影响的程度[21]。本研究中,SOD、CAT活性和GSH含量在整个无水保活期中的变化趋势具有一致性,其中4 ℃和10 ℃组随着保活时间的延长先升高后降低,且4 ℃组在保活第1 天时上升幅度更明显,表明4 ℃组缢蛏在保活初期由于降温幅度更大且还未适应低温环境,机体处于氧化应激状态,并产生大量活性氧,诱导了抗氧化酶活性和GSH含量的升高;而在保活后期,4 ℃组缢蛏SOD、CAT活性和GSH含量逐渐趋于平稳,表明机体内氧自由基与抗氧化酶之间达到了动态平衡,抗氧化系统有效地清除了过量活性氧。此外,15 ℃组缢蛏由于其保活温度与暂养温度较为接近,抗氧化酶活性变化幅度不大,且始终处于较低水平。综上,在无水保活期间,4 ℃组SOD、CAT活性和GSH含量大幅升高,表明其加速催化分解了机体内过量的O2-·和H2O2并转化为无毒害物质,对维持缢蛏体内的活性氧代谢平衡产生积极作用。
在无水保活后期(第7 天),各组缢蛏存活率差异较为明显,4 ℃组存活率高达84%,而15 ℃组仅为52%。4 ℃接近于缢蛏的生态冰温区,在此温度下缢蛏处于休眠状态,自身呼吸作用和新陈代谢处于较低水平[13];当温度升高时,缢蛏的新陈代谢逐渐增强,耗氧量增大,能量消耗加速,存活率也随之下降。在其他贝类无水保活研究中,太平洋牡蛎()4 ℃无水保活前3天存活率为100%,到第7 天时存活率仍高达83.3%[22];虾夷扇贝()在低温(5~10 ℃)条件下无水冰藏保活7 d后存活率达到75%,显著高于高温(25~30) ℃(< 0.05)[23]。存活率试验表明,保活前两天各组缢蛏存活率无明显差异,而在保活后期4 ℃组缢蛏较其他两个温度组能维持更好的存活状态。
缢蛏作为典型的双壳贝类,其主要供能储能物质是糖原,机体在应对外界胁迫或处在逆境条件下时,为了维持其生命活动,糖原被大量消耗,因此糖原的水平可反映贝类在胁迫条件下维持其基本生存和应对持续的胁迫因素的能力[4]。本研究中,各温度组糖原含量在整个无水保活过程中均呈现出持续下降的趋势,且均在保活第7 天时达到最低值,表明缢蛏无水保活过程中由于没有其他能量获取方式,机体内糖原首先被消耗以维持正常生理代谢。对比3个不同温度处理组,从整体来看,4 ℃组糖原含量下降得最慢,10 ℃组次之,而15 ℃组下降得最快,且15 ℃组糖原含量在保活第7 天时显著低于其他两组,一方面是因为15 ℃相较于其他组温度较高,缢蛏机体耗氧量也随之升高,能量消耗得快,导致糖原含量下降得也快;另一方面是因为缢蛏在4 ℃条件下逐渐进入低温休眠状态,呼吸强度也随之减弱,在此温度下,缢蛏仅需维持正常生命活动的基础代谢,无需消耗糖原进行额外供能,糖原消耗速率随之减缓。类似结果在香港牡蛎()[4]和虾夷扇贝()[23]的无水保活研究中均有报道。作为机体无氧代谢的产物,乳酸也是机体通过糖异生途径合成葡萄糖和糖原的底物[24]。本研究中,随着保活时间的延长,3个温度组缢蛏乳酸含量均呈现持续升高的趋势,且15 ℃组上升最快,表明在保活期间缢蛏供氧量不足,无氧呼吸作用增强,乳酸水平迅速升高并到达峰值;当保活温度较高时机体耗能随之增加,导致糖原消耗加快,乳酸从而大量积聚在体内,这与苏艳玲[12]在对菲律宾蛤仔()保活研究中得出的糖原含量与乳酸含量呈负相关关系的结论相一致。此外,当缢蛏处在低温环境中时,机体逐渐适应逆境条件并进入低温休眠状态,新陈代谢减弱,能量消耗减小,无氧呼吸强度降低,乳酸积累速率有所下降。
综合对比各组,4 ℃组缢蛏SOD活性、CAT活性以及GSH含量均显著高于其他两组(< 0.05),10 ℃组缢蛏在保活1~3 d时糖原含量下降幅度为各组最低,15 ℃组同样在保活初期维持着较低的MDA含量和H2O2含量。因此,本研究结果表明,10 ℃组和15 ℃组缢蛏在保活前2 d均能维持95 %以上的存活率,较4 ℃组无显著差异,结合经济效益等因素,在实际无水运输过程中,建议在10 ℃和15 ℃条件下进行缢蛏的短途运输(2 d);而4 ℃无水条件能激活缢蛏体内SOD活性和CAT活性并诱导GSH水平的升高,并在保活后期对MDA含量与H2O2含量有着明显的抑制作用,且能减缓糖原消耗量和乳酸积累速率,保活7 d时的存活率仍能高达84%,远高于其余各组,更利于长途运输(7 d)。
[1] 孟德龙, 申奔龙, 白万强, 等. 缢蛏热休克转录因子1(HSF1)基因克隆、组织表达及功能[J]. 南方水产科学, 2020, 16(5): 115-122.
[2] 张欢, 董迎辉, 姚韩韩, 等. 缢蛏()GST和HSP90基因克隆及其在氨氮胁迫下的表达特征分析[J]. 海洋学报, 2020, 42(4): 66-78.
[3] 曹井志, 徐若, 包建强. 厚壳贻贝低温无水保活技术[J]. 安徽农业科学, 2008, 36(10): 4248-4249, 4274.
[4] 高加龙, 章超桦, 秦小明, 等. 不同温度无水保活对香港牡蛎微生物和基本营养成分的影响[J]. 广东海洋大学学报, 2020, 40(5): 90-96.
[5] 申淑琦, 万玉美, 王小瑞, 等. 海湾扇贝低温无水保活过程中营养成分和生化特性的变化[J]. 大连海洋大学学报, 2014, 29(6): 633-637.
[6] 崔艳, 江莉, 包建强. 波纹巴非蛤无水低温保活过程中的生化变化[J]. 安徽农业科学, 2008, 36(26): 11539- 11541.
[7] 朱光来, 吴杨平. 温度和湿度对四角蛤蜊保活的影响[J]. 安徽农业科学, 2011, 39(1): 295-296, 304.
[8] 亢玉静, 郎明远, 赵文. 水生生物体内抗氧化酶及其影响因素研究进展[J]. 微生物学杂志, 2013, 33(3): 75-80.
[9] LUSHCHAK V I, BAGNYUKOVA T V. Temperature increase results in oxidative stress in goldfish tissues. 1. Indices of oxidative stress[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2006, 143(1): 30-35.
[10] NIE X B, LEI J L, CHEN S X, et al. Physiological, proteomic, and gene expression analysis of turbot () in response to cold acclimation[J]. Aquaculture, 2018, 495: 281-287.
[11] 郑惠娜, 唐小艳, 周春霞, 等. 文蛤无水保活及水溶性蛋白组成变化初步研究[J]. 水产科技情报, 2016, 43(2): 108-112.
[12] 苏艳玲. 菲律宾蛤仔低温保活及营养成分变化的研究[J]. 晋中学院学报, 2019, 36(3): 38-43.
[13] 李含. 缢蛏综合保活技术研究[D]. 福州: 福建农林大学, 2014.
[14] 郝爽, 张敏. 不同冷胁迫方式对缢蛏无水保活期抗氧化酶活性及脂质过氧化的影响[J]. 大连海洋大学学报, 2020, 35(4): 584-590.
[15] 鲁雅琴, 宋焱峰, 侯一平. 还原型谷胱甘肽对大鼠局灶性脑梗死后丙二醛、谷胱甘肽过氧化物酶、超氧化物歧化酶表达的影响[J]. 中国康复理论与实践, 2006, 12(11): 923-925, 1013.
[16] 高捷, 刘红英, 齐凤生, 等. 缢蛏保活过程中糖原变化的研究[J]. 食品工业科技, 2011, 32(5): 361-362, 421.
[17] 高捷, 刘红英, 齐凤生, 等. 缢蛏保活过程中乳酸变化的研究[J]. 江苏农业科学, 2011, 39(2): 406-408.
[18] IGHODARO O M, AKINLOYE O A. First line defence antioxidants-superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX): their fundamental role in the entire antioxidant defence grid[J]. Alex J Med, 2018, 54(4): 287-293.
[19] MACHADO C, ZALESKI T, RODRIGUES E, et al. Effect of temperature acclimation on the liver antioxidant defence system of the Antarctic nototheniids Notothenia coriiceps and Notothenia rossii[J]. Comp Biochem Physiol B Biochem Mol Biol, 2014, 172/173: 21-28.
[20] 郝爽, 张敏, 方佳琪. 缢蛏在急性温度胁迫下的氧化应激响应及生理代谢变化[J]. 上海海洋大学学报, 2021, 30(2): 214-221.
[21] POMPELLA A, VISVIKIS A, PAOLICCHI A, et al. The changing faces of glutathione, a cellular protagonist[J]. Biochem Pharmacol, 2003, 66(8): 1499-1503.
[22] 郭晓伟. 牡蛎冰温气调保鲜技术研究[D]. 青岛: 中国海洋大学, 2010.
[23] 陈文秀. 虾夷扇贝保活品质变化与贮藏条件调控技术研究[D]. 上海: 上海海洋大学, 2020.
[24] 倪锦, 傅润泽, 沈建. 高值贝类保活运输车与鲍鱼应用效果分析[J]. 渔业现代化, 2015, 42(6): 37-42.
Effects of low-temperature waterless preservation on reactive oxygen species metabolism,glycogen and lactic acid of razor clam
FANG Jiaqi1, ZHANG Min1,2,3
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306; 2. National Experimental Teaching Demonstration Center for Food Science and Engineering, Shanghai Ocean University, Shanghai 201306; 3. Shanghai Professional Technology Service Platform on Cold Chain Equipment Performance and Energy, Saving Evaluation, Shanghai 201306)
To investigate the changes of reactive oxygen species metabolism, glycogen and lactic acid in bivalve mollusks during the waterless preservation period,was kept at 4 ℃, 10 ℃ and 15 ℃ without water, to determine the survival rate, SOD activity, CAT activity, GSH content, MDA content, H2O2content, glycogen content and lactic acid content. The results showed that the survival rate ofmaintained above 90 % in each groups in the first 3 days; the survival rate of 4 ℃ group could still reach 84 % after 7 days of waterless preservation, which was higher than 67 % of 10 ℃, and the lowest survival rate was only 52 % at 15 ℃. In the whole waterless preservation period, the SOD activity, CAT activity and GSH content at 4 ℃ were significantly higher than other groups (<0.05); compared with other groups, theat 4 ℃ had the lowest MDA content and H2O2content significantly in the later waterless preservation period (<0.05); in addition, the glycogen content decreased by only 3.7 % at 10 ℃ whenwas kept alive for 1-3 days, which was the lowest in each group; with the prolongation of waterless preservation time, the glycogen content in each group ofcontinued to decrease, while the lactic acid content continued to increase. At the same time, the consumption of glycogen inat 4 ℃ was less than that of other groups and the accumulation rate of lactic acid was also slower. These results indicated that 10 ℃ and 15 ℃ could maintain the high survival rate ofand were suitable for short-distance transportation(2 days); while 4 ℃ could effectively induce the increase of SOD activity, CAT activity and GSH content of, inhibit MDA content and H2O2content, slow down the consumption of glycogen and the accumulation rate of lactic acid, which had the better preservation effect and was more appropriate for long-distance transportation(7 days).
; waterless preservation; temperature; reactive oxygen species metabolism; glycogen; lactic acid
S984.3
A
1672-352X (2022)05-0764-07
10.13610/j.cnki.1672-352x.20221111.017
2022-11-15 8:57:08
[URL] https://kns.cnki.net/kcms/detail/34.1162.s.20221111.1117.034.html
2022-01-19
方佳琪, 硕士研究生。E-mail:18621606073@163.com
张 敏, 博士, 教授。E-mail:zhangm@shou.edu.cn
