干扰lncRNA DANCR的表达增强直肠癌细胞放疗敏感性的作用研究*
2022-11-18刘伟边超周杨东丽
刘伟 边超 周杨 东丽
(内蒙古自治区人民医院 1.放射治疗科;2.肿瘤内科,内蒙古 呼和浩特 010010)
结直肠癌是全球第三大常见恶性肿瘤,2018年诊断出约180万新发病例,每年导致超过约5万人死亡[1]。在这些病例中,近三分之一的肿瘤起源于大肠的远端部分,即齿状线和直肠-乙状结肠交界处之间的直肠癌。目前结直肠癌,尤其是直肠癌的治疗仍然具有挑战性,缺乏分子靶向治疗[2]。最近的研究表明,直肠癌的发病率仍然不断上升,具有年轻化趋势,生存率更差[3]。新辅助放疗是缩小局部/晚期直肠癌体积和分期的首选方法[4]。研究表明肿瘤进展中差异表达的分子影响肿瘤细胞对放射治疗的敏感性[5]。长链非编码RNA 分化拮抗非蛋白质编码RNA(Long noncoding RNA Differentiation antagonizing non-protein coding RNA, lncRNA DANCR)作为致癌基因促进包括增殖、侵袭、转移和化学治疗抗性等恶性生物学行为,正在成为恶性肿瘤治疗的新靶点[6-7]。Lu等[8]报道DANCR 在结直肠癌组织和细胞系中表达升高,并与患者TNM分期增加和淋巴结转移阳性显著相关,DANCR过表达促进结直肠癌细胞增殖、迁移、侵袭和细胞周期进程,抑制细胞凋亡。同时Xiong等[9]发现DANCR的表达可以抑制多柔比星作用的肿瘤细胞凋亡,进而抑制结直肠癌细胞的恶性进展。本研究旨在探讨DANCR是否在直肠癌放疗抵抗中发挥重要作用,现报告如下。
1 材料与方法
1.1 临床样本 选择2012年1月~2015年3月在我院治疗的直肠癌患者,入组要求:患者进行根治术前已进行新辅助放射治疗;患者具有完整的病理分期和生存资料;手术标本包括癌组织和远离癌组织3 cm的癌旁组织;患者及家属均签署知情同意书;具备放疗前后的影像学资料,并根据CT扫描结果进行放疗疗效评定,根据实体瘤评价标准,放疗抵抗为稳定及疾病进展,放疗敏感为完全缓解和部分缓解。所有患者均接受随访。最终收集90例直肠癌组织和配对的癌旁组织。本研究遵从赫尔辛基宣言进行,并获得我院伦理委员会批准。
1.2 主要试剂材料 Trizol试剂购于日本TaKaRa公司;AMV One-step RT-PCR试剂盒,上海生物工程技术有限公司;DANCR和GAPDH引物,上海生工生物工程有限公司;直肠癌细胞系HT29购自美国ATCC细胞库;胎牛血清、培养基和胰蛋白酶购自美国Gibco公司;MTS试剂购自美国Sigma公司;DANCR siRNA购自广州奥博生物技术有限公司;吉姆萨染液和细胞周期检测试剂盒购自上海碧云天生物技术有限公司;Annexin V-FITC/PI凋亡检测试剂盒购自南京凯基生物技术有限公司;RIPA蛋白裂解液和BCA检测蛋白浓度试剂盒购自北京索莱宝试剂有限公司;PVDF膜购自美国millipore公司;ECL化学发光试剂盒购自上海慧颖生物科技有限公司;cyclinD1、CDK4、CDK6和凋亡相关蛋白caspase 3、Bcl-2、Bax抗体购自英国Abcam公司。
1.3 qRT-PCR检测 直肠癌组织和癌旁组织中加入Trizol试剂进行组织裂解,并采用氯仿提取RNA方法获得总RNA。检测RNA浓度及纯度后采用one step RT-PCR 检测试剂盒检测DANCR的相对表达量。反应体系为10X One Step RT-PCR Buffer 5 μL、上游引物2 μL、下游引物2 μL、RNA 1 μg、Taq DNA polymerase 1 μL、AMV RT 0.5 μL、RNase inhibitor 0.5 μL、无RNA酶的双蒸水补足50 μL。设置反应条件为:45℃逆转录30 min、94℃预变性5 min,94℃变性30 s,65℃退火30 s,72℃延伸30 s,其中变性、退火和延伸进行40个循环,于7500PCR仪进行qRT-PCR扩增反应。按照2-ΔΔCt公式以GAPDH为内参计算DANCR的相对表达量。DANCR引物F:5′-GCCACAGGAGCTAGAGCAGT-3′,R:5′-GCAGAGTATTCAGGGTAAGGGT-3′;GAPDH引物F:5′-AACGGATTTGGTCGTATTGGG-3′,R:5′-CGCTCCTGGAAGATGGTGAT-3′。
1.4 细胞培养和HT29-R细胞的构建 于液氮取出直肠癌细胞系HT29后快速放入37℃水浴锅中,细胞冻存液溶解后,于800 rpm离心3 min,弃掉细胞冻存液,采用含有10%胎牛血清的细胞培养基中重悬细胞,放置37℃、5%CO2的全湿度培养箱中培养。显微镜下观察细胞状态,及时更换新鲜培养基,并且采用胰酶消化进行细胞传代。将生长状态良好的HT29细胞进行放射线辐射,并进行分次递增照射,首先1 Gy剂量的放射线辐射细胞,培养48 h后继续辐射1次,然后2 Gy剂量辐射2次,4 Gy剂量辐射2次。将细胞克隆团胰酶消化后培养,最终细胞稳定生长在4 Gy的辐射剂量中。
1.5 细胞转染 取生长状态较好的HT29-R细胞,以2×105个细胞接种至6孔板中,分为si-NC组和si-DANCR组,放置37℃、5%CO2的全湿度培养箱中培养12 h。采用脂质体2000与siRNA混合后进行各组细胞的转染,si-NC组转染对照siRNA,si-DANCR组转染DANCR siRNA,放置37℃、5%CO2的全湿度培养箱中培养12 h后更换新鲜培养基。采用qRT-PCR 检测各组细胞中DANCR的相对表达量。
1.6 MTS实验检测细胞增殖能力 取生长状态较好的HT29细胞和HT29-R细胞,以3000个细胞接种至96孔板中,每组设置6个重复孔,放置37℃、5%CO2的全湿度培养箱中培养12 h。分别采用0、1、2、4、8、16和32 Gy的放射剂量处理HT29细胞和HT29-R细胞。培养48 h后,每孔加入20 μL MTS试剂,继续放置37℃、5%CO2的全湿度培养箱中培养2 h,测得细胞490 nm处的吸光度(OD值)。细胞增殖率=(对应放射剂量组平均OD值/0组平均OD值)×100%。
1.7 平板克隆实验检测细胞克隆形成能力 取生长状态较好的HT29-R细胞,以1000个细胞接种至6孔板中,分为si-NC组和si-DANCR组,每组设置3个重复孔,按上述转染方法转染各组细胞,并采用4 Gy放射剂量照射细胞,放置37℃、5%CO2的全湿度培养箱中培养。显微镜下观察细胞状态,及时更换细胞培养基。待细胞形成肉眼可见的克隆团时,终止细胞培养。PBS洗3次,加入甲醇溶液固定细胞10 min,弃掉甲醇,加入吉姆萨染液染色10 min,PBS洗3次后计数细胞克隆形成数目。
1.8 流式细胞仪检测细胞周期 取生长状态较好的HT29-R细胞,以2×105个细胞接种至6孔板中,分为si-NC组和si-DANCR组,每组设置3个重复孔,按上述转染方法转染各组细胞,并采用4 Gy放射剂量照射细胞,放置37℃、5%CO2的全湿度培养箱中培养48 h。采用胰酶消化收集各组细胞,PBS洗3次后,加入细胞周期检测缓冲液500 μL重悬细胞,同时加入碘化丙啶染色液(PI)25 μL和RNA酶10 μL,混匀后放置37℃中避光孵育30 min,采用流式细胞仪检测各组细胞周期比率。
1.9 流式细胞仪检测细胞凋亡 取生长状态较好的HT29-R细胞,以2×105个细胞接种至6孔板中,分为si-NC组和si-DANCR组,每组设置3个重复孔,按上述转染方法转染各组细胞,并采用4 Gy放射剂量照射细胞,放置37℃、5%CO2的全湿度培养箱中培养48 h。采用无EDTA的胰酶消化收集各组细胞,PBS洗3次后,加入细胞凋亡检测染色缓冲液500 μL重悬细胞,加入Annexin V-FITC试剂5 μL和PI试剂5 μL,混匀后于常温中避光孵育30 min,采用流式细胞仪检测各组细胞凋亡率。
1.10 Western blot检测 胰酶消化收集待检测的细胞,PBS洗3次后,加入RIPA蛋白裂解液,细胞完全裂解后于低温高速离心去除细胞碎片,将蛋白上清液移至新的EP管中,并采用BCA试剂盒检测各样品蛋白浓度。蛋白经煮沸变性后进行凝胶电泳,采用10%的凝胶,蛋白样品加入凝胶中,采用80 V进行样品的蛋白分离。电泳完成后采用100 V湿转进行PVDF膜蛋白转移。蛋白膜经封闭液常温孵育1 h、TBST洗3次后,与目的一抗(cyclinD1、CDK4、CDK6、caspase 3、Bcl-2、Bax)4℃孵育过夜,TBST洗3次后,与兔二抗或鼠二抗室温孵育1 h,采用ECL试剂盒曝光蛋白条带。
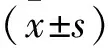
2 结果
2.1 qRT-PCR检测DANCR在直肠癌组织中的表达及临床意义 qRT-PCR检测结果显示,DANCR在直肠癌和癌旁组织中的表达水平分别为1.78±0.75和0.83±0.38;与癌旁组织相比,DANCR在直肠癌组织中的表达显著上调(t=10.80,P<0.001)(图1)。同时DANCR在TNM分期晚期和放疗抵抗直肠癌组织中的表达分别高于其在TNM分期早期和放疗敏感的直肠癌组织中的表达(P<0.05),表明DANCR的表达与直肠癌患者TNM分期和放疗抵抗性相关,见表1。

图1 qRT-PCR检测直肠癌组织中DANCR的表达
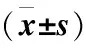
表1 DANCR表达与直肠癌患者临床病理参数之间的关系
2.2 DANCR的表达对直肠癌患者预后影响 依据DANCR在直肠癌组织中的表达水平分为DANCR高表达组(n=52,>1.78)和DANCR低表达组(n=38,≤1.78),采用Kaplan-Meier绘制生存曲线,LogRank分析显示与DANCR低表达的直肠癌患者相比,DANCR高表达的直肠癌患者预后较差(P<0.05),见图2。

图2 LogRank分析DANCR的表达对直肠癌患者预后影响
2.3 HT29-R细胞的构建 分次放射剂量递增建立放射抵抗型细胞株HT29-R,qRT-PCR检测结果显示,DANCR在HT29细胞中的相对表达量为1.35±0.12,在HT29-R细胞中的相对表达量为3.97±0.20,与放射敏感性细胞HT29相比,DANCR在放射抵抗细胞HT29-R中的表达增加(t=19.46,P<0.001)(图3)。采用不同放射剂量照射HT29和HT29-R细胞,MTS结果显示在相同放射剂量照射下,HT29-R细胞的增殖率显著高于HT29细胞的增殖率(P<0.05),HT29-R细胞具有显著放疗抵抗性,见表2。

图3 qRT-PCR检测DANCR在HT29和HT29-R中的表达
2.4 DANCR siRNA的干扰效果 DANCR siRNA转染HT29-R细胞,qRT-PCR检测结果显示,DAN-CR在si-NC组细胞中DANCR的表达量为0.99±0.04,在si-DANCR组细胞中的表达量为0.45±0.08,与si-NC组相比,si-DANCR组细胞中DANCR的表达降低(t=3.982,P=0.011),见图4。
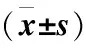
表2 不同放射剂量对HT29和HT29-R细胞增殖率的影响

图4 qRT-PCR检测DANCR siRNA转染HT29-R细胞的干扰效果
2.5 干扰DANCR对HT29-R细胞放疗敏感性的影响 采用不同放射剂量照射si-NC组和si-DANCR组HT29-R细胞,MTS结果显示,在相同放射剂量照射下,si-DANCR细胞的增殖率显著低于si-NC组HT29-R细胞的增殖率(P<0.05),干扰DANCR增强HT29-R细胞的放疗敏感性,见表3。
2.6 干扰DANCR对HT29-R细胞平板克隆能力的影响 4 Gy放射剂量照射si-NC组和si-DANCR组HT29-R细胞,平板克隆实验结果显示,si-NC组细胞克隆形成数目为(68.67±6.33)个,si-DANCR组细胞克隆形成数目为(42.33±5.84)个,与si-NC组相比,si-DANCR组细胞的克隆形成能力显著降低(t=5.297,P=0.003),见图5。
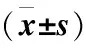
表3 干扰DANCR对HT29-R细胞放疗敏感性的影响

图5 平板克隆实验检测各组细胞克隆形成能力
2.7 干扰DANCR对HT29-R细胞周期的影响 4 Gy放射剂量照射si-NC组和si-DANCR组HT29-R细胞,流式细胞实验结果显示,与si-NC组相比,si-DANCR组细胞周期阻滞在G0/G1期(t=4.312,P=0.008),见图6。

图6 流式细胞实验检测各组细胞周期
2.8 干扰DANCR对HT29-R细胞凋亡的影响 4 Gy放射剂量照射si-NC组和si-DANCR组HT29-R细胞,流式细胞实验结果显示,si-NC组细胞凋亡率为(6.12±2.53)%,si-DANCR组细胞凋亡率为(33.85±6.07)%,与si-NC组相比,si-DANCR组细胞的凋亡显著增加(t=7.304,P=0.001),见图7。

图7 流式细胞实验检测各组细胞凋亡
2.9 干扰DANCR对HT29-R细胞中周期和凋亡相关蛋白的影响 4 Gy放射剂量照射si-NC组和si-DANCR组HT29-R细胞,western blot结果显示,与si-NC组相比,si-DANCR组细胞中周期相关蛋白cyclinD1、CDK4、CDK6表达降低和凋亡相关蛋白caspase 3、Bax表达增加,Bcl-2蛋白表达降低活化(P<0.05)。见图8、表4。

图8 western blot检测各组细胞周期和凋亡相关蛋白的表达
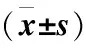
表4 各组细胞中凋亡相关蛋白的相对表达量
3 讨论
直肠癌是一种常见的致命疾病,治疗的首选方法是手术切除,研究显示直肠癌患者治愈率与肿瘤整体切除率密切相关。而大多数直肠癌患者是在晚期被诊断出来,失去手术机会,放疗作为晚期患者的重要治疗策略,但晚期患者的生存率仍较低[2]。直肠癌是一项复杂的临床挑战,需要多模式治疗和手术才能提供最佳治愈机会。研究显示在许多患者中,新辅助放化疗是降低肿瘤分期、减少结肠造口术和减少局部复发的主要治疗方法,新辅助放化疗后进行手术可减少局部复发,被认为是局部晚期直肠癌的标准治疗[4]。然而放射治疗的抵抗是患者预后较差的主要障碍[10]。因此研究直肠癌放疗抵抗的分子机制具有重要意义。
lncRNA是一类长度从200 nt到100 kb的非编码RNA,由于其广泛的作用而受到越来越多的关注。lncRNA的表达失调通过影响表观遗传学参与肿瘤的发生发展,lncRNA 的调控是抑制肿瘤进展和克服肿瘤耐药性的重要策略,正在成为肿瘤诊断的新型生物标志物和肿瘤治疗的靶点[11]。DANCR位于4号染色体上,长度为855个碱基对,具有抑制表皮祖细胞分化的功能。研究显示DANCR表达异常导致包括人类肿瘤在内的疾病发生,在肺癌和卵巢癌等常见肿瘤中DANCR表达上调,促进肿瘤细胞增殖、侵袭和转移[6-7]。同时DANCR密切参与胃癌和肝细胞肝癌等消化系统的化疗耐药[12-13],提示DANCR可能与肿瘤放疗抵抗相关。Shen等[14]报道结直肠癌组织和血清中DANCR水平显著上调,术后患者血清DANCR表达较治疗前和复发患者降低,DANCR的高表达是结直肠癌诊断的潜在生物标志物。本研究采用qRT-PCR检测发现DANCR在直肠癌组织中表达升高,高表达DANCR与患者TNM分期显著相关,与Lu等[8]报道一致。Assani等[15]报道DANCR在结肠癌组织和细胞中表达较高,较高水平的DANCR与患者较差的预后和较短的生存时间相关,而本研究生存分析显示DANCR高表达预示结直肠癌患者预后较差。同时本研究发现与直肠癌放疗敏感性患者相比,直肠癌放疗抵抗患者组织中DANCR的表达增加,表明DANCR可能促进直肠癌的放疗抵抗。
既往研究表明DANCR促进结直肠癌细胞增殖、细胞周期、侵袭、转移和耐药,并抑制细胞凋亡[8],本研究注重DANCR在直肠癌放疗抵抗中发挥的作用,首先成功诱导直肠放疗抵抗耐药细胞株HT29-R,qRT-PCR检测显示与放疗敏感性的细胞相比,DANCR在直肠放疗抵抗耐药细胞株HT29-R中的表达升高,干扰DANCR的表达后,MTS结果显示HT29-R细胞的放射敏感性增加。同时在放射线辐射作用下干扰DANCR的表达后,HT29-R细胞的平板克隆形成能力降低,表明降低DANCR的表达增强直肠癌细胞放疗敏感性。细胞周期调控失控及细胞凋亡是肿瘤细胞放疗抵抗的重要机制[16],本研究显示干扰DANCR的表达后,HT29-R细胞周期阻滞在G0/G1期,细胞凋亡率增加。在胃癌细胞中干扰DANCR的表达诱导细胞阻滞在G0/G1期,促进细胞的凋亡,敲减DANCR的表达抑制细胞周期蛋白cyclinD1表达,及抗凋亡蛋白Bcl-2表达下调,促凋亡蛋白Bax表达上调[12]。cyclinD1蛋白和周期蛋白依赖性激酶CDK4、CDK6结合形成复合物促进细胞周期由G0/G1期至S期的转变,以促进细胞周期进展[17-18],本研究采用western blot检测显示敲减DANCR的表达,HT29-R细胞中cyclinD1、CDK4和CDK6蛋白表达降低。Caspase蛋白激活后促使细胞发生凋亡,caspase、Bcl-2和Bax蛋白是调控细胞线粒体凋亡途径重要机制[19-20]。本研究结果显示敲减DANCR的表达,HT29-R细胞中caspase 3、Bax表达增加,Bcl-2蛋白表达降低。表明DANCR通过调控细胞周期相关蛋白和凋亡相关蛋白促进直肠癌细胞放疗抵抗。
4 结论
DANCR在直肠癌组织中表达上调,与患者TNM分期、放疗抵抗和生存预后相关。干扰DANCR的表达显著增强直肠癌细胞放疗敏感性,其作用机制可能是通过调控细胞周期和凋亡相关蛋白。DANCR是直肠癌患者预后和治疗潜在分子靶点。本研究的不足之处在于未能深入的研究DANCR具体的作用靶点及调控机制,仍需在后续研究中进一步探讨。
