基于形态和Cytb序列的短颌鲚种群遗传分化研究
2022-11-18王玮欣朱洪赓张婉茹冯广朋陈建华
王玮欣,李 宇,朱洪赓,张婉茹,冯广朋,陈建华
( 1.江苏海洋大学 海洋科学与水产学院,江苏省海洋生物技术重点实验室,江苏 连云港 222005; 2.中国水产科学研究院 东海水产研究所,上海 200090 )
鄱阳湖和洪泽湖分别为我国第一、第四大淡水湖,分别为长江中下游地区和淮河下游地区江湖复合生态系统的重要组成部分,不仅具有重要的生态功能,还拥有复杂的淡水生物群落,鱼类资源非常丰富[1]。但近年来,过度捕捞、围网养殖和污水排放等人类活动导致湖泊水质污染加剧,生态平衡遭到破坏,水产资源损失较为严重。
形态特征的差异是生物多样性最直观的表现,而从形态上分析鱼类的外部特征是研究其种质差异的重要方法之一[2],该方法不仅直观,而且操作简单。传统的鱼类形态鉴别采用单一可量、可数性状的比较,但该方法在鉴定形态相似程度高的种内不同地理群体方面存在较大的缺陷[3]。为弥补可量性状或可数性状测量法的不足,有学者将可量性状特征与框架结构特征结合起来应用于鉴定不同地理群体[4-5]。框架分析法从多角度测量鱼体的形态参数,借助判别分析、主成分分析和聚类分析等多种统计方法进行多变量分析[4,6],筛选出具有显著差异的变量用于鉴别不同种群间的差异。
遗传多样性即基因多样性,是指一个群体内不同个体或种内不同群体之间的遗传变异的总和[7]。物种的遗传变异越丰富,对环境变化的适应能力就越强[8]。不同区域的种群具有不同的遗传多样性,因此不同区域种群间会出现一定的遗传距离[9]。线粒体DNA因其结构相对简单、演化速度较快、检测方便等特点已被作为常用的分子标记,其中线粒体细胞色素b(Cytb)基因序列近年来广泛应用于研究爬行类和鱼类等的系统发育、分类鉴定和群体遗传多样性[10-11]。如赵丽丽等[10]通过分析秋刀鱼(Cololabissaira)Cytb序列发现,秋刀鱼的遗传多样性比较低,群体经历了种群扩张,其遗传变异来自群体内,地理分化不显著,遗传分化水平相对较低。
短颌鲚(Coiliabrachygnathus)属鲱形目鳀科鲚属。其与刀鲚(C.nasus)的主要区别在于上颌骨较短,向后延长不超过鳃盖的后缘,体侧纵列鳞数目较少[12]。短颌鲚主要分布于长江及淮河流域中、下游,偶见于长江口咸淡水区[13]。其肉质细嫩鲜美,深受广大消费者的喜爱,具有重要的经济价值,也是主要的捕捞对象之一[14]。自20世纪90年代起,因过度捕捞、水体污染及生态环境恶化等因素导致鲚属鱼类资源衰退[15]。目前,有关短颌鲚的生物学特性、资源分布、遗传多样性等方面的研究已有报道[12-13,16],但关于不同湖泊之间短颌鲚种群分化的研究报道较少。
笔者以洪泽湖和鄱阳湖4个不同水域中的短颌鲚为研究对象,结合形态学和线粒体Cytb序列,分析2个湖泊的短颌鲚种群之间的差异,探讨不同地理种群的遗传多样性,旨在为我国长江中下游湖泊短颌鲚的资源保护和合理开发利用、良种选育等提供基础资料和科学指导。
1 材料与方法
1.1 样本收集和处理
短颌鲚样本2019年7—11月采集于都昌县、余干县瑞洪镇、泗洪县临淮镇和洪泽区高良涧,共154尾。取少量肌肉组织浸泡于95%乙醇,储存于-80 ℃冰箱备用。
1.2 形态分析
结合传统形态度量学和框架结构度量学方法,使用数显游标卡尺测量短颌鲚样品[17]。测量数据包括传统可量性状参数和框架性状参数,共27项。其中传统形态参数包括全长、体长、体高、头长、吻长、眼径、眼间距、尾柄高、臀鳍基长、胸鳍长、上颌骨长、眼后头长共13个。框架性状测量参数参照文献[17]选取9个解剖学同源坐标点(图1),框架坐标点之间直线距离形成的14个框架参数:吻端至额部有鳞部最前缘(2—4)、吻端至胸鳍起点距离(2—1)、额部有鳞部最前缘至胸鳍起点距离(4—1)、额部有鳞部最前缘至腹鳍起点距离(4—3)、额部有鳞部最前缘至臀鳍起点距离(4—5)、胸鳍起点至腹鳍起点距离(1—3)、背鳍起点至胸鳍起点距离(6—1)、背鳍起点至腹鳍起点距离(6—3)、背鳍起点至臀鳍起点距离(6—5)、腹鳍起点至臀鳍起点距离(3—5)、腹鳍起点至背鳍末端距离(3—8)、背鳍末端至臀鳍起点距离(8—5)、臀鳍起点至尾鳍背部起点距离(5—9)、背鳍末端至臀鳍末端距离(8—7)。
为消除样本体型大小对量度特征变量的影响,将可量性状数据和框架数据进行比值校正(表1),共得到26项形态数值。采用SPSS 26.0软件进行聚类分析、主成分分析和判别分析。其中判别分析采用逐步判别法,选择Wilks的λ统计量值最小的变量进行判别分析[18];聚类分析以欧氏最短距离系统聚类法[5]作为聚类方法。
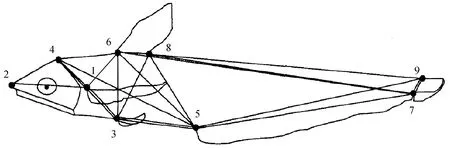
图1 短颌鲚的框架特征[17]Fig.1 Frame characteristic diagram of shortjaw tapertail anchovy C. brachygnathus[17]1.胸鳍起点; 2.吻端; 3.腹鳍起点; 4.额部有鳞部最前缘; 5.臀鳍起点; 6.背鳍起点; 7.臀鳍末端; 8.背鳍末端; 9.尾鳍背部起点.1.starting point of pectoral fin; 2.tip of snout; 3.starting point of pelvic fin; 4.most anterior of scales on skull; 5.starting point of anal fin; 6.starting point of dorsal fin; 7.end of anal fin; 8.end of dorsal fin; 9.dorsal starting point of caudal fin.
1.3 线粒体Cytb分析
1.3.1 DNA抽提、PCR扩增及测序
肌肉组织基因组DNA的提取采用DNA提取试剂盒(南京诺唯赞生物科技有限公司),按照说明书进行操作。线粒体Cytb序列PCR扩增所用引物[7]为CF(5′-GAC TTG AAA AAC CAC CGT TG-3′)和CR(5′-CTC CGA TCT CCG GAT TAC AAG AC-3′)。PCR反应体系为50 μL:10×LA Taq BufferⅡ(Mg2+Plus)5 μL,dNTP Mixture(2.5 mmol/L each)8 μL,上、下游引物各1 μL,TaKaRa LA Taq(5 U/μL)1 μL,DNA模板1 μL,ddH2O 33 μL。反应程序:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃延伸10 min,4 ℃保存。PCR产物用琼脂糖凝胶电泳检测,选择目标条带明亮、单一的PCR产物送通用生物股份有限公司进行双向测序。

表1 形态分析变量及校正参数
1.3.2 数据处理
测得序列用Clustal X[19]软件比对,并进行人工校对。通过DNASP 5.0[20]软件计算单倍型数、单倍型多样性(Hd)、核苷酸多样性(Pi)。采用MEGA 7.0软件分析序列的碱基组成、多态位点和简约信息位点;计算单倍型Kimara双参数模型的遗传距离,采用邻接法以凤鲚(Mystuscastaneous) (GenBank登录号KF809936.1)构建单倍型系统进化树;计算群体内和群体间Tajima-Nei模型遗传距离,并以种群间矩阵构建的群体间邻接树。由Arlequin 3.5软件[21]进行Tajima′sD、Fu′sFs中性检验,计算遗传分化指数(Fst)并进行分子变异分析,根据公式Nm=1/(4Fst)-1/4计算群体间基因流(Nm)[22]。
2 结 果
2.1 形态分析
2.1.1 判别分析
对4个短颌鲚种群的框架数据的校正值和可量性状数据逐步进行判别分析,共选出10个性状:吻长/体长(x3)、吻长/头长(x5)、头长/体长(x6)、眼径/眼间距(x11)、胸鳍长/体长(x12)、2—4/体长(x13)、4—3/体长(x16)、1—3/体长(x18)、6—3/体长(x20)、8—5/体长(x24)。构建4个种群的费希尔判别函数(都昌种群y1、瑞洪种群y2、高良涧种群y3、临淮种群y4),检验显示,4个短颌鲚群体间形态判别差异显著(P<0.01)。将短颌鲚种群形态参数的校正值分别代入对应判别函数进行预测分类。结果显示,种群的综合判别准确率为87.00%,其中都昌种群、瑞洪种群、高良涧种群和临淮种群的判别准确率分别为91.40%、80.00%、84.60%和82.50%。
都昌种群:
y1=-11 562.492-768 611.074x3+122 429.953x5+146 182.791x6+207.477x11-135.188x12-1966.207x13-312.009x16-1204.588x18+554.656x20-326.263x24
瑞洪种群:
y2=-11 382.763-761 116.427x3+121 315.304x5+144 941.037x6+219.90x11-146.133x12-1912.060x13-462.876x16-1048.538x18+716.114x20-421.765x24
高良涧种群:
y3=-11 502.947-768 188.900x3+122 397.561x5+145 870.367x6+161.466x11-109.948x12-1887.908x13-254.092x16-1115.892x18+491.011x20-415.235x24
临淮种群:
y4=-11 417.997-765 442.199x3+121 932.980x5+145 265.505x6+171.405x11-158.925x12-1683.051x13-159.440x16-1125.828x18+411.587x20-393.568x24
2.1.2 聚类分析
对不同种群的14个框架参数的校正值和12个可量性状参数(除全长外)进行聚类分析(图2)。结果表明,鄱阳湖湖区内短颌鲚种群(都昌种群和瑞洪种群)聚成一支,洪泽湖湖区内短颌鲚种群(高良涧种群和临淮种群)聚成一支。
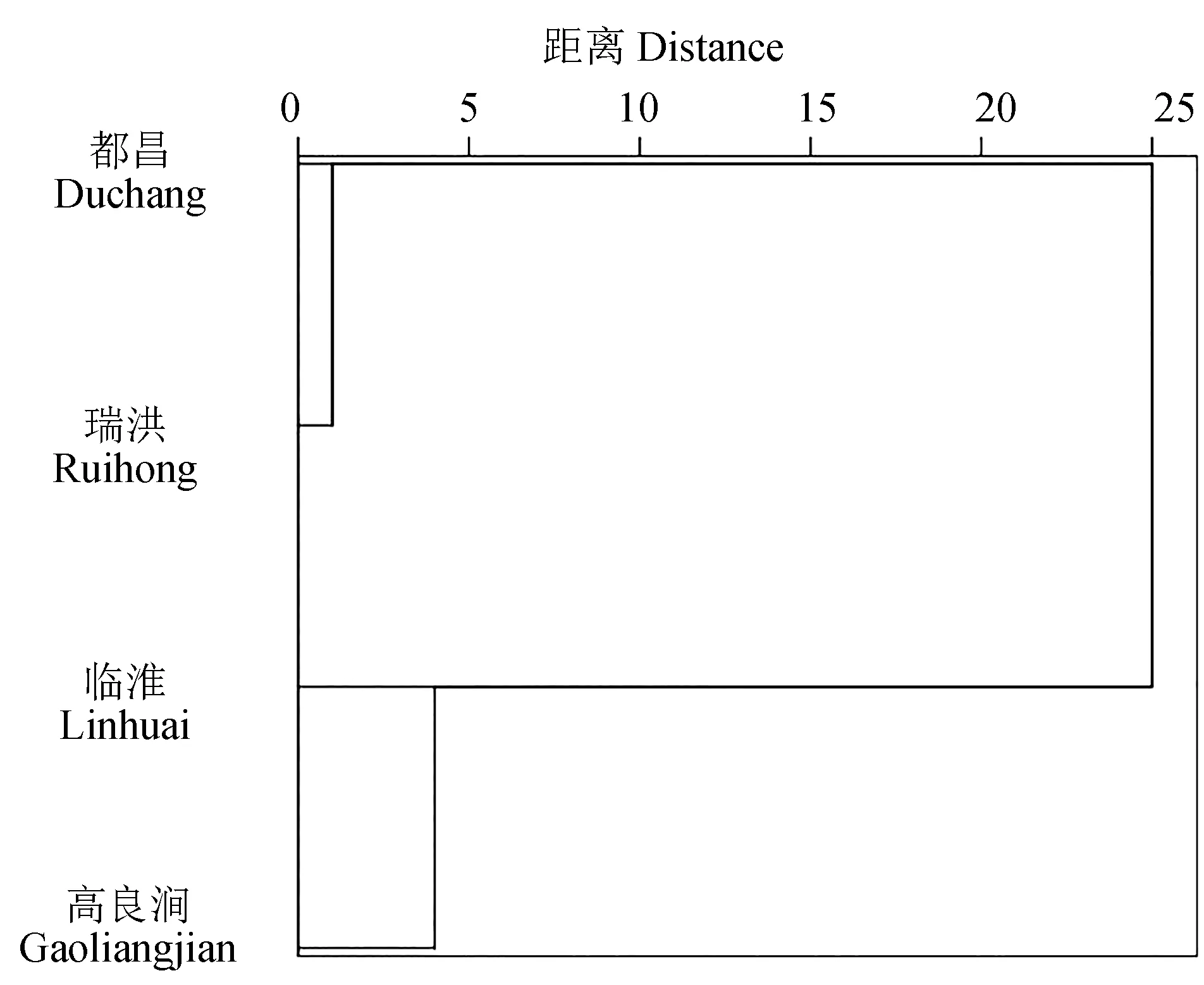
图2 不同短颌鲚种群的形态聚类分析Fig.2 Morphological cluster diagrams of different populations of shortjaw tapertail anchovy C. brachygnathus
2.1.3 主成分分析
对4个短颌鲚种群的形态数据校正值进行主成分分析,得到协方差矩阵的累积贡献率、贡献率及特征根(表2)。分析结果共提取了6个主成分,其中前3个主成分(1、2、3)的总贡献率为65.12%。在主成分1中,影响较大的变量为头长/体长、眼径/头长、眼径/眼间距;对主成分2影响较大的变量为眼后头长/体长、眼后头长/头长;对主成分3影响较大的为4—5/体长。
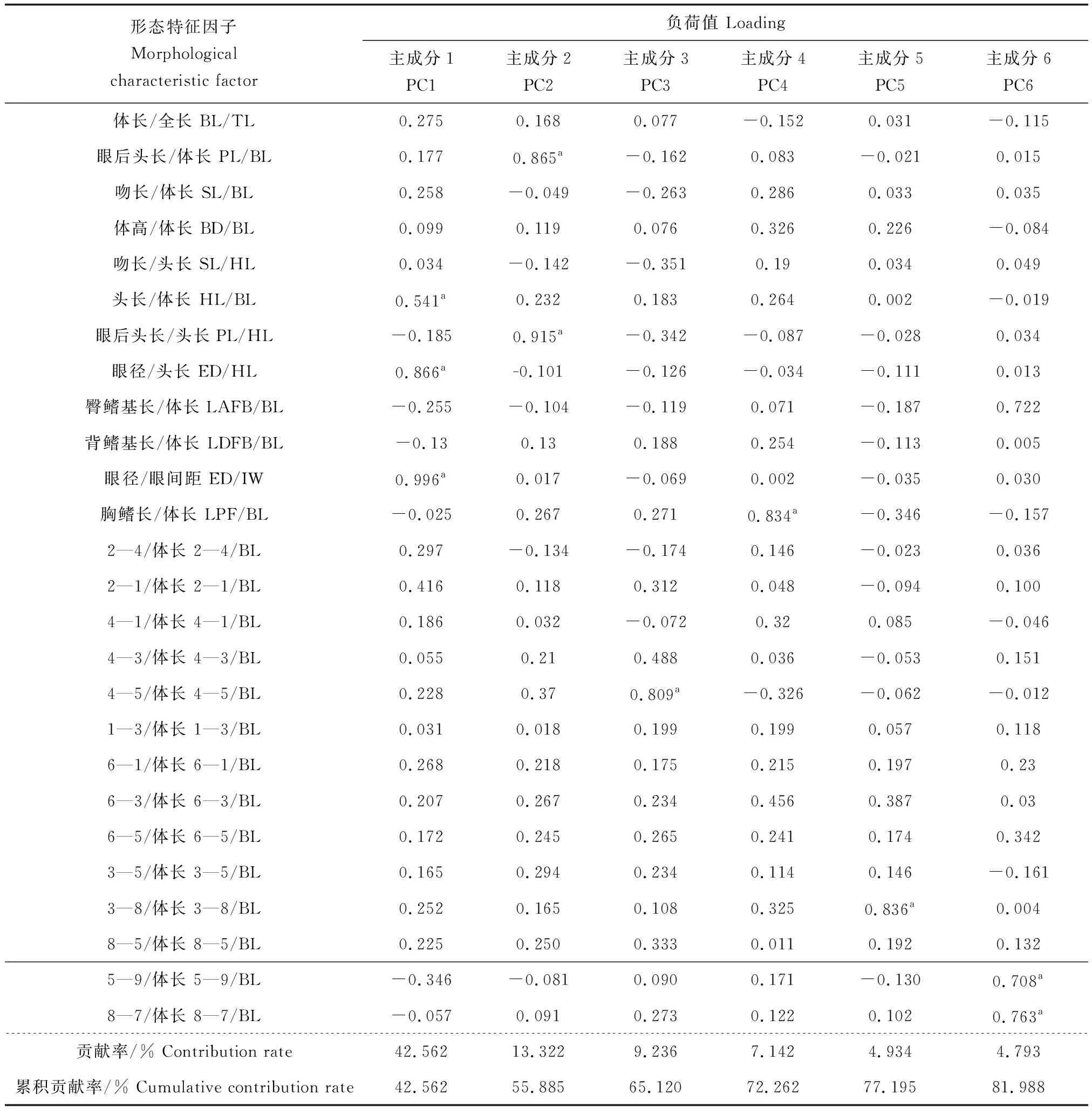
表2 4个短颌鲚种群的形态特征因子负荷矩阵及主成分贡献率
2.2 线粒体Cytb分析
2.2.1 序列碱基组成及种群遗传多样性
共得到60条长度为1148 bp的Cytb序列,其中突变位点49个(4.27%),简约信息位点13个。Cytb基因片段碱基含量的平均含量分别为:A=28.4%、T=27.8%、C=28.6%、G=15.2%,A+T(56.2%)含量显著高于G+C(43.8%)含量。
通过统计60条Cytb基因共定义33种单倍型(表3)。Hap-1、Hap-2、Hap-3、Hap-4为都昌种群和瑞洪种群共有,数量分别为9、3、4、3,占所有单倍型数量的31.67%;Hap-6、Hap-12为都昌种群、高良涧种群和临淮种群共有,数量分别为6、5,占所有单倍型数量的18.33%;都昌种群和临淮种群共有单倍型为Hap-13,数量为2;Hap-25为高良涧种群和临淮种群的共有单倍型,数量为2;其余单倍型均为特有单倍型,共有28个,占单倍型总数的百分比为75.75%。

表3 短颌鲚Cytb序列33种单倍型在4个群体中的分布
从遗传多样性指数看(表4),4种群的基因多态性较高,核苷酸多态性较低。不同种群间比较可以发现,无论是基因多态性还是核苷酸多态性,瑞洪种群均最低(0.778、0.00166),而都昌种群的基因多态性和核苷酸多态性均最高(0.963、0.00486)。
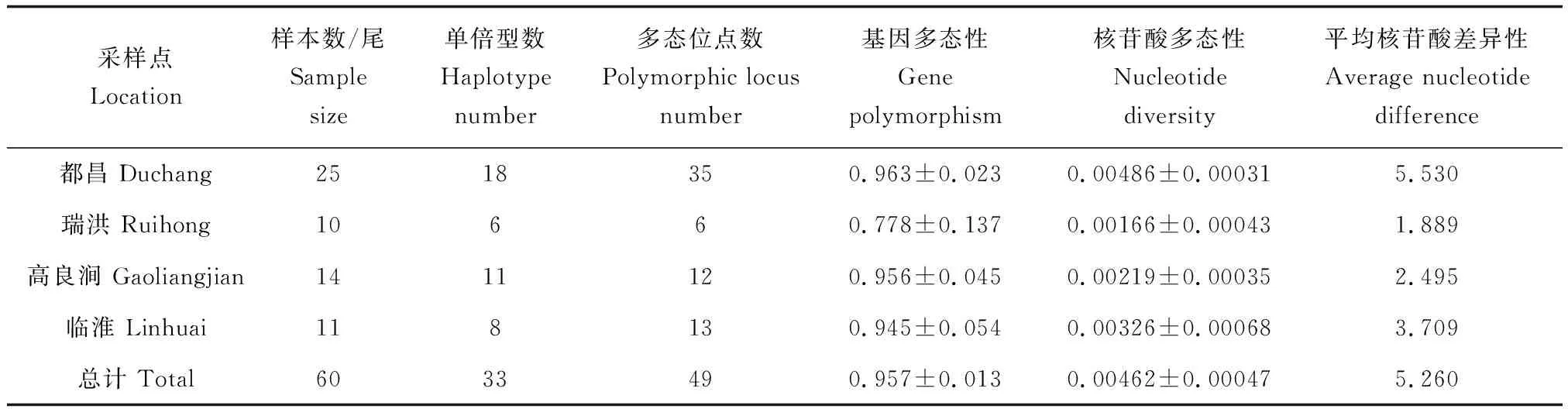
表4 短颌鲚种群Cytb序列的遗传多样性参数
2.2.2 种群间遗传分化与分子进化树
系统进化树显示,除单倍型Hap-16、共有单倍型(8个)、个别单倍型(3个)之外,其他单倍型主要分为两系(图3)。来源于洪泽湖湖区短颌鲚样本的11种单倍型Hap-27、Hap-26、Hap-32、Hap-28、Hap-22、Hap-31、Hap-23、Hap-29、Hap-24、Hap-30、Hap-33单独成为一系,来源于鄱阳湖湖区短颌鲚样本的10种单倍型Hap-8、Hap-14、Hap-18、Hap-20、Hap-11、Hap-7、Hap-17、Hap-5、Hap-15、Hap-19成为另外一系。

图3 基于短颌鲚Cytb基因序列构建的邻接法系统进化树Fig.3 Construction of adjacency (neighbor-joining) phylogenetic tree based on Cytb gene sequence of shortjaw tapertail anchovy C. brachygnathus“○”表示都昌;“□” 表示瑞洪;“△” 表示高良涧;“▽” 表示临淮;“◆” 表示共有单倍型.“○” shows Duchang;“□” shows Ruihong;“△” shows Gaoliangjian;“▽” shows Linhuai;“◆” shows common haplotype.
2.2.3 种群的历史动态
中性检验结果显示,4个种群的Tajima′sD值与Fu′sFs值均为负值(表5)。其中都昌种群的Tajima′sD值统计有显著差异(P<0.05),高良涧和都昌种群的Fu′sFs值统计有极显著差异(P<0.01),表明都昌和高良涧种群的Cytb序列进化显著偏离中性化。由此判断,洪泽湖和鄱阳湖短颌鲚近期经历了群体扩张模式[23]。
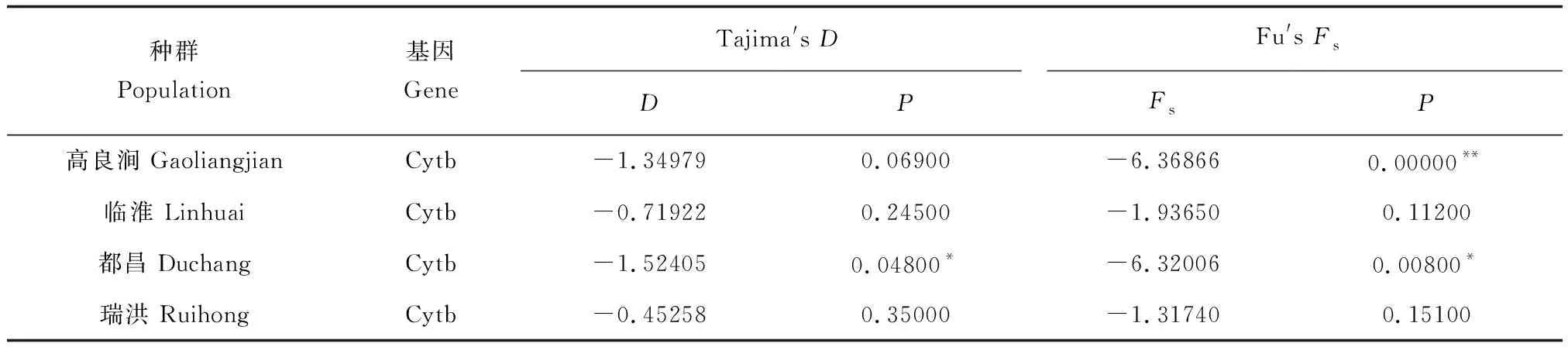
表5 短颌鲚种群内的中性检测结果
2.2.4 种群间遗传距离和分化
以Tajima-Nei遗传距离模型计算4个种群内和种群间的遗传距离,结果显示,Cytb序列在种群内的遗传距离为0.002~0.006,种群间的遗传距离为0.003~0.006(表6)。总体上遗传距离差距较小,无论种群内还是种群间均小于0.05。

表6 短颌鲚Cytb序列单倍型间遗传距离
由种群间系统发育树(图4)可见,短颌鲚4个地理种群可分为两大支:同属鄱阳湖的都昌种群与瑞洪种群聚为一支,同属洪泽湖的临淮种群与高良涧种群聚为一支。

图4 基于Tajima-Nei遗传距离模型的种群间邻接树Fig.4 Neighbor joining tree among populations based on Tajima-Nei genetic distance model
遗传分化指数大小可以判断4个种群之间的遗传分化程度。都昌种群与临淮种群、高良涧种群之间的遗传分化指数分别为0.22972和0.34085(P<0.05),瑞洪种群与临淮种群、高良涧种群之间的遗传分化指数分别为0.48406和0.60873(P<0.05);而都昌种群与瑞洪种群间、高良涧与临淮种群间的遗传分化指数均小于0.05,且统计检验均不显著(P>0.05)(表7)。都昌种群与瑞洪种群间的基因流、高良涧种群与临淮种群间的基因流均大于1,其余种群之间的基因流均小于1。

表7 基于Cytb序列的短颌鲚两两种群间遗传分化指数(对角线下)和基因流(对角线上)
分子变异分析结果显示,种群内的遗传变异为71.22%,种群间变异为28.78% (P<0.05)(表8)。

表8 短颌鲚种群分子变异分析结果
3 讨 论
3.1 种群形态差异分析
形态分析结果显示,在主成分分析上,这些性状主要反映了鱼体的头部特征、鳍位置等与游泳有关的特征,由此认为,环境的不同导致短颌鲚头部和游泳特征的差异[24],久而久之,4个种群产生形态上的差异。聚类分析结果显示,存在明显的地理相关性;判别分析中F检验显示,4个短颌鲚种群间形态判别差异显著(P<0.01),种群的综合判别准确率为87.00%。综合形态分析结果,短颌鲚各地理种群间存在明显形态差异,说明已经产生了明显的种群分化。
3.2 种群遗传多样性与历史动态
本研究中,不同短颌鲚种群的Cytb序列A+T含量(56.2%)显著高于G+C含量(43.8%),存在显著的碱基偏倚性,这与鲑亚科[25]、秋刀鱼(C.saira)[10]和刀鲚[26]等类似。中性检验结果显示,都昌种群、瑞洪种群、高良涧种群和临淮种群Tajima′sD值和Fu′sFs值均为负数,表明4个短颌鲚种群的Cytb序列进化均显著偏离中性进化,推测洪泽湖和鄱阳湖短颌鲚近期经历了群体扩张模式。这可能是因为短颌鲚喜欢集群,较易拓展新的栖息地并能快速扩张种群[27]。
3.3 种群遗传分化
在种群遗传分化上,Freeland[28]认为,遗传分化指数0~0.05为低度分化,遗传分化指数>0.05~0.25为中度分化,遗传分化指数>0.25为高度分化。本研究中,基于短颌鲚两两种群间遗传差异的分析显示,都昌种群和瑞洪种群间基因交流频繁,遗传分化程度较小,为低度分化(遗传分化指数<0.05),高良涧种群和临淮种群间同上(遗传分化指数<0.05);而都昌种群分别与高良涧种群、临淮种群之间的遗传分化程度显著,属于高度分化(遗传分化指数>0.25,P<0.05),瑞洪种群分别与高良涧种群、临淮种群之间同上(遗传分化指数>0.25,P<0.05)。通过短颌鲚种群地理位置分布,都昌种群和瑞洪种群属于鄱阳湖,高良涧种群和临淮种群属于洪泽湖,与两两种群间遗传差异分析结果相符合;基于Tajima-Nei遗传距离模型的种群间邻接树也显示了相同的结果。不同种群间的基因交流越充分,其遗传分化就越小,当基因流<1时,基因流不足以维持遗传匀质化,遗传漂变会导致遗传分化[29]。由本研究的基因流结果可见,都昌种群和瑞洪种群分别与高良涧种群和临淮种群间之间线粒体基因流均小于1,显示其基因流已不足以维持遗传匀质化,遗传漂变等因素会导致鄱阳湖湖区和洪泽湖湖区短颌鲚进一步分化[30],表明鄱阳湖与洪泽湖短颌鲚种群间产生了较大的遗传分化,而鄱阳湖和洪泽湖内部短颌鲚种群间遗传分化程度较小[31]。
由短颌鲚Cytb序列的33种单倍型在各种群中的分布以及系统进化树结果可见:Hap-1、Hap-2、Hap-3和Hap-4为都昌种群和瑞洪种群的共有单倍型,Hap-5、Hap-7~Hap-11、Hap-14~Hap-18为都昌种群的特有单倍型,Hap-19~Hap-20为瑞洪种群的特有单倍型;高良涧种群的特有单倍型为Hap-26~Hap-33,临淮种群的特有单倍型为Hap-21~Hap-24,Hap-25为瑞洪种群和高良涧种群的共有单倍型;而鄱阳湖种群与洪泽湖种群存在的共有单倍型仅为3种:Hap-6、Hap-12、Hap-13,由此可见,鄱阳湖湖区种群与洪泽湖湖区种群之间,在单倍型分布上也存在较大差异。结合分子变异分析结果,进一步表明各地理群体间已产生显著的遗传分化。
根据形态和分子分析结果可知,鄱阳湖湖区与洪泽湖湖区的短颌鲚种群间已经产生了种群分化,这可能是因为鄱阳湖距洪泽湖较远,且没有明显河流连通两大湖泊,另外栖息的自然环境不同以及地理隔离等,可能导致两大湖区的短颌鲚长时间缺少基因交流,逐渐产生遗传分化。
4 结 论
本研究结果显示:洪泽湖和鄱阳湖的短颌鲚种群之间存在由头部和游泳特征所引起的形态差异;鄱阳湖湖区与与洪泽湖湖区的短颌鲚种群间遗传分化程度显著。为更准确客观地了解不同湖泊短颌鲚种群之间的遗传变异程度,仍需要增加采样点,并应用微卫星或单核苷酸多态性等分子标记开展更深入的研究分析。
