大黄鱼陆基低盐节水模式下水体生物结构的变化及其影响
2022-11-18陈佳
陈 佳
(1.大黄鱼育种国家重点实验室,福建 宁德 352103;2.宁德市富发水产有限公司,福建 宁德 352103)
在养殖中,残饵和鱼体代谢产物等分解使水体中的营养盐浓度升高,导致水质恶化。微藻等浮游藻类是光能自养型单细胞植物,具有分布广泛、光合效率高、生长速度快、负荷能力强、适应性强的特点[1]。藻类种类众多,大小相差悬殊。在分类学中主要依据它们所含的色素及形态结构进行分类,主要有蓝藻门(cyanophyta)、红藻门(rhodophyta)、隐藻门(cryptophyta)、甲藻门(pyrrophyta)、褐藻门(phaeophyta)、黄藻门(xanthophyta)、金藻门(chrysophyta)硅藻门(bacillariophyta)、裸藻门(englenophyta)、绿藻门(chlorophyta)、轮藻门(charophyta)。
浮游藻类是池塘水环境主要的初级生产者[2],细菌将水体中含氮、磷的有机物转化为硝酸盐和正磷酸盐等无机盐。藻类以无机盐为原料,通过光合作用合成有机物供给浮游动物,调节pH 值,并释放氧气,增加水体溶氧[3]。同时,浮游动物可作为活饵料被营养级和生态位不同的各种养殖生物利用,形成多级食物链,提高物质利用率,减少水体营养盐,从而控制养殖水水质,形成水体稳态[4]。
水体藻类中数量和生物量占优的为优势种,对养殖水体发挥主要功能,决定了水体的稳定性。由于营养等条件不同,浮游微藻的优势种类分布、种群多样性等群落特征有一定差异。一般认为,养殖池中绿藻类和硅藻类为优势种时,水质稳定,水色优良;当甲藻和蓝藻大量繁殖时,水质恶劣[5]。但水体中藻类种群单一、优势度过高、物种多样性低时,生态系统稳定性差,因此藻类的多样性指数也是判断水质好坏的重要标准之一[6]。
李雪松等[7]对泉州湾对虾多样性研究中指出,在盐度16~20 的虾池中,优势种群以喜高盐的硅藻为主。但养殖后期投饵量大,水体负荷加重,出现富营养化,出现大量能分泌毒素的甲藻类,给对虾带来很大危害。因此,作为水中的初级生产者,浮游藻类的藻像变化直接反映养殖水体营养状况。
藻类的数目和类型变化又可以表示为几种生物多样性指数:多样性指数H',均匀度指数J,Margalef 指数d(丰富度指数)的变化。每个指数仅是反映水体的粗略衡量,并不准确,有时甚至是错误的。将几个指数结合进行研究和综合分析,能够客观反映水体状态[8]。
很多藻类如甲藻、硅藻等,是鱼、虾、贝的天然饵料,即使不直接以藻类为饵料的经济水生生物,所食的浮游动物或其他小型水生生物,也直接或间接以藻类为饵料[9]。因此,水体浮游动物的多样性指数变化也反映了水体状态。
大黄鱼陆基节水养殖已取得一定养殖效果,但对于养殖水体中浮游藻类的群落结构及其影响研究很少。本试验着重研究了大黄鱼养殖水体中浮游藻类群落结构,并探求其与养殖水体水质和大黄鱼生长的相关性。
1 材料与方法
1.1 试验器材和试剂
紫外光分光光度计(CARY50Bio,美国VARIAN 公司)、可见光分光光度计(CARY50Bio,美国VARIAN 公司)、光学显微镜(XSP-3C)、便携式pH 计(PHC-2,上海伟业仪器厂)、漩涡式充气增氧机(HG-1500,浙江森森集团股份有限公司)、搅拌机(FB-618A,佛山市南海福利宝电器有限公司)、软颗粒制粒机(Y112M-4,杭州奥力电机制造有限公司)。
采样器、25号浮游生物过滤网、梨形分液漏斗、0.1 mL计数框、1.0 mL 计数框、移液枪、具塞比色管(50 mL)、烘箱、水浴锅等。
微孔滤膜(孔径0.45μm,直径60 mm)、真空泵、吸滤瓶、无齿扁咀镊子。
水质分析试剂(A.R):浓盐酸、氢氧化钠、碘、碘化汞、四水合酒石酸钾钠、氯化铵、磺胺、盐酸萘乙二胺、亚硝酸钠等;磷酸二氢钾、过硫酸钾、钼酸铵、酒石酸锑钾、硫酸、抗坏血酸。
鲁哥氏试剂:KI(A.R)20.0 g溶解于10%冰醋酸200 mL中,加入I2(A.R)10.0 g,充分溶解并贮存于棕色试剂瓶中。
福尔马林固定液:取甲醛溶液4 mL 和甘油10 mL,溶于蒸馏水中并定容至100 mL.
1.2 试验条件和材料
1.2.1 试验条件。25 m2室内养殖池(长5 m×宽5 m×深0.8 m),棚顶为花格保温薄膜,30%透光率,棚壁为10K泡沫彩钢板;配备增氧装置、沉淀分离井、无孔隔栅、生物滤池和气提装置等。水池池底与沉淀井底以管道联通,沉淀分离井与生物滤池以隔栅隔开;生物滤池用于分离悬浮颗粒,并作为菌团等生物群落的附着基,滤池后端配气提装置。养殖池水面略高于隔栅,生物滤池与养殖池水面平齐,可开启气提装置,利用气提负压原理将水引入养殖池,形成液面差,养殖水通过连通管道补偿进入沉淀分离井,井表面清水溢流进入生物滤池,形成水循环。每日对沉淀井进行定时排污,并根据水位线补充淡水。
1.2.2 试验材料。选用经低盐驯养,平均规格达到4.20±0.53 cm 的大黄鱼幼鱼800 尾作为试验用鱼,选用拉运自马尾闽江入海口处的近海咸淡水,兑淡水稀释至13±0.2 盐度作为养殖用水。养殖期间每日仅作少量排污和淡水补水,养殖水盐度从15‰逐步稀释至5‰。
养殖饲料:海马牌大黄鱼配合饲料(慢沉性)、鳗鱼粉料所制软颗粒料。
1.3 试验管理
待水池消毒完毕后,引入养殖用水,调节pH值并充分曝气5天,投苗当天及时清理殇苗;待幼鱼稳定后,每日以体质量1.5%~2.5%投饵,每日虹吸残饵和粪便,定时清除沉淀分离井和生物滤池的污泥,并根据水位线少量淡水补充损耗,除此外整个养殖过程不换水[10]。
监测养殖过程中养殖水体的浮游植物(藻类)的指标。
1.4 试验设计
1.4.1 水体中藻类检测
(1)水样采集和处理
每月2 次对试验池进行采样检测,水样采集时间为上午9 点到10 点。在池子选取均匀分布的4 个采样点,每个点用采样器取水表面下0.3 m 处水样约250 mL,共采集水样1000 mL,倒入梨形分液漏斗,用10.0 mL 鲁哥氏试剂固定,并用4~5 mL福尔马林固定,标识保存。经48 h 静置沉淀,用虹吸管小心吸取上清液,将漏斗底层约30 mL 浓缩液移出到50 mL 定量标本瓶中,用少量纯水洗涤漏斗2~3 次,然后引入标本瓶中并定容至50 mL,用于定性鉴别和计数。
(2)藻类观察和计数
浮游藻类定性样品在10×40 显微镜下观察鉴定,非优势种群鉴定到属,优势种群鉴定到种[9,10]。
浮游藻类定量样品计数,将样品充分混匀,取0.1 mL 经预处理过的样品于0.1 mL 计数框中,盖上盖玻片,置于10×40显微镜下进行观察计数。每个样品计数2 片,取平均值。如两片计数结果相差15%以上,则进行第3 片计数,取其中个数相近的2 片取平均值。将计数结果代入公式,得到每升藻类数量。
计算每升水中藻类的数量(N):
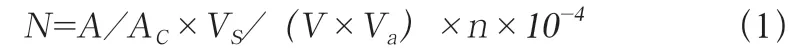
式中,A为计数框面积(mm2);Ac为计数面积(mm2);n为计数所得的藻类总数;Vs为1 L 水样沉淀浓缩后的体积,为50 mL;Va为计数框体积,为0.1 mL。
1.4.2 水体中浮游动物的检测方法
(1)采样与处理
在养殖水体中均匀分布的4 个点采样,每个采样点各取上、中、下层混合水样各1 L,并混合至4 L。所取水样用25 号浮游生物过滤网过滤,并用清水反复清洗滤网,然后将滤网上的过滤物洗入标本瓶中,定容至50 mL。
(2)浮游生物观察和计数
将标本瓶摇匀,用移液枪移取1 mL 样品于1 mL 计数框中,盖上盖玻片固定浮游动物,置于显微镜下计数。每个样品计数3片,取平均值。
计算水中浮游动物个体数(N):

式中:n为计数所得个数;V为水样体积(L);Vs为浓缩体积(mL);Va为计数体积(mL)。
水体中轮虫个体小,过滤网难以过滤,因此检测方法同藻类。
1.4.3 浮游生物优势种群的确定
多样性指数是可以用来反映丰富度和均匀度的综合指标,是根据不同群落藻类和浮游动物的物种及其个体数来计算不同群落的指数值,可以了解不同群落中中间个体的差异、群落结构组成及物种的分布格局。浮游生物多样性指数越高,表明该点物种越多,食物链及群落结构复杂,群落较稳定。许多生态学家认为水体浮游生物的多样性与水生态系统稳定性密切相关。
浮游生物多样性指数采用Shannon-Wiener 指数方程计算[11]。
多样性指数
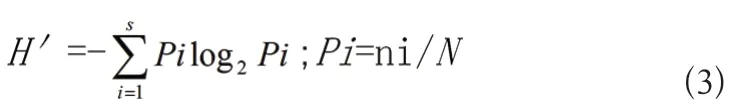
Margalef 丰富度指数计算式(d):
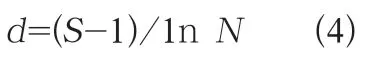
浮游生物均匀度指数采用Pielou 指数方程计算[12]
均匀度指数

式中:S为样品中物种总数;Pi为第i 种的个体数(ni)与总个体数(N)的比值。
优势度(Y)计算公式为:

当浮游生物种群的优势度Y≥0.02 时,定义为优势种群。
式中:ni为第i种的总个体数;fi为第i种在各样品中出现的频率;N为全部样品的总个体数。
2 结果与分析
2.1 大黄鱼的存活率、质量变化及水质指标变化趋势
如图1、图2 所示,在试验期间,大黄鱼在养殖前、中期养殖过程中死亡极少,生长正常,存活率高于95%,但进入150 日龄后(7 月中旬)大黄鱼开始持续进食不良,生长受限;同时大黄鱼存活率急剧下降,到试验结束时,大黄鱼的存活率不到60%。
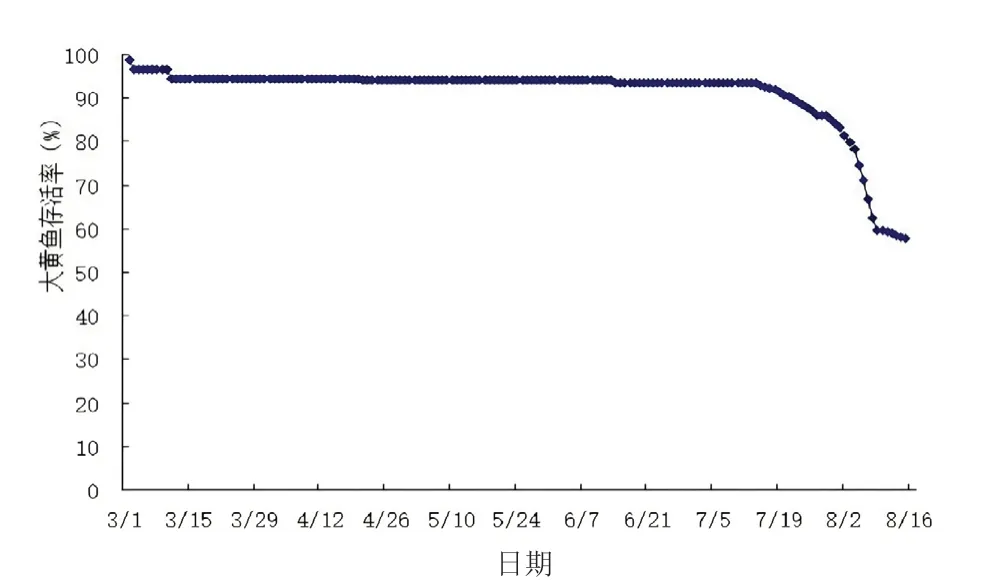
图1 大黄鱼存活率
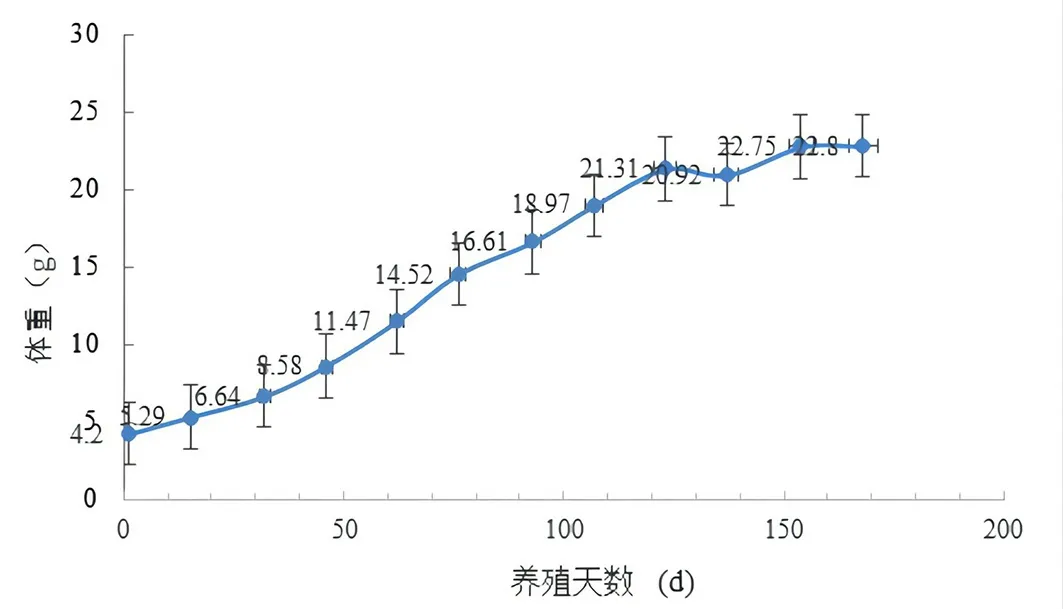
图2 大黄鱼体重变化趋势
2.2 浮游藻类种类组成
试验期间,从试验池子中采集的定性和定量样品中,共观察到浮游藻类4门18属(种),其中,甲藻门(Pyrrophyta)2属(种),硅藻门(Bacillariophyta)7 属(种),绿藻门(Chlorophyta)5属(种)、裸藻门(Euglenophyta)1属(种),蓝藻门(Cyanophyta)3属(种)。在13属(种)藻类中,甲藻门的圆鳞异囊藻(Heterocapsa circularisquama)、裸甲藻属(Gymnodinium sp.);硅藻门的简单舟形藻(Navicula simplex)、卵圆双眉藻(Amphora ovalis)、海生胸隔藻双头变种(Mastogloia smithii v.amphicephala)、奇异棍形藻(Bacillaria paradoxa);绿藻门的交错丝藻(Ulothrix implexa)和裸藻门的裸藻属(Euglena sp.)等8 属(种)出现的频率很高,且在数量分布上占一定比例,为常见种。
2.3 浮游藻类生物数量变化
如表1 所示,在养殖前期,由于养殖用水为新注入的海水,藻类基数低,可检出种类少,且各藻类的数量值差异度小,同时水体营养值低,藻类繁殖速度慢。随着饵料的持续投喂与鱼类排泄物的分解,水体营养值升高,随着气候转暖,光照时间和光照强度增加,藻类繁殖速度大大加快、种类增多、水色加深[13]。随着水体中生物结构的建立,水体中藻类不断演替变化,各属藻类数量值出现差异化,优势藻种大量繁殖,非优势藻种数量在低值徘徊,甚至未被检出。
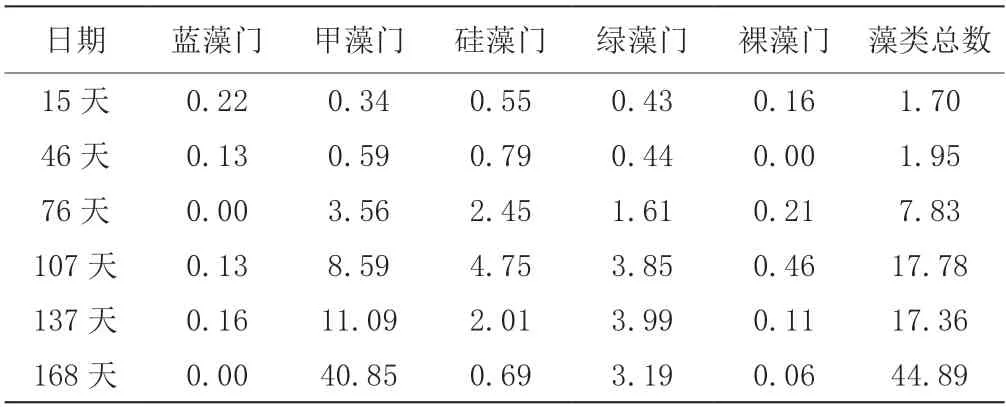
表1 浮游藻类数量(104 ind/L)
养殖后期,水体藻类平衡被打破,甲藻大量繁殖。其中裸甲藻不但会阻塞鱼的呼吸细胞,死亡的藻类还会产生毒素毒害鱼体,造成大黄鱼的死亡,笔者认为这是导致大黄鱼死亡的最主要原因。
2.4 藻类优势种群变化
如表2 和图3a 所示,养殖前期各门藻类比例差异不大,虽然各门藻类均有检出优势度Y≥0.02 的种类,但总体数量均处于低值,可视为未出现优势种。
如表2、图3b、图3c 和图3d 所示,养殖中期,甲藻门、硅藻门和绿藻门的藻类百分比值占90%以上,水色逐渐呈茶色,各藻类的优势度逐渐呈明显差异化。其中,卵圆双眉藻(Amphora ovalis)、简单舟形藻(Navicula simplex)、圆鳞异囊藻(Heterocapsa circularisquama)、交错丝藻(Ulothrix implexa)、海生胸隔藻双头变种(Mastogloia smithii v.amphicephala)、奇异棍形藻(Bacillaria paradoxa)成为主要优势种,裸藻门和蓝藻门的藻类生长繁殖受明显抑制,数量处于低值。
由表1 可知,各门藻类的数量级为103~104ind/L,藻类密度不高,圆鳞异囊藻和裸甲藻虽处于优势种状态,但并未对大黄鱼造成生长障碍。
如表2、图3e 和图3f 所示,在养殖中后期,硅藻门藻类所占藻类总量百分比显著下降,绿藻门在藻类总量中的百分比也有所下降。其中,卵圆双眉藻、简单舟形藻、海生胸隔藻双头变种、奇异棍形藻变为非优势种群,而甲藻门藻类大量增殖,圆鳞异囊藻和裸甲藻成为优势种群。
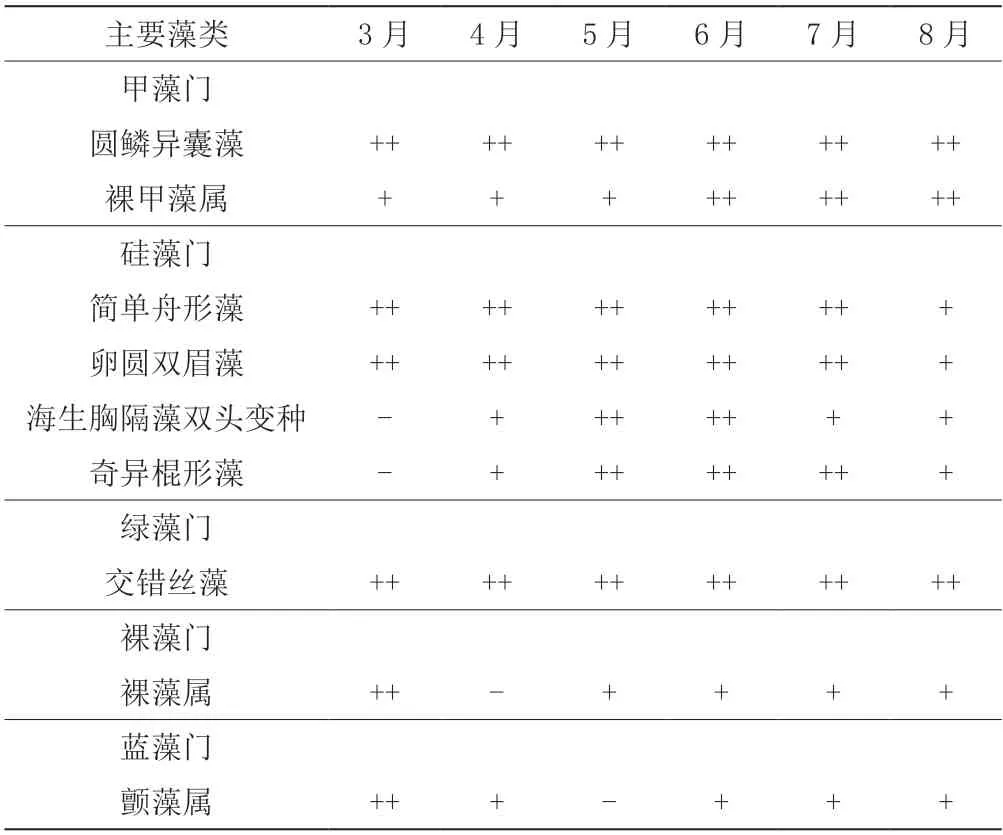
表2 试验各时期优势藻种
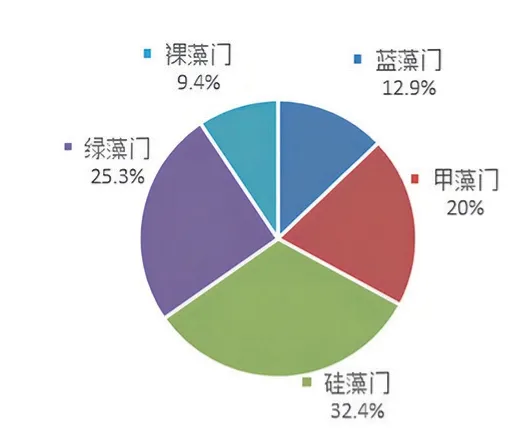
图3 a 15 天各藻类数量的百分比
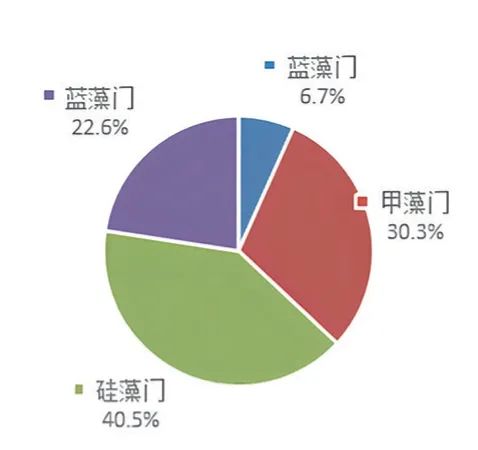
图3 b 46 天各藻类数量的百分比

图3 c 76 天各藻类数量的百分比

图3 d 107 天各藻类数量的百分比
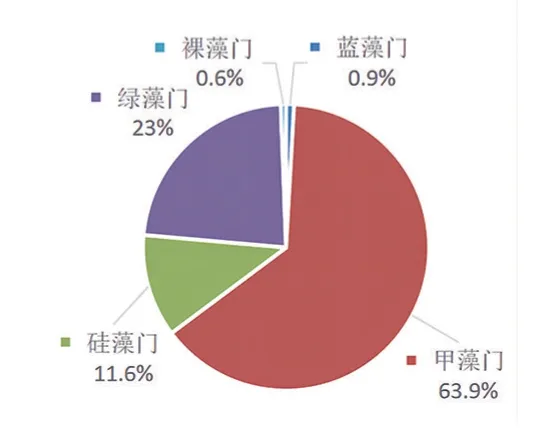
图3 e 137 天各藻类数量的百分比
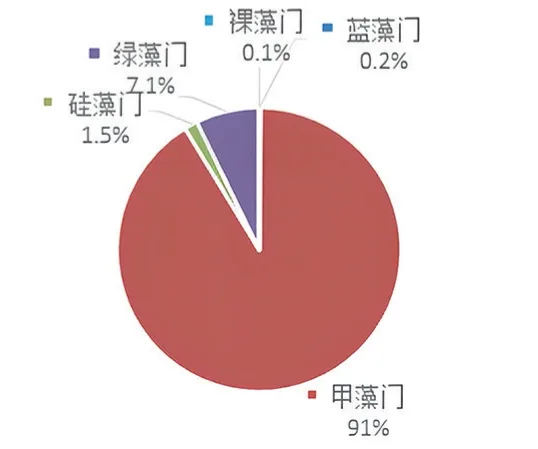
图3 f 168 天各藻类数量的百分比
由表1 可知,硅藻门藻类数量减少,绿藻门藻类数量波动不大,蓝藻门和裸藻门藻类数量值极低,而甲藻门藻类数量激增,数量级达到105ind/L,水色也由茶色转为,此时大黄鱼进食欲望大为减弱,生长受限,大黄鱼开始频繁死亡。至168 天,大黄鱼存活率下降为57.25%。结合藻类变化趋势和大黄鱼死亡症状,可推断主要是由于养殖后期投饵量大而导致水体营养盐充足,裸甲藻大量增殖,裸甲藻堵塞大黄鱼的鳃丝,阻碍呼吸,同时裸甲藻产生毒素,使鱼体中毒[14]。
由此可知,敏感型藻类在水质污染情况下生长受限,数量少,对养殖整体不造成明显影响;硅藻门、甲藻门、绿藻门等多门藻类并存并且数量百分比较为均衡的情况下,水体稳定,大黄鱼生长正常。而裸甲藻、圆鳞异囊藻等可在自然海域形成赤潮,并引起养殖鱼类大面积死亡的藻类,在水体藻相平衡时不会大量增殖,对鱼体生长并不构成危害[15];只有当水体富营养化、营养盐过于充足、水体藻相不稳定时,有害藻类才会大量增殖,对大黄鱼构成危害。
3 讨论
3.1 水体浮游植物多样性指数
藻类的H'值高低代表藻类群落结构的多样性和稳定性[16]。H'值高的水体生物群落结构复杂,水体稳定性高水质好;H'值低,群落结构简单,水体稳定性低,水质差。由表3 可知,15~107 天养殖池水H'值为1.68~2.20,根据评价标准评价可知水质较好;137 天养殖池水H'值为1.37,水质一般;到168 天左右,H'值为0.52,水质差。这与2.1 中大黄鱼在养殖后期的死亡和2.3 中有害藻类的爆发时间相符。
J评价标准为:0~0.3 重污染,0.3~0.5 中污染,0.5~0.8轻或无污染。d评价标准为:d>3 水质清洁,d=1~3 水质一般,d<1 水质差。由表3 可知,15~137 天藻类的均匀度指数J为0.77~0.95,为轻度富营养化;137~168 天J为0.22~0.59,水体中等到重富营养化。15~137 天藻类的Margalef 指数d为0.99~1.23,水质一般;137~168 天d为0.92~0.99,水质较差。数据说明在养殖中后期水质恶化明显。

表3 水体藻类多样性指数和均匀度指数
综上可知,水体浮游植物的多样性指数对水质的监控和大黄鱼的生长状况有实际指导意义。可通过各多样性指数对养殖水体水质进行评定[17],从而及时调节水质,有效预防水质恶化导致的养殖鱼类大量死亡。
3.2 改善水体水生生物结构
3.2.1 观察水色,及时调节。水色主要指水中的浮游生物在阳光照射下呈现出的颜色[18]。一般而言,常见的水色有以下3 种:
黄绿而清爽:浓淡适中,浮游生物组成以硅藻为主,绿藻和裸藻也比较多。
油青色:比较适中的肥水,浮游生物中硅藻、绿藻和甲藻的数量比较平衡。
茶褐色:比较适中的肥水,腐殖质浓度较高,浮游生物以硅藻、隐藻为主,裸藻、甲藻、绿藻也比较多[19]。
以上3 种水色有利于鱼类生长,属于好水。而灰绿而浑浊、橙黄而浑浊、灰白色、黑褐色、淡红色的水不利于鱼类生长[20]。
3.2.2 氮磷的控制。大黄鱼养殖中,鱼类摄食和排泄都在水中进行,水体中长期累积了大量排泄物和部分未被消化的饲料,在异养型细菌的分解作用下,水中的蛋白质会被分解为含氮有机物,含氮有机物在亚硝化细菌的作用下转化为亚硝酸,而亚硝酸可与金属物质结合形成对鱼体有害的亚硝酸盐,易造成鱼类大量死亡[21]。同时氮磷是浮游微藻生长繁殖的重要营养盐,氮磷超标时,藻类迅速繁殖,生物量大大增加,其中有害藻种对鱼体造成威胁。因此,测定水中各种形态的氮磷化合物,有助于评价水体被污染和自净状况。实时测定水体中的氮磷浓度,有助于了解和控制氮磷污染。
培养适量的硝化细菌,包括亚硝化细菌和硝化杆菌,是降解氨和亚硝酸盐的有效方法。亚硝化细菌通过亚硝化作用将含氮有机物氧化为亚硝酸盐,紧接着由硝化杆菌通过硝化作用将亚硝酸盐转化为可被藻类利用的硝酸盐,从而起到净化水质的作用。
水质改良剂,如沸石粉[22]、活性炭等,能够吸附水体中有害氨氮,对缓解水质恶化有一定作用。合理换水,循环用水,在水体生物结构稳定期间,以定期定量换水稀释营养盐浓度,控制水体富营养化程度。
3.2.3 改进养殖设施。改进沉淀池和净化池,改善沉淀分离和有机悬浮物分离的能力[23]。添加固定化生物膜,提高生物分解能力,在沉淀池入口处放置大量滤材过滤,滤材的多孔特性也能为硝化细菌的培养提供有利场所。
3.2.4 优化藻类。调控环境因子,培养微藻,促进硅藻、绿藻等有益藻类的繁殖,抑制蓝藻、甲藻等藻类的数量,构建优良微藻藻相[24]。如绿色巴夫藻和海水小球藻,对养殖废水营养盐污染均可起到净化作用,提高养殖废水中NH4+-N、NO2--N 和PO43--P 的去除率。马沛明等[25]认为,底栖藻类对水体中的氮、磷有明显的去除效果。稳定的波吉卵囊藻和微绿球藻,不仅可以提高水中的溶氧含量,还能降低水中氨氮、亚硝酸盐等有害因子的浓度,从而达到净化污水和保持良好水环境的作用[26]。
3.3 水体藻类单一性的危害
在试验后期,养殖水体中的藻类结构单一,甲藻门占据浮游生物种类上风,导致大黄鱼大量死亡。养殖中大量投饵,鱼类排泄物使养殖水体的氨氮、亚硝酸盐积累超标,养殖水体恶化,改变养殖水体中的藻类组成,抑制了藻类的多样性[27]。严重时,水环境恶劣会使以氨氮、亚硝酸盐为营养盐类的藻类过度繁殖,形成单一种群,藻类老化死亡后对养殖鱼类造成显著危害[28]。如甲藻大量繁殖会使水分层,发出腥臭味,水中溶解氧量急剧下降,导致养殖动物鳃负担过重,或直接附着在鳃丝上出现黄鳃、肿鳃等问题。甲藻老化后产生的甲藻毒素会直接危害肝脏,严重影响养殖动物的健康[29]。随着养殖水环境恶化,以有害藻类为饵的浮游动物繁殖受到抑制,甚至也带毒,造成水质生态链失衡。
3.4 生物调控
生态养殖中,为预防藻类繁殖,建议采取生物防治的方法调控水质。光合藻类大繁殖前就人为接种一定种群数量的浮游动物,浮游动物捕食藻类,混养鱼类捕食浮游动物[30],达到生态平衡,有效解决藻类大量繁殖问题。在一定范围内,可以通过调控养殖水体中生物的种类及各种类的生物量,达到提高养殖水体水质及单位水体鱼产力增加的目的。
4 结论
在一定的时间内,生态系统中各种生物之间可以达到相对的稳定和平衡,并在一定强度的外来干扰下能通过自我调节恢复稳定状态。但由于调节能力有限,且25 m2的小水体也无法构建稳定且强大的生态系统,物种不够丰富可能导致自我调节能力减弱;同时,如果破坏强度过大,超出阈限,则无法实现自我调节。如,过量投喂饲料会导致水中的氮、磷等有害物含量骤增,养殖后期水生生物比例失调,藻类生物过量、品种单一,且大部分为有害藻种,因此导致水体生态系统无法自行调节至平衡状态,大黄鱼出现大量死亡。
保持水体中藻类和浮游动物的多样性是大黄鱼健康生长的关键之一,任一物种生物量都不宜超出主养对象所能负荷的阈值,确保不使某种生物大量死亡,也不会使某种生物大量增殖,水体保持动态平衡状态。所以,在大黄鱼生态循环水养殖中,控制过度增殖的藻类十分必要。
