不同病毒载量乙型肝炎患者的肝功能与肠道微生态分布及数量变化的关系研究
2022-11-17徐文琦唐晓琦
徐文琦,唐晓琦
乙型肝炎(以下简称为“乙肝”)是由乙肝DNA病毒感染导致的肝脏炎性状态。目前在我国仍有超过100万人口感染乙型肝炎,若不给予有效治疗,有高达40%患者可进展为肝硬化、肝癌,危及患者生命[1]。而乙型肝炎病毒(hepatitis B virus,HBV)-DNA载量是预测HBV感染最具高灵敏度、特异度的指标。而监测乙肝患者肝功能指标,可反映患者肝脏受损程度[2]。近年来,乙肝与肠道菌群相互作用受临床广泛关注。大量研究表明,乙肝患者肠道微生态失衡与疾病有关,随着肝脏炎症反应机纤维化进展发挥推波助澜的作用,从而影响肝功能[3]。因此,对乙肝患者肠道菌群结构与肝功能全面深入的鉴定分析,将有助于乙肝患者的治疗及预后。本研究将对乙肝患者的肝功能与肠道微生态进行探讨,分析肝功能、肠道微生态与患者疾病的关系。
1 资料与方法
1.1 一般资料选择2017年1月-2021年1月经宜兴市人民医院治疗的乙型肝炎患者94例。其中男49例,女45例;年龄18~71岁,平均年龄(39.78±11.79)岁。根据乙型肝炎病毒(HBV)-DNA检测结果将患者分为阴性组,阳性组。其中阴性组(HBVDNA载量<1.0×103copies/mL)29例,阳性组65例。参照杨莉等[4]文献内容将阳性组患者分为低、中拷贝组(1.0×103copies/mL≤血清HBV-DNA载量<1.0x 107copies/mL)共43例、高拷贝组(HBV-DNA载量≥1.0x 107copies/mL)共22例,同期选择50例正常者为对照组。纳入标准:①符合《慢性乙型肝炎防治指南(2019年版)》中相关乙肝诊断标准[5];②未使用影响肠道菌群、环境及肝功能的药物、制剂。排除标准:①合并甲丙丁等肝炎病毒感染者;②合并重要脏器严重疾病。本研究通过医学伦理学批准(编号:伦审2021技015),所有受试者知晓研究意图,签署同意书。
1.2 方法
1.2.1 采集血液标本抽取受试者空腹晨静脉血5 mL,室内放置2 h后,3000 r/min(离心半径5.5cm)离心20 min,取上清液,置于-80℃冰箱中保存备用。
1.2.2 血清HBV-DNA载量检测采集患者500 μL血清于1.5 mL离心管中,再取100μL血清加入等量DNA浓缩液于1 mL离心管中,震荡5 s混匀,6000 r/min(离心半径7.5cm)离心20 s,除上清液,加30μL DNA提取液,静置30 min后,震荡8 s,置入100℃条件下的恒温箱中10 min,再10000 r/min(离心半径9.5cm)离心5 min,采用美国ABI的QuanStudio 3实时荧光定量PCR仪扩增,用乙型肝炎病毒核酸定量检测试剂盒(上海联迈生物工程有限公司,最低检出限浓度为30 copies/mL,最低定量浓度为100 copies/mL)、PCR-荧光探针法检测血清HBV-DNA载量。根据结果显示将94例患者分为阴性组29例、低、中拷贝组43例、高拷贝组22例。
1.2.3 肝功能指标检测取备用血液4 mL,用erb‐axl-1000全自动生化仪(广州华埔生物科技有限公司)检测肝功能水平,包括丙氨酸氨基转移酶(ala‐nine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(γglutamyl transpeptidase,γ-GT)、碱性磷酸酶(alkaline phosphatase,ALP)。
1.3 肠道微生态检测
1.3.1 采集粪便样本采集粪便样本时,应避免尿液污染。在1 h内完成,采用一次性采样勺取适宜量新鲜粪便样本送至实验室后,取其230 mg于EP管中,保存于-80℃冰箱中备用。
1.3.2 肠道菌群检测取1 g粪便,4℃下复融,加入1 mL的PBS溶液震荡5 min使其充分混匀,13000 r/min(离心半径11.0cm)离心3 min,取沉淀;加入50 μL蒸馏水得到粪便悬浮液,加入50 μL的1%TritonX-100溶解粪便内脂质等物质;置于100℃沸水中煮沸5 min,取出后立即置于冰水中冷却;设计引物序列,并将其与16S核糖体核糖核酸(ribosomal Ribonucleic Acid,rRNA)全 序 列 在BLAST数据库中进行验证比较。引物序列见表1。

表1 不同菌种的引物序列
反应体系:上游引物0.25 μL、下游引物0.25 μL、10×Buffer2.5 μL、4×dNTP(上海泽叶生物科技有限公司,货号ZY51208A)2.0 μL、MgCl22.5 μL、Taq DNA聚合酶0.75 μL、DNA模板3 μL、SYBR GreenⅠ(10000×)2.5 μL、双蒸水11.25 μL;利用美国ABI公司7500实时荧光定量PCR仪进行PCR扩增和分析,反应条件:95℃预变性5 min,1个循环,95℃,15s,60℃,1min,72℃,45s,87℃,5s,40个循环,72℃延伸10 min;在Blast基因库中对比其特异性,然后用赛默飞ABI 7500型实时荧光定量PCR仪对肠道中常见几种细菌进行定量测定,均以10~108copies/μL浓度的含有标准菌种16S rRNA基因片段的质粒DNA构建标准曲线,标准菌株质粒购自美国Invitrogen公司,取1 g粪便中细菌基因拷贝数的对数lg copies/g表示细菌数量,计算样品中拟杆菌属、普雷沃氏菌属、瘤胃球菌属、梭菌属、乳酸杆菌属、双歧杆菌属、粪球菌属、白色念珠菌、肠杆菌科细菌的含量。
1.4 统计学处理采用SPSS 21.0软件。计数资料以[n(%)]表示,采用χ2检验比较,组间两两比较采用卡方分割法,正态分布的计量资料以均数±标准差()表示,两组间比较采用独立样本t检验比较,三组间比较采用单因素方差分析(ANOVA),进一步组间两两比较采用SNK-q检验;患者肝功能指标与肠道微生态相关性分析采用Pearson相关分析。
2 结果
2.1 各组研究对象一般资料比较各组研究对象一般资料比较,差异不具有统计学意义(P>0.05)。见表2。
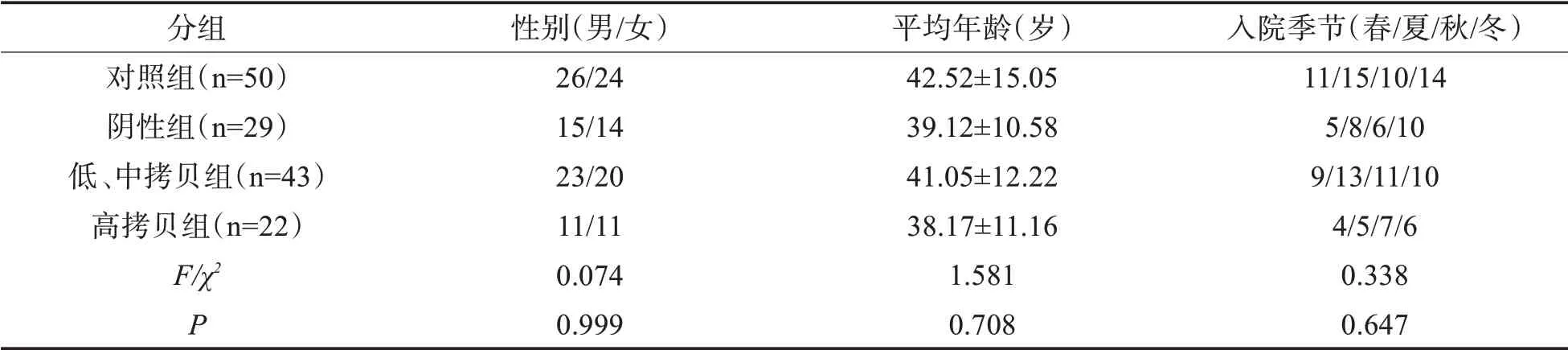
表2 各组研究对象一般资料比较
2.2 各组受试者肝功能指标水平比较三组受试者ALP水平比较,差异无统计学意义(P>0.05);阳性组患者ALT、AST、γ-GT水平均高于阴性组、对照组(P<0.05);阴性组与对照组肝功能指标比较,差异无统计学意义(P>0.05)。见表3。
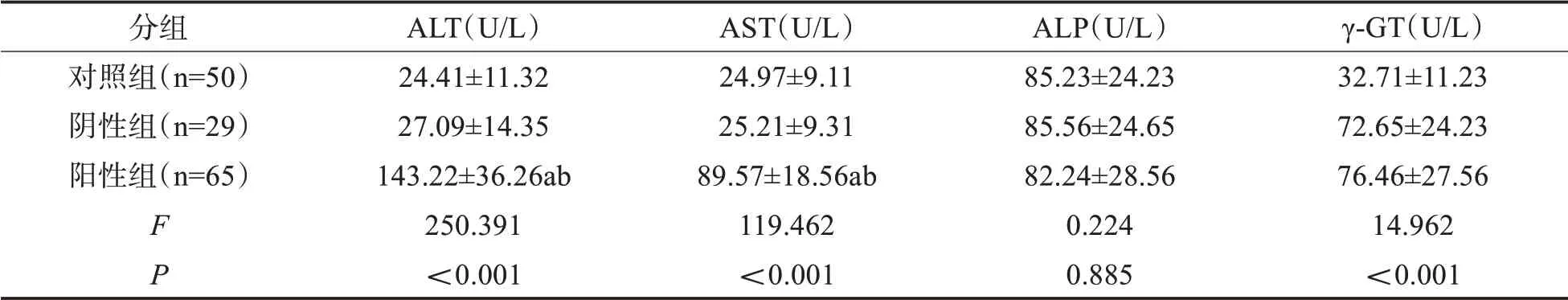
表3 各组受试者肝功能指标水平比较
2.3 不同HBV-DNA载量患者肠道微生态数量比较低、中拷贝组和高拷贝组患者ALP、γ-GT水平比较,差异无统计学意义(P>0.05);而高拷贝组患者ALT、AST水平均高于低、中拷贝组(P<0.05)。见表4。
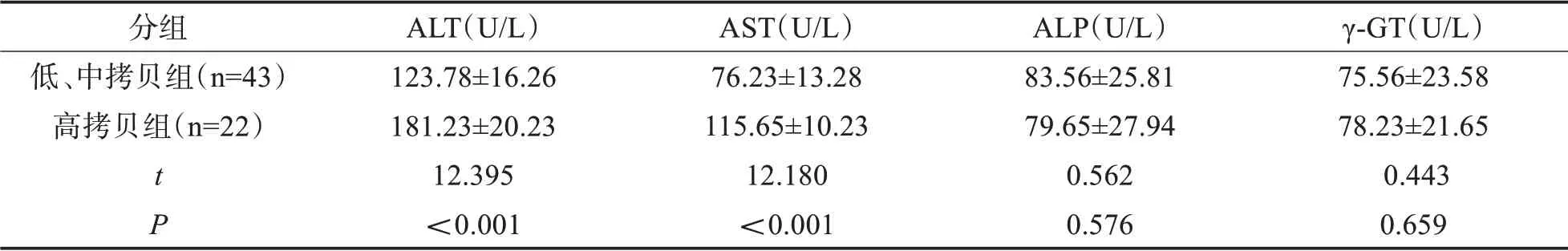
表4 各组受试者肝功能指标水平比较
2.4 各组受试者肠道微生态数量比较阳性组患者普雷沃氏菌属、梭菌属、肠杆菌科细菌、粪球菌属、白色念珠菌数量均高于阴性组、对照组(P<0.05),而拟杆菌属、瘤胃球菌属、乳酸杆菌属、双歧杆菌属低于阴性组、对照组(P<0.05);阴性组与对照组肠道微生态数量无显著差异(P>0.05)。见表5。
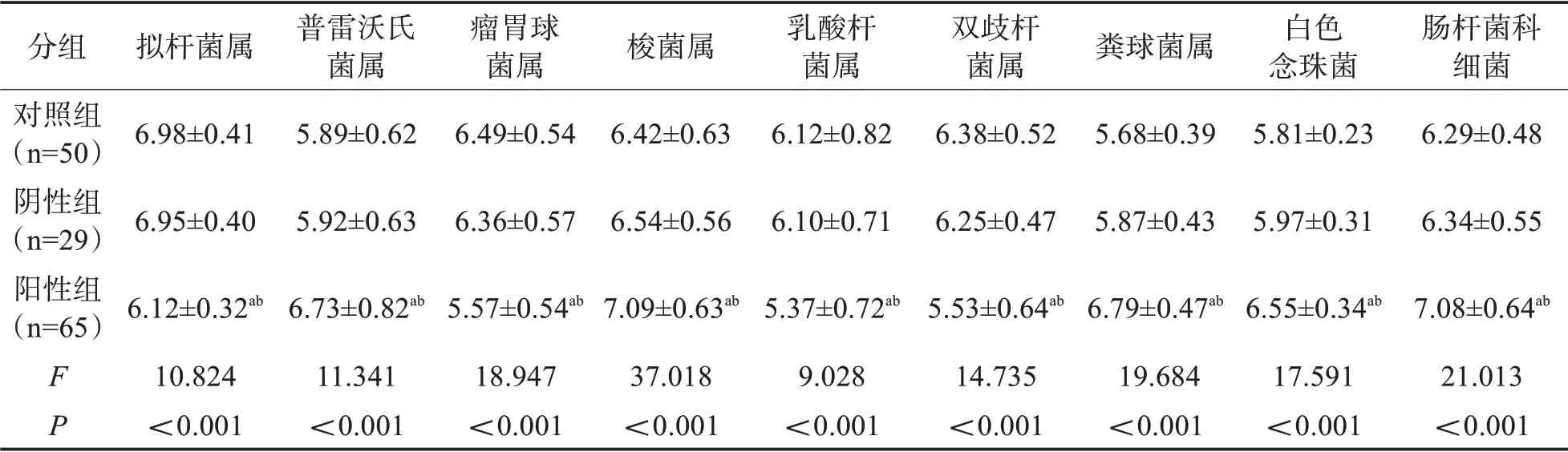
表5 各组受试者肠道微生态数量比较
2.5 各组受试者肠道微生态数量比较高拷贝组患者普雷沃氏菌属、瘤胃球菌属、梭菌属、粪球菌属、白色念珠菌数量均高于低、中拷贝组(P<0.05),而拟杆菌属低于低、中拷贝组(P<0.05)。见表6。
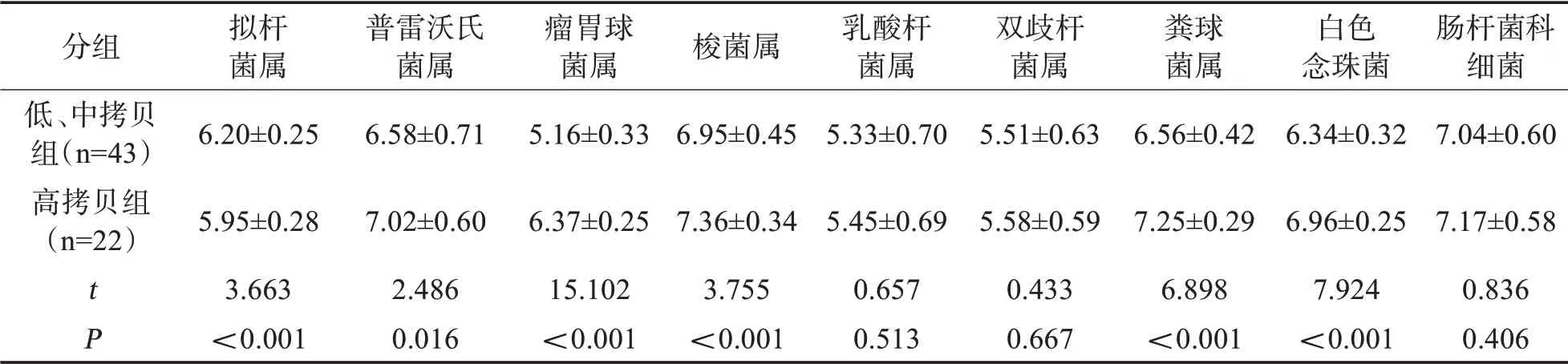
表6 各组受试者肠道微生态数量比较
2.6 高病毒载量乙肝患者肝功能与肠道微生态变化的关系高病毒载量乙肝患者ALT、AST、γ-GT水平与拟杆菌属、瘤胃球菌属、乳酸杆菌属呈负相关,与普雷沃氏菌属、梭菌属、双歧杆菌属、粪球菌属、白色念珠菌、肠杆菌科细菌呈正相关(P<0.05);ALP水平与肝功能指标水平无关(P>0.05)。见表7。
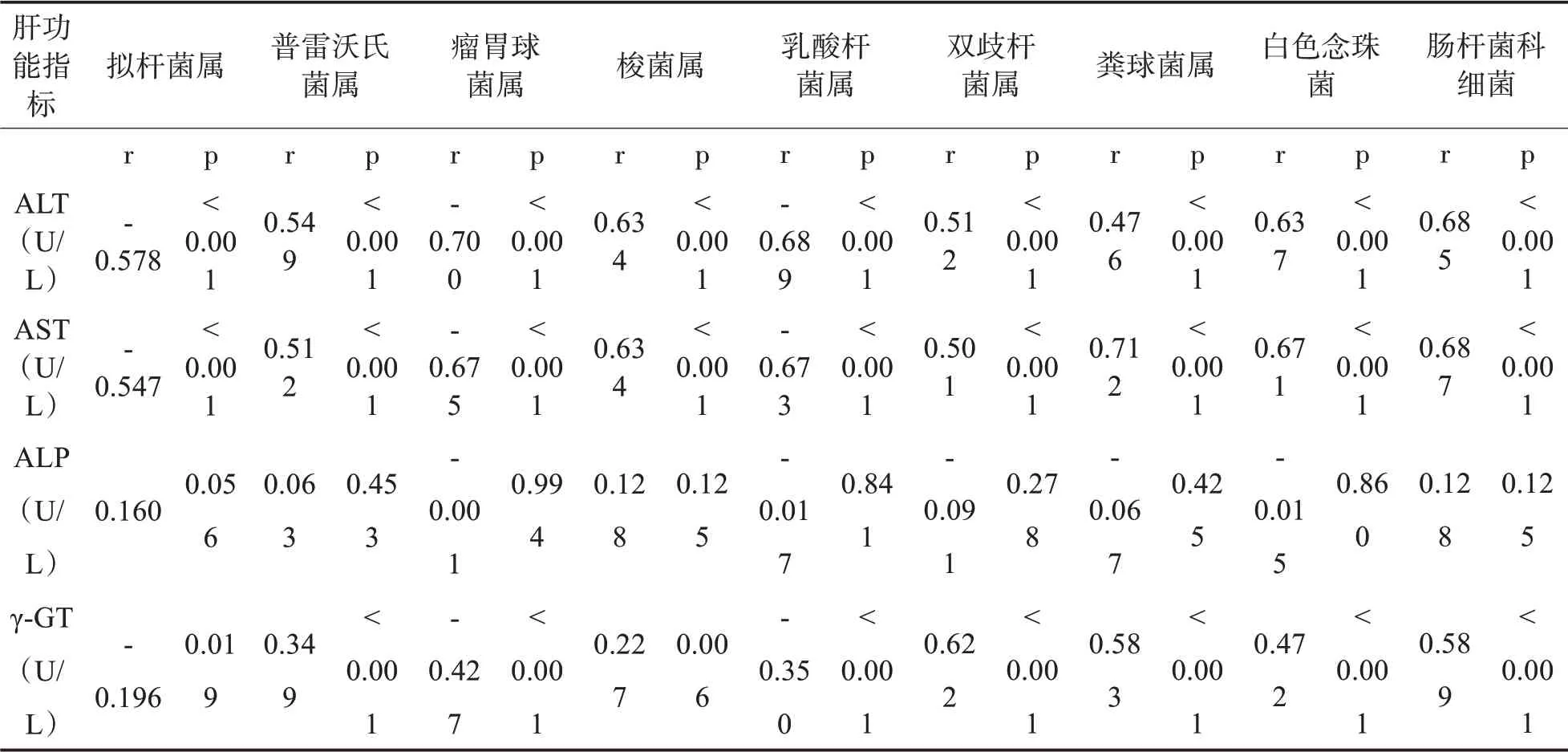
表7 高病毒载量乙肝患者肝功能与肠道微生态变化的关系
3 讨论
3.1 受试者肠道微生态数量变化及高病毒载量乙肝患者肠道微生态分布乙型肝炎发生率高,患者病情若得不到有效控制易进展为肝癌或失代偿期肝硬化,严重影响生活。有研究结果表明,乙肝患者机体内存在不同程度的肠道微生态失调现象[6]。肠道菌群是人体重要定植菌群,具有免疫调节、防御病原体及代谢物质等生理作用。当菌群结构发生改变时,机体肠道内炎症介质、内毒素释放,肠道屏障遭受破坏,引发疾病;且有害代谢产物可通过肠-肝轴运输至肝脏,导致其结构破坏及功能受损[7]。拟杆菌属革兰氏阴性菌,死亡溶解后会释放出细胞壁中脂多糖,这可能与乙肝患者伴内毒血症有关。普雷沃氏菌属表面的LPS可诱导炎症因子基因表达,使炎症反应增强[8]。目前已被证明20种普氏菌属下的细菌可会引起多部位感染[9]。粪球菌属细菌可代谢短链脂肪酸,调节肠道免疫功能和物质代谢,目前发现的瘤胃球菌属细菌多数含有胆汁酸水解酶,与次级胆汁酸的产生密切相关,而胆汁酸可以刺激肠壁,破坏肠道微生态和机体免疫功能,影响机体对肠道菌群结构的调节[9]。白色念珠菌是寄生于人体口腔、肠道、阴道及皮肤表面的一种常见的念珠菌,一般情况下不引发疾病,但当机体免疫功能下降时,易引起感染[10]。双歧杆菌为有益菌,对机体健康有营养、生物屏障、免疫力增强等生理作用。乳酸杆菌属是有益于人体健康的微生物,它可通过产生乳酸、过氧化氢和细菌素等抗菌物质,或通过竞争肠道黏附位点或小肠食糜内的营养来抑制致病菌;通过诱导黏附素分泌细胞表面因子、蛋白质及可溶性肽,或者通过阻止细胞凋亡等途经来增强肠道的屏障功能,从而保护肠道[11]。作为肠道非优势菌群,肠杆菌科细菌在特定条件下会产生侵袭性并会对患者机体产生不良影响。现有众多研究表明,乙型肝炎肝硬化患者肠道菌群结构发生改变,且随着病情的发展而变化[12]。本研究结果显示,阳性组患者普雷沃氏菌属、梭菌属、肠杆菌科细菌、粪球菌属、白色念珠菌数量均高于阴性组、对照组,而拟杆菌属、瘤胃球菌属、乳酸杆菌属、双歧杆菌属低于阴性组、对照组。高拷贝组患者普雷沃氏菌属、瘤胃球菌属、梭菌属、粪球菌属、白色念珠菌数量均高于低、中拷贝组,而拟杆菌属低于低、中拷贝组。故,不同程度病毒载量乙肝患者均存在不同程度肠道微生态数量失调情况,且肠道微生态结构变化对肝脏组织产生一定程度损伤[13]。
3.2 乙肝患者肝功能分析血清HBV-DNA阳性表明HBV复制和有传染性。血清HBV-DNA载量越高,病毒复制越多,传染性较强。血清HBV-DNA载量、ALT、AST等指标均是反映乙肝患者肝功能的重要指标[14]。本研究结果显示,阳性组患者ALT、AST、γ-GT水平均高于阴性组、对照组;而高拷贝组患者ALT、AST水平均高于低、中拷贝组;表明HBV复制可会影响肝功能指标水平,与曹莉等[13]研究结果一致。分析其原因可能是HBV感染会引起肝细胞损伤,而肝细胞表面HBV抗原可引起人体的免疫应答,造成肝细胞损伤。
3.3 高病毒载量乙肝患者肝功能与肠道微生态变化的关系目前有研究认为,肠道菌群失调致肝炎机制主要与内毒素生成增加、肠壁通透性增加及肠道屏障功能破坏密切相关[15]。当肠道菌群发生失衡后,细菌及其产物容易移位到门静脉,从而将肝细胞中的Toll样受体信号激活,导致氧化应激和炎症反应,促进了肝炎发展[16]。故高病毒载量乙肝患者肝功能与肠道微生态变化呈相关性。其患者肠道微生态变化可致病毒载量呈高表达,导致肝功能受损,影响肝功能指标水平变化。
3.4 不足之处本研究为样本量小的单中心研究,需扩大样本量进一步证实本研究结果。
综上所述,高病毒载量乙肝患者肝功能与肠道微生态变化呈相关性。其患者病毒载越高,肠道微生态越紊乱,导致肝功能受损,影响肝功能指标水平变化。
