藏猪和大约克夏猪CXCL10 基因多态性及表达差异分析
2022-11-17刘思源何辰庆陈军军叶幼荣强巴央宗
刘思源,何辰庆,陈军军,叶幼荣,张 健,商 鹏*,强巴央宗
(1.西藏农牧学院动物科学学院,西藏林芝 860000;2.西藏特色农牧资源研发省部共建协同创新中心,西藏林芝 860000)
生猪养殖在我国养殖行业中长久以来都占据着重要位置。而生长性状是生猪养殖行业中最重要的经济性状,由多种因素共同调控。随着现代化养殖的发展和我国科研水平的提升,将遗传性状的分子调控机制研究与现代育种相结合,已成为种业提升大背景下的重要技术手段[1-2]。藏猪长期生活于我国青藏高原地区,是典型的高原小型猪种,常被作为试验材料应用于猪生长性状的研究中[3]。由于藏猪抗逆性强、沉脂力高、生长缓慢、出栏周期较长,无法满足商业需求。所以,通过分子技术手段,对影响基因转录进程的起始密码子上游3 kb 区域(含基因启动子区和5'UTR 区)进行挖掘,探究基因表达模式,有利于提高藏猪生长性能,能够从一定程度上推进藏猪产业的发展[4-5]。
CXC 基序趋化因子配体10(CXCL10)属于趋化因子CXC 家族,定位于猪第8 号染色体上,包含3 个内含子、4 个外显子,主要由成纤维细胞、肝实质细胞等多种细胞产生[6-7],被视作多功能的分泌因子。最新研究发现,CXCL10基因是一种新的肌肉生长因子,能够参与多种生物学进程,如控制胰岛素分泌,抑制肌细胞增长和肌内血管生成,是肌肉代谢相关网络中的重要节点和枢纽基因,与动物的生长发育密切相关[8-10]。本团队前期对藏猪、大约克夏猪背最长肌组织RNA-seq转录组学研究发现,CXCL10基因富集于肌肉生长调控机制相关通路上,是参与肌肉生长发育的关键功能候选基因[11]。
本研究将地方重要品种资源藏猪和引进猪种大约克夏猪作为实验动物,利用一代测序Sanger 法对CXCL10起始密码子上游3 kb 区域进行SNP 筛选,通过RT-qPCR 技术对2 个猪种的不同组织(背最长肌、腿肌、肝脏)进行mRNA 水平检测,从而探究CXCL10基因在猪生长发育性状中发挥的作用,为藏猪这一地方品种的种质资源保护及品种改良提供理论基础。
1 材料与方法
1.1 实验材料 本研究选取藏猪(TP)和大约克夏猪(YY)为研究对象,藏猪来自西藏农牧学院实习牧场,大约克夏猪来自林芝市宇高生态农业开发有限公司。采集藏猪(TP,n=46)和大约克夏猪(YY,n=57)的耳组织用于提取DNA。随机选取饲养模式相同的健康去势公猪藏猪和大约克夏猪各10 头,饲养至180 日龄进行屠宰,采集背最长肌、腿肌和肝脏组织,置于液氮中冷冻保存,用于RNA 提取。
1.2 DNA、RNA 的提取及cDNA 制备 使用苯酚-氯仿法从猪耳组织中提取基因组DNA,-20℃冻存[12]。根据北京天根生化科技有限公司总RNA 提取试剂盒说明书(DP171221),北京天根快速反转录cDNA 试剂盒说明书(KR180123),提取总RNA 并合成cDNA,置-20℃保存。
1.3 SNPs 筛选及基因分型引物设计 登录GenBank(http://www.ncbi.nlm.nih.gov/genbank),下载猪CXCL10基因DNA 序列(登录号:NC_010446.5),采用Primer Premier 5.0 软件进行引物设计,扩增起始密码子上游3 kb 区域,特异性检验后由生工生物工程(上海)股份有限公司合成,RNase-Free ddH2O 溶解,4℃保存。引物信息见表1。

表1 CXCL10 基因5'UTR 引物信息
1.4 转录因子预测 从Gene Bank 下载CXCL10基因组序列,使用在线网站CONSITE(http://jaspar.binf.ku.dk/)预测SNP 位点突变前后转录因子结合位点的变化。
1.5 实时荧光定量PCR 引物设计 NCBI 官网(http://www.ncbi.nlm.nih.gov/)下载基因的mRNA 序列,选取CXCL10(登录号:NM_001008691)为目的基因,选取GAPDH(登陆号:NM_001206359.1)作为内参基因,利用Primer Premier 5.0 软件进行引物设计,由生工生物工程(上海)股份有限公司进行合成,合成后用RNase-Free ddH2O 溶解,于4℃保存。引物信息见表2。

表2 CXCL10 基因和GAPDH 基因定量引物信息
1.6 实时荧光定量PCR 以cDNA 为模板,选用GAPDH为内参基因,藏猪和大约克夏猪待测样品每个样品设置3 个重复,实时荧光定量PCR 扩增体系(总体积为20 μL):上下游引物各0.5 μL,SYBR Green Mix 10 μL,cDNA模板0.8 μL,RNase-free ddH2O 8.2 μL。利 用实时荧光定量PCR 仪(罗氏,Light Cycler96)进行扩增。实时荧光定量PCR 扩增程序为三步法:95℃预变性900 s;95℃变性30 s,57℃退火20 s,72℃延伸30 s,65℃再延伸60 s。
1.7 数据统计分析 利用DNAMAN 6.0 和Chromas Pro 2.1.3 软件分析个体测序结果,对SNP 位点进行筛选。利用SPSS 18.0 软件χ2检验分析各突变位点的基因频率和基因型频率差异,对CXCL10基因表达量进行单因素方差分析。对RT-qPCR 结果,采用2-ΔΔCt方法计算CXCL10基因的mRNA 相对表达量。使用Excel 进行整理,并使用Sigma Plot 10.0 制图。数据以“平均值±标准误”表示,P<0.05 表示差异显著,P<0.01 表示差异极显著。
样品目的基因表达量采用2-ΔΔCt法计算:
ΔCt(样品)=Ct(样品目的基因)-Ct(样品内参基因)
ΔCt(标准样)=Ct(标准样目的基因)-Ct(标准样内参基因)
ΔΔCt=ΔCt(样品)-ΔCt(标准样)
目的基因表达量=2-ΔΔCt
2 结果与分析
2.1 电泳检测CXCL10基因以DNA 为模板的普通PCR 产物可见清晰的1 095 bp 条带(图1),扩增产物特异性较好,满足下一步实验需求。
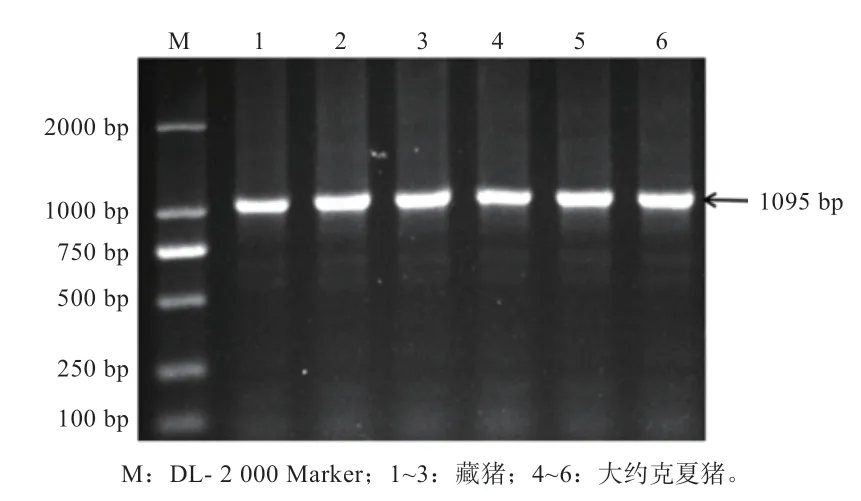
图1 CXCL10 基因普通PCR 产物
2.2 SNPs 筛选与功能预测 测序结果发现在CXCL10基因起始密码子上游3 kb 存在3 个SNP 位点,分别记为:T-832G、A-808G、T-694C。测序峰图如图2 所示。运用Excel 10.0 计算各个突变位点的基因频率和基因型频率,经卡方检验显示这3 个突变位点均符合哈迪-温伯格(Hardy-Weinberg)平衡定律,藏猪与大约克夏猪基因频率存在极显著差异。基因型频率和基因频率见表3。
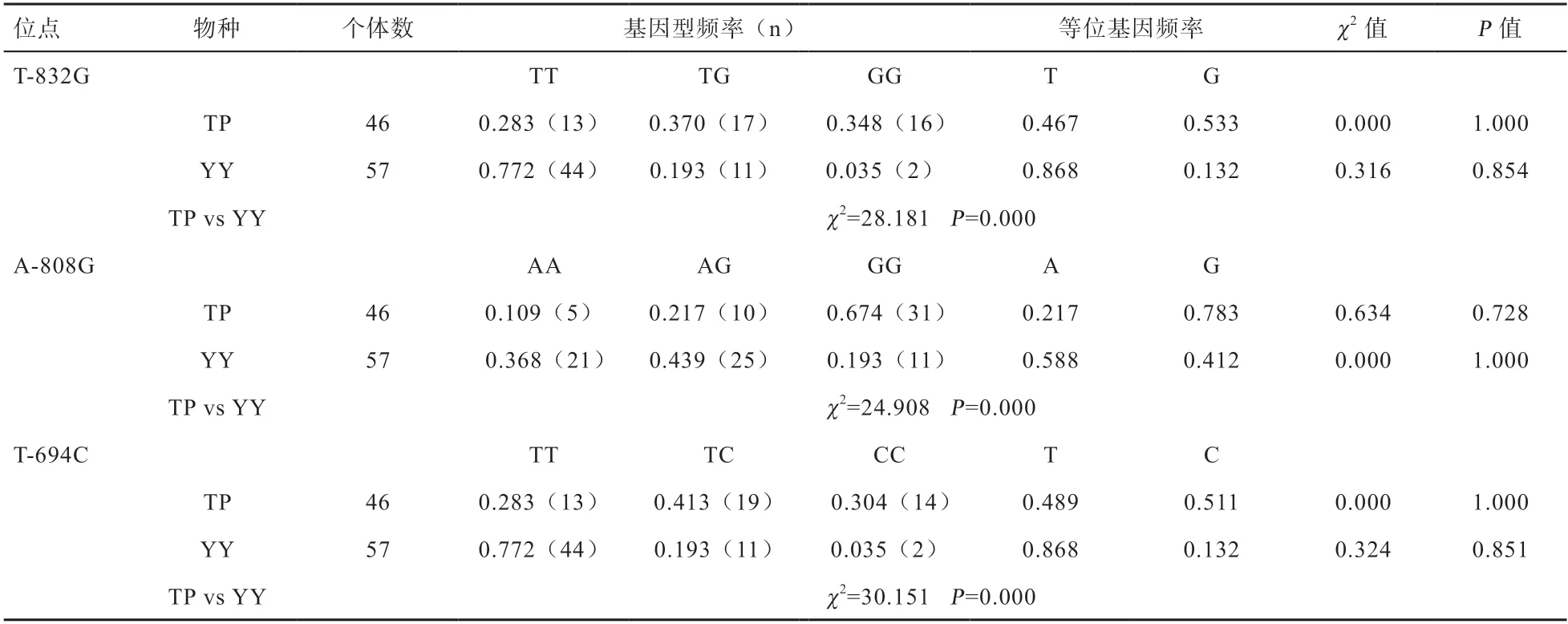
表3 CXCL10 基因多态性位点基因型频率和等位基因频率
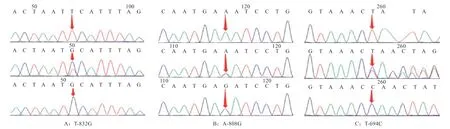
图2 CXCL10 基因突变位点测序峰图
通过转录因子预测,发现SNP 位点碱基突变前后CXCL10基因起始密码子上游3 kb 2 个SNP 位点(T-832G、A-808G)突变后转录因子结合位点消失,T-832G 处突变导致ARGFX、ARID3B 结合位点消失,A-808G 突变导致ARID3A 结合位点消失。
2.3 总RNA 提取 藏猪和大约克夏猪各组织RNA 提取结果见图3。琼脂糖凝胶电泳结果显示18S 和28S 条带清晰,无DNA 污染和降解现象。使用Nano Drop 2000检测RNA 质量,260/280 和260/230 值均在2.0 左右,可满足后续实验要求。
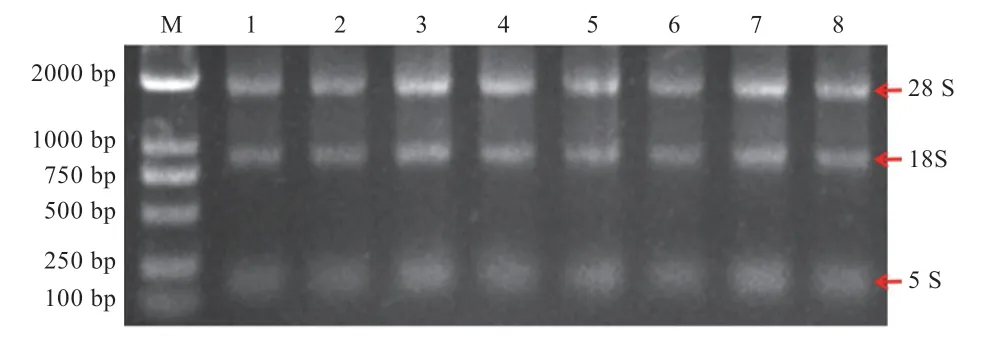
图3 RNA 提取结果
2.4CXCL10基因mRNA 表达 利用RT-qPCR 技术对CXCL10基因在藏猪和大约克夏猪背最长肌、腿肌、肝脏组织中的表达水平进行检测,结果如图4 所示,背最长肌、腿肌、肝脏这3 个组织中CXCL10基因表达量均为藏猪极显著高于大约克夏猪。
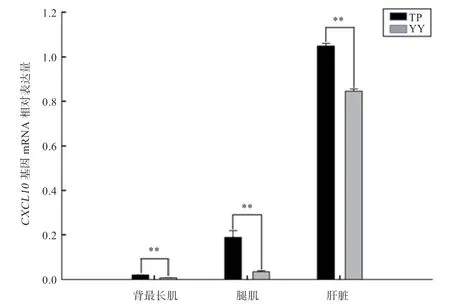
图4 CXCL10 基因在TP、YY 2 个品种猪背最长肌、腿肌和肝脏中mRNA 的相对表达量
3 讨 论
据Pan 等[13]研究,CXCL10基因是肌肉发育调节网络中的枢纽,而存在基因点突变可能会通过转录因子的改变影响基因功能和转录效率。本研究在CXCL10基因起始密码子上游3 kb 区域发现了3 个SNP 位点(T-832G、A-808G 和T-694C),且经卡方检验显示藏猪和大约克夏猪基因频率间存在极显著差异(P<0.01)。其中T-832G、A-808G 位点与地方猪种民猪中的发现一致,暗示该位点可能导致猪瘦肉率低、生长速度慢等[14]。经转录因子预测,T-832G 和A-808G 位点碱基突变前后ARID3A、ARID3B、ARGFX 3 个转录因子结合位点消失,其中结合位点ARGFX 是同源框超家族的中心成员,控制细胞分化和胚胎致密化,主要参与细胞周期的调控[15-16];ARID3A/B 属于ARID(富含AT 的相互作用域)转录因子的亚家族成员,同样参与细胞的增殖、分化和发育,且通过REKLES 域结合,共同促进细胞增殖并显著提高细胞存活水平[17-19]。由此推测,随着ARID3A、ARID3B、ARGFX 转录因子结合位点的消失,可能导致CXCL10基因功能转变,从而影响肌肉细胞的增殖分化。
根 据Guiraud[21]、Hathout[21]、Alayi 等[22]研究,CXCL10基因通过与G 蛋白偶联受体和整合素相互作用来发挥其生物活性,并在高浓度血糖、脂肪酸水平下增强表达,抗细胞增殖,被认为是肌萎缩蛋白表达的相关生物标志物。本研究发现CXCL10基因在藏猪背最长肌、腿肌和肝脏组织中的表达均极显著高于大约克夏猪,结合脂肪型猪种藏猪相对于国外猪种体型较小、肌肉生长速度较慢的特点,推测当动物机体内血糖浓度过高时,刺激CXCL10基因高表达,继而促进血糖转变为脂肪和蛋白质,反之,当CXCL10基因低表达时,抑制血糖向脂肪和蛋白质的转变,使之作用于机体的能量消耗。这与Michal 等[23]发现的营养不良群体存在肌纤维萎缩、脂肪填充增多现象呈一致性。诸多证据表明,CXCL10基因在肌肉生长发育中呈负调控作用,联合一代测序结果及RT-qPCR 结果发现,在藏猪和大约克夏猪中,CXCL10基因的SNP 差异情况与荧光定量结果的差异性趋于一致[24-25]。综上所述,推测CXCL10基因中所存在的T-832G、A-808G 和T-694C 这3 个突变位点可能是影响猪肌肉生长发育的关键功能位点。
4 结 论
综上所述,通过对藏猪和大约克夏猪CXCL10基因起始密码子上游3 kb DNA 序列多态性分析和背最长肌、腿肌、肝脏组织中CXCL10基因的mRNA 表达量检测发现,在2 个猪种中,该基因存在3 个SNP 位点(T-832G、A-808G 和T-694C),mRNA 水平表达量表现为背最长肌、腿肌中藏猪表达量极显著高于大约克夏猪,其差异性与SNP 差异性趋于一致,认为可能是这3 个SNP 位点的突变影响猪肌肉生长发育,推测CXCL10基因在肌肉组织生成中起到负向调控作用。研究结果为进一步探究猪肌肉生长发育机理提供材料基础。
