miRNA-133b激活剂对过敏性鼻炎-哮喘综合征小鼠气道炎症的影响
2022-11-16程慧雯袁文清魏水清唐华平
程慧雯 袁文清 魏水清 唐华平




[摘要] 目的 探讨microRNA-133b(miRNA-133b)激活剂对过敏性鼻炎-哮喘综合征(CARAS)小鼠气道炎症的影响。
方法 将BALB/c小鼠随机分为对照组、CARAS组和miRNA-133b组。后两组通过鼻腔滴注和鼠尾静脉注射卵清蛋白(OVA)致敏3周,并以20 g/L OVA连续5 d雾化激发,建立CARAS小鼠模型。miRNA-133b组在每次雾化激发前3 h分别鼻腔滴注和鼠尾静脉注射miRNA-133b激活剂,CARAS组则注射miRNA-133b阴性对照。采用实时荧光定量PCR(q-PCR)法检测各组小鼠鼻黏膜及肺组织中miRNA-133b的表达,酶联免疫吸附试验(ELISA)法检测血清中白細胞介素(IL)-17A和IL-1β的水平,蛋白印迹分析(Western blot)法检测肺组织中Toll样受体2(TLR2)、核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)和核因子-κB P65(NF-κB P65)蛋白表达。通过瑞氏染色计算支气管肺泡灌洗液(BALF)中白细胞总数及嗜酸性粒细胞比例,苏木精-伊红(HE)染色观察鼻黏膜及肺组织的病理学变化。
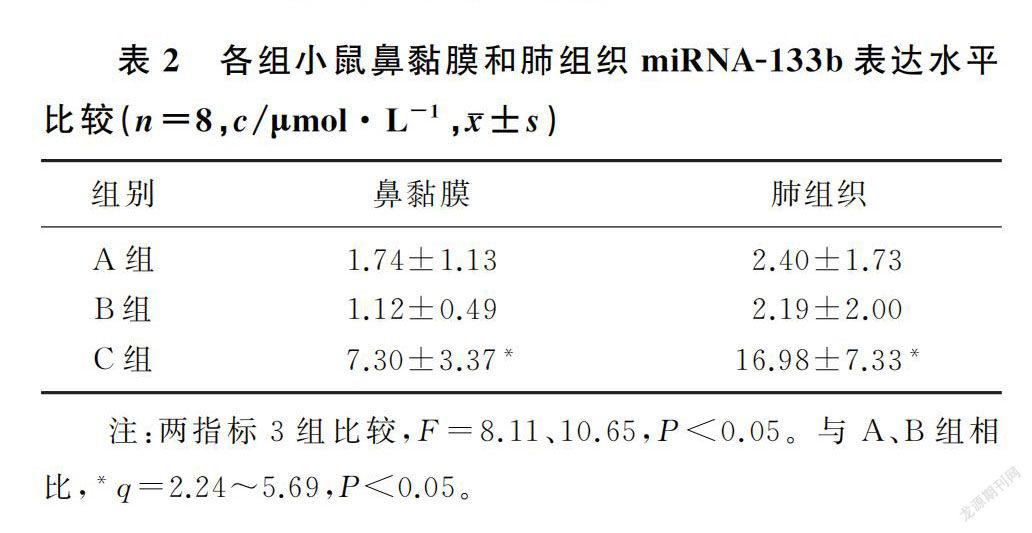
结果 miRNA-133b组小鼠鼻黏膜及肺组织中miRNA-133b的表达水平较对照组、CARAS组显著提高,差异具有统计学意义(F=8.11、10.65,P<0.05)。miRNA-133b组小鼠鼻黏膜及肺组织气道受损及炎性细胞浸润较CARAS组明显减轻。与CARAS组比较,miRNA-133b组小鼠擦鼻和打喷嚏的频率、BALF中白细胞总数和嗜酸性粒细胞比例、细胞因子(TLR2、NLRP3、NF-κB P65、IL-17A和IL-1β)的水平显著降低,差异均具有统计学意义(F=198.21~9 685.00,P<0.05)。
结论 miRNA-133b激活剂可能通过抑制TLR2-NLRP3信号通路的激活改善CARAS小鼠气道炎症。
[关键词] 鼻炎,过敏性;哮喘;微RNAs;Toll样受体2;NLR家族,热蛋白结构域包含蛋白3;小鼠
[中图分类号] R562.25;R765.213
[文献标志码] A
[文章编号] 2096-5532(2022)05-0733-06doi:10.11712/jms.2096-5532.2022.58.123
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20220628.1713.002.html;2022-06-30 09:16:09
EFFECT OF MICRORNA-133B ACTIVATOR ON AIRWAY INFLAMMATION IN MICE WITH COMBINED ALLERGIC RHINITIS AND ASTHMA SYNDROME
CHENG Huiwen, YUAN Wenqing, WEI Shuiqing, TANG Huaping
(Department of Respiratory Medicine, Qingdao Municipal Hospital Affiliated to Qingdao University, Qingdao 266071, China)
[ABSTRACT] Objective To investigate the effect of microRNA-133b (miRNA-133b) activator on airway inflammation in mice with combined allergic rhinitis and asthma syndrome (CARAS).
Methods BALB/c mice were randomly divided into control group, CARAS group, and miRNA-133b group. All mice except those in the control group were sensitized by nasal drip and tail vein injection of ovalbumin (OVA) for 3 weeks and were given aerosol challenge with 20 g/L OVA for 5 consecutive days to establish a mouse model of CARAS. The mice in the miRNA-133b group were given nasal drip and tail vein injection of miRNA-133b activator at 3 hours before each time of aerosol challenge, and those in the CARAS group were injected with miRNA-133b negative control. Quantitative real-time PCR was used to measure the expression of miRNA-133b in nasal mucosa and lung tissue; ELISA was used to measure the serum levels of interleukin-17A (IL-17A) and interleukin-1β (IL-1β); Western blot was used to measure the protein expression of Toll-like receptor 2 (TLR2), nucleotide-binding oligomerization domain-like receptor protein 3 (NLRP3), and nuclear factor-kappa B P65 (NF-κB P65) in lung tissue. Wright’s staining was used to calculate total leukocyte count and eosinophil ratio in bronchoalveolar lavage fluid (BALF), and HE staining was used to observe the pathological changes of nasal mucosa and lung tissue.
Results The miRNA-133b group had a significantly higher expression level of miRNA-133b in nasal mucosa and lung tissue than the control group and the CARAS group (F=8.11,10.65;P<0.05). Compared with the CARAS group, the miRNA-133b group had significant alleviation of airway damage and inflammatory cell infiltration in nasal mucosa and lung tissue. Compared with the CARAS group, the miRNA-133b group had significantly lower frequency of nasal wiping and sneezing, total leukocyte count and eosinophil ratio in BALF, and levels of cytokines (TLR2, NLRP3, NF-κB P65, IL-17A, and IL-1β) (F=198.21-9 685.00,P<0.05).
Conclusion This study shows that miRNA-133b activator can improve airway inflammation in CARAS mice by inhibiting activation of the TLR2-NLRP3 signaling pathway.
[KEY WORDS] rhinitis, allergic; asthma; microRNAs; Toll-like receptor 2; NLR family, pyrin domain-containing 3 protein; mice
过敏性鼻炎-哮喘综合征(CARAS)是近年来提出的一种全新的学术诊断,其医学定义为临床或亚临床同时出现的上呼吸道过敏(过敏性鼻炎)和下呼吸道过敏症状(哮喘)。尽管过敏性鼻炎和哮喘使用不同的炎症指标检验,但二者存在相似的炎症细胞(嗜酸性粒细胞)及炎症因子(核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)、核因子-κB P65(NF-κB P65)、白细胞介素(IL)-17A),共同参与炎症反应。虽然目前临床上有单纯针对哮喘或者过敏性鼻炎的缓解用药,但二者常存在多种缓解药联合应用效果不佳的情况,因此我们设想从基因表达层面研究CARAS可能的改善方法。microRNA-133b(miRNA-133b)是普遍存在于真核細胞中的单链RNA,可以调控免疫应答反应。先前的研究结果显示,miRNA-133b在急性发作期哮喘病儿血液中的表达量显著降低;miRNA-133b激活剂可以减轻小鼠过敏性鼻炎症状。上述研究表明miRNA-133b参与过敏性炎症反应的调控,但目前尚未有miRNA-133b参与CARAS发生、发展的相关研究。此外有研究表明,在哮喘和过敏性鼻炎中存在Toll样受体2(TLR2)-NLRP3反应轴的激活,Toll样受体 mRNA存在3′-UTR序列,而miRNA-133b存在能够与靶mRNA 3′-UTR区碱基互补配对的特殊序列,由此推测miRNA-133b可能是通过影响TLR2/NLRP3的激活改善CARAS。故本研究向CARAS小鼠体内注射miRNA-133b激动剂上调miRNA-133b表达,通过观察小鼠体内炎性因子水平及组织病理学变化,来进一步探讨miRNA-133b上调是否能减轻CARAS小鼠气道炎症。现将结果报告如下。
1 材料与方法
1.1 实验动物
清洁级雌性BALB/c小鼠24只,6~7周龄,体质量(22.0±2.5)g,购自北京维通利华实验动物技术有限公司(许可证号为SCXK(京)2016-0006),饲养于青岛大学动物房(许可证号SYXK(鲁)2020-0009)。将小鼠圈养在气温23~25 ℃、湿度(50±5)%、12 h明暗循环屏障环境中,用标准无卵清蛋白(OVA)饲料(D12450B)喂养,小鼠可自由饮水和摄食。本研究中所用小鼠按照青岛大学附属医院动物委员会批准的方案饲养。
1.2 动物分组及处理
适应性饲养1周后,将小鼠随机分为对照组(A组)、CARAS组(B组)和miRNA-133b组(C组),每组8只。本研究中小鼠CARAS模型制备借鉴了小鼠哮喘模型、鼻炎模型及CARAS模型的研究结果,并对OVA用量、浓度及预实验进行适当调整。CARAS组和miRNA-133b组小鼠分别在实验第1、8天腹腔注射含25 μg OVA和2 mg氢氧化铝凝胶佐剂的OVA致敏液0.2 mL;从第15天开始每天鼻腔滴注1 g/L OVA致敏液20 μL(每个鼻孔10 μL),连续滴注7 d;从第22天开始给予20 g/L OVA雾化激发,每天1次,每次持续30 min,连续5 d。对照组给予等量生理盐水进行腹腔注射、鼻腔滴注及雾化激发,周期同样为26 d。miRNA-133b组每次雾化激发前3 h鼠尾静脉注射25 μmol/L miRNA-133b agomir 200 μL,鼻腔滴注5 μmol/L miRNA-133b agomir 20 μL(每个鼻孔10 μL);对照组小鼠用等量生理盐水处理,CARAS组小鼠注射等量的 miRNA-133b NC,操作同miRNA-133b 组。其中miRNA-133b agomir为miRNA-133b激动剂,miRNA-133b NC为阴性对照,均购自广州市锐博生物科技有限公司。
1.3 标本采集
于末次OVA激发后24 h内,小鼠以50 g/L水合氯醛0.4 mL腹腔注射麻醉。摘除眼球取血,静置30 min后以2 000 r/min离心10 min,取血清保存于-80 ℃。采血后立即打开胸腔,在主支气管处结扎右肺后,分离取出右肺,置40 g/L多聚甲醛中固定。然后气管插管,用预冷的PBS灌洗左肺3次,每次0.4 mL,灌洗液回收率超过80%。
1.4 鼻黏膜及肺组织病理学检查
眼球取血后处死小鼠,收集其鼻黏膜及肺组织,用甲醛固定24 h,然后用乙醇脱水,将组织包埋在石蜡中。使用切片机将鼻黏膜及肺组织切成4 μm厚的切片,然后行苏木精-伊红(HE)染色,在光学显微镜下进行组织病理学观察,评估小鼠鼻黏膜及肺损伤程度。
1.5 支气管肺泡灌洗液(BALF)中白细胞及嗜酸性粒细胞计数BALF于4 ℃下以3 000 r/min离心10 min,收集细胞沉淀用1 mL的PBS重悬浮,取20 μL于细胞计数板上计数白细胞;另取0.1 mL涂片,瑞氏染色后,至少计数200个细胞,计算嗜酸性粒细胞比例(嗜酸性粒细胞数/白细胞总数)。
1.6 酶联免疫吸附试验(ELISA)法检测血清中IL-17A和IL-1β含量使用ELISA试剂盒(上海酶联生物科技有限公司),根据制造商的产品说明操作,在波长450 nm处读取吸光度值,测量小鼠血清中IL-17A和IL-1β含量。
1.7 实时荧光定量PCR(q-PCR)法检测鼻黏膜和肺组织中miRNA-133b含量取各组小鼠鼻黏膜和肺组织,根据制造商的产品说明使用TRIzol试剂(诺唯赞生物科技股份有限公司)分离出总RNA。使用cDNA反转录试剂盒(miRcute增强型miRNA cDNA第一链合成试剂盒(KR211),天根生化科技(北京)有限公司)逆转录2 μg RNA。采用miRcute增强型miRNA荧光定量检测试剂盒(SYBR Green(FP411),天根生化科技(北京)有限公司)和QuantStudio 3 System(上海巴玖实业有限公司)进行q-PCR。PCR所用的miRNA-133b引物如下:前引物(Forward)的序列为5′-CTGGTCAAACGGAACCAAGTC-3′,后引物(Reverse)序列为5′-ATATTGAGCTTTGCCAGC-CC-3′。反应条件为:95 ℃起始模板变性15 min;94 ℃变性20 s,循环40次;60 ℃退火、延伸34 s。通过GAPDH将目标mRNA水平标准化,并采用2方法计算数据。
1.8 蛋白印迹分析(Western blot)检测肺组织中TLR2、NLRP3和NF-κB P65蛋白的表達
用含有蛋白酶抑制剂和磷酸酶抑制剂混合物的RIPA裂解缓冲液分离肺组织总蛋白,采用BCA法测定蛋白质浓度。等量的样品蛋白通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,并转移到PVDF膜上。膜在室温下用50 g/L的脱脂牛奶封闭1 h,然后用1∶1 000稀释的抗β-actin抗体、1∶1 500稀释的抗NLRP3抗体、1∶1 000稀释的抗TLR2抗体和1∶1 000稀释的抗NF-κB P65抗体4 ℃过夜孵育。洗膜后用1∶5 000稀释的辣根过氧化物酶标记的抗兔IgG二抗在室温下孵育1 h。清洗3次后,滴加化学发光液进行显影,并使用Image J软件分析条带灰度值,结果以目的蛋白与β-actin的比值表示。
1.9 统计学分析
使用Graph Pad Prism软件进行统计学处理。所得计量资料结果以±s表示,多组比较采用单因素方差分析(One-Way ANOVA),进一步组间两两比较采用Turkey法。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠BALF中白细胞总数和嗜酸性粒细胞比例的比较
与对照组相比,CARAS组小鼠每10 min打喷嚏和鼻擦的次数显著增加,miRNA-133b组小鼠打喷嚏和鼻擦的次数无显著变化。3组小鼠BALF中白细胞总数、嗜酸性粒细胞比例比较差异有显著性(F=2 894.00、868.70,P<0.05)。与对照组相比,CARAS组小鼠BALF中白细胞总数和嗜酸性粒细胞比例均显著增加(q=99.76、53.69,P<0.05),而miRNA-133b组与CARAS组比较二者均显著降低(q=84.80、55.32,P<0.05)。见表1。
2.2 组织病理学观察
CARAS组小鼠鼻黏膜病理切片中有大量的炎性细胞(包括嗜酸性粒细胞和单核细胞)浸润,鼻黏膜组织结构紊乱,腺管管腔内充满黏液栓;肺组织病理切片可见支气管上皮细胞变性、黏膜皱襞改变及支气管平滑肌增生等表现。表明本次实验OVA诱导的CARAS小鼠模型制备成功。miRNA-133b组小鼠鼻黏膜结构与对照组相似,未见明显的黏液栓,仅有散在的炎性细胞浸润;肺组织病理改变也较CARAS组减轻。见图1。
2.3 miRNA-133b激活剂对miRNA-133b表达的影响
本文3组小鼠鼻黏膜及肺组织中miRNA-133b的表达水平比较差异有显著性(F=8.11、10.65,P<0.05)。miRNA-133b组小鼠鼻黏膜及肺组织中miRNA-133b的表达水平较对照组、CARAS组显著提高,差异具有统计学意义(q=2.24~5.69,P<0.05)。见表2。
2.4 各组小鼠血清IL-17A、IL-1β水平的比较
本文3组小鼠血清IL-17A、IL-1β水平比较差异均具有显著性(F=1 534.00、277.30,P<0.05)。CARAS组小鼠血清IL-17A、IL-1β水平显著高于对照组和miRNA-133b组(q=4.88~64.98,P<0.05)。见表3。
2.5 各组小鼠肺组织中TLR2、NLRP3以及NF-κB P65蛋白表达的比较
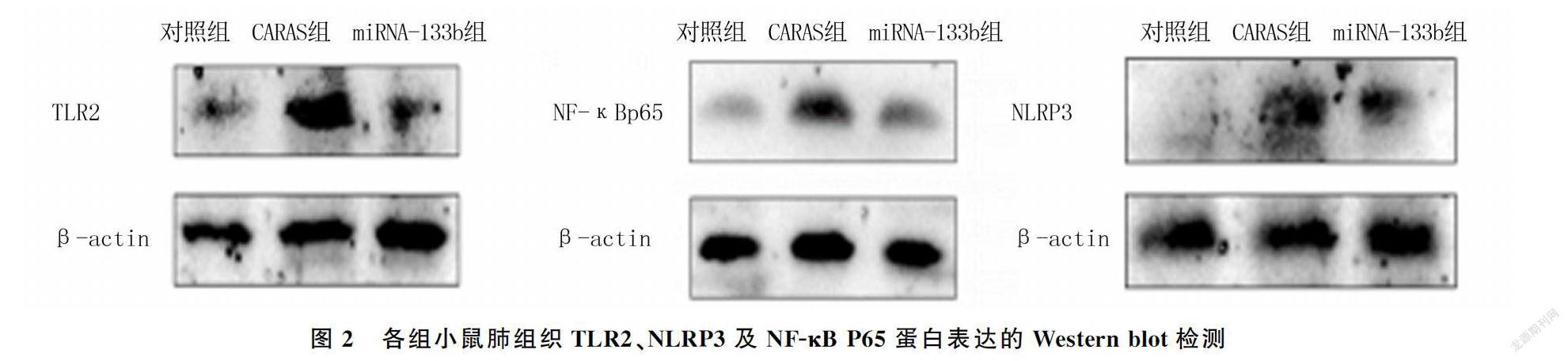
Western blot检测结果显示,3组小鼠肺组织中TLR2、NLRP3及NF-κB P65表达比较差异有显著性(F=198.20~9 685.00,P<0.05)。CARAS组小鼠肺组织中TLR2、NLRP3及NF-κB P65表达水平显著高于对照组和miRNA-133b组(q=4.35~113.70,P<0.05)。见表4、图2。
3 讨 论
CARAS作为医学界全新的学术诊断名词,阐释了过敏性鼻炎和哮喘之间的紧密联系。过敏性鼻炎和哮喘的发生、发展相辅相成,在病因、免疫学和发病机制等方面均相似。二者病情反复,最终60%的病人可发展成CARAS,引发后期更为复杂的治疗。虽然目前针对单纯鼻炎或单纯哮喘疾病有相应的缓解炎症用药,但尚不能从根本上逆转CARAS的进展。因此,近年医学界对CARAS的关注越来越多,为更好地治疗CARAS,CARAS的实验模型不断被建立与完善,以便人们更好地理解该疾病的发病机制及进行新的潜在治疗药物的药理学研究。CARAS小鼠模型建立成功与否主要通过病理组织形态学评价。本实验研究结果显示,与对照组小鼠相比较,CARAS组小鼠的鼻黏膜及肺组织炎性改变显著,表明OVA诱导的CARAS小鼠模型制备成功。
有研究表明,可通过miRNAs预测机体的过敏状态,从源头上抑制炎症反应,miRNA-133b便是其中之一。哮喘病人的临床研究及过敏性鼻炎小鼠的实验研究均表明,miRNA-133b参与了过敏性炎症的发生发展。
本研究結果表明,miRNA-133b激活剂影响CARAS小鼠气道炎症的发展。miRNA-133b组小鼠鼻黏膜及肺组织中miRNA-133b表达水平较CARAS组显著升高,且miRNA-133b组小鼠过敏性症状、组织炎症细胞(白细胞、嗜酸性粒细胞)浸润和炎性因子(IL-17A和IL-1β)表达水平较CARAS组显著改善,表明miRNA-133b表达水平上调可改善CARAS小鼠气道炎症,这可能是治疗CARAS的一种潜在方法。同时我们也注意到,CARAS组小鼠鼻黏膜及肺组织中miRNA-133b表达水平较对照组显著降低,这与前述研究中哮喘病儿体内miRNA-133b表达水平下调的结果相一致。上述结果提示miRNA-133b可作为预测CARAS的指标。
已有研究表明,miRNA-133b的特殊序列通过与靶mRNA的3′-UTR区碱基互补配对,抑制后者表达,影响后续炎症激活。有研究发现,TLR2 mRNA中存在3′-UTR序列,且在过敏性气道炎症中存在TLR2-NLRP3轴,后者在炎症反应中起重要作用。因此我们推测,miRNA-133b可能通过影响TLR2-NLRP3轴相关反应改善CARAS小鼠气道炎症。为进一步了解miRNA-133b激动剂改善CARAS的可能机制,本实验检测了各组小鼠肺组织中TLR2、NLRP3蛋白的表达水平。因为NF-κB P65是TLR2-NLRP3轴激活过程中的关键核转录因子,也是TLR2-NLRP3信号通路激活的标志性因子,故本实验也检测了NF-κB P65蛋白的表达水平。本文的研究结果显示,CARAS组小鼠TLR2、NLRP3、NF-κB P65表达水平较对照组显著升高,推测CARAS小鼠体内TLR2-NLRP3信号通路被激活;而miRNA-133b组小鼠TLR2、NLRP3、NF-κB P65表达水平较CARAS组显著降低,与对照组的水平接近,表明miRNA-133b水平上调影响TLR2-NLRP3轴中信号因子表达。由此我们推测,miRNA-133b激活剂可能通过下调TLR2-NLRP3轴相关信号因子的表达水平以改善CARAS气道炎症。但miRNA-133b作用于TLR2-NLRP3信号通路的相关分子机制目前仍未明确,有待于今后进一步研究。
[参考文献]
[1]PAWANKAR R. Allergic rhinitis and asthma: are they manifestations of one syndrome[J]? Clinical & Experimental Allergy, 2006,36(1):1-4.
[2]TARAMARCAZ P, GIBSON P G. The effectiveness of intranasal corticosteroids in combined allergic rhinitis and asthma syndrome[J]. Clinical & Experimental Allergy, 2004,34(12):1883-1889.
[3]李明华,刘颖慧. 过敏性鼻炎-哮喘综合征研究进展[J]. 华中医学杂志, 2006(4):276-277,285.
[4]XIAO L F, JIANG L, HU Q, et al. microRNA-133b ameliorates allergic inflammation and symptom in murine model of allergic rhinitis by targeting Nlrp3[J]. Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2017,42(3):901-912.
[5]XIAO L F, JIANG L, HU Q, et al. miR-302e attenuates allergic inflammation in vitro model by targeting RelA[J]. Bioscience Reports, 2018,38(3):BSR20180025.
[6]李勇,高春彪,盛伟武,等. 儿童支气管哮喘患者血浆中miRNA-125b及miRNA-133b的表达及临床意义[J]. 现代检验医学杂志, 2017,32(3):59-62.
[7]蔡为为,于昌平,赵睿瑄,等. 大黄素可通过抑制NLRP3炎性小体活化减轻哮喘小鼠的炎症反应[J]. 解剖科学进展, 2020,26(2):174-176,181.
[8]WU H M, ZHAO C C, XIE Q M, et al. TLR2-melatonin feedback loop regulates the activation of NLRP3 inflammasome in murine allergic airway inflammation[J]. Frontiers in Immunology, 2020,11:172.
[9]CHENG Y Z, LI S, WANG M Z, et al. Peroxisome proliferator activated receptor gamma (PPARγ) agonist rosiglitazone ameliorate airway inflammation by inhibiting toll-like receptor 2 (TLR2)/nod-like receptor with pyrin domain containing 3 (NLRP3) inflammatory corpuscle activation in asthmatic mice[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2018,24:9045-9053.
[10]CASARO M, SOUZA V R, OLIVEIRA F A, et al. OVA-induced allergic airway inflammation mouse model[J]. Methods in Molecular Biology, 2019,1916:297-301.
[11]LIANG C Q, YANG Z X, ZOU Q Y, et al. Construction of an irreversible allergic rhinitis-induced olfactory loss mouse model[J]. Biochemical and Biophysical Research Communications, 2019,513(3):635-641.
[12]葉茂宇, 谭国林. 变应性鼻炎小鼠造模方法研究进展[J]. 中华耳鼻咽喉头颈外科杂志, 2019,54(9):712-716.
[13]LI H T, ZHANG T T, CHEN Z G, et al. Intranasal administration of CpG oligodeoxynucleotides reduces lower airway inflammation in a murine model of combined allergic rhinitis and asthma syndrome[J]. International Immunopharmacology, 2015,28(1):390-398.
[14]史锁芳,周奎龙. 过敏性鼻炎-哮喘综合征大鼠模型的建立与评价[J]. 江西中医药大学学报, 2014,26(3):71-74.
[15]KLEINJAN A, VAN NIMWEGEN M, LEMAN K, et al. Topical treatment targeting sphingosine-1-phosphate and sphingosine lyase abrogates experimental allergic rhinitis in a murine model[J]. Allergy, 2013,68(2):204-212.
[16]JULIUSSON S, HOLMBERG K, KARLSSON G, et al. Mast cells and mediators in the nasal mucosa after allergen challenge. Effects of four weeks’ treatment with topical glucocorticoid[J]. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology, 1993,23(7):591-599.
[17]PAIVA FERREIRA L K D, PAIVA FERREIRA L A M, MONTEIRO T M, et al. Combined allergic rhinitis and asthma syndrome (CARAS)[J]. International Immunopharmaco-logy, 2019,74:105718.
[18]WANG X, LIU C, WU L C, et al. Potent ameliorating effect of Hypoxia-inducible factor 1α (HIF-1α) antagonist YC-1 on combined allergic rhinitis and asthma syndrome (CARAS) in Rats[J]. European Journal of Pharmacology, 2016,788:343-350.
[19]PANGANIBAN R P, WANG Y L, HOWRYLAK J, et al. Circulating microRNAs as biomarkers in patients with allergic rhinitis and asthma[J]. The Journal of Allergy and Clinical Immunology, 2016,137(5):1423-1432.
[20]TADA H, AIBA S, SHIBATA K I, et al. Synergistic effect of Nod1 and Nod2 agonists with toll-like receptor agonists on human dendritic cells to generate interleukin-12 and T helper type 1 cells[J]. Infection and Immunity, 2005,73(12):7967-7976.
[21]JEONG J W, LEE H H, HAN M H, et al. Anti-inflammatory effects of genistein via suppression of the toll-like receptor 4-mediated signaling pathway in lipopolysaccharide-stimulated BV2 microglia[J]. Chemico-Biological Interactions, 2014,212:30-39.
[22]MAY M J, GHOSH S. Signal transduction through NF-kappa B[J]. Immunology Today, 1998,19(2):80-88.
[23]乔羽. TLR诱导NF-κB活化上调NLRP3表达的机制研究[D]. 济南:山东大学, 2012.
(本文编辑 马伟平)
