lncRNA NEAT1靶向miR-497-5p对胰腺癌细胞增殖、凋亡及上皮-间质转化的影响
2022-11-16于文昊王海久青海大学附属医院肝胆胰外科西宁810000
于文昊 王海久(青海大学附属医院肝胆胰外科,西宁 810000)
胰腺癌是临床常见消化系统恶性肿瘤,近30年来其发病率在全球范围内呈上升趋势,且病死率较高,其早期症状不明显,缺乏特异性筛查指标,80%患者确诊时多已是中晚期,仅5%左右患者进行手术治疗,但五年生存率不足5%[1-3]。因此,探寻胰腺癌新型生物治疗靶标已成为临床研究热点。长链非 编 码RNA(long non-coding RNAs,lncRNAs)是一种反义RNA分子,不具有蛋白编码能力,能与靶基因非编码区特异性结合,调节基因转录和表达而发挥促癌或抑癌作用[4]。核富集转录体1(nuclear enriched abundant transcript 1,NEAT1)是lncRNAs家族成员之一,研究显示,其对多种恶性肿瘤如甲状腺癌、肝癌、舌鳞状细胞癌等细胞生物学行为均具有调控作用[5-7]。miR-497-5p属于miRNAs家族重要一员[8],姜达伟等[9]研究显示,过表达miR-497-5p能够诱导胰腺癌细胞周期阻滞进而抑制细胞增殖。XIA等[10]研究显示,NEAT1靶向下调miR-497-5p表达促进胃癌细胞增殖并抑制凋亡。目前,有关NEAT1能否调控miR-497-5p影响胰腺癌细胞生物学行为的研究鲜有报道,因此本研究探讨NEAT1与miR-497-5p对胰腺癌细胞增殖、凋亡等的影响,以期为临床寻找胰腺癌新型生物治疗靶点提供一定参考。
1 材料与方法
1.1 材料
1.1.1 细胞 人胰腺癌PANC-1细胞(bio-51676)购自北京百欧博伟生物技术有限公司。
1.1.2 试剂与仪器DMEM培养基(3-2001)、蛋白提取试剂盒(BC3711-50T)、LipofectamineTM3000转染试剂盒(EF010-E)购自美国艾美捷(武汉)科技有限公司;CCK-8试剂盒(CA1210-500T)、Annexin V-FITC/PI凋亡检测试剂盒(WK304)、反转录试剂盒(RP1105-100T)、AceQqPCR SYBR Green Mix(ALH185)、Trizol Reagent核酸分离试剂(YT526)、双荧光素酶报告基因检测试剂盒(KFS303-HUV)购自北京百奥莱博科技有限公司;靶向NEAT1的特异性siRNA(NEAT1-siRNA)及无关序列siRNA-NC由上海普迈生物科技有限公司设计合成;miR-497-5p-inhibitor及相应阴性对照inhibitor-NC由百奥迈科生物技术有限公司合成;兔抗人细胞增殖相关核抗原(MKI67 Affinity Purified Polyclonal Ab,Ki-67)(100130-MM21)、B淋巴 细 胞 瘤 基 因-2(B-cell lymphoma-2,Bcl-2)(FTB3598S)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)(ATA25287)、E-钙黏附蛋白(E-cadherin)抗体(货号ACRO)、间质标志物波形蛋白(Vimentin)(货号K26866-PGZ)、N-钙黏附蛋白(N-cadherin)抗体(货号M00403-FCZ)、β-actin(ABP57456)多克隆抗体、山羊抗兔HRP(SE12-0.1)二抗均购自武汉益普生物科技有限公司;二氧化碳细胞培养箱(型号:BBD6220)购自美国Thermo Fisher Scientific公司;酶标仪(型号:ELx800)、荧光定量PCR仪(型号:C1000)购自美国Bio-Rad公司;流式细胞仪(型号:CytoFLEX)购自美国Beckman公司。
1.2 方法
1.2.1 细胞培养 取PANC-1细胞解冻,复苏,置于含10%灭活胎牛血清(FBS)+DMEM培养基,37℃、5%CO2培养箱中培养,每2~3 d换液,无菌操作,细胞已长满(达80%~90%)时进行传代培养。
1.2.2 细胞瞬时转染及分组处理 取1.2.1对数生长期的PANC-1细胞接种于24孔板(2.5×104个/孔),培养24 h后,更换无FBS的培养液,对细胞进行转染并分组:①空白对照组(NG组):细胞不做特殊处理;②阴性转染组(siRNA-NC组):采用LipofectamineTM3000将NEAT1-siRNA转染至PANC-1细胞中;③沉默NEAT1组(NEAT1-siRNA组):采用LipofectamineTM3000将NEAT1-siRNA转染至PANC-1细胞中;④共转染组(NEAT1-siRNA+miR-497-5p-inhibitor组):采用LipofectamineTM3000将NEAT1-siRNA和miR-497-5p-inhibitor序列共转染。用含10%灭活FBS+DMEM培养液继续培养细胞48 h。严格按照转染试剂盒说明书操作,收集各组细胞用于后续实验。
1.2.3 实时定量聚合酶链反应检测NEAT1、miR-497-5p水平TRIzol法提取1.2.2各组培养48 h的PANC-1细胞总RNA并测定浓度。以RNA为模板、PrimeScript RT reagent试剂盒说明书为操作标准进行逆转录合成cDNA。体系20µl:ULtraSYBR mixture(10.0µl)、模板cDNA(2.0µl)、上下游引物(各2.0µl)、去离子纯化水(4.0µl);93℃30 s、93℃5 s、65℃30 s,40个循环。引物序列详见表1,由苏州泓迅生物科技股份有限公司设计并合成。采用2-ΔΔCt方法计算NEAT1、miR-497-5p水平相对表达量。

表1 引物序列Tab.1 Primer sequences
1.2.4 CCK-8法检测各组PANC-1细胞增殖能力取1.2.2各组培养48 h后的PANC-1细胞,消化,接种至24孔板(2.5×104个/孔),继续培养48 h,严格按照CCK-8试剂盒说明书加入CCK-8试剂,继续培养2 h,检测490 nm处各孔细胞光密度(optical density,OD)值,计算细胞增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%。实验重复3次。
1.2.5 流式细胞术检测各组PANC-1细胞凋亡率取1.2.2各组培养48 h后的PANC-1细胞接种于24孔板中(2.5×105个/孔),按照Annexin-V FITC/PI试剂盒说明书处理细胞;加5µl碘化丙啶(PI)+5µl Annexin V-FITC混匀,染色,稀释,流式细胞仪检测细胞凋亡率。实验重复3次。
1.2.6 Western blot检测增殖、凋亡及上皮-间质转化(epithelial-mesenchymal transition,EMT)标志蛋白表达情况 以RIPA液裂解细胞,提取总蛋白并检测浓度及纯度,行10%SDS-PAGE电泳、转膜,以5%脱脂牛奶封闭,加入一抗Ki-67、Bcl-2、Bax、E-cadherin、N-cadherin、Vimentin及内参β-actin,稀释比均为1∶500,4℃过夜,清洗,加入HRP标记的山羊抗兔二抗(1∶1 000)孵育1 h。分析各蛋白相对表达量。
1.2.7 双荧光素酶报告基因实验 数据库(Starbase)显示NEAT1与miR-497-5p核苷酸存在结合位点,根据miR-497-5p与NEAT1-3'UTR结合位点的预测结果,采用PCR技术扩增NEAT1-3'UTR序列中包含与miR-497-5p存在结合位点的片段,并插入到荧光素酶pGL4载体中,构建NEAT1野生型质粒(NEAT1-WT),并利用基因突变技术将个别结合位点序列突变,构建突变型质粒(NEAT1-MT)。使用LipofectamineTM3000将NEAT1-WT、NEAT1-MT分别与miR-497-5p-inhibitor-NC、miR-497-5p-inhibitor共转染于PANC-1细胞,分别为miR-497-5p-inhibitor-NC-NEAT1-WT组、miR-497-5p-inhibitor-NEAT1-WT组、miR-497-5p-inhibitor-NC-NEAT1-MT组、miR-497-5p-inhibitor-NC-NEAT1-MT组,转染48 h后,用PBS洗涤细胞,加入RIPA裂解液(250µl)于室温摇床中摇晃15 min裂解细胞,收集裂解液,加入50µl荧光素酶检测试剂Ⅱ,以自动荧光素酶检测仪测定荧光强度A,之后加入Stop&Glo,测定荧光强度B,以A/B表示荧光素酶相对活性。
1.3 统计学方法 采用SPSS22.0分析数据,计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组PANC-1细胞NEAT1、miR-497-5p水平比较 与NG组、siRNA-NC组比较,NEAT1-siRNA组PANC-1细胞NEAT1水平显著降低(P<0.05),miR-497-5p水平显著升高(P<0.05);与NEAT1-siRNA组比较,NEAT1-siRNA+miR-497-5p-inhibitor组PANC-1细胞NEAT1水平差异无统计学意义(P>0.05),miR-497-5p水平显著降低(P<0.05,表2)。
表2 各 组PANC-1细 胞NEAT1、miR-497-5p水 平 比较(±s,n=6)Tab.2 Comparison of NEAT1 and miR-497-5p levels in PANC-1 cells of each group(±s,n=6)
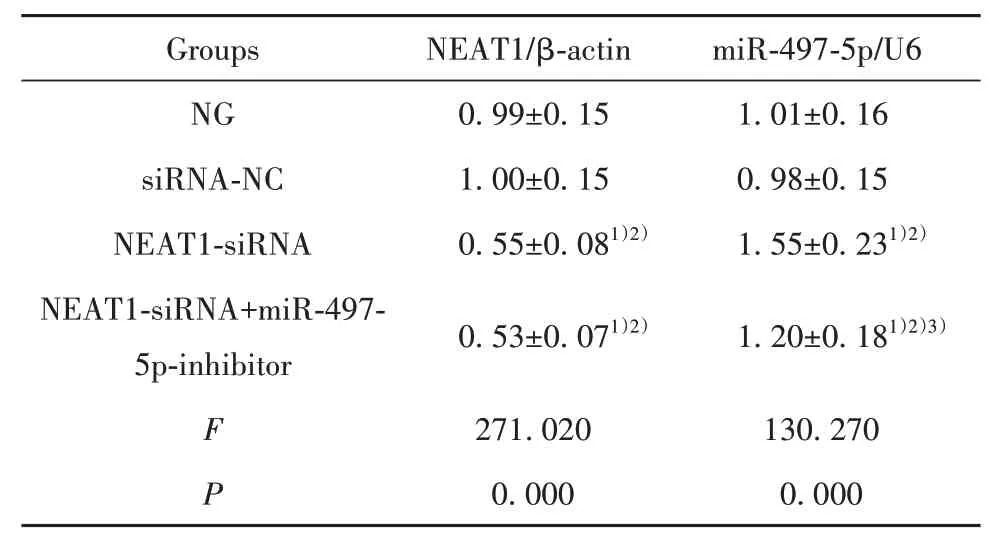
表2 各 组PANC-1细 胞NEAT1、miR-497-5p水 平 比较(±s,n=6)Tab.2 Comparison of NEAT1 and miR-497-5p levels in PANC-1 cells of each group(±s,n=6)
Note:Compared with NG group,1)P<0.05;compared with siRNA-NC group,2)P<0.05;compared with NEAT1-siRNA group,3)P<0.05.
Groups NG siRNA-NC NEAT1-siRNA NEAT1-siRNA+miR-497-5p-inhibitor F P NEAT1/β-actin 0.99±0.15 1.00±0.15 0.55±0.081)2)0.53±0.071)2)271.020 0.000 miR-497-5p/U6 1.01±0.16 0.98±0.15 1.55±0.231)2)1.20±0.181)2)3)130.270 0.000
2.2 各组PANC-1细胞增殖情况比较 与NG组、siRNA-NC组比较,NEAT1-siRNA组PANC-1细胞增殖抑制率显著升高(P<0.05);与NEAT1-siRNA组比较,NEAT1-siRNA+miR-497-5p-inhibitor组PANC-1细胞增殖抑制率显著降低(P<0.05,表3)。
表3 各组PANC-1细胞增殖情况比较(±s,n=6)Tab.3 Comparison of PANC-1 cell proliferation in each group(±s,n=6)
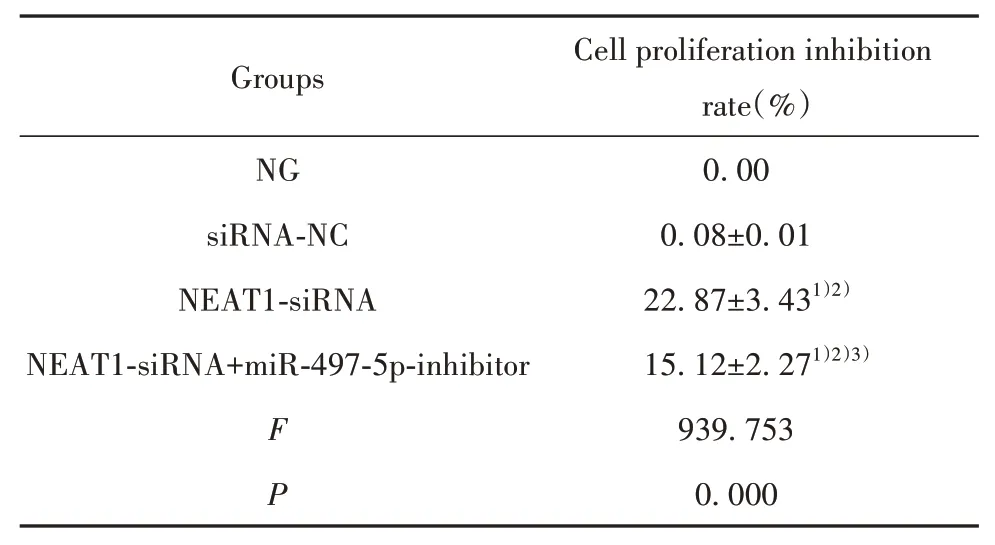
表3 各组PANC-1细胞增殖情况比较(±s,n=6)Tab.3 Comparison of PANC-1 cell proliferation in each group(±s,n=6)
Note:Compared with NG group,1)P<0.05;compared with siRNA-NC group,2)P<0.05;compared with NEAT1-siRNA group,3)P<0.05.
Groups NG siRNA-NC NEAT1-siRNA NEAT1-siRNA+miR-497-5p-inhibitor F P Cell proliferation inhibition rate(%)0.00 0.08±0.01 22.87±3.431)2)15.12±2.271)2)3)939.753 0.000
2.3 各组PANC-1细胞凋亡情况比较 与NG组、siRNA-NC组比较,NEAT1-siRNA组PANC-1细胞凋亡率显著升高(P<0.05);与NEAT1-siRNA组比较,NEAT1-siRNA+miR-497-5p-inhibitor组PANC-1细 胞凋亡率显著降低(P<0.05,图1、表4)。
表4 各组PANC-1细胞凋亡情况比较(±s,n=6)Tab.4 Comparison of PANC-1 cell apoptosis in each group(±s,n=6)
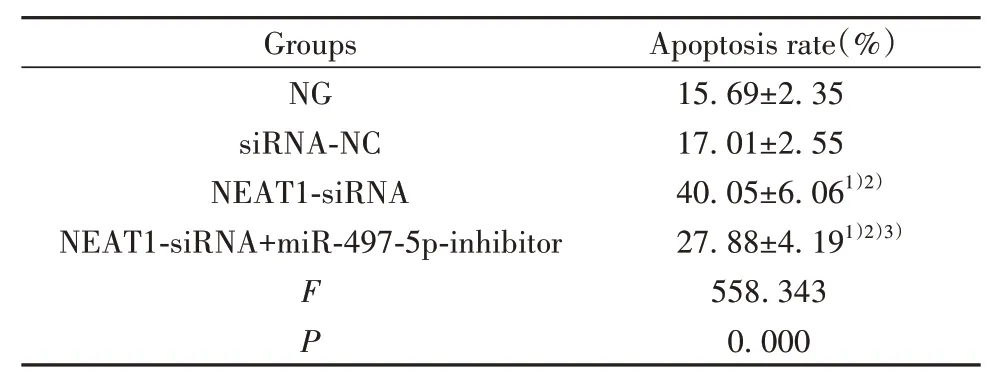
表4 各组PANC-1细胞凋亡情况比较(±s,n=6)Tab.4 Comparison of PANC-1 cell apoptosis in each group(±s,n=6)
Note:Compared with NG group,1)P<0.05;compared with siRNA-NC group,2)P<0.05;compared with NEAT1-siRNA group,3)P<0.05.
Groups NG siRNA-NC NEAT1-siRNA NEAT1-siRNA+miR-497-5p-inhibitor FP Apoptosis rate(%)15.69±2.35 17.01±2.55 40.05±6.061)2)27.88±4.191)2)3)558.343 0.000
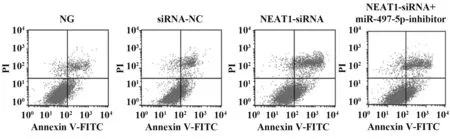
图1 各组PANC-1细胞凋亡情况比较Fig.1 Comparison of PANC-1 cell apoptosis in each group
2.4 各组PANC-1细胞增殖、凋亡及EMT相关蛋白表达比较 与NG组、siRNA-NC组比较,NEAT1-siRNA组PANC-1细胞Ki-67、Bcl-2、N-cadherin、Vimentin蛋白表达显著降低(P<0.05),Bax、E-cadherin蛋白表达显著升高(P<0.05);与NEAT1-siRNA组比较,NEAT1-siRNA+miR-497-5p-inhibitor组PANC-1细胞Ki-67、Bcl-2、N-cadherin、Vimentin蛋白表达显著升高(P<0.05),Bax、E-cadherin蛋白表达显著降低(P<0.05,图2、表5)。
表5 各组PANC-1细胞增殖、凋亡及EMT相关蛋白表达比较(±s,n=6)Tab.5 Comparison of proliferation,apoptosis and EMT related protein expressions of PANC-1 cells in each group(±s,n=6)
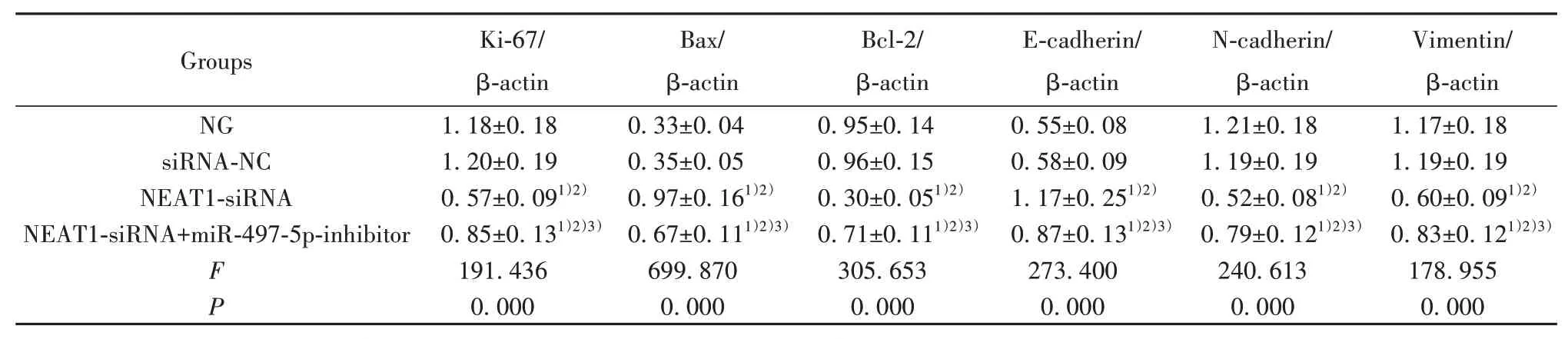
表5 各组PANC-1细胞增殖、凋亡及EMT相关蛋白表达比较(±s,n=6)Tab.5 Comparison of proliferation,apoptosis and EMT related protein expressions of PANC-1 cells in each group(±s,n=6)
Note:Compared with NG group,1)P<0.05;compared with siRNA-NC group,2)P<0.05;compared with NEAT1-siRNA group,3)P<0.05.
Groups NG siRNA-NC NEAT1-siRNA NEAT1-siRNA+miR-497-5p-inhibitor FP Ki-67/β-actin 1.18±0.18 1.20±0.19 0.57±0.091)2)0.85±0.131)2)3)191.436 0.000 Bax/β-actin 0.33±0.04 0.35±0.05 0.97±0.161)2)0.67±0.111)2)3)699.870 0.000 Bcl-2/β-actin 0.95±0.14 0.96±0.15 0.30±0.051)2)0.71±0.111)2)3)305.653 0.000 E-cadherin/β-actin 0.55±0.08 0.58±0.09 1.17±0.251)2)0.87±0.131)2)3)273.400 0.000 N-cadherin/β-actin 1.21±0.18 1.19±0.19 0.52±0.081)2)0.79±0.121)2)3)240.613 0.000 Vimentin/β-actin 1.17±0.18 1.19±0.19 0.60±0.091)2)0.83±0.121)2)3)178.955 0.000
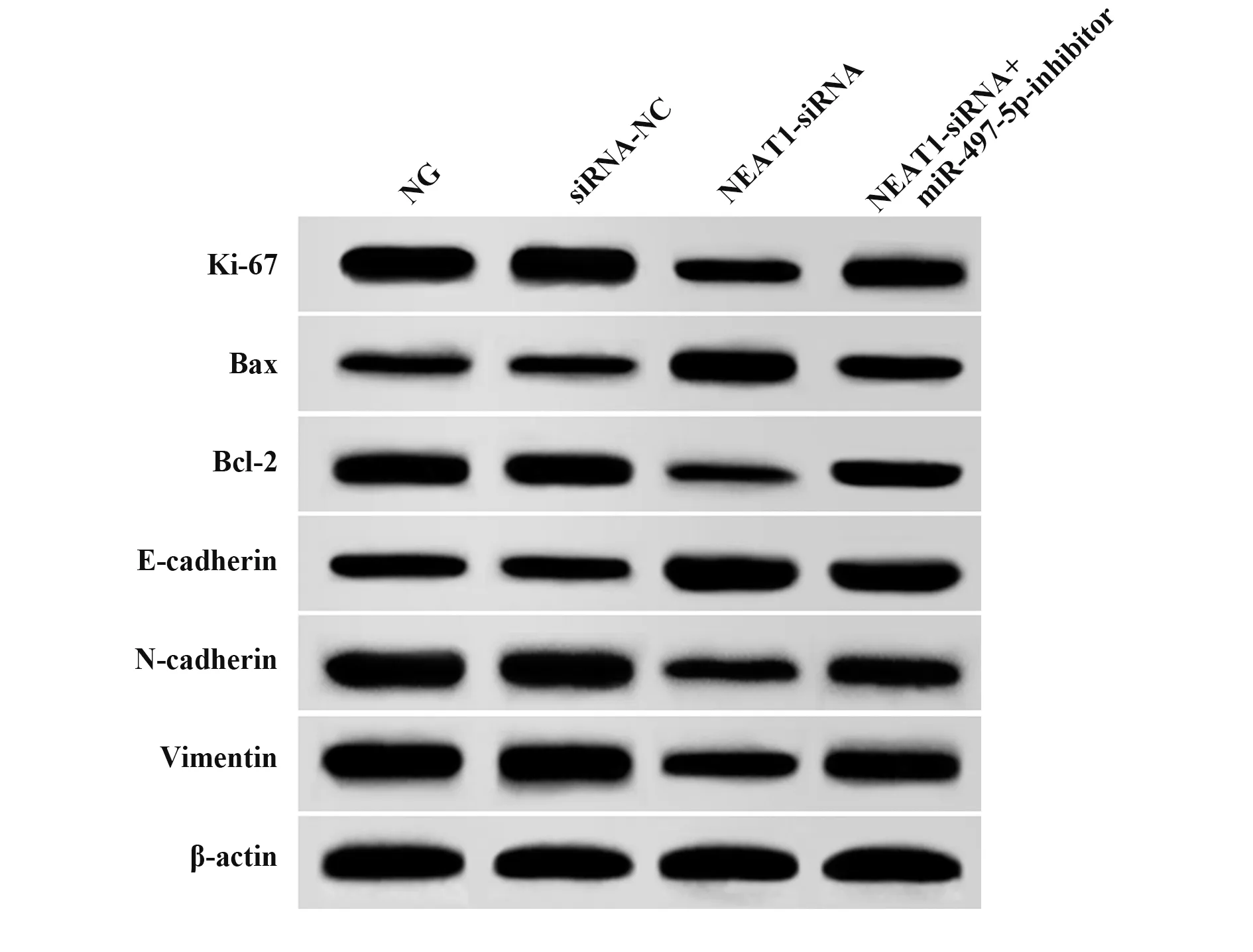
图2 各组PANC-1细胞增殖、凋亡及EMT相关蛋白表达比较Fig.2 Comparison of proliferation,apoptosis and EMT related protein expression of PANC-1 cells in each group
2.5 双荧光素酶报告基因检测NEAT1对miR-497-5p的转录调控Starbase(http://starbase.sysu.edu.cn/degradomeRNA.php?source=mRNA)预测结果显示,NEAT1与miR-497-5p基因序列存在结合位点,见图3。荧光素酶报告基因实验结果显示,转染NEAT1 WT的实验中,miR-497-5p-inhibitor-NEAT1-WT组荧光素酶活性(1.37±0.21)显著高于miR-497-5p-inhibitor-NC-NEAT1-WT组(1.03±0.15),(P<0.05,图4)。
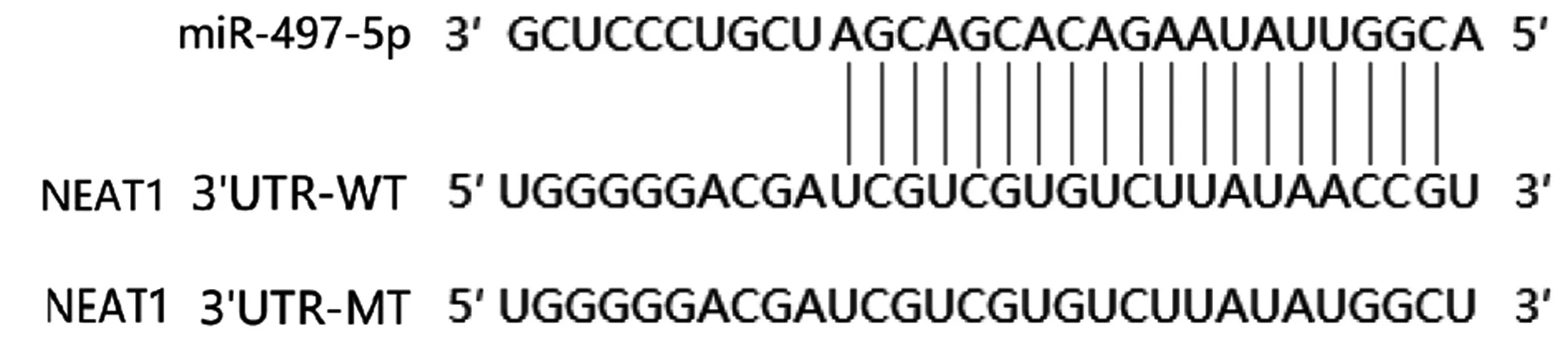
图3 NEAT1与miR-497-5p基因靶向关系Fig.3 Targeting relationship between NEAT1 and miR-497-5p gene
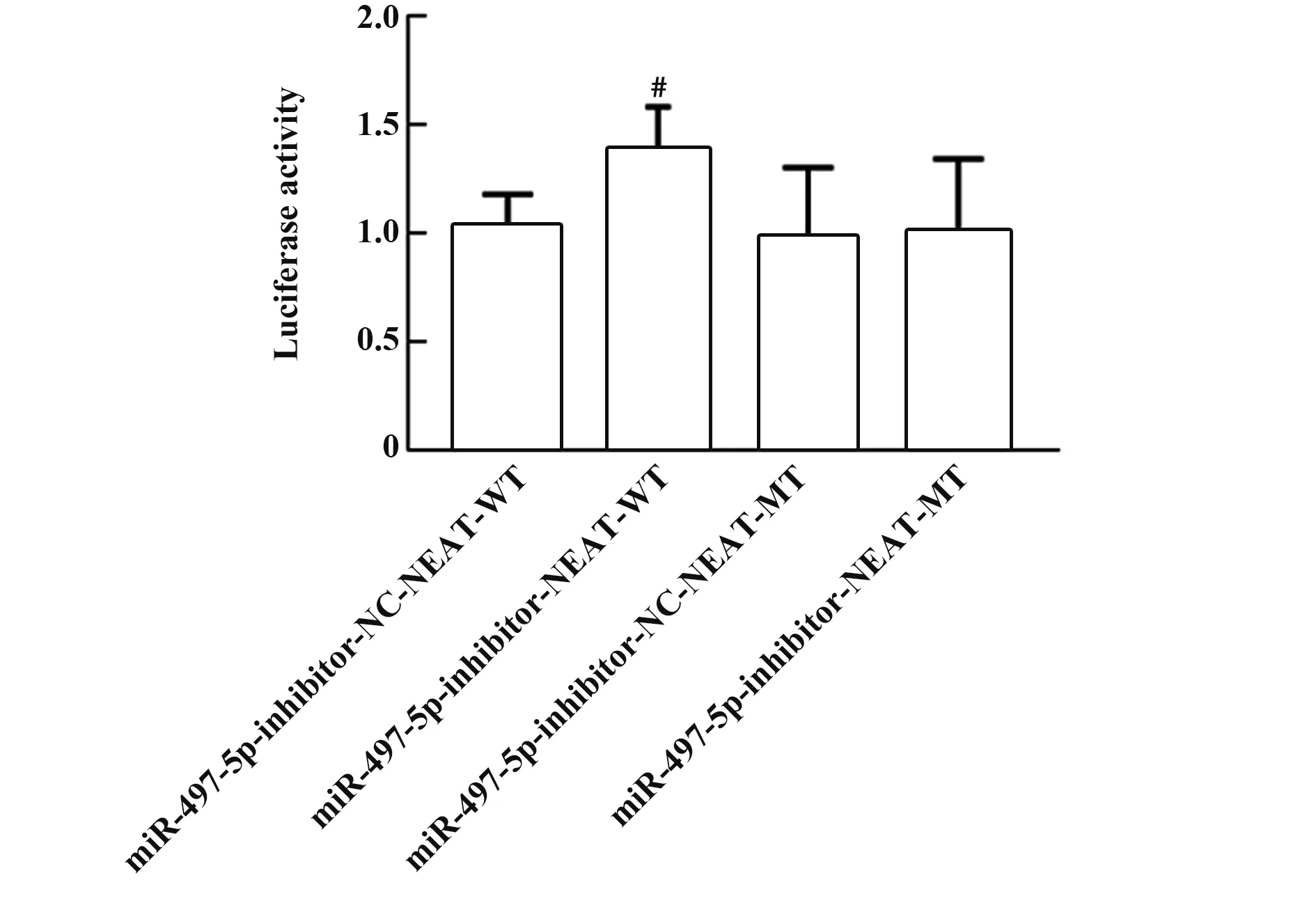
图4 荧光素酶实验结果Fig.4 Results of luciferase experiment
3 讨论
胰腺癌是消化系统恶性肿瘤,具有发病隐匿、侵袭性强特点,导致大多数患者确诊时已是中晚期[11]。目前手术及化疗手段是临床治疗胰腺癌的主要手段,但手术对于浸润程度深的患者有较大风险,同时疗效有一定局限性,而肿瘤细胞对化疗药物耐药性又限制了化疗药物的广泛应用及疗效。
NEAT1是新近发现的一个lncRNA,能够参与多种基因转录调控,研究表明,其作为癌基因参与多种肿瘤发生发展[12]。郭春芳等[13]研究显示,NEAT1在卵巢癌组织中异常高表达可能是卵巢癌潜 在 治 疗 靶 点。WANG等[14]研 究 显 示,过 表 达NEAT1显著促进子宫内膜癌细胞增殖、侵袭等。细胞增殖及凋亡失衡是肿瘤发生发展的关键,而EMT是指上皮细胞在正常生理及病理特征下向间质细胞表型的转变过程,是肿瘤细胞发生迁移和侵袭的关键步骤[15-16]。其中上皮细胞标志蛋白E-cadherin及间质细胞标志蛋白N-cadherin、Vimentin是EMT标志蛋白,E-cadherin表达下调及N-cadherin、Vimentin表达上调,胞间黏附作用减弱,进一步促使癌细胞向周边正常组织发生侵袭、转移[17-18]。本研究结果显示,与NG组、siRNA-NC组比较,NEAT1-siRNA组PANC-1细胞增殖抑制率、凋亡率、Bax、Ecadherin蛋白表达显著升高,NEAT1水平及Ki-67、Bcl-2、N-cadherin、Vimentin蛋白表达显著降低。与既往肿瘤研究中表达模式一致,说明沉默NEAT1表达可能抑制胰腺癌细胞增殖、EMT过程并诱导细胞凋亡。miR-497-5p是一种单链小分子RNA,位于肿瘤易突变区域人类染色体17q13.1,在多种肿瘤中异常低表达[19]。LIU等[20]研究显示,miR-497可能通过抑制血管内皮生长因子-A表达抑制胰腺癌细胞增殖、血管生成和转移能力。本研究结果显示,与NG组、siRNA-NC组比较,NEAT1-siRNA组PANC-1细胞miR-497-5p水平显著升高,当在转染NEAT1-siRNA基础上抑制miR-497-5p表达后,沉默NEAT1表达抑制PANC-1细胞增殖并诱导细胞凋亡能力减弱,说明沉默NEAT1表达可能通过上调miR-497-5p表达发挥抑癌作用。研究发现,NEAT1可对miR-497-5p发挥负调控作用促进胃癌细胞增殖并抑制凋亡[10]。本研究经生物信息学预测网站得知NEAT1与miR-497-5p基因序列存在结合位点,且经双荧光素酶报告实验证实,miR-497-5p-inhibitor-NEAT1-WT组荧光素酶活性显著高于miR-497-5pinhibitor-NC-NEAT1-WT组。以上研究结果表明,沉默NEAT1表达可能靶向上调miR-497-5p表达,抑制胰腺癌细胞增殖及EMT过程,并诱导细胞凋亡。
综上所述,沉默lncRNA NEAT1表达能抑制胰腺癌细胞增殖及EMT过程,并诱导细胞凋亡,可能是通过靶向上调miR-497-5p实现的。然而胰腺癌发生发展是多因素的复杂过程,关于其细胞增殖、凋亡等生物学恶性行为进展中lncRNA NEAT1对下游靶基因或相关通路的调控作用仍需深入探索。
