栀子多糖调控miR-141-3p对LPS诱导的心肌细胞炎症反应及凋亡的影响
2022-11-16刘大朋孙作乾
刘大朋 李 影 孙作乾 宋 涛 陈 敏
(枣庄科技职业学院医学技术系临床医学教研室,滕州 277599)
心肌细胞凋亡参与多种心血管疾病发生、发展,可导致心肌损伤,进而引起炎症反应,而炎症细胞浸润又会加剧心肌细胞凋亡[1-2]。脂多糖(lipopolysaccharide,LPS)可诱导细胞炎症因子IL-1β、TNF-α等的分泌,炎症因子可通过直接或间接方式导致心肌损伤[3]。栀子是我国传统的常用中药材,主要含环烯醚萜类、挥发油类、黄酮、皂苷、多糖等化合物,具有抗炎、抗氧化、抗血栓等作用[4]。栀子苷可减轻高脂饮食诱导的心肌炎症和心肌细胞凋亡[5]。栀 子 苷 可 通 过 上 调miR-145-5p表 达 保 护PC12细胞免受LPS引起的炎症损伤[6]。栀子苷通过下调THRIL减轻心肌细胞的损伤和心脏功能障碍[7]。但栀子多糖对LPS诱导的心肌细胞炎症反应及凋亡的影响及机制尚不清楚。miRNA不仅参与细胞增殖、分化、凋亡,还参与炎症免疫等[8]。研究发现miR-141-3p在内毒素血症大鼠心肌组织中表达下调,可能与心肌损伤发生有关[9]。小鼠胚胎成纤维细胞衰老中miR-141-3p表达下降,可能通过调控Keap1-Nrf2/ARE氧 化 应 激 通 路 加 速 衰 老[10]。miR-141-3p对LPS诱导的心肌细胞炎症反应及凋亡的影响尚不清楚,且栀子多糖影响心肌细胞炎症反应及凋亡的机制是否与miR-141-3p相关尚未可知。本研究旨在研究栀子多糖对心肌细胞炎症反应及凋亡的影响及其机制是否与miR-141-3p有关。
1 材料与方法
1.1 材料 心肌细胞H9C2购自深圳市百恩维生物科技有限公司;RPMI1640培养基购自美国Gibco公司;LPS购自北京寰宇科创生物科技发展有限公司;栀子多糖购自云南麦瑞科生物科技有限公司;ELISA试剂盒购自上海继锦化学科技有限公司;蛋白提取试剂盒购自碧云天生物技术研究所;Annexin V-FITC和PI试剂盒、双荧光素酶报告基因检测试剂盒购自北京Solarbio公司;荧光定量试剂盒购自美国Progema公司。
1.2 方法
1.2.1 细胞培养与分组H9C2细胞用含10%胎牛血清的RPMI1640培养液培养,将其分为对照组(Con)、LPS组、栀子多糖低、中、高浓度组;对照组细胞采用正常培养基培养,LPS组细胞采用100 ng/ml LPS处理,栀子多糖低、中、高浓度组细胞分别采用终浓度为2.5、5、10µmol/L的栀子多糖和100 ng/ml LPS共同培养。
将anti-miR-NC、anti-miR-141-3p、pcDNA3.1、pcDNA3.1-KLF6分别转染至H9C2细胞,再采用10µmol/L栀子多糖和100 ng/ml LPS处理,记为LPS+Experiment-H+anti-miR-NC组、LPS+Experiment-H+anti-miR-141-3p组、LPS+Experiment-H+pcDNA 3.1组、LPS+Experiment-H+pcDNA3.1-KLF6组。
1.2.2 ELISA检测IL-1β、TNF-α水平 各组细胞培养48 h后取上清,按照试剂盒说明书操作。
1.2.3 Western blot检 测Bax、KLF6蛋 白 表 达提取细胞总蛋白,定量后取60µg进行SDSPAGE,转至PVDF膜,5%脱脂牛奶封闭后分别加入一抗和二抗孵育,暗室中曝光显影、定影,分析蛋白条带灰度值,计算蛋白表达。
1.2.4 流式细胞术检测细胞凋亡 细胞培养48 h,漂洗后加入10µl Annexin V-FITC和PI混匀,避光孵育10 min,流式细胞仪检测细胞凋亡率。
1.2.5 RT-qPCR检测miR-141-3p表达 提取细胞总RNA,合成cDNA后以U6为内参进行PCR扩增,循环条件为95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40个循环。相对表达量采用2-ΔΔCt法计算。
1.2.6 荧光素酶报告实验检测miR-141-3p对KLF6的靶向调控作用 构建KLF6的野生型和突变型荧光素酶表达载体WT-KLF6和MUT-KLF6,将其分别与miR-NC和miR-141-3p共转染至H9C2细胞中,按试剂盒说明检测荧光素酶活性。将miR-NC、miR-141-3p、anti-miR-NC、anti-miR-141-3p分别转染至H9C2细胞中,按1.2.5检测KLF6表达。
1.3 统计学分析 实验数据采用SPSS20.0软件分析,计量资料用±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 栀子多糖对LPS作用的H9C2细胞炎症反应的影响 与对照组相比,LPS组H9C2细胞中IL-1β、TNF-α水平显著升高(P<0.05),与LPS组相比,栀子多糖低、中、高浓度组H9C2细胞中IL-1β、TNF-α水平显著降低(P<0.05,表1)。
表1 栀子多糖对LPS作用的H9C2细胞炎症反应的影响(±s,n=9)Tab.1 Effects of gardenia polysaccharide on inflammatory response in cells affected by LPS in H9C2(±s,n=9)
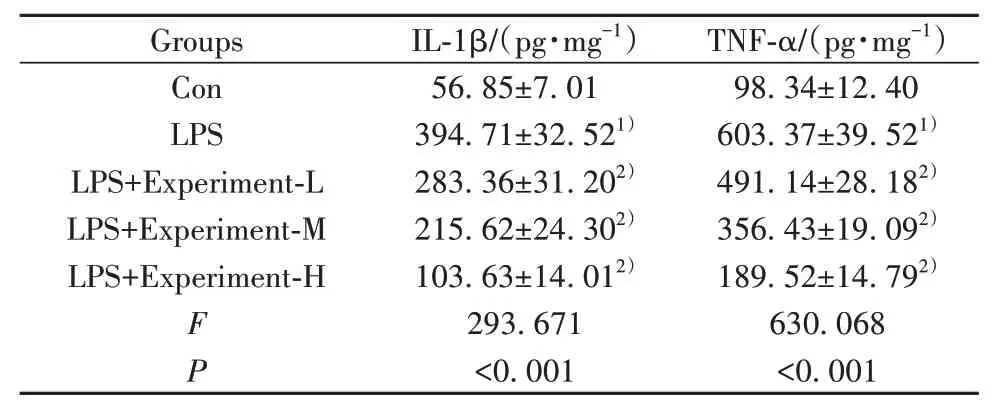
表1 栀子多糖对LPS作用的H9C2细胞炎症反应的影响(±s,n=9)Tab.1 Effects of gardenia polysaccharide on inflammatory response in cells affected by LPS in H9C2(±s,n=9)
Note:Compared with Con group,1)P<0.01;compared with LPS group,2)P<0.01.
Groups Con LPS LPS+Experiment-L LPS+Experiment-M LPS+Experiment-H FP IL-1β/(pg·mg-1)56.85±7.01 394.71±32.521)283.36±31.202)215.62±24.302)103.63±14.012)293.671<0.001 TNF-α/(pg·mg-1)98.34±12.40 603.37±39.521)491.14±28.182)356.43±19.092)189.52±14.792)630.068<0.001
2.2 栀子多糖对LPS作用的H9C2细胞凋亡及Bax表达的影响 与对照组相比,LPS组H9C2细胞中Bax表达显著升高,细胞凋亡率显著升高(P<0.05),与LPS组相比,栀子多糖低、中、高浓度组H9C2细胞Bax表达显著降低,细胞凋亡率显著降低(P<0.05,图1、表2)。
表2 栀子多糖对LPS作用的细胞H9C2凋亡及Bax表达的影响(±s,n=9)Tab.2 Effects of gardenia polysaccharide on apoptosis and Bax expression of H9C2 cells induced by LPS(±s,n=9)
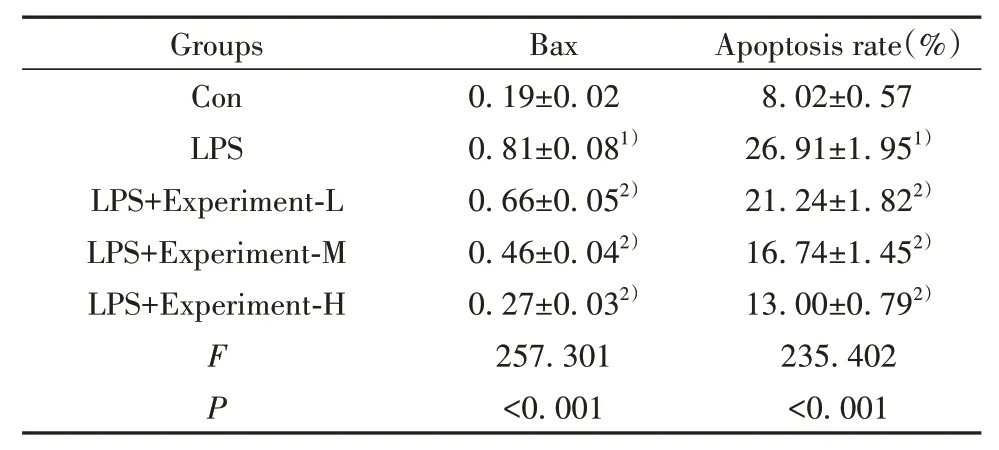
表2 栀子多糖对LPS作用的细胞H9C2凋亡及Bax表达的影响(±s,n=9)Tab.2 Effects of gardenia polysaccharide on apoptosis and Bax expression of H9C2 cells induced by LPS(±s,n=9)
Note:Compared with Con group,1)P<0.01;compared with LPS group,2)P<0.01.
Groups Con LPS LPS+Experiment-L LPS+Experiment-M LPS+Experiment-H FP Bax 0.19±0.02 0.81±0.081)0.66±0.052)0.46±0.042)0.27±0.032)257.301<0.001 Apoptosis rate(%)8.02±0.57 26.91±1.951)21.24±1.822)16.74±1.452)13.00±0.792)235.402<0.001
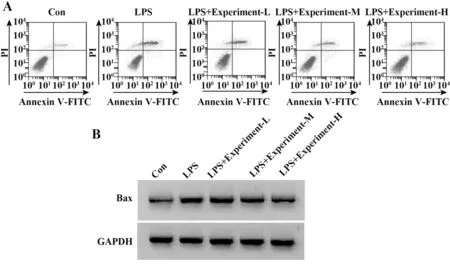
图1 栀子多糖对LPS作用的H9C2细胞凋亡及Bax表达的影响Fig.1 Effects of gardenia polysaccharide on apoptosis and Bax expression of H9C2 cells induced by LPS
2.3 栀子多糖对LPS作用的H9C2细胞miR-141-3p、KLF6表达的影响 与对照组相比,LPS组H9C2细胞miR-141-3p表达显著降低,KLF6表达显著升高(P<0.05),与LPS组相比,栀子多糖高浓度组H9C2细胞miR-141-3p表达显著升高,KLF6表达水平显著降低(P<0.05,图2、表3)。
表3 栀子多糖对LPS作用的H9C2细胞miR-141-3p、KLF6表达的影响(±s,n=9)Tab.3 Effects of gardenia polysaccharide on expressions of miR-141-3p and KLF6 in H9C2 cells induced by LPS(±s,n=9)
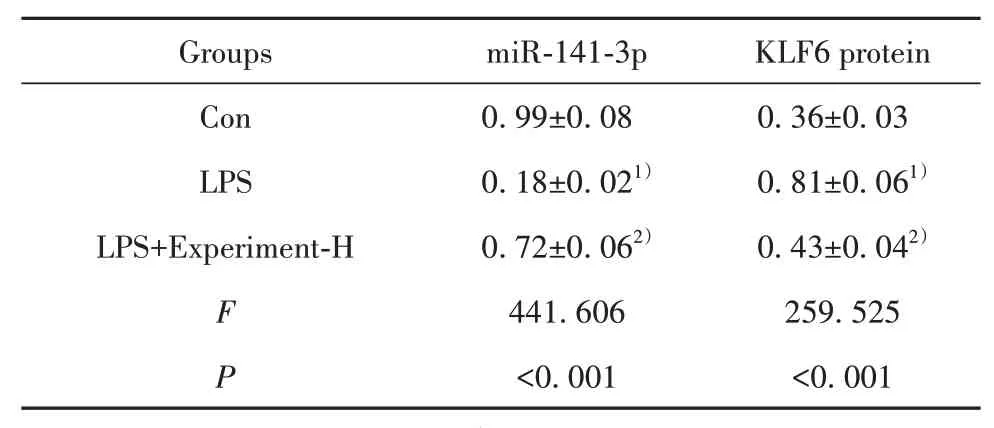
表3 栀子多糖对LPS作用的H9C2细胞miR-141-3p、KLF6表达的影响(±s,n=9)Tab.3 Effects of gardenia polysaccharide on expressions of miR-141-3p and KLF6 in H9C2 cells induced by LPS(±s,n=9)
Note:Compared with Con group,1)P<0.01;compared with LPS group,2)P<0.01.
Groups Con LPS LPS+Experiment-H F P miR-141-3p 0.99±0.08 0.18±0.021)0.72±0.062)441.606<0.001 KLF6 protein 0.36±0.03 0.81±0.061)0.43±0.042)259.525<0.001
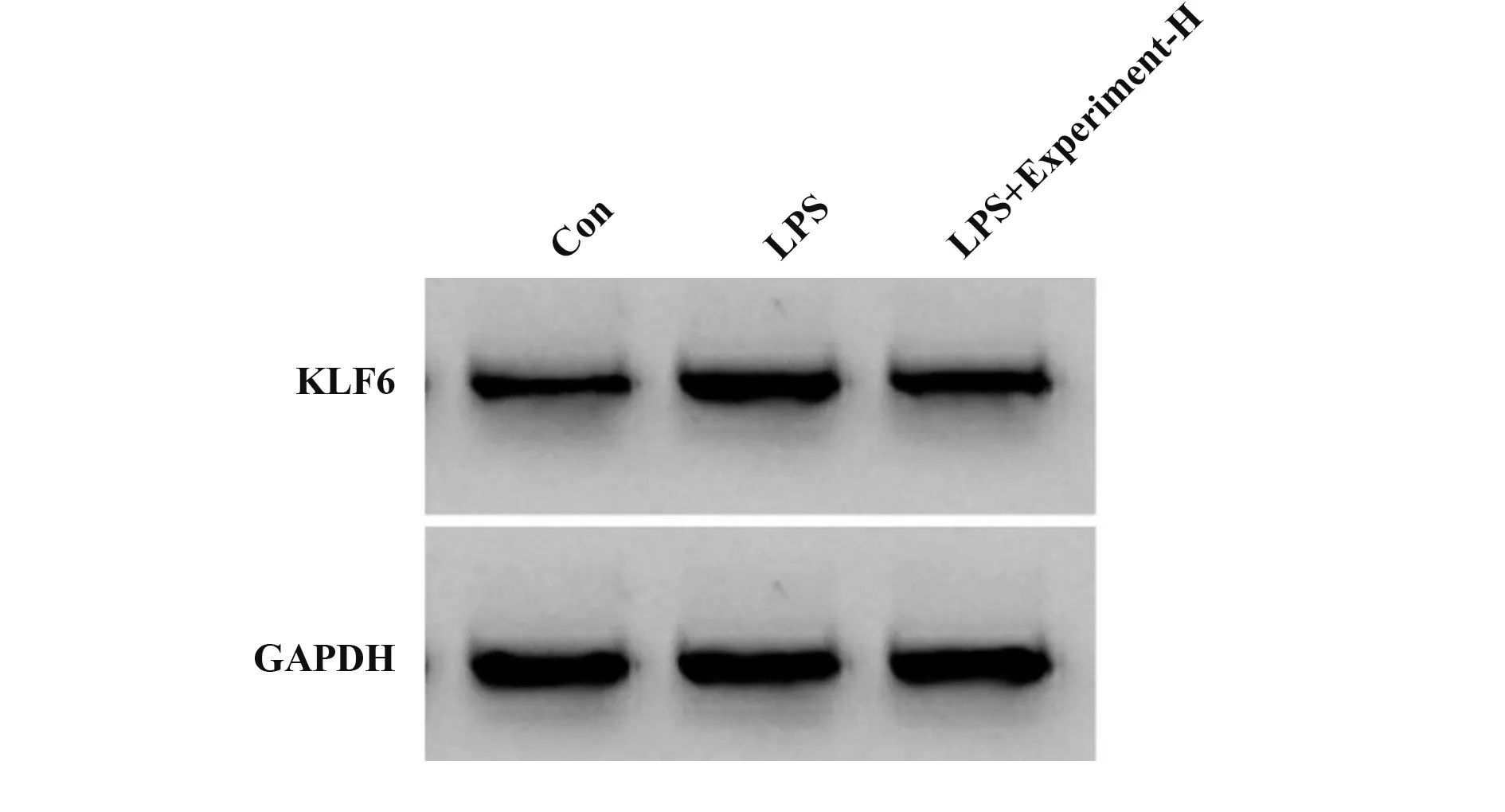
图2 KLF6蛋白表达Fig.2 Expression of KLF6 protein
2.4 抑制miR-141-3p表达能逆转栀子多糖对LPS作用的H9C2细胞炎症反应及凋亡的影响 与LPS+Experiment-H+anti-miR-NC组相比,LPS+Experiment-H+anti-miR-141-3p组细胞H9C2中miR-141-3p表达显著降低,IL-1β、TNF-α水平、Bax表达和细胞凋亡率均显著升高(P<0.05,图3、表4)。
表4 抑制miR-141-3p表达能逆转栀子多糖对LPS作用的H9C2细胞中炎症反应及凋亡的影响(±s,n=9)Tab.4 Inhibition of miR-141-3p can reverse effect of gardenia polysaccharide on inflammatory response and apoptosis of H9C2 cells induced by LPS(±s,n=9)

表4 抑制miR-141-3p表达能逆转栀子多糖对LPS作用的H9C2细胞中炎症反应及凋亡的影响(±s,n=9)Tab.4 Inhibition of miR-141-3p can reverse effect of gardenia polysaccharide on inflammatory response and apoptosis of H9C2 cells induced by LPS(±s,n=9)
Note:Compared with LPS+Experiment-H+anti-miR-NC group,1)P<0.01.
Groups LPS+Experiment-H+anti-miR-NC LPS+Experiment-H+anti-miR-141-3p tP miR-141-3p 0.71±0.06 0.20±0.021)24.191<0.001 IL-1β/(pg·mg-1)101.86±7.33 320.92±19.351)31.760<0.001 TNF-α/(pg·mg-1)190.14±13.09 523.56±22.661)38.223<0.001 Bax 0.28±0.03 0.66±0.051)19.551<0.001 Apoptosis rate(%)13.13±0.63 23.51±1.151)23.748<0.001
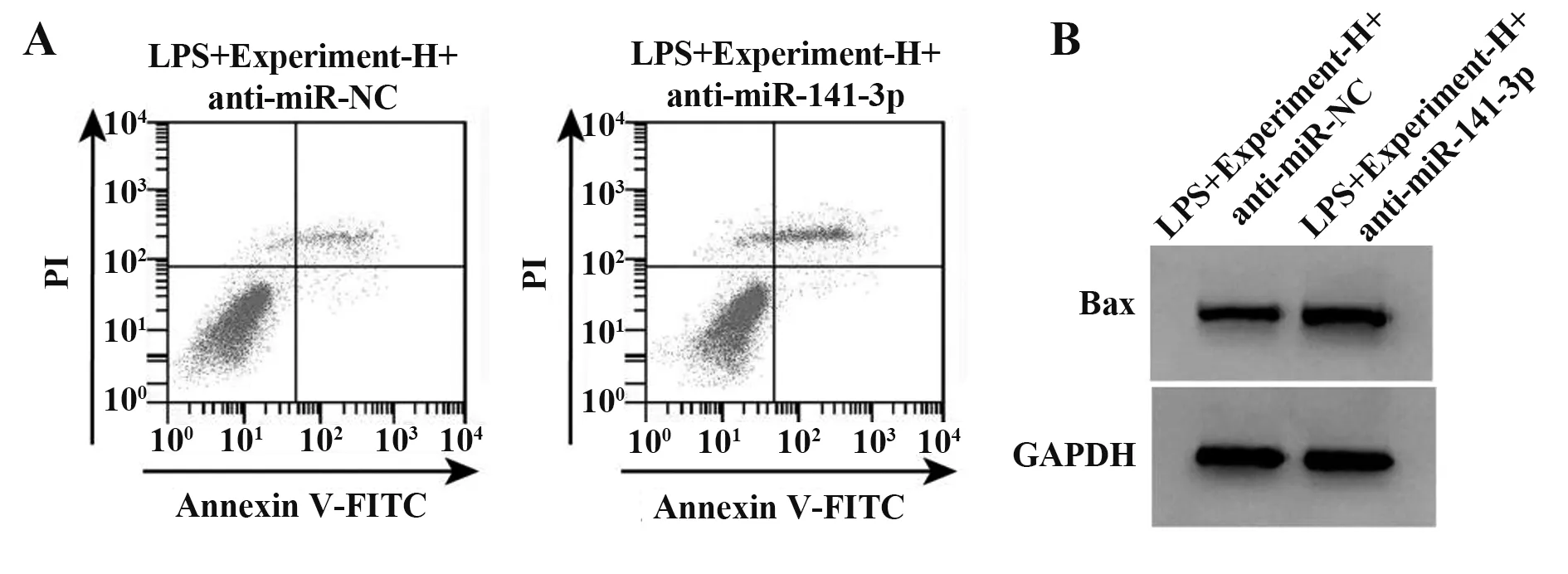
图3 抑制miR-141-3p能逆转栀子多糖对LPS作用的H9C2细胞凋亡的影响Fig.3 Inhibition of miR-141-3p reverses effect of gardenia polysaccharide on apoptosis of H9C2 cells induced by LPS
2.5 过表达KLF6能逆转栀子多糖对LPS作用的细胞H9C2中炎症反应及凋亡的影响 与LPS+Experiment-H+pcDNA3.1组 相 比,LPS+Experiment-H+pc-DNA3.1-KLF6组细胞H9C2KLF6表达显著升高,IL-1β、TNF-α水平及Bax表达显著升高,细胞凋亡率显著升高(P<0.05,表5、图4)。
表5 过表达KLF6能逆转栀子多糖对LPS作用的细胞H9C2中炎症反应及凋亡的影响(±s,n=9)Tab.5 Overexpression of KLF6 can reverse effect of gardenia polysaccharide on inflammatory response and apoptosis of H9C2 cells induced by LPS(±s,n=9)

表5 过表达KLF6能逆转栀子多糖对LPS作用的细胞H9C2中炎症反应及凋亡的影响(±s,n=9)Tab.5 Overexpression of KLF6 can reverse effect of gardenia polysaccharide on inflammatory response and apoptosis of H9C2 cells induced by LPS(±s,n=9)
Note:Compared with LPS+Experiment-H+pcDNA3.1 group,1)P<0.01.
Groups LPS+Experiment-H+pcDNA3.1 LPS+Experiment-H+pcDNA3.1-KLF6 t P KLF6 protein 0.42±0.04 0.75±0.051)15.461<0.001 IL-1β/(pg·mg-1)102.28±7.77 291.10±18.251)28.558<0.001 TNF-α/(pg·mg-1)189.33±12.96 507.33±20.731)39.022<0.001 Bax 0.27±0.03 0.59±0.061)14.311<0.001 Apoptosis rate(%)13.23±0.94 21.33±1.591)13.156<0.001
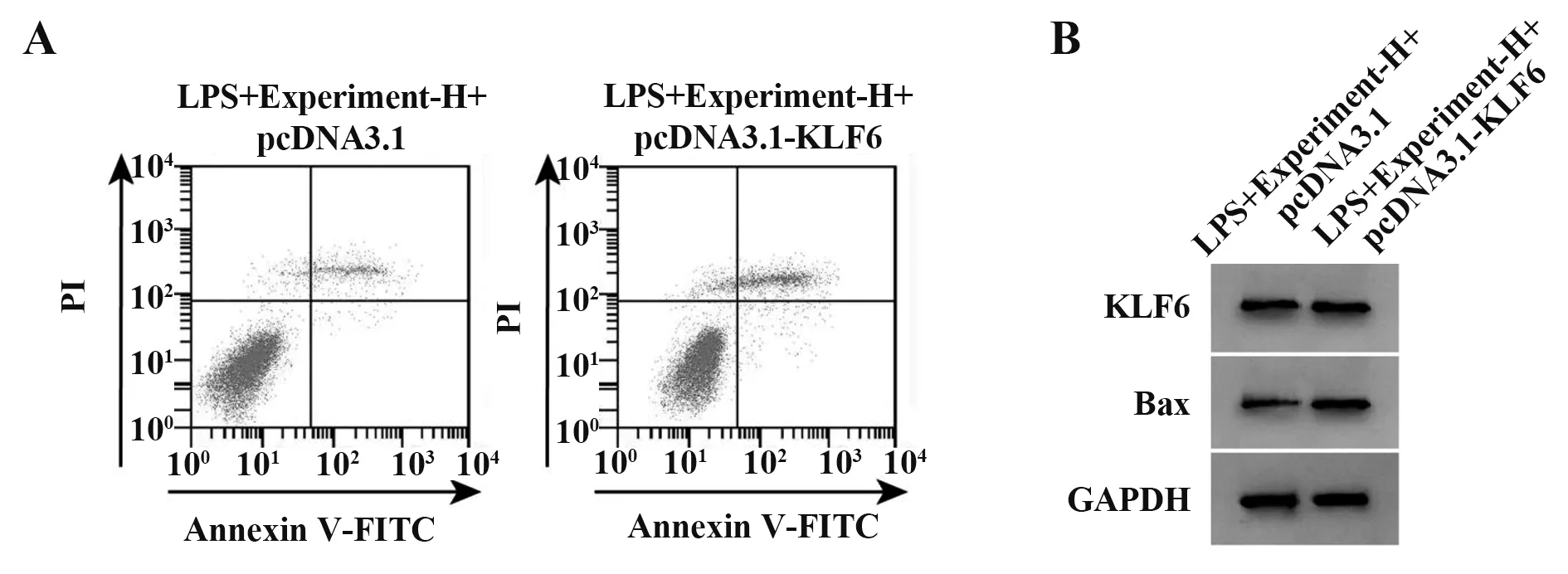
图4 过表达KLF6能逆转栀子多糖对LPS作用的H9C2细胞凋亡的影响Fig.4 Overexpression of KLF6 reverses effect of gardenia polysaccharide on apoptosis of H9C2 cells induced by LPS
2.6 miR-141-3p靶 向调 控KLF6 TargetScan预 测显示KLF6与miR-141-3p存在结合位点(图5A)。荧光素酶报告实验显示,miR-141-3p与WT-KLF6共转染的H9C2细胞荧光素酶活性显著降低(P<0.05);而miR-141-3p与MUT-KLF6共转染的H9C2细胞荧光素酶活性差异无统计学意义(表6)。过表达miR-141-3p后KLF6表达降低,而抑制miR-141-3p表达后KLF6表达升高(P<0.05,图5B、表7)。
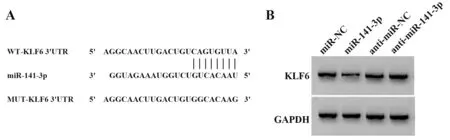
图5 miR-141-3p靶向调控KLF6Fig.5 miR-141-3p targeting regulates KLF6
表6 双荧光素酶报告实验(±s,n=9)Tab.6 Dual luciferase reporting experiment(±s,n=9)
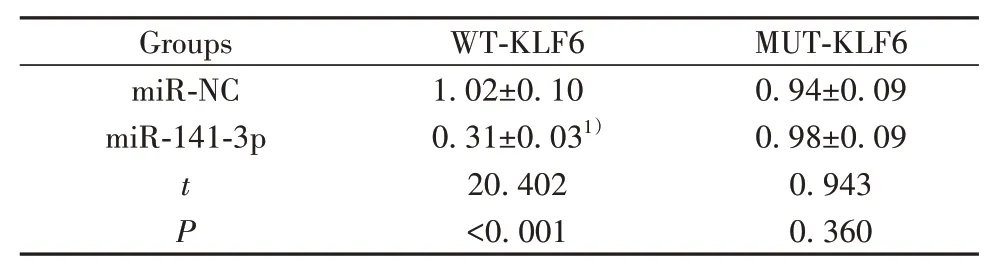
表6 双荧光素酶报告实验(±s,n=9)Tab.6 Dual luciferase reporting experiment(±s,n=9)
Note:Compared with miR-NC group,1)P<0.01.
Groups miR-NC miR-141-3p tP WT-KLF6 1.02±0.10 0.31±0.031)20.402<0.001 MUT-KLF6 0.94±0.09 0.98±0.09 0.943 0.360
表7 miR-141-3p调控KLF6表达(±s,n=9)Tab.7 miR-141-3p regulates KLF6 expression(±s,n=9)
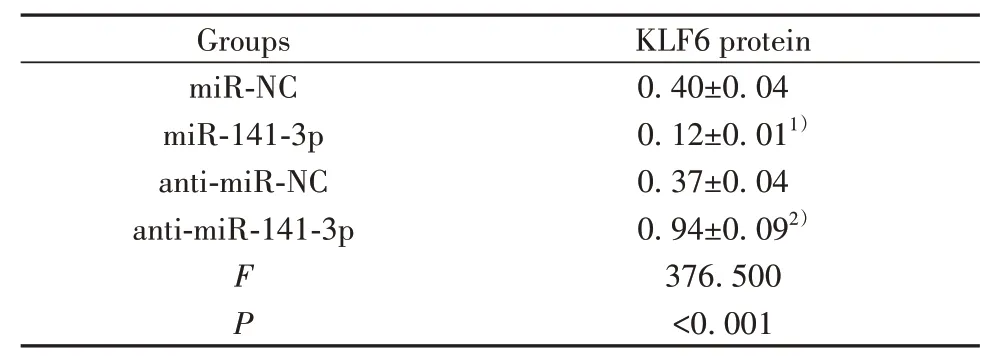
表7 miR-141-3p调控KLF6表达(±s,n=9)Tab.7 miR-141-3p regulates KLF6 expression(±s,n=9)
Note:Compared with miR-NC group,1)P<0.01;compared with antimiR-NC group,2)P<0.01.
Groups miR-NC miR-141-3p anti-miR-NC anti-miR-141-3p FP KLF6 protein 0.40±0.04 0.12±0.011)0.37±0.04 0.94±0.092)376.500<0.001
3 讨论
中药对心肌损伤具有保护作用[11]。炎症因子和细胞凋亡均可导致心肌损伤,TNF-α、IL-6、IL-1β均属于促炎因子,其水平升高会促发炎症反应[12]。研究发现栀子苷通过上调miR-145表达减轻LPS诱导的H9C2细胞损伤[13]。栀子苷可通过激活Keap1/Nrf2通路抑制过氧化氢引起的心肌细胞氧化损伤[14]。栀子苷通过激活AMPKα抑制心肌ROS积累,从而阻断NLRP3炎症体介导的心肌细胞凋亡,并改善败血症小鼠心脏功能[15]。表明栀子苷对于心肌细胞损伤具有保护作用。本研究采用不同浓度栀子多糖处理LPS诱导的心肌细胞,结果显示,IL-1β、TNF-α水平、细胞凋亡率显著降低,说明栀子多糖可抑制LPS诱导的炎症因子分泌及细胞凋亡。提示栀子多糖也对LPS诱导的心肌损伤具有保护作用。
研究报道miR-141-3p过表达降低了慢性炎症性疼痛小鼠IL-1β、TNF-α和IL-6水平[16]。说明miR-141-3p可参与调控炎症反应发生。本研究结果显示,LPS诱导的心肌细胞miR-141-3p表达显著降低,提示miR-141-3p参与心肌细胞损伤过程。为研究栀子多糖对心肌损伤的影响是否与miR-141-3p有关,本研究先检测栀子多糖处理后miR-141-3p表达,结果显示,miR-141-3p表达升高,而抑制miR-141-3p表达逆转了栀子多糖对LPS诱导的心肌细胞炎症反应和凋亡的抑制作用。表明栀子多糖可能通过调控miR-141-3p影响心肌细胞炎症反应和凋亡。
研究显示,Kruppel样因子(kruppel-like factor,KLF)6可调节心肌细胞纤维化[17]。KLF6通过抑制B细胞白血病/淋巴瘤6表达促进巨噬细胞介导的炎症[18]。miR-141-3p可通过靶向KLF12促进子宫内膜间质细胞凋亡[19]。本实验通过在线软件预测miR-141-3p可能的靶基因,发现miR-141-3p与KLF6有结合位点,且进一步通过双荧光素酶实验证实miR-141-3p可靶向调控KLF6表达。此外,本研究还发现栀子多糖可降低KLF6表达,而过表达KLF6逆转了栀子多糖对LPS作用的心肌细胞凋亡和炎症因子的抑制作用。提示栀子多糖可能通过调控miR-141-3p进而调控KLF6表达影响心肌细胞炎症反应和凋亡。
综上所述,栀子多糖可能通过调控miR-141-3p和KLF6抑制LPS诱导的心肌细胞凋亡和炎症因子释放,对LPS诱导的心肌细胞损伤有保护作用。
