基于ITS序列分析传统轮作对参田土壤真菌群落组成及多样性的影响
2022-11-16郭瑞齐管仁伟李红霞林慧彬
郭瑞齐,管仁伟,李红霞,林慧彬
(山东省中医药研究院,山东济南 250014)
西洋参(PainaxquinquefoliumL.)为五加科人参属多年生宿根植物,具有补气养阴、清热生津等功效。西洋参忌地性极强,是阻碍其产业发展的限制因素,因此重茬土壤修复再利用已成为西洋参研究的重点问题。前期研究表明,自毒物质积累、土壤理化性状转变、土壤微生物群落变化以及土传病害的增加,皆是导致西洋参连作障碍的关键因素。其中土壤微生物群落的变化是导致西洋参连作障碍的主要因素,连作引起土壤微生物多样性及组成发生变化,进而影响土壤生产力[1]。
土壤微生物影响西洋参生长的关键生态过程,其生长过程中土壤类型从“细菌型”转变为“真菌型”,土壤中滋生大量的土传病害及拮抗因子[2]。真菌在西洋参种植土壤环境、土传病害等方面至关重要,然而关于参田土壤的处理再利用,提高土壤转换率以及大田土壤真菌群落变化的研究较少。因此,本研究采用高通量测序技术,分析新茬大田土壤、传统轮作1年大田土壤、传统轮作2年大田土壤、未种植西洋参大田土壤中真菌组成变化,阐述传统轮作状态下老参田土壤真菌群落的变化,以期为老参田土壤改良修复提供基础数据。
1 材料与方法
1.1 土壤样品采集
土壤样品于2019年12月27日采集自山东省威海市文登区大水泊镇西水坡村西洋参种植基地(122°14′11.82″ E,37°10′38.17″ N)。样品分为4组:新茬地采收后的参田土(A组);传统轮作小麦、玉米1年的大田土(B组);传统轮作小麦、玉米2年的大田土(C组);未种西洋参的空白对照大田土壤(D组)。每组分别在不同的位置采集3份样品作为试验重复。用五点取样法采集参田土壤,去除表层土壤,采集10~20 cm深度土样,混合,用四分法分取部分样品,装入无菌聚乙烯封口袋内,加入干冰4 ℃条件下贮藏,封口,低温运输至实验室处理。
1.2 基因间隔序列(ITS)基因文库构建和高通量测序
基于已提取并验证合格的土壤总DNA为模板,针对真菌ITS区选择 PCR 扩增通用引物对ITS1F和ITS2R(ITS1F:5′-C T T G G T C A T T T A G A G G A A G T AA-3′;ITS2R:5′-G C T G C G T T C T T C A T C G A T G C-3′)为引物对ITS区真菌进行PCR扩增,高通量测序工作在Illumina Miseq PE300平台上进行。
2 结果与分析
2.1 真菌ITS测序数据统计及操作分类单元(OTU)分析
经过MiSeq测序和质控后,4组土壤样品共得到651 234条优化序列。土壤样本稀释曲线能够充分反映土壤中群落所包含的微生物物种组成[3]。当检测的数量达到一定深度时,样本的稀释曲线均基本趋于平缓,说明测序数量足够(图1)。按照 97%的相似度进行OTU 聚类,4组样本共929个OTU。其中A组注释到11门27纲 60目116科210属476个OTU,B组注释到14门31纲65目129科224属511个OTU,C组注释到10门26纲60目117科216属453个OUT,D组注释到11门30纲62目114科204属435个OTU。
对4组样品真菌群落OTU进行分析,Venn图(图2)可直观反映出不同土壤样品中OTU的分布情况。4组样品共有的 OTU有 929个。A组与B组共有的 OTU有266个,与C组共有OTU 243个,与D组共有的 OTU 256个。B组和C组共同含有267个OTU,B组和D组共同含有273个OTU。C组和D组共同含有268个OTU。其中A组与B组共有OTU比A组与C组共有OTU增多9.47%;而B组与D组共有OTU比C组与D组共有增多1.87%。随着老参田土壤传统轮作时间的延长,共有的OTU渐次减少,而特有的真菌OTU渐次增加,最终导致老参田土壤真菌群落组成分布发生改变[4]。
2.2 土壤样品中真菌α-多样性指数
Chao指数、ACE指数常用来分析土壤样品群落丰富度。二者数值越大,表明土壤中真菌群落丰富度越大。由表1可知,A、B、C、D组中Chao指数平均值分别是222.74、241.79、236.82、242.48;ACE指数平均值分别为221.67、240.40、235.59、242.34。Shannon指数、Simpson指数常用来分析土壤微生物群落的多样性和均匀度。Shannon指数越高,表明土壤真菌群落的多样性越高;而Simpson指数与其相反[5]。A、B、C、D组中shannon指数依次为2.78、3.30、3.42、3.03;Simpson指数依次为0.18、0.08、0.06、0.11。与A组相比,B、C、D等3组土壤真菌群落的多样性、丰富度指数上升,推测随着轮作年限延长,土壤真菌多样性及均匀度发生变化。
2.3 真菌群落组成分析
对西洋参传统轮作大田土壤及空白土壤真菌在门分类水平进行群落组成分析,4组土壤样品真菌中主要包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢菌门(Mortierellomycota)、壶菌门(Chytridiomycota)和未知真菌5类(图3)。子囊菌门在各组土壤中平均相对丰度为51.26%,是最具有优势的物种,在C组中相对丰度最高;其次是担子菌门、被孢菌门、壶菌门,平均相对丰度分别为23.46%、20.57%、3.63%;未知真菌平均相对丰度约为0.77%。在门分类水平上,4组样品之间的群落丰度有一定的区别。
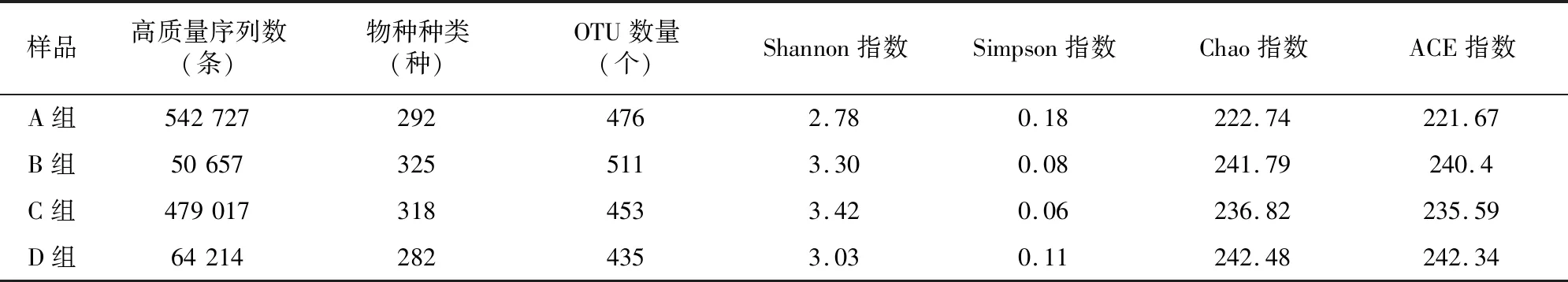
表1 各土壤样品真菌多样性指数
在属水平,4组土壤样品中真菌覆盖333属,丰度排名前20的物种,各组土样中真菌群落组成与结构明显不同。各组大田土壤中真菌分别有19、20、19、17个优势属。其相对丰度的总和均大于80%,A组为87.64%、B组为83.81%、C组为81.62%、D组为88.93%。被孢霉属(Mortierella)、毛壳菌属(Chaetomium)、镰刀菌属(Fusarium)、Saitozyma、unclassified_f_Chaetomiaceae、Solicoccozyma、裸节菌属(Talaromyces)、Lophotrichus、青霉属(Penicillium)、木霉属(Trichoderma)为样本共有的优势属(表2)。毛壳菌属、青霉属的丰度在C组最高、B组次之,A组最低;镰刀菌属在空白土壤中的丰度最高(11.01%),在新茬大田土中的丰度最低(1.90%);而木霉属相反,在新茬大田土中的丰度最高(4.24%),在传统轮作2年大田土中的丰度最低(0.02%)。
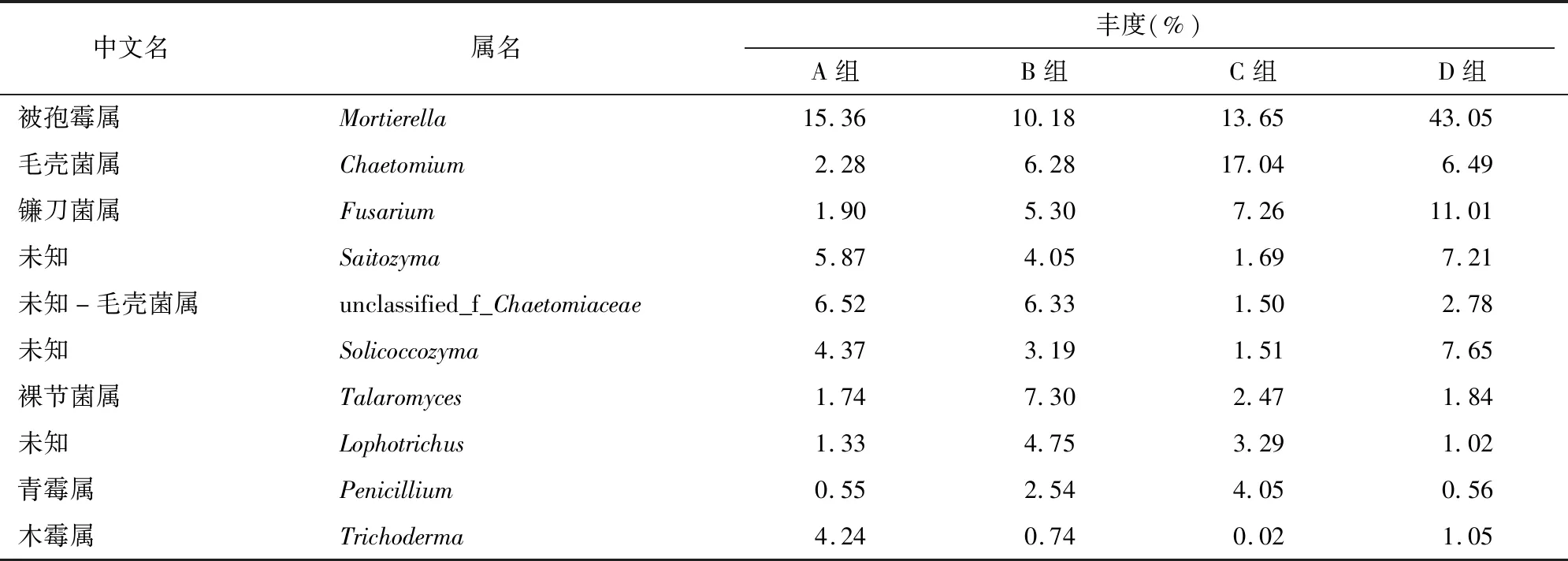
表2 属水平优势种群丰度
2.4 土壤样品中真菌的 β-多样性分析
高通量测序中,常用β-多样性分析不同样本群落结构组成的相似性[6]。在属水平上,对老参田土壤真菌组成进行主坐标(PCoA)分析,数据中的比例分别为20.17%、16.90%(图4)。可以看出,4组样品组内分布距离较近,样品组内真菌群落结构相似度较高;而样本组间距离相对较远,表明4组土壤样品组间真菌群落结构有明显差别。此结果与4组样品的层级聚类结果类似。
在属分类单元水平上,运用 weighted-UniFrac对各组样本进行相似性(ANOSIM)分析以及距离热图(heatmap)的分析(图5)。ANOSIM(R=0.802 5,P=0.001)分析结果表明,4组样本的组间差异大于组内。而4组样本距离热图显示,新茬西洋参大田与空白大田土壤之间差异最大,传统轮作大田土壤之间差异最小。以上结果显示,样本类型是影响大田土壤真菌群落结构的主要因素,其中新茬地与传统轮作大田土壤的真菌群落结构差异依次增大。
2.5 真菌功能预测
运用FUNGuild软件,对4组大田土壤样品真菌群落进行真菌功能预测分析。选择可能(probable)和很可能(highly probable)等2个置信水平,得到土壤真菌营养型在不同样本中的丰度信息[7]。预测结果(图6-a)显示,土壤样本中的真菌类群[8]主要包括腐生营养型(saprotroph)、病理营养型(pathotroph)、共生营养型(symbiotroph)、病理-腐生营养型(pathotroph-saprotroph)等营养类型。其中腐生营养型、病理营养型、病理-腐生营养型的相对丰度较高,腐生营养型(A>C>B>D)、病理营养型(B>A>C>D)、病理-腐生营养型(A>B>C>D)呈现渐次差异。
4组样本预测得到15个生态共位群[9-10],相对丰度如图6-b所示,共有优势菌主要包括未定腐生菌(Undefined Saprotroph,45.39%、20.17%、31.05%、10.87%)、内生植物-凋落物腐生体-土壤腐生体-未定义腐生体(Endophyte-Litter Saprotroph-Soil Saprotroph-Undefined Saprotroph,15.36%、10.19%、13.58%、43.05%)、动物病原体-粪便腐生体-内生真菌-附生植物-植物腐生体-木材腐生体(Animal Pathogen-Dung Saprotroph-Endophyte-Epiphyte-Plant Saprotroph-Wood Saprotroph,8.84%、12.77%、18.55%、9.28%)、真菌寄生物-未定义腐生菌(Fungal Parasite-Undefined Saprotroph,6.67%、5.31%、2.14%、7.51%)、动物病原体-内生真菌-地衣寄生虫-植物病原体-土壤腐生体-木材腐生体(Animal Pathogen-Endophyte-Lichen Parasite-Plant Pathogen-Soil Saprotroph-Wood Saprotroph,1.9%、5.30%、7.26%、11.01%)。除共有优势菌以外,各组特有优势菌主要包括:新茬西洋参大田土(A组)中内生菌(Endophyte,1.52%);传统轮作1年大田土(B组)中内生植物病原体(Endophyte-Plant Pathogen,1.28%)、粪便腐养-外生菌根-土壤腐养-木材腐养(Dung Saprotroph-Ectomycorrhizal-Soil Saprotroph-Wood Saprotroph,3.99%)、动物病原体-粪便腐生菌-内生菌-植物腐生菌-土壤腐生菌-木材腐生菌(Animal Pathogen-Dung Saprotroph-Endophyte-Plant Saprotroph-Soil Saprotroph-Wood Saprotroph,1.37%);传统轮作2年大田土(C组)植物病原体(Plant Pathogen,5.83%)、动物病原体-植物病原体未定义腐生菌(Animal Pathogen-Plant Pathogen-Undefined Saprotroph,2.29%)、粪便腐生生物(Dung Saprotroph,1.3%);而D组除共生菌外,无特有优势菌群。
3 讨论
高通量测序技术可全面揭示土壤微生物组成变化[11]。重茬土壤中微生物通过其特有的代谢产物在一定程度上影响土壤养分及物理特性。本研究对传统轮作、新茬地、空白对照大田土壤进行测序分析,进一步阐述传统轮作方式对老参田土壤真菌结构的影响。通过测序分析发现,传统轮作方式可改变老参田土壤真菌多样性,在西洋参种植过程中土壤结构发生变化或施用生物菌肥导致土壤养分改变,最终影响了土壤真菌的丰度与多样性。其次,西洋参种植过程中土壤中某些致病真菌大量增加,真菌群落之间相互拮抗,造成某些有益真菌减少甚至消失,这也是传统轮作大田土壤真菌多样性减少的因素之一[12]。
高通量数据分析结果表明,传统轮作方式对老参田土壤真菌组成有一定的影响。随着传统轮作时间的延长,在属分类水平,毛壳菌属、青霉属的丰度渐次增加。毛壳菌属中的纤维素酶,能有效降解土壤中的纤维素和有机质,可抑制土壤病原微生物的生长,故属于拮抗菌;土壤中的青霉属真菌是西洋参根际有益微生物,也是生防菌筛选的主要菌种,在栽参土壤中青霉属的丰度表现为C组>B组>A组,可以推测随传统轮作时间的延长其丰度渐次增加[10]。木霉属可引起人参属植物叶斑病,属内大多数木霉菌对植物病原真菌、细菌及昆虫具有拮抗作用[13]。木霉属作为另外一种生防菌菌种来源,其在新茬大田土中丰度高达4.24%,在传统轮作1年大田土中丰度为0.74%。结合威海市当地西洋参种植中常施用生防菌木霉素,推测其丰度大小受到了施肥管理的影响。镰刀菌属是引起西洋参根腐病的主要致病菌之一,随着传统轮作时间延长,丰度在各组大田土丰度渐次增加,推测可能与西洋参种植过程中施加生物肥料有关[14]。从真菌功能预测结果可以看出,传统农田栽培模式对栽参土壤进行改良中,人为添加大量的微生物菌剂和生物肥料,使原生微生物群落被破坏,新生的微生物群落结构稳定性差,各种微生物处于无限制繁殖阶段,这也是农田栽培模式土壤中大量的腐生真菌存在的原因[14]。而传统轮作栽培模式农田土壤真菌多样性的差异是否存在广泛性还有待进一步研究。
