肿瘤新抗原免疫治疗的研究进展*
2022-11-15王倩倩毕纹玫魏阳冯燮林蒋文军吴少波
王倩倩,毕纹玫,魏阳,冯燮林,蒋文军,吴少波
611731 成都, 电子科技大学 医学院 (王倩倩);213300 江苏 常州,溧阳市中医医院 检验科 (毕纹玫); 610041成都, 四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 胸部肿瘤内科 (魏阳), 肝胆胰外科(冯燮林), 研究所 (蒋文军);610052成都,中国医学科学院 输血研究所 (吴少波)
恶性肿瘤严重地威胁人类的健康, 目前肿瘤治疗手段仍主要是外科手术、放疗及化疗。对于早期甚至一些进展期癌症患者,根治性外科手术治疗仍是首选的方案,手术后再根据病理结果和实际的临床分期,给予适当的术后辅助治疗,如静脉化疗、局部放射治疗、基因靶向治疗等,尽可能防止肿瘤复发和转移。而对于中晚期尚未远端转移的肿瘤患者,大多采用综合性的治疗,如使用介入等手术方法、化疗或者放疗等联合疗法。这些治疗方法都具有其局限性,常引起患者不同程度的不良反应,或出现药物副作用,及抗药和耐药性,整体疗效欠佳,患者长期生存率低。近几年来,肿瘤新抗原已越来越来多进入临床试验,成为肿瘤免疫治疗的新领域,期待不久能应用于晚期癌症患者的有效治疗。肿瘤抗原是指与细胞恶性转化和肿瘤发生发展过程中相关的新产生或过度表达的蛋白和多肽分子,可分为肿瘤相关抗原(tumor associated antigens,TAA)和肿瘤特异性抗原(tumor specific antigen,TSA)。TAA常常是肿瘤细胞过量表达的癌基因编码蛋白、胚胎性蛋白或过量表达的糖蛋白等,但并非肿瘤细胞所特有,在正常细胞中也有低水平的表达。TAA在免疫治疗中易发生机体的免疫耐受以及自身免疫损伤,且由于其免疫原性弱,很难诱导持久的特异性免疫应答,从而极大限制了它们的临床应用,甚至可能导致免疫激活相关的严重自身免疫性疾病[1]。TSA又称为肿瘤新抗原,是肿瘤细胞在化学、物理及生物(如病毒)等致癌因素诱发或自发突变而形成的新型多肽,这些新抗原由于其高度特异性、显著外源性等特点而成为一种理想的免疫治疗靶点[2-3]。
自1988年De Plaen等[4]通过cDNA文库筛选鉴定了第一个T细胞识别的新抗原以来,一系列与人类肿瘤相关的自体突变新抗原的研究日益引起了人们的重视, 研究表明新抗原在特异性T细胞介导的抗肿瘤免疫中发挥了关键作用[5-7]。图1展示了肿瘤新抗原研究的发展概况。本文就肿瘤新抗原的筛选、基于新抗原免疫治疗的临床应用以及遇到的相关问题进行综述。
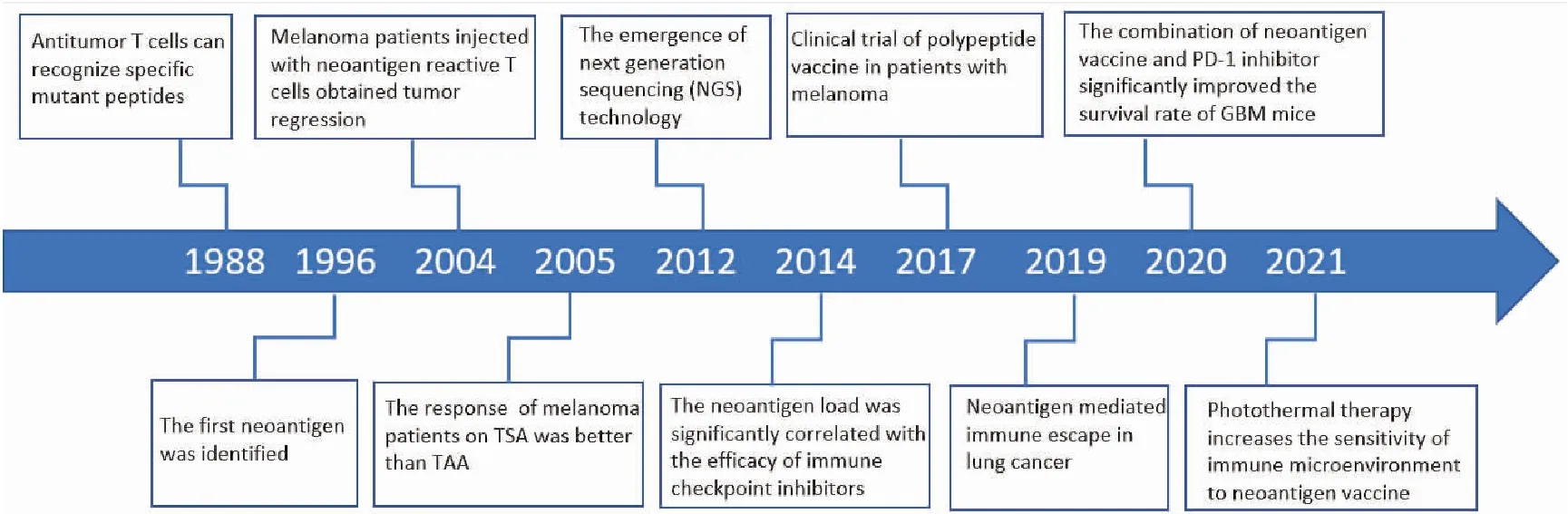
图1 肿瘤新抗原的研究历程
1 肿瘤新抗原的筛选
肿瘤新抗原具有肿瘤细胞的特异性,肿瘤细胞的基因组突变在不同个体间、不同肿瘤组织类型甚至同一肿瘤组织的不同细胞克隆之间都存在异质性,并且随肿瘤发展的不同阶段而发生变化[8-9]。利用现代基因深度测序方法,可以鉴别出肿瘤的大量体细胞突变,结合现代蛋白质组学和生物信息学技术,从中筛选出可能被T细胞识别并具有较强免疫原性的肿瘤新抗原多肽基因序列[10]。目前肿瘤新抗原筛选大致分为3种主要方法(图2):1)应用新一代测序技术(next generation sequencing,NGS)对肿瘤细胞或正常细胞测序(如外周血细胞),确定肿瘤组织基因突变位点,通过RNA测序(RNA-seq)找出肿瘤特异性突变位点的多肽基因序列并评估突变位点等位基因的表达,通过主要组织相容性复合体(major histocompatibility complex,MHC)-肽计算机软件预测MHC递呈的多肽,通过全外显子基因组测序确定肿瘤组织基因突变位点,人工合成新抗原多肽,并进行体外T细胞识别验证;2)基于高通量基因测序等技术,鉴定肿瘤细胞特异性突变位点,并筛选潜在与人白细胞抗原(human leukocyte antigen,HLA)亲和力较高的新抗原多肽分子构建串联小基因,在体外转录形成可表达多个多肽分子的RNA,再将RNA转染到抗原呈递细胞中,与肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)共培养,鉴定新抗原的免疫反应性;3)于数据库或文献中鉴定肿瘤细胞特异性突变位点,进而体外检测免疫反应活性。
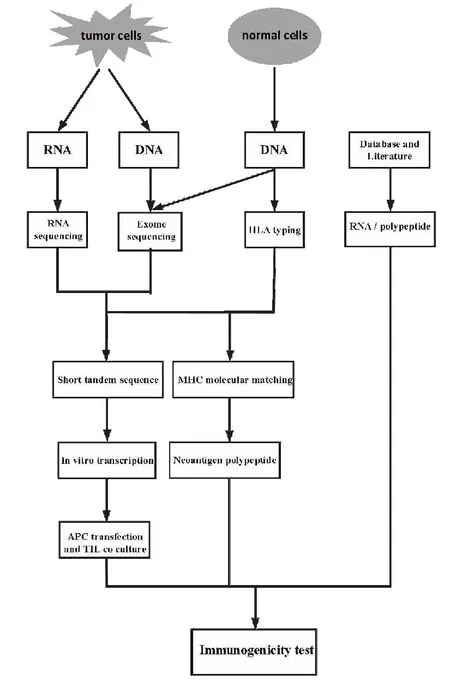
图2 新抗原的筛选方式
2 基于肿瘤新抗原的临床试验进展
2.1 基于新抗原的治疗性疫苗
肿瘤突变的多样性及异质性,使得个体化治疗性肿瘤疫苗成为有价值的研究方向[11]。研究者可通过皮下注射或者体外电脉冲甚至纳米材料辅助的方式将疫苗递送至患者体内[12],机体免疫系统识别疫苗所引入的特异性新抗原,引起效应细胞激活和释放一系列效应分子,达到攻击和清除肿瘤细胞或抑制肿瘤生长的目的[13-14]。其中,树突状细胞疫苗、病毒载体疫苗、多肽疫苗、DNA及RNA疫苗(核酸疫苗)在多种肿瘤的研究中显示,新抗原特异性T细胞浸润和抗肿瘤免疫反应可被有效激活[15-16]。Ott等[17]进行了一项针对20种预测的肿瘤新抗原设计的长肽疫苗的试验,结果表明在6名接种疫苗的黑色素瘤患者中,4名患者接种25个月后没有复发,而2名复发患者在进行了抗程序性死亡受体(programmed cell death protein,PD-1)治疗后,肿瘤完全消退。近期Hu等[18]的相关研究证明黑色素瘤患者的个体化新抗原疫苗接种可诱导具有细胞毒性基因特征的持久性和特异性记忆T细胞克隆,并且出现了多个不同功能T细胞受体(T cell receptor,TCR)克隆型,扩大了肿瘤特异性细胞毒性的范围。Ding等[19]以12例重度转移性肺癌患者为试验对象, 应用特异性树突状细胞疫苗,客观有效率与疾病控制率得到有效提高。Cafri等[20]应用mRNA 疫苗接种了转移性胃肠道癌症患者,成功诱导了突变特异性T细胞应答,并证明了该疫苗在胃肠道肿瘤患者中应用的安全可行性。新抗原疫苗的出现为肿瘤的免疫靶向治疗带来了里程碑的突破,在系列实体肿瘤临床试验中取得一定效果,并表现出良好的应用前景,而其高度特异性的特点也伴随着生产周期较长以及生产成本较高的代价,探寻通用型疫苗或许是未来值得研究探索的方向。
2.2 基于新抗原的过继性免疫治疗
过继性细胞疗法(adoptive cell therapy,ACT)是指给肿瘤患者输注具有抗肿瘤活性的免疫效应细胞,使其在肿瘤患者体内发挥抗肿瘤作用。不同于传统的过继细胞疗法,基于新抗原的ACT在增加效应T细胞数量的基础上,更加强调靶向实体肿瘤的特异性杀伤能力。ACT大致可分为两种治疗策略:一是从现有肿瘤团块中分离自然发生的肿瘤特异性T细胞,经过体外扩增后回输至患者体内;第二是从患者外周血中分离出T细胞,并进行基因修饰,使其表达TCR或嵌合抗原受体等可特异性识别肿瘤细胞的受体后回输。早期已有研究证明,TILs与卵巢癌[21]、乳腺癌[22]、原发性皮肤黑色素瘤[23]、结直肠癌[24]的临床预后密切相关。Zacharakis等[25]学者报告了1例针对4种突变蛋白(slc3a2、KIAA0368、CADPS2、CTSB)的转移性乳腺癌患者的特异性TILs的过继转移联合疗法使肿瘤持久完全消退。ACT依赖于足够数量的抗肿瘤T细胞介导肿瘤的消灭和根除。而对于TILs水平较低的头颈部鳞状细胞癌,可能不具备足够数量的浸润淋巴细胞进行过继转移。Wei等[26]用体外扩增TILs和HLA匹配的异体C1R细胞作为抗原提呈细胞来筛选新抗原特异性TCR, 并通过体内实验验证了其抗肿瘤效能。虽然过继性免疫治疗表现出了良好的治疗前景,随着研究深入, 一些阻碍因素也逐渐显露,例如靶标毒性(过继T细胞对表达相同靶向抗原的正常组织造成损伤)、脱靶毒性(过继T细胞误伤了表达与靶点抗原相似表位的正常组织)以及免疫微环境对T细胞的抑制作用[27-28],因此筛选合适的靶向抗原、优化过继性T细胞的制备工艺、改善免疫微环境以提高T细胞活性等方向仍需要更多的探索。
2.3 新抗原负荷预测免疫检查点抑制剂疗效
针对PD-1和细胞毒性T淋巴细胞抗原4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)的免疫检查点抑制剂的临床试验中取得了令人欣喜的结果,然而仍有部分患者在病情得到控制后有复发迹象,并可能出现致命的耐药性[29]。大量的文献报道证明肿瘤突变负荷(tumor mutation burden,TMB)与新抗原负荷呈正相关[30]。有研究表明,抗PD-1/PD-L1 或CTLA-4去除免疫抑制,在高突变负荷患者体内可激发机体特异性免疫应答从而显著提高杀伤肿瘤细胞能力。Rizvi等[31]对PD-1抗体pembrolizumab治疗的非小细胞肺癌患者的进行全外显子组测序,发现拥有较高的非同义突变负荷的患者得到了更持久的临床获益(局部或稳定反应时间大于 6 个月)。Snyder等[32]对接受CTLA-4抑制剂Ipilimumab和tremelimumab治疗的黑色素瘤患者肿瘤组织及匹配的血液样本进行了全外显子测序,结果证明突变负荷与黑色素瘤患者的临床获益程度呈现正相关。 McGranahan等[33]也证明了晚期非小细胞肺癌和黑色素瘤患者对PD-1和CTLA-4阻断剂的敏感性在克隆新抗原富集的肿瘤中增强。反之,低TMB的癌症,如前列腺癌等,免疫检查点抑制剂效果就收效甚微。免疫抑制剂疗效的预测标志物对于提高免疫抑制有效性至关重要,特别是对于临床应用最为广泛的PD-1/PD-L1抑制剂或CTLA-4 抑制剂,从近年来的研究结果来看,接受免疫抑制疗法患者的TMB与其临床获益呈显著相关性[34-35]。因此,TMB与新抗原负荷有望成为判断免疫检查点抑制剂疗效和患者预后的理想生物学标志物。
2.4 基于新抗原免疫疗法的联合治疗
目前关于联合治疗大致可分为与其他免疫疗法的联合以及与其他常规疗法的联合。由于PD-1/PD-L1途径对CD8+T细胞介导的抗肿瘤免疫反应具有免疫抑制作用,一些基于新抗原的疫苗或ACT疗法联合检查点抑制剂的临床前研究和早期临床试验已经产生了强大的T细胞应答和抗肿瘤作用。Liu等[36]在抗PD-L1耐药小鼠的胶质母细胞瘤中鉴定了内源性新抗原特异性CD8+T细胞,通过新抗原疫苗与PD-L1抑制剂联合应用可显著提高其生存率。Ni等[37]发现一种双佐剂新抗原纳米疫苗(banNV)可使T细胞上的免疫检查点PD-1致敏,在构建的新抗原特异性大肠癌小鼠模型中,aPD-1+banNVs治疗的小鼠第48天的存活率提高到70%,而单独使用banNVs的存活率仅为40%。此外,化疗对免疫系统的调节作用已经改变了我们对化疗单纯的杀瘤作用的认识,一些化疗药物已经被证明可以诱导亚克隆新抗原,有助于增加突变负荷,并可能与改善抗原呈递或T细胞应答反应有关[38-39]。最新研究表明,以棘状金纳米颗粒为基础的光热疗法通过热诱导细胞和分子损伤破坏肿瘤微环境增加新抗原疫苗的敏感性,而新抗原疫苗可克服光热疗法诱导的局部免疫抑制,两者相辅相成,有效地根治大的原发肿瘤,并对转移性肿瘤形成远距作用[40]。此研究为中晚期肿瘤的治疗带来了新的希望。
3 肿瘤新抗原的免疫逃逸问题
基于新抗原的免疫治疗取得了一定的临床疗效,并且有望成为肿瘤免疫治疗的优质靶标,但是作为一种新兴的治疗方式,尚未形成成熟的设计及应用体系,在发展过程中仍面临着许多亟待解决的问题与挑战,包括:肿瘤异质性对个体化新抗原疫苗的限制;免疫抑制环境的形成对于为肿瘤免疫逃逸创造机会;个体化新抗原疫苗与过继免疫T细胞的制备成本高昂且周期较长;缺乏特异性免疫学指标评价新抗原免疫疗法的免疫应答反应。
其中,肿瘤微环境在肿瘤免疫治疗的应答率和临床结果方面起关键作用。研究表明,具有高TMB和丰富免疫细胞浸润的实体瘤更易在治疗过程中被消灭。但在免疫监视的生存压力下,肿瘤细胞不断进化并且改变着其分子表达,以逃避免疫监视甚至产生免疫抑制。肿瘤免疫编辑过程中,免疫系统与肿瘤的关系可分为3个阶段,即清除、相持和逃逸阶段。免疫系统在肿瘤发生中往往扮演了双重作用,免疫系统在抑制肿瘤生长的同时又对肿瘤具有免疫选择压力下的重塑作用,其中弱免疫原性的肿瘤可能逃脱免疫系统的监视,从而发生逃逸[41-42]。肿瘤细胞在免疫编辑过程中进化出几种机制来逃脱免疫反应[43-44]:1)肿瘤细胞通过改变自身抗原如抗原丢失或下调MHC的表达从而躲避免疫系统的监视;2)肿瘤细胞通过改变微环境如改变信号通路来促进炎症因子的分泌或新生异常血管,一方面维持肿瘤的生长与侵袭,另一方面导致氧、氮自由基的积累可抑制免疫细胞的功能;3)肿瘤细胞通过分泌外泌体、表达抑制性配体介导免疫逃逸。新抗原具有较强的免疫原性,在免疫编辑过程中将极大可能的激发免疫系统的杀伤能力从而被消除,但研究发现肿瘤新抗原仍可能逃避免疫系统的监视。Rosenthal等[45]对非小细胞肺癌的研究中发现免疫编辑的强弱与免疫浸润强度密切相关。免疫浸润的肿瘤区域免疫编辑结果可导致HLA杂合性丧失或表达的新抗原减少,另一方面,新抗原突变基因的启动子超甲基化降低了新抗原的表达。总之,新抗原逃避免疫逃逸机制的空白区域具有开发拓展的重要价值。
4 总结与展望
虽然新抗原疫苗在肿瘤治疗领域具有广阔前景,但面临如下几点主要挑战:1)肿瘤的高度异质性,即表现在空间(细胞间、组织间及器官间)及时间上(同一肿瘤病灶在不同的临床分期)而呈现不同表型特性、高度的遗传异质性和基因突变的多样性。因而所筛选的肿瘤新抗原,难以覆盖所有肿瘤细胞表型和潜在靶点。此外肿瘤患者HLA的异质性,新抗原的提呈和识别存在多态性和显著的个体差异性。这样高度个性化的治疗,限制了新抗原疫苗的广泛应用;2)肿瘤与周围微环境形成相对稳定的小生态系统,具有高度异质化、抑制免疫系统作用、易形成免疫逃逸及保持相对的独立性,是新抗原疫苗治疗实体瘤面临的重要屏障;3)对新抗原的预测缺乏准确性、完整性及有效性。对插入和缺失的突变检测能力十分有限。加上HLA的异质性,增添了预测和筛造表位的难度;4)生产周期长而成本高:新抗原疫苗的生产一般需3~5个月,周期过长以致晚期患者等待的时间难以接受,并且价格高昂,一般患者也难以负担;5)缺乏新抗原免疫治疗的疗效评价系统:新抗原疫苗属于主动性的治疗性方法,暂缺直接的标志物。
肿瘤新抗原免疫治疗充满挑战,也孕育更多的发展机遇。首先,我们猜想是否在肿瘤患者中可能存在通用型抗原从而使疫苗为广大患者服务呢?虽然不同患者间存在通用型的新抗原的概率较低,因很少能从驱动基因发掘新抗原,人们在尝试从非驱动基因突变中发现具有让多数患者获益的新抗原。其次是搞高预测准确性和优化疫苗设计,采用更标准化及统一化的算法系统,增加基因融合、缺失和插入等基因突变因素,并增大MHC II类型识别表位的新抗原的筛选;增强多表位疫苗的设计,减少免疫逃逸的情形,并改良和开发新型佐剂,提高免疫原性。最后,增加联合治疗的方案,如肿瘤抗原疫苗,能诱导抗肿瘤特异性T细胞的形成,结合免疫抑制剂疗法,起协同抗肿瘤的效应;而结合化疗,可降低化疗剂量和不良反应的发生率;与靶向药联合使用,可减轻肿瘤负荷,而获更佳疗效。
随着NGS、蛋白组学及生物信息学的飞速发展、肿瘤与免疫相互作用的研究愈发深入,新抗原免疫治疗设计、研发与应用势必快速发展,相信不久的将来,更完善的新抗原精准免疫疗法将为肿瘤治疗带来一次新革命。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
