PARP抑制剂在恶性肿瘤中的应用及耐药研究进展
2022-11-12杨婉婉叶芳羽吴雨佳王昊辰
杨婉婉,叶芳羽,吴雨佳,王昊辰,赵 丽
(中国药科大学基础医学与临床药学学院,南京 211198)
聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)是一类将ADP-核糖基团转移至靶标蛋白从而影响各种细胞过程的蛋白质超家族,由17种酶构成,它们在维持基因组稳定性和调节信号通路等方面发挥着不可替代的作用。其中PARP-1 在细胞中表达高且响应快,能快速催化并修饰DNA 修复因子,与它们相互作用参与各种DNA修复过程。因此针对DNA损伤修复缺陷的肿瘤细胞,PARP 抑制剂应运而生。PARP 抑制剂的主要作用机制有两种:(1)合成致死效应:PARP-1识别并修复DNA 单链断裂(single-strand breakage,SSB)损伤,结合并捕获在断裂的DNA 上,引起DNA 单链损伤积累,导致更严重的DNA 双链断裂(double-strand breakage,DSB),断裂的双链可以通过同源重组修复(homologous recombination repair,HRR),但在BRCA1/2 突变后 HRR 途径受到抑制,DNA 损伤得不到修复,最终导致细胞死亡。(2)PARP-DNA 捕获理论:PARP 抑制剂将 PARP-1 蛋白捕获在DNA 上,长期存在的PARP-DNA 复合物占据DNA 损伤位点,导致细胞停滞在S 期,PARP捕获的DNA 不断积累,造成了毒性更强的DSB 损伤,干扰DNA 复制,导致复制叉的停滞和后续的双链DNA损伤,从而引起细胞死亡[1]。
1 PARP抑制剂在肿瘤中的应用
1.1 PARP 抑制剂在卵巢癌,乳腺癌,前列腺癌和胰腺癌中的应用
迄今为止,PARP 抑制剂在伴有BRCA1/2 突变的实体瘤中进行了广泛的研究,并被批准用于卵巢癌、乳腺癌、前列腺癌和胰腺癌。目前美国食品药品监督管理局(FDA)批准的PARP 抑制剂有奥拉帕利(olaparib)、尼拉帕利(niraparib)、卢卡帕利(rucaparib)和他拉唑帕利(talazoparib)。获批情况见表1。中国国家药品监督管理局(NMPA)批准的PARP 抑制剂有奥拉帕利、尼拉帕利、氟唑帕利(fluzoparib)和帕米帕利(pamiparib)[2]。
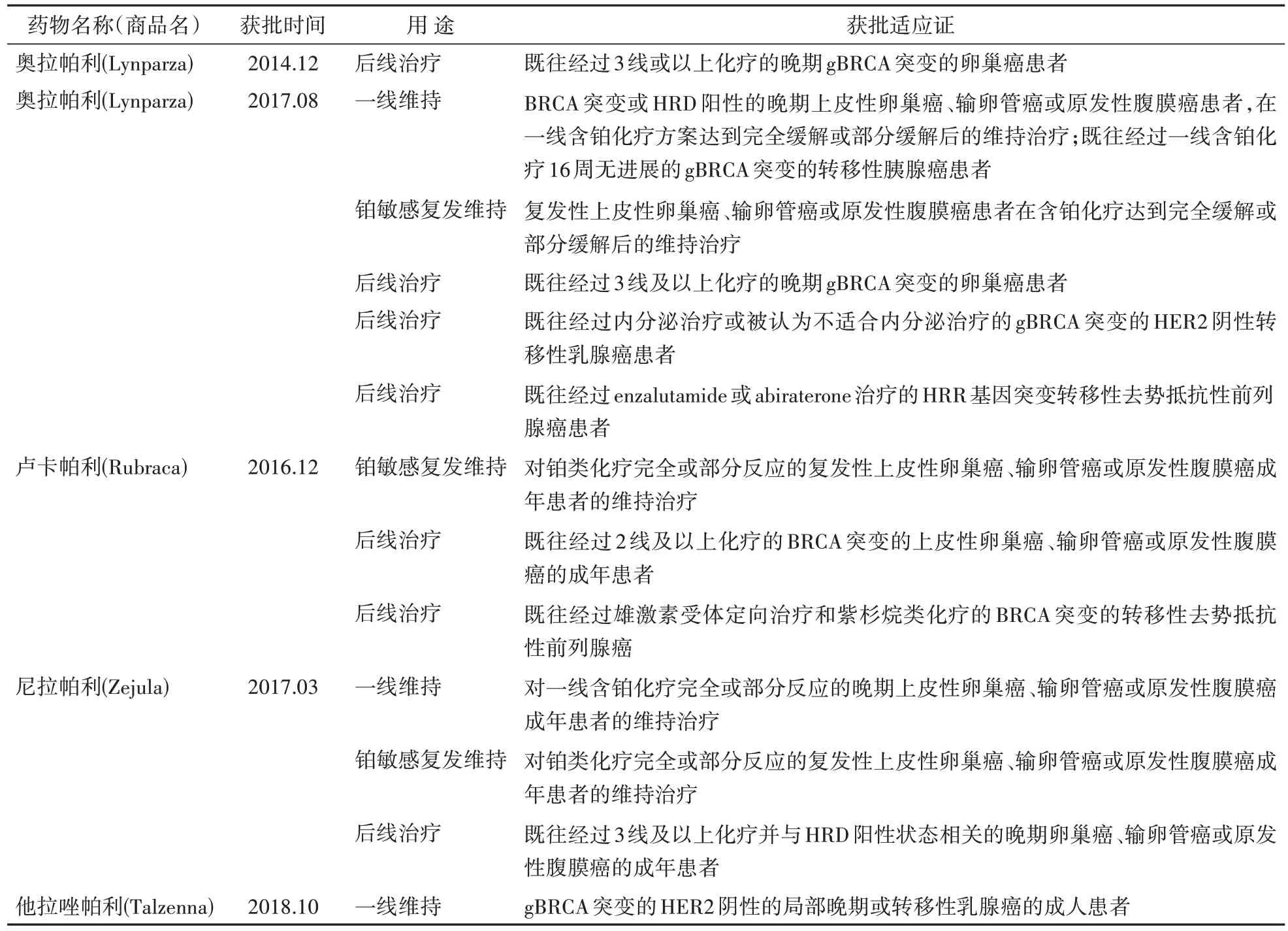
表1 FDA批准的PARP抑制剂
PARP 抑制剂利用合成致死效应形成DNA 双链损伤,HRR 是DNA 双链损伤的重要修复方式,起作用的关键蛋白是BRCA1 和BRCA2,如果肿瘤细胞HRR功能异常(如BRCA突变),就会引起肿瘤细胞死亡。其他HRR 相关基因(如RAD51、ATM、PALB2、MRE11、CHEK2 等)发生突变、或 BRCA 基因启动子甲基化以及其他原因都会引起HRR功能异常(homologous recombination deficiency,HRD),因此在使用PARP 抑制剂之前,有必要对患者进行HRD 检测。HRD 检测是针对HRR 相关基因的检测,BRCA 突变只是导致HRD 的原因之一,虽然BRCA1/2 突变是首选的PARP 抑制剂敏感生物标志物[3],但仅仅存在于约20%的患者中。通过HRR 基因突变检测和基因瘢痕检测反映HRD 状态可将PARP抑制剂的应用扩大至约50%的患者。Ⅲ期 POLO 试验[4]、PRIMA 试验[5]、TOPARP-B[6]等表明HRD 阳性患者使用PARP 抑制剂能够延长患者生存期,HRR 相关基因突变可不同程度预测PARP 抑制剂对患者的疗效,这提示对于非BRCA突变患者,HRD 检测可作为用药参考提高个体化治疗效果。
1.2 PARP抑制剂在其他恶性肿瘤中的应用
1.2.1 肺 癌 在常见恶性肿瘤中,肺癌的发病率和病死率均居首位。小细胞肺癌(small cell lung cancer,SCLC)主要与吸烟有关,约占所有肺癌的10% ~ 15%。SCLC 基因组普遍存在TP53 和RB1失活,这使肿瘤细胞更加依赖DNA 损伤修复。研究发现SCLC 中PARP-1 表达高且对铂类化疗敏感[7],提示DNA 修复损伤在其中发挥重要功能,这与PARP抑制剂的治疗机制不谋而合。PARP抑制剂单药在SCLC 中进行了初步探索,de Bono 等[8]探索了他拉唑帕利在HRD的晚期肿瘤患者中的安全性、药代动力学、药效学和初步疗效,发现在纳入的23 例广泛期SCLC 患者中,他拉唑帕利表现出单药抗肿瘤活性并且耐受性良好。虽然PARP 抑制剂单药表现出良好活性,但作用仍十分有限,PARP 抑制剂与化疗药物联用成为一种选择。两项Ⅰ期临床试验[9-10]研究了维拉帕利(veliparib)与传统铂类化疗药物治疗SCLC 的疗效和安全性。初步发现维拉帕利-卡铂(carboplatin)-依托泊苷(etoposide)组合是安全的。Ⅱ期临床试验[11]评估了替莫唑胺(temozolomide)和维拉帕利在复发SCLC 患者中的疗效和安全性,发现联合治疗组显著改善客观缓解率(objective response rate,ORR),并首次在临床试验中证明Schlafen 家族成员11(Schlafen family member 11,SLFN11)是一种有前景的PARP 抑制剂敏感性生物标志物。SLFN11 是一种被招募到DNA损伤位点、抑制HRR 并激活复制应激反应的蛋白质,其表达水平可预测SCLC对PARP-1 抑制剂的敏感性,这提示以SLFN11 为生物标志物,优化给药方案可实现精准治疗[12]。另一项奥拉帕利和替莫唑胺联合治疗的Ⅰ/Ⅱ期临床试验[13]发现在 50 例患者中,联用组 ORR 为41.7%,无进展生存期(progression free survival,PFS)为4.1 个月,总生存期(overall survival,OS)为8.5 个月,疗效良好。另外维拉帕利联合拓扑替康(topotecan)(NCT03227016),EP0057 和奥拉帕利联合(NCT02769962)治疗SCLC 等都正在研究中。PARP 抑制剂不仅与化疗药物联用显示出显著疗效,也可以增加放疗的敏感性。研究发现维拉帕利和他拉唑帕利联合放疗可抑制SCLC 移植瘤生长,而且PARP-1 捕获可增强这种作用。与维拉帕利相比,他拉唑帕利表现出更强的PARP-1 捕获活性,因此其放射增敏作用更强[14]。提示PARP抑制剂联合放疗治疗肺癌的可行性。
表皮生长因子受体酪氨酸激酶抑制剂(EGFRTKI)耐药已成为晚期肺癌的主要挑战。研究表明PARP-1 在TKI 敏感细胞中的表达低于抗性细胞,且TKI 耐药细胞对PARP 抑制剂的敏感性显著高于TKI 敏感细胞,这在7 ~ 8 个患者来源的肿瘤细胞中得到了验证[15]。进一步研究发现奥拉帕利和埃克替尼(icotinib)组合通过减少体内PARP-1 表达和自噬发挥显著抗肿瘤作用[16]。因此PARP 抑制剂可作为克服TKI耐药的新策略。
1.2.2 肝细胞癌 肝细胞癌(hepatocellular carcinoma,HCC)系原发性肝癌最为典型的病理学分型之一,约占原发性肝癌的85% ~90%,其发生率世界排名第6位,致死率排名第4位。研究表明HRD与肝细胞癌的发生发展存在密切的关系。在分析27 名HCC 患者PARP-1 表达差异时发现与非癌组织相比,癌组织中的PARP-1 蛋白显著增加,且在分化程度较低的肿瘤中PARP-1 的表达更高[17]。不仅如此,与癌旁组织相比,HRR 和非同源末端连接(nonhomologous end joining,NHEJ)修复效率在HCC中显著上调,其中PARP-1和DNA依赖蛋白激酶(DNA-dependent protein kinase,DNA-PKcs)是导致该变化的关键基因。将奥拉帕利与NU7441(DNA-PKcs 抑制剂)联合使用,可协同抑制小鼠和HCC 患者衍生的异种移植模型的生长[18]。除此之外,在用二乙基亚硝胺诱导的肝癌小鼠模型和异种移植瘤中,PARP 抑制剂也显著抑制肿瘤的增殖和血管生成[19]。在肝移植和放射治疗后,PARP-1被诱导上调并通过调节CXCL1/CXCR2 信号传导,进而促进肝脏募集中性粒细胞,导致治疗后HCC复发[20]。PARP1不仅在肝癌细胞DNA修复过程中发挥重要作用,在肝癌细胞增殖过程中也起着关键作用,本课题组在研究肝癌细胞恶性进展过程中发现过表达PARP1能够显著促进肝癌细胞的增殖。这提示PARP 抑制剂应用于治疗HCC 并缓解复发的可能性。
索拉菲尼(sorafenib)被FDA 批准为晚期HCC的一线治疗药物。然而耐药性的发展通常会阻碍其长期疗效。研究发现在异种移植小鼠模型中用索拉菲尼治疗后,PARP-1被激活并通过维持“开放染色质”结构来促进DNA 损伤修复。这导致肝癌细胞对索拉菲尼产生抗性。体内外实验也证实奥拉帕利和尼拉帕利可显著增加索拉菲尼的疗效[17]。提示PARP 抑制剂与索拉菲尼联用解决耐药的可行性。
1.2.3 胶质母细胞瘤 胶质母细胞瘤(glioblastoma multiforme,GBM)是最常见的侵袭性原发性恶性脑肿瘤,目前治疗主要包括手术切除后放疗和化疗。然而中位生存期仅略微延长,且复发肿瘤在数月内就会出现。研究发现PARP-1在GBM 中过表达,且PARP-1 的表达水平与肿瘤分级呈正相关,与患者存活率呈负相关[21]。患者来源的胶质瘤干细胞(glioma stem cells,GSC)对他拉唑帕利治疗表现出显著敏感性[22]。虽然在 GBM 中 BRCA 突变并不常见[23],但携带着其他类BRCA标志物如异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)1/2、表皮生长因子受体(epidermal growth factor receptor,EGFR)、磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)、MYC 原癌基因和雌激素受体 β(estrogen receptor β,ERβ)等,这些生物标志物能够预测GBM 对PARP 抑制剂治疗的反应,实现精准治疗[24]。临床前实验发现在原位GBM小鼠模型中,奥拉帕利联合放疗显著延迟了体外和体内的复发,提高了小鼠的总体存活率[25]。基于此,研究者研究了一种131I标记的PARP-1治疗剂,131I-PARP治疗剂和FDA 批准的PARP 抑制剂奥拉帕利具有相似的药理学特征,能通过肿瘤内对流增强递送实现局部给药,这为PARP 抑制剂在脑肿瘤放疗的维持治疗提供了参考[21]。Ⅰ期OPARATIC 试验发现低浓度(100~1 000 nmol/L)下,奥拉帕利在测试的6 个GBM 细胞系中能够显著增加放疗敏感性,且奥拉帕利与低剂量替莫唑胺联合使用安全性和耐受性良好,值得注意的是,为减轻奥拉帕利的血液学毒性,需间歇减量给药[26]。相关临床试验也在开展,Ⅱ期临床试验(NCT03212274)评估奥拉帕利在复发/进行性IDH1/2 突变实体瘤包括GBM 中的疗效,另一项Ⅱ期临床试验(NCT03561870)评估奥拉帕利在复发性IDH 突变高级别GBM 中的疗效。另外,肿瘤电场治疗(tumor-treating fields,TTFields)与尼拉帕利治疗复发性GBM的Ⅱ期临床试验(NCT04221503)也正在开展。
错配修复(mismatch repair,MMR)缺陷的出现是GBM 对化疗药物替莫唑胺产生获得性耐药的常见机制。研究发现不依赖于O-6-甲基鸟嘌呤DNA 甲基转移酶(O-6-methylguanine DNA methyltranferase,MGMT)和PTEN,替莫唑胺联合PARP抑制剂可用于克服化疗药物获得性耐药性[27]。相关临床试验正在开展,Ⅰ期临床试验(NCT01390571)研究奥拉帕利和替莫唑胺治疗复发性GBM 患者的不良反应和最佳剂量。另一项Ⅰ期临床试验(NCT03749187)研究帕米帕利和替莫唑胺治疗新诊断或复发的IDH1/2 突变GBM 患者的不良反应和最佳剂量。Ⅱ期临床试验研究维拉帕利、替莫唑胺联合放疗在治疗新诊断的没有H3K27M 或BRAFV600突变的恶性GBM患者的疗效。Ⅱ/Ⅲ期临床试验(NCT02152982)研究替莫唑胺和维拉帕利在治疗新诊断的多形性GBM患者的疗效。
1.2.4 白血病 急性髓细胞白血病(acute myeloid leukemia,AML)是一种具有遗传多样性和侵袭性的血液恶性肿瘤。近年来不断有揭示白血病发生的分子机制,虽然在白血病中与DNA 损伤修复相关的基因组突变频率较低[28],但仍有其他基因突变使白血病对PARP 抑制剂敏感。在AML 中,研究发现 c-kit 原癌基因突变,IDH1/2 突变,TP53 和BCL6 辅抑制因子(recombinant Bcl6 corepressor,Bcor)突变,Fms样酪氨酸激酶3基因内部串联重复(Fms-like tyrosine kinase 3 internal-tandem duplication,FLT3-ITD)和TET 甲基胞嘧啶双加氧酶2(ten eleven translocation methylcytosine dioxygenase 2,TET2)缺失,基质抗原2(stromal antigen 2,STAG2)突变,这些基因改变均使患者对PARP 抑制剂敏感。在急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)中,转录因子3-肝白血病因子(transcription factor 3-hepatic leukemia factor,TCF3-HLF),TET1突变使患者对PARP抑制剂敏感,尚未在 ALL 中发现阻碍 PARP 敏感性的基因改变[28]。这为PARP抑制剂在白血病中应用可行性提供了理论基础。研究分析339 例细胞遗传学正常的AML(cytogenetically normal acute myeloid leukemia,CNAML)患者中PARP-1 的表达,发现与正常骨髓细胞相比,CN-AML 患者细胞中PARP-1 表达显著增加,且PARP-1 表达高的患者总生存期短[29]。临床前研究发现维拉帕利可有效增强烷化剂替莫唑胺在AML 中的疗效。基于此,Ⅰ期临床试验(NCT01139970)[30]研究维拉帕利联合替莫唑胺治疗AML 患者的不良反应和最佳剂量,安全性和耐受性良好。其他相关临床试验也在开展中,Ⅰ期临床试验(NCT05101551)研究他拉唑帕利与常规化疗拓扑替康+吉西他滨(gemcitabine)联合治疗AML 患者的安全性,并确定联合使用时的最大耐受剂量(maximal tolerable dose,MTD)。Ⅱ期临床试验(NCT03953898)研究奥拉帕利在治疗复发、难治性或骨髓增生异常综合征的AML 患者中的效果。
1.2.5 宫颈癌 宫颈癌(cervical cancer,CC)是常见的导致女性患癌死亡的癌种。研究发现CC中信号转导和转录激活因子1(signal transduction and activation of transcription 1,STAT1)可在转录和转录后水平上调节CC 细胞中PARP-1 的表达,使用PARP 抑制剂可选择性提高抗性CC 细胞对药物治疗的敏感性。GEPIA 和TCGA 数据库分析表明,CC中PARP-1 mRNA 高于正常组织,并且PARP-1 mRNA表达水平的增加与CC患者不良预后相关[31],这提示PARP 抑制剂可能作为CC 化疗后的维持治疗。Ⅰ期临床试验(NCT#01281852)[32]研究了维拉帕利、紫杉醇(paclitaxel)和顺铂(cisplatin)联合治疗持续性和复发性CC 患者时的不良反应和MTD,发现组合治疗剂量安全可行,29 名可分析患者的ORR 为34%。相关临床研究也在进行中,Ⅱ期临床试验帕博利珠单抗(pembrolizumab)联合奥拉帕利治疗CC(NCT04483544),卢卡帕利联合贝伐珠单抗(bevacizumab)治疗CC(NCT03476798)、第二代PARP 抑制剂AZD5305 与抗癌药联合治疗晚期实体瘤包括CC(NCT04644068)的研究正在开展,PARP抑制剂有望在CC治疗中发挥作用。
2 PARP抑制剂的耐药机制及解决策略
2.1 PARP抑制剂的耐药机制
PARP 抑制剂虽然在恶性肿瘤的治疗中发挥重要的作用,但也不可避免地会产生耐药,这对靶向治疗造成了巨大阻碍。目前,PARP 抑制剂的主要耐药机制有以下几点:(1)HRR 的恢复:这是PARP 抑制剂获得性耐药经典的机制之一,由于回复突变或NHEJ 活性的抑制使HRR 恢复,肿瘤细胞继续存活。回复突变指二次突变重新激活BRCA1/2,BRCA1/2 的开放阅读框恢复,从而使其蛋白活性恢复,导致肿瘤细胞DNA 损伤功能恢复,最早在被诊断患有BRCA 突变的乳腺癌和卵巢癌患者中发现[33]。除此之外,对于DSB 损伤,主要有NHEJ 和 HRR 两种修复,P53 结合蛋白 1(p53-binding protein 1,53BP1)是一种参与 NHEJ 的蛋白质,在G1期保护DSB 末端免受外切核酸酶处理。在BRCA 突变细胞中,DSB 主要通过NHEJ途径修复,53BP1 的下调或缺失导致HRR 功能部分恢复,从而引起耐药[34]。(2)药物外排蛋白过表达:迄今为止开发的部分PARP 抑制剂长期用药会导致P-糖蛋白和乳腺癌抗性蛋白水平上调使药物外排增加,引起药物浓度降低,从而产生耐药。(3)药物靶点的变化:PARP-1 点突变、启动子甲基化均引起PARP-1 蛋白水平降低,从而导致PARP 抑制剂的获得性耐药。(4)致死性DNA 损伤减少:复制叉稳定性增加使DNA 链不能被降解,不能形成足够的致死性DNA损伤也导致对PARP抑制剂耐药。
2.2 PARP抑制剂耐药解决策略
2.2.1 PARP 抑制剂与DNA 损伤修复抑制剂联用 PARP 抑制剂的功能决定了其耐药机制并不集中在靶标蛋白突变上,肿瘤细胞倾向于改变DNA损伤修复状态导致耐药。在DNA损伤修复过程中,除了PARP-1 外,其他相关蛋白也参与损伤修复,如共济失调-毛细血管扩张突变蛋白(ataxia telangiectasia-mutated,ATM)被DSB 招募并执行检查点信号和DNA 修复;共济失调毛细血管扩张Rad3 相关蛋白(ataxia telangiectasia-mutated and Rad3 related,ATR)能被复制压力激活,从而稳定和重启复制叉;细胞周期检查点激酶1/2(checkpoint kinase 1/2,ChK1/2)是在 ATR 和 ATM 下游起作用的激酶;WEE1 是一种典型的检查点激酶,对有丝分裂负调节;磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)和细胞间质上皮转换因子(cellular-mesenchymal epithelial transition factor,c-Met)能够稳定HRR,控制DNA 修复断裂。若作为单药治疗,这些靶点抑制剂的疗效取决于相关的生物学功能。由于每种抑制剂针对靶点的局限性,DNA 损伤修复抑制剂之间联合治疗可能是一种可行的治疗策略[35]。
CDK4/6 抑制剂帕博西尼(palbociclib)能与CDK4 单独结合,抑制细胞周期从G1期进入S 期从而使肿瘤细胞死亡,已获FDA 批准治疗晚期乳腺癌。最近研究表明,帕博西尼和奥拉帕利联用可抑制三阴性乳腺癌(triple-negative breast cancer,TNBC)生长。在奥拉帕利耐药的乳腺癌细胞中,Wnt信号通路被激活并导致奥拉帕利抗性,通过与帕博西尼联合治疗可提高奥拉帕利的疗效[36]。在前列腺癌中也得到了一致效果。膀胱癌中也发现他拉唑帕利和帕博西尼组合可有效增强BRCA 突变患者的疗效[37]。除此之外,在 TNBC 中发现CDK12 抑制剂也可以增加肿瘤细胞对PARP 抑制剂的敏感性[38],提示联合 PARP 抑制剂和 CDK 抑制剂可能是一个有前景的策略。
WEE1 是丝氨酸/苏氨酸蛋白激酶家族中的一员,是DNA 损伤修复通路和细胞周期相关的重要激酶。研究表明在TNBC,SCLC 和胰腺癌中,PARP 抑制剂与WEE1 抑制剂联用可增加治疗效果,减轻 WEE1 抑制剂的毒性作用[39]。AML 和ALL 中也发现WEE1 抑制剂adavosertib 和奥拉帕利的协同作用,AML 鼠模型中得到证实[40]。这给临床试验的可行性提供了基础。
ATR 是磷脂酰肌醇3-激酶相关激酶蛋白家族成员,被激活后可调控细胞周期阻滞、启动复制叉和修复DNA 损伤等。在小鼠皮下和原位肺癌模型中发现ATR 抑制剂ceralasertib 联合奥拉帕利大大增强了对皮下肿瘤的疗效[41]。在GBM 中也发现ATR 抑制剂berzosertib 与PARP 抑制剂联合可延长携带GSC 衍生原位肿瘤的小鼠的生存期,即便对PARP 抑制剂无反应或难治性肿瘤也有效果[42]。除此之外,研究显示缺失ATM 基因的前列腺癌患者对 PARP 抑制剂联合 ATR 抑制剂高度敏感[43]。奥拉帕利联合ceralasertib 在复发性高级别浆液性卵巢癌(high-grade serous ovarian cancer,HGSOC)中的临床试验(NCT03462342)也正在进行。
CHK1 抑制剂prexasertib 与奥拉帕利联合在HGSOC 患者源性异种移植耐药模型中产生了显著的肿瘤抑制作用[44]。在此基础上,进一步发现CHK1 抑制剂不仅可用于HR 修复功能正常且对PARP 抑制剂具有固有抗性的肿瘤,还可克服已恢复HR 修复功能的BRCA 突变性肿瘤对PARP 抑制剂的耐药性[45]。随后的临床试验研究了prexasertib联合奥拉帕利对PARP 抑制剂耐药HGSOC 患者的缓解作用。发现18 名患者中有4 名得到了缓解,显示联合治疗有初步疗效[46]。
PI3K 在肿瘤细胞的生长转移与扩散中发挥着关键作用。在GBM 中发现卢卡帕利和PI3K 抑制剂buparlisib 同时治疗具有协同抗癌作用[47]。在BRCA 突变的TNBC 中也发现buparlisib 与奥拉帕利联合能够扩大奥拉帕利的应用[48]。除此之外,buparlisib 和他拉唑帕利在SCLC 细胞系和异种移植瘤中显示出显著活性[49]。这在临床试验中得到了验证,Ⅰ期临床试验研究了buparlisib 和奥拉帕利联合给药对复发性乳腺癌或卵巢癌的疗效,发现在可评价的59名患者中,卵巢癌有效率为29%,乳腺癌有效率为28%,疾病稳定率近50%,总的疾病控制率(disease control rate,DCR)为76%[50]。提示联合给药的可行性。
c-Met 是受体酪氨酸激酶家族成员。c-Met 信号通路激活促使肿瘤形成、侵袭和转移。研究发现c-Met 可通过磷酸化PARP-1 增加其酶活,从而引起乳腺癌细胞对PARP 抑制剂产生抵抗。联合使用c-Met和PARP 抑制剂可以协同阻止乳腺癌细胞的生长,在小鼠的肺癌模型中也有一致的效果[51]。胃癌、HCC、前列腺癌、胰腺癌中也有相似的结果。卡博替尼(cabozantinib)和帕米帕利联合治疗实体瘤的临床试验(NCT05038839)正在进行,提示联合c-Met抑制剂和PARP 抑制剂是一种有前景的策略。
2.2.2 PARP 抑制剂与免疫检查点抑制剂联用目前研究发现的免疫检查点有程序性死亡蛋白-1(programmed cell death protein-1,PD-1)、程序性死亡配体-1(programmed death ligand-1,PD-L1)以及细胞毒性T淋巴细胞相关抗原-4(cytotoxic tlymphocyte associated antigen-4,CTLA-4)。针对这些靶点设计的免疫检查点抑制剂能够激活肿瘤免疫应答反应,实现抗肿瘤作用。研究发现尼拉帕利可上调卵巢癌细胞表面PD-L1的表达,增强CD8+T的比例和功能,对肿瘤微环境产生免疫抑制作用[52]。与免疫检查点抑制剂联合治疗可诱导肿瘤细胞对PARP 抑制剂敏感,且联用比单用有更强的抗肿瘤活性[53],因此联合PARP抑制剂和免疫检查点抑制剂不失为一种有前景的策略。胰腺癌中发现与帕米帕利单药相比,帕米帕利联合PD-1/PD-L1 抑制剂显著增强了治疗效果,且这种作用不依赖BRCA的状态[54]。在乳腺癌、卵巢癌中也得到了一致的结果。基于此,相关临床试验已经开展并获得了不错的结果,Ⅰ/Ⅱ期临床试验(NCT02657889)[55]评估尼拉帕利和帕博利珠单抗联合治疗TNBC 或复发性卵巢癌患者的安全性和有效性,并确定了临床试验Ⅱ期推荐剂量(recommended phase Ⅱdose,RP2D)。MEDIOLA 试验(NCT02734004)[56]评估奥拉帕利与度伐单抗(durvalumab)联合用于BRCA2突变的转移性乳腺癌和卵巢癌患者的安全性和活性,结果显示在32 例卵巢癌患者中,28 周DCR 为65.6%,ORR 为71.9%,其中7 例患者达到了完全缓解(complete remission,CR)。在30 例乳腺癌患者中,28 周DCR 为50%,缓解持续时间(duration of response,DOR)为 9.2 个月,PFS 为8.2个月,OS为21.5个月,这提示PARP 抑制剂联合免疫检查点抑制剂治疗实体瘤是可行的。除此之外,PARP 抑制剂联合帕博利珠单抗(NCT02861573、NCT03834519)和 度 伐 单 抗 (NCT03810105、NCT03810105)治疗晚期前列腺癌,奥拉帕利联合抗 CTLA4 抗 体 曲 美 木 单 抗(tremelimumab)(NCT02571725)治疗复发性卵巢癌,奥拉帕利联合度伐单抗(NCT02484404)治疗晚期实体瘤,这些临床试验均在开展中。
2.2.3 PARP 抑制剂与抗血管生成药物联用 血管内皮生长因子(vascular endothelial growth factor,VEGF)具有促进血管新生和再生的功能。VEGFR抑制剂通过抑制肿瘤细胞的血管生成,减少肿瘤细胞的营养获取,最终达到治疗目的。研究发现VEGFR3 抑制剂能够诱导HRR 相关蛋白质BRCA1/2 和 RAD51 的下调,对增强 PARP 抑制剂的敏感性具有潜在价值,因此联合VEGFR 抑制剂和PARP 抑制剂治疗成为一种选择。在卵巢癌异种移植瘤中发现VEGFR 抑制剂西地尼布(cediranib)能够增加奥拉帕利的敏感性,且这种作用和BRCA 状态无关[57]。相关临床研究也给患者带来了希望。Ⅱ期 EVOLVE 研究[58](NCT02681237)评估了奥拉帕利联用西地尼布对PARP 抑制剂治疗失败的HGSOC 患者的疗效。34 名患者分为3 组:治疗后的铂敏感患者(PS 组)、治疗后的铂耐药患者(PR 组)、治疗中进展并再次化疗(PE 组)。BRCA 突变比例分别是 9/11(PS 组),8/10(PR 组),7/13(PE 组),共有4 名患者治疗后有部分反应(PR组 2 名,PE 组2 名),18 名患者维持稳定,一年后总生存率 PS 组为 81.8%,PR 组为 64.8%,PE 组为39.1%。提示PARP 抑制剂治疗失败后联用西地尼布是可行的,这是目前评估PARP 抑制剂治疗失败及相关组织基因组耐药机制的最大前瞻性临床试验。另一项Ⅱ期临床试验(NCT02354131)研究了尼拉帕利单药与尼拉帕利和贝伐珠单拉联合治疗铂敏感复发性卵巢癌的疗效,发现与单独使用尼拉帕利相比,联用组PFS 显著提高(11.9 个月vs 5.5个月)[59]。除此之外,其他相关的临床试验也给出了肯定的答复。Ⅰ期临床试验(NCT01116648)验证了西地尼布和奥拉帕利的组合在卵巢癌患者的可行性。其他相关临床试验正在进行中,如Ⅱ/Ⅲ期临床试验(NCT02502266)研究西地尼布和奥拉帕利联合在复发性卵巢癌中的疗效。Ⅱ期临床试验(NCT03117933)比较奥拉帕利单药、西地尼布联合奥拉帕利或紫杉醇在铂耐药乳腺癌患者中的疗效。
2.2.4 PARP 抑制剂与其他化疗药物联用 大多数化疗药物的作用机制是直接或间接损伤DNA 链从而杀伤肿瘤细胞,大量临床前数据表明PARP 抑制剂联用化疗药物具有协同增效的作用。PARP抑制剂与烷化剂替莫唑胺或卡铂联合治疗实体瘤的临床前研究已有很多,临床试验也相继开展[9,11,26,30]。PARP 抑制剂与拓扑异构酶(topoisomerase,Topo)抑制剂联合应用使肿瘤细胞合成致死的研究也有很多,Ⅰ期临床试验发现维拉帕利联合拓扑替康治疗AML[60],维拉帕利联合伊立替康(irinotecan)治疗晚期实体瘤[61]都是可行的,他拉唑帕利联合拓扑替康治疗 AML 患者(NCT05101551),维拉帕利联合拓扑替康治疗实体瘤(NCT01012817)的临床试验正在进行中。此外,蒽环类化疗药物多柔比星(adriamycin),抗代谢类化疗药物卡培他滨(capecitabine),蛋白酶体抑制剂类化疗药物硼替佐米(bortezomib)与PARP 抑制剂也体现出良好的协同作用。
3 总结与展望
作为一种新型抗肿瘤药物,PARP 抑制剂一方面在HRD 的肿瘤治疗中起着重要的作用,另一方面,针对PARP 抑制剂治疗局限性,采用PARP抑制剂与其他抗肿瘤药物联合应用也表现出良好的疗效,但PARP 抑制剂仍面临着重大的挑战:(1)联合用药的安全性:在联用其他药物克服耐药性的同时,如何在保证疗效的同时减轻不良反应。(2)HRD 检测手段:除了HRR 基因突变检测和基因瘢痕检测,能否研究其他精确高效的手段或工具检测HRR相关基因的突变,降低患者检测成本。(3)PARP 抑制剂敏感的生物标志物:随着PARP 抑制剂临床研究及临床前研究的不断进行,有必要筛选出针对PARP 抑制剂敏感的生物标志物。通过分析血液,尿液,粪便和肿瘤组织样本,确定对PARP 抑制剂敏感的生物标志物,有利于实验精准治疗。这个艰巨的任务需要密切的多学科合作,才能最终应用于临床实践。(4)PARP 抑制剂在其他癌种中的应用:目前PARP 抑制剂在乳腺癌、卵巢癌、前列腺癌和胰腺癌中得到了广泛应用,这基于PARP1的合成致死效应。是否能从其他方面如PARP1 对增殖、免疫、侵袭转移等的影响来探讨PARP 抑制剂在其他非HRD 癌种中应用的合理性值得思考。总之,PARP 抑制剂有望给更多的恶性肿瘤患者带来希望。
