春季油樟可培养内生真菌多样性及产黄酮功能初筛
2022-11-11周万海刘雯雯胡连清冯瑞章赵善梅任玉嫣
周万海,刘雯雯,魏 琴,胡连清,冯瑞章*,赵善梅,任玉嫣
春季油樟可培养内生真菌多样性及产黄酮功能初筛
周万海1,2,刘雯雯1,2,魏 琴1,2,胡连清1,2,冯瑞章1,2*,赵善梅1,2,任玉嫣2
1. 宜宾学院四川省油樟工程技术研究中心,四川宜宾 644007;2. 宜宾学院农林与食品工程学部,四川宜宾 644007
为开发油樟内生菌资源并发现潜在活性成分,本研究以春季油樟健康植株的根、茎、叶为材料,采用组织培养法分离纯化可培养内生真菌,结合ITS序列和系统发育树分析菌株多样性,筛选具有产黄酮功能菌株,设计单因素和正交试验优化产黄酮效果最佳菌株的发酵条件。结果表明:从油樟中共分离到62株可培养内生真菌,划分为3门、7纲、14目、22科、28属、54种。其中优势门为子囊菌门(Ascomycota,RF为88.71%),优势纲为座囊菌纲(Dothideomycetes,RF为45.16%),优势目为格孢腔菌目(Pleosporales,RF为37.10%),优势科为格孢菌科(Pleosporineae,RF为14.52%)、亚隔孢壳科(Didymellaceae,RF为12.90%),优势属为链格孢属(,RF为12.90%)、附球菌属(,RF为11.29%)。以纲为类群单位,根组织分离的16属20种21株真菌的系统发育可分为7个类群,茎分离的13属24种30株真菌则分为2个类群,叶的8属10种11株真菌则分为3个类群。多样性指数和均匀度系数结果表明,油樟根部内生真菌种群多样性相对较丰富,群落分布相对均匀。10株内生真菌具有产黄酮功能,5株来自根部,5株来自于茎部,隶属2门3纲5目8科9属,其中YZ-29菌株产黄酮能力相对较强。YZ-29菌株最优发酵条件为初始pH 7、时间7 d、温度30℃、转速175 r/min、装液量80 mL/150 mL。综上结果显示,内生真菌在油樟不同组织数量、种群及组成上存在差异,分离得到的功能性菌株值得深入挖掘和开发利用,为开展内生真菌在油樟抗氧化成分的生物合成机制方面的研究奠定基础。
油樟;内生真菌;多样性分析;黄酮;发酵条件
植物内生真菌是指长期或生活史中某一个阶段共生或寄生于健康植物组织而不引起植物组织明显病理症状的一类丝状微生物[1]。几乎所有植物体内都有内生真菌的存在,且微生物种类随植物种类、地域、季节或组织部位等不同而不同。植物内生真菌和宿主已形成互利共生关系,内生真菌能促进宿主植物生长、抵抗外界不良环境、促使活性物质的产生[2],同时自身能代谢分泌种类多样、活性强且结构新颖的天然物质,包括生物碱、萜类化合物、黄酮类化合物、环肽类等药用成分[3]。因此,植物内生真菌被认为是挖掘具有应用价值的天然产物的重要潜在资源和热点研究领域[4-5]。
油樟[(Gamble) N. Chao]属樟科、樟属,是我国特有的香料林业资源,从油樟根、茎、叶组织提取的油樟油是国防、医药、日化、食品等行业不可缺少的重要原料[6]。油樟富含黄酮成分且具有较强的抗氧化能力,杜永华等[7]以油樟叶为材料提取总黄酮量42.09 mg/g;梁寒峭等[8]利用大孔树脂纯化从脱油油樟叶渣中获得总黄酮质量分数72.4%±0.5%;程贤等[9]研究证明春秋两季油樟叶精油总抗氧化能力达到维生素C(Vitamin C, Vc)的40%。基于共生理论[10],油樟内生真菌可能会代谢产生黄酮类物质。关于油樟内生菌的多样性和功能性研究已有一些报道,如严宽等[11]发现2J1和3J1内生真菌孢子悬浮液分别喷洒在油樟叶片上均能显著提高叶片挥发油的含量;冯瑞章等[12]从油樟中筛选得到的YG43、YG60和YG25内生溶磷细菌,在促进植物生长、提高抗性和生物防治方面具有应用潜力;黄金风[13]通过紫外线诱变油樟叶分离的内生细菌,筛选出高产α-松油醇菌株;周万海等[14]研究表明不同季节油樟叶内生细菌的种群数量、均匀度、优势度均存在差异。大部分研究集中于内生细菌,针对油樟内生真菌根、茎、叶不同组织的可培养内生真菌多样性及产黄酮功能筛选少见报道。
四川省宜宾市是全国最大且最集中的油樟产地,占全国油樟总资源的75%以上,其生长的油樟存在与其他地区、其他物种完全不同的潜在的内生真菌资源[15-17]。本研究以四川省宜宾市春季油樟为材料,研究根、茎、叶不同组织可培养内生真菌的多样性和分布情况,筛选具有产黄酮功能菌株,为油樟内生真菌资源多样性及提供可应用的功能菌株奠定基础。
1 材料与方法
1.1 材料
供试植物材料采集于四川省宜宾市高县月江森林经营所油樟母本园(28°47'77²N,104°59'76²E)的春季40龄健康油樟根、茎、叶,装入无菌袋中24 h内分离培养。马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA)用于内生真菌的分离和纯化,马铃薯葡萄糖液体培养基(potato dextrose broth, PDB)用于内生真菌的发酵培养。
1.2 方法
1.2.1 油樟可培养内生真菌的分离纯化 用自来水冲洗油樟根、茎、叶组织表面,无菌滤纸吸干表面水分后,转入到灭菌瓶中进行表面灭菌。无菌水冲洗2次后,95%乙醇漂洗1 min,无菌水冲洗1次,4%次氯酸钠漂洗5 min,95%乙醇漂洗1 min,无菌水冲洗4~6次。为验证消毒是否彻底,将最后一次冲洗过的无菌水涂布在分离培养基上作空白对照,28℃培养并观察,未见任何菌长出才说明表面消毒彻底。将消毒后的组织放在无菌滤纸上吸干水分,利用无菌剪刀将根斜剪成1 cm小段,茎段斜剪切成小圆片,叶片剪成约0.5 cm´0.5 cm小叶块,分别接种到3个固体培养基上,28℃恒温培养箱培养。待菌落长出后,挑取不同形态菌落至新的平板上,连续传代培养至菌落形态单一[18]。
1.2.2 内生真菌ITS rRNA序列分析 采用真菌通用引物扩增内转录间隔区ITS序列(ITS1:5¢-TCCGTAGGTGAACCTGCGG-3¢,ITS4:5¢-TCCTCCGCTTATTGATATGC-3¢)。总PCR反应体系为总体积50 μL:ddH2O 21 μL,2×PCR Master Mix 25 μL,ITS1和ITS4引物各1 μL,模板DNA 2 μL。反应条件为94℃预变性10 min,94℃变性30 s,58℃退火30 s,72℃延伸45 s,共35个循环,最后72℃终延伸10 min。扩增目标产物用1%琼脂糖凝胶电泳检测,合格后送生工生物工程(上海)股份有限公司进行测序。测序结果利用NCBI网站BLAST程序在线进行序列的同源性比对,MEGA X软件聚类分析,采用邻接法(neighbor joining method)构建系统发育树,其中bootstrap检验值≥50%,重复1000次[19]。
1.2.3 多样性分析 物种丰富度(species richness, S)、香农-维纳指数Shannon-Weiner多样性指数(H¢)、辛普森指数(simpson index, D)、均匀度指数(Evenness index, E)计算公式[20]:
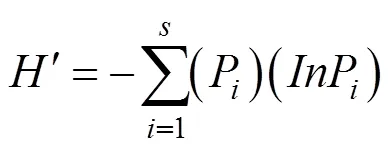
式中,i为属相对频率(PF),指样本中分离到的某属内生真菌的菌株数占分离到的总菌株数的百分比。
1.2.4 内生真菌产黄酮功能菌株筛选 因考虑到试剂安全性和试验简便性,参考王欢等[21]的研究选择氯化铝溶液、氢氧化钠溶液和氯化铁溶液进行显色反应筛选黄酮菌株,利用紫外分光光度法测定黄酮含有量。
1.2.5 最佳菌株发酵条件的优化 选取培养时间(d)、培养温度(℃)、转速(r/min)、装液量(mL/150 mL)和培养基起始pH共5种单因素水平进行单因素试验,如表1所示。设置基本发酵条件为起始pH,将目的菌株接入装液量50 mL/150 mL发酵培养基中,28℃、150 r/min条件下振荡培养7 d,以此为基础,调整各因素水平。选取4因素3水平进行L9(34)正交试验,确定最适发酵条件。

表1 单因素试验的因素和水平
2 结果与分析
2.1 内生真菌的分离
从油樟根、茎、叶组织分离的菌株经过分离纯化共获得62株内生真菌,不同器官分离获得的内生真菌菌株数量存在差异,其中根部21株、茎部30株、叶部11株(表2)。对其完成分子鉴定并进行分子系统学分析,62株菌株归属于3门、7纲、14目、22科、28属、54种(表3)。相对频率(RF)显示样本真菌群落中某类真菌的优势度[22],所有分离菌株中,优势门为子囊菌门(Ascomycota,RF为88.71%),优势纲为座囊菌纲(Dothideomycetes,RF为45.16%),优势目为格孢腔菌目(Pleosporales,RF为37.10%),优势科为格孢菌科(Pleosporineae,RF为14.52%)、亚隔孢壳科(Didymellaceae,RF为12.90%),优势属为链格孢属(,RF为12.90%)、附球菌属(,RF为11.29%)。62株内生真菌划分的28属所占比例见图1,其中,和占比最多,其次是。按照油樟不同部位菌株分布显示,根的21株菌鉴定为7纲11目13科16属,分别是,优势属为;茎的30株菌鉴定为2纲6目11科13属,分别是,优势属为;叶的11株菌鉴定为3纲7目8科8属,分别是,其中各种属所占比例差别较小,无优势菌属。果实和茎的共有属为,根和叶的共有属为,茎和叶共有属为,茎、叶和花未见共有属(图2)。
2.2 不同组织内生真菌系统发育树
将菌株ITS序列测定后在GenBank数据库进行比对分析,选用已发表文章的序列或权威机构的序列与本研究中62株代表菌株的ITS序列进行系统发育树的构建,以邻接法构建油樟根(图3A)、茎(图3B)和叶(图3C)组织分离的可培养内生真菌的系统发育树。以纲为类群单位,系统发育树将根组织中分离的16个属分为7个不同的类群,将茎组织中分离的13个属分为2个不同的类群,将叶组织中分离的8个属分为3个不同的类群,说明油樟不同组织分离的可培养内生真菌系统发育存在多样性。
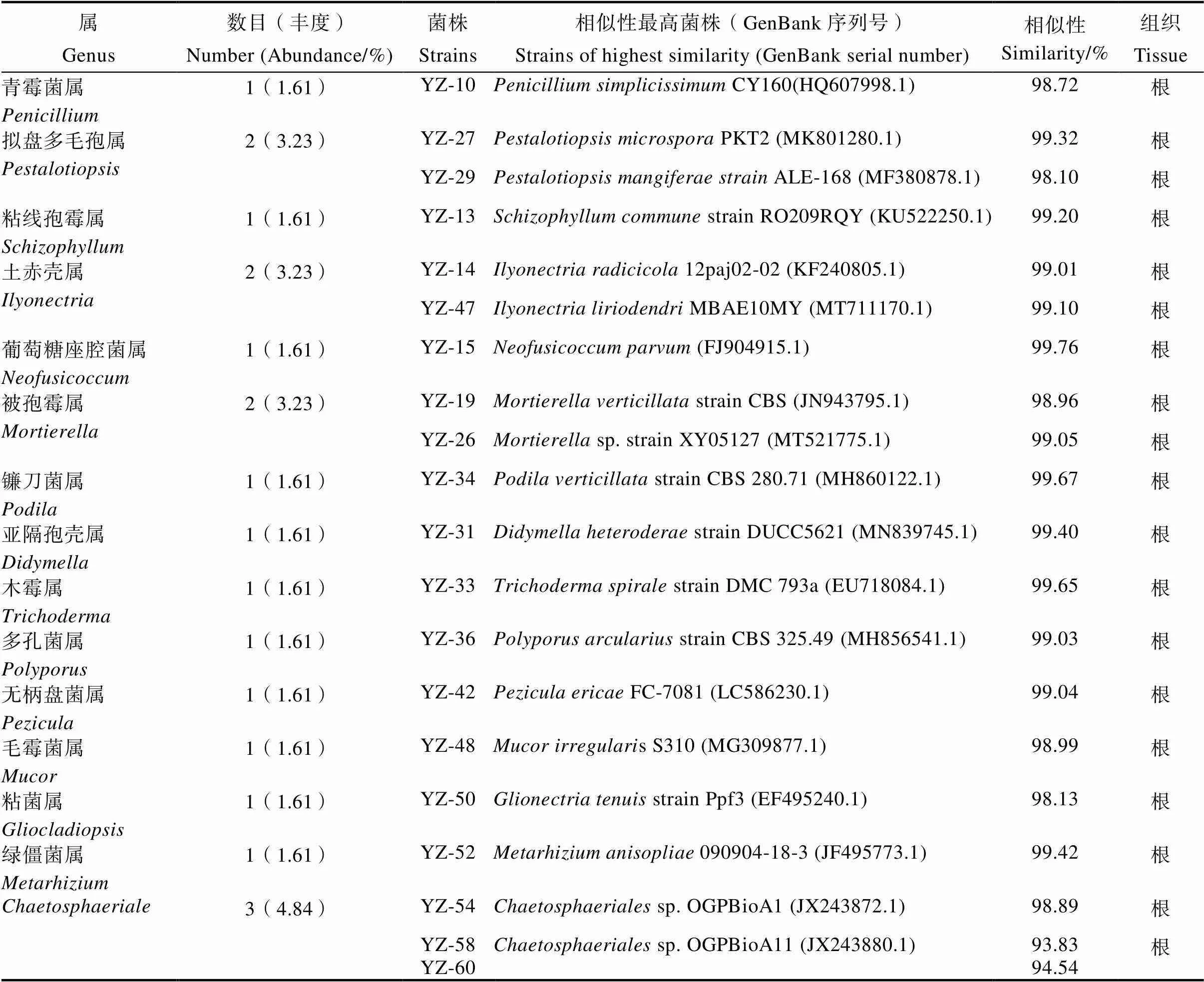
表2 油樟不同组织内生真菌分布及ITS序列BLAST比对结果
续表2 油樟不同组织内生真菌分布及ITS序列BLAST比对结果

表3 油樟内生真菌的种类组成
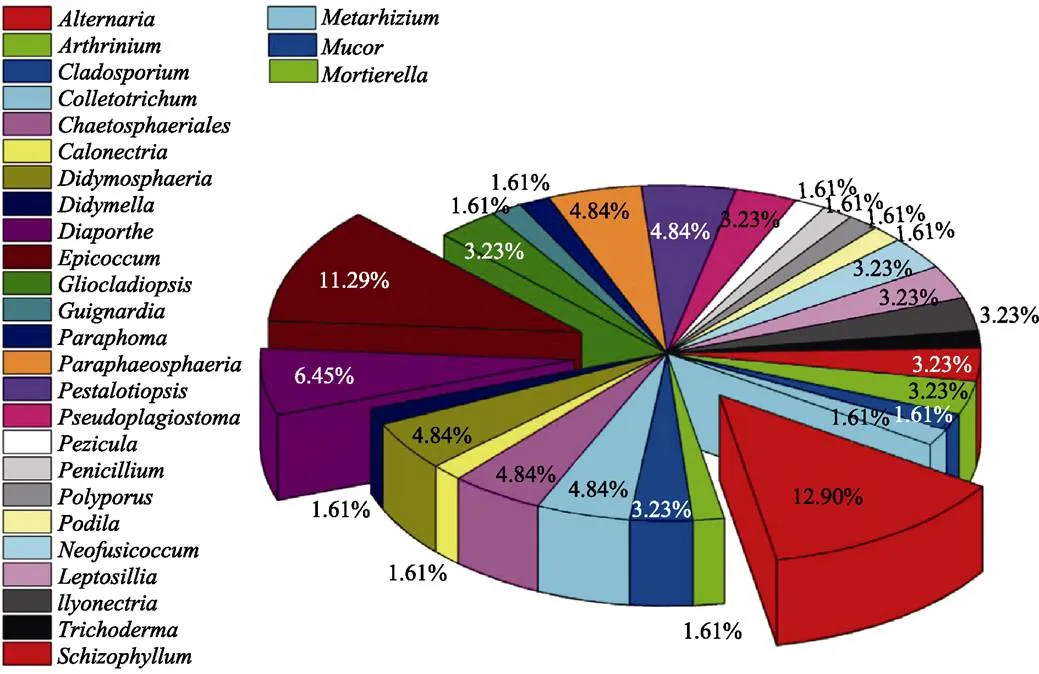
图1 油樟内生真菌各属比例图

图2 油樟内生真菌菌株分布Venn图
2.3 内生真菌的多样性
Shannon-Weiner多样性指数(H')与物种丰富度的关系最密切,但辛普森指数(D)与物种丰富度(S)关系较远。均匀度指数(E)敏感性高于Shannon-Weiner多样性指数,分析内生真菌群落分布的均匀程度(表4)。综合来看,油樟根、茎、叶3个部位中,根部内生真菌种群多样性相对较丰富,群落分布相对均匀。
2.4 油樟内生真菌产黄酮功能筛选
62株内生真菌中10株具有产黄酮功能,5株分离自根、5株分离自茎,共归类于2门3纲5目8科9属,分别是。菌株产黄酮强弱依次为YZ-29、YZ-31、YZ-15、YZ-3、YZ-41、YZ-30、YZ-28、YZ-33、YZ-36、YZ-38,其中YZ-29显色反应最明显且产黄酮量相对最高,为2.48 mg/g。

图3 油樟根(A)、茎(B)、叶(C)组织内生真菌群进化树
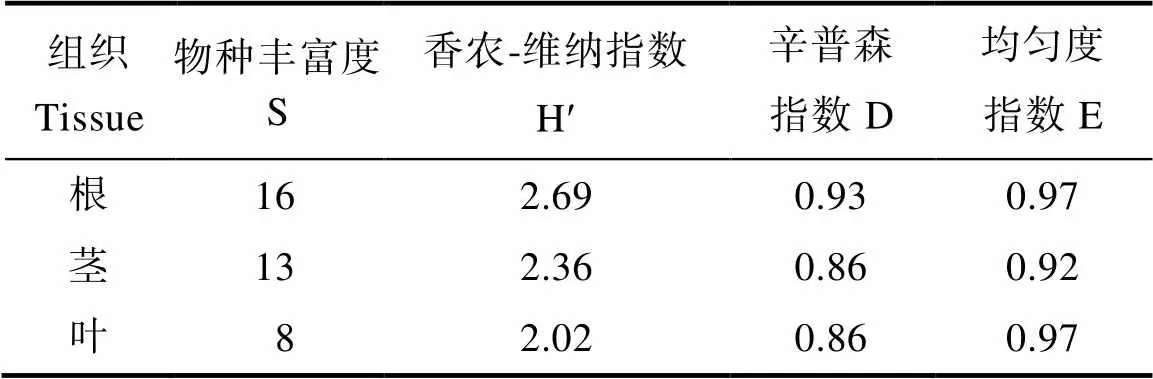
表4 不同组织内生真菌的多样性指数
2.5 菌株YZ-29发酵条件单因素优化
由图4可知,YZ-29黄酮产量在发酵7 d前逐渐增加,随后呈下降的趋势,其原因可能是菌种代谢和黄酮产量呈正相关,但随着菌株老化,营养物质的减少,菌株代谢活动减弱而黄酮产量降低,因此,正交试验选择发酵时间为5、7、9 d。当温度较低时,菌株YZ-29生长受到限制,当温度升高产黄酮量也增多,但超过28℃后黄酮产量缓慢下降,基于此,正交试验选择发酵温度为26、28、30℃。在100~150 r/min摇床转速间,菌株黄酮产量增加,可能是转速较低时,氧气量少而阻碍菌株代谢活动。当转速超过150 r/min时黄酮产量显著降低,可能因速度过大形成剪切力,破坏菌丝体结构导致黄酮产量略下降。因此摇床转速以125、150、175 r/min进行正交试验较为合适。装液量在70 mL/150 mL时黄酮产量最多,装液量为60、70、80 mL(150 mL锥形瓶)作为正交试验较为合适。当pH从酸性逐渐变为中性,黄酮产量逐渐增加,中性时黄酮产量最多,而pH为碱性时,黄酮产量下降明显。正交试验确定培养基起始pH为7较为合适。
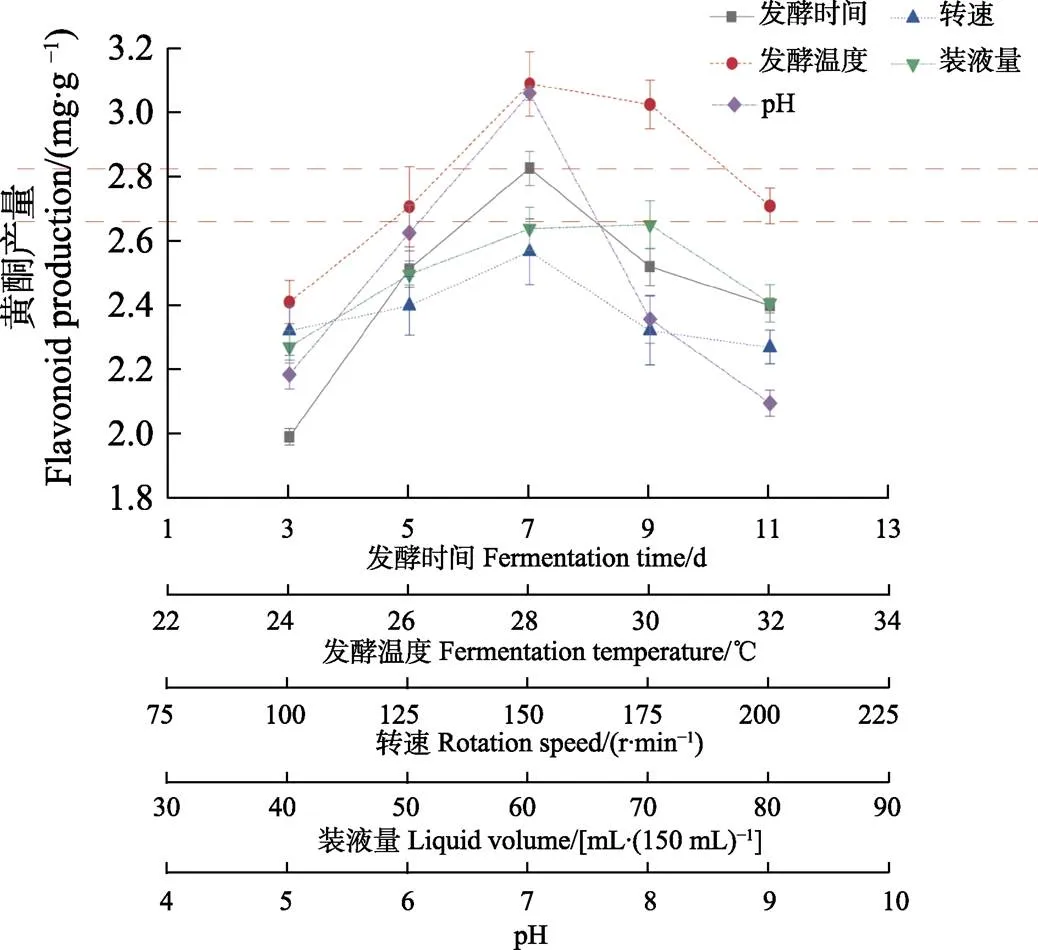
图4 YZ-29菌株发酵条件的单因素试验结果
2.6 内生真菌YZ-29发酵条件正交试验优化
由表5可知,4个因素对YZ-29菌丝黄酮产量的主次影响为发酵时间>装液量>转速>发酵温度。以菌丝体黄酮含有量为指标,YZ-29最适发酵条件为A2B3C3D3:初始pH 7、时间7 d、温度30℃、转速175 r/min、装液量80 mL/150 mL;利用最佳组合进行验证,YZ-29产黄酮量为3.73 mg/g。
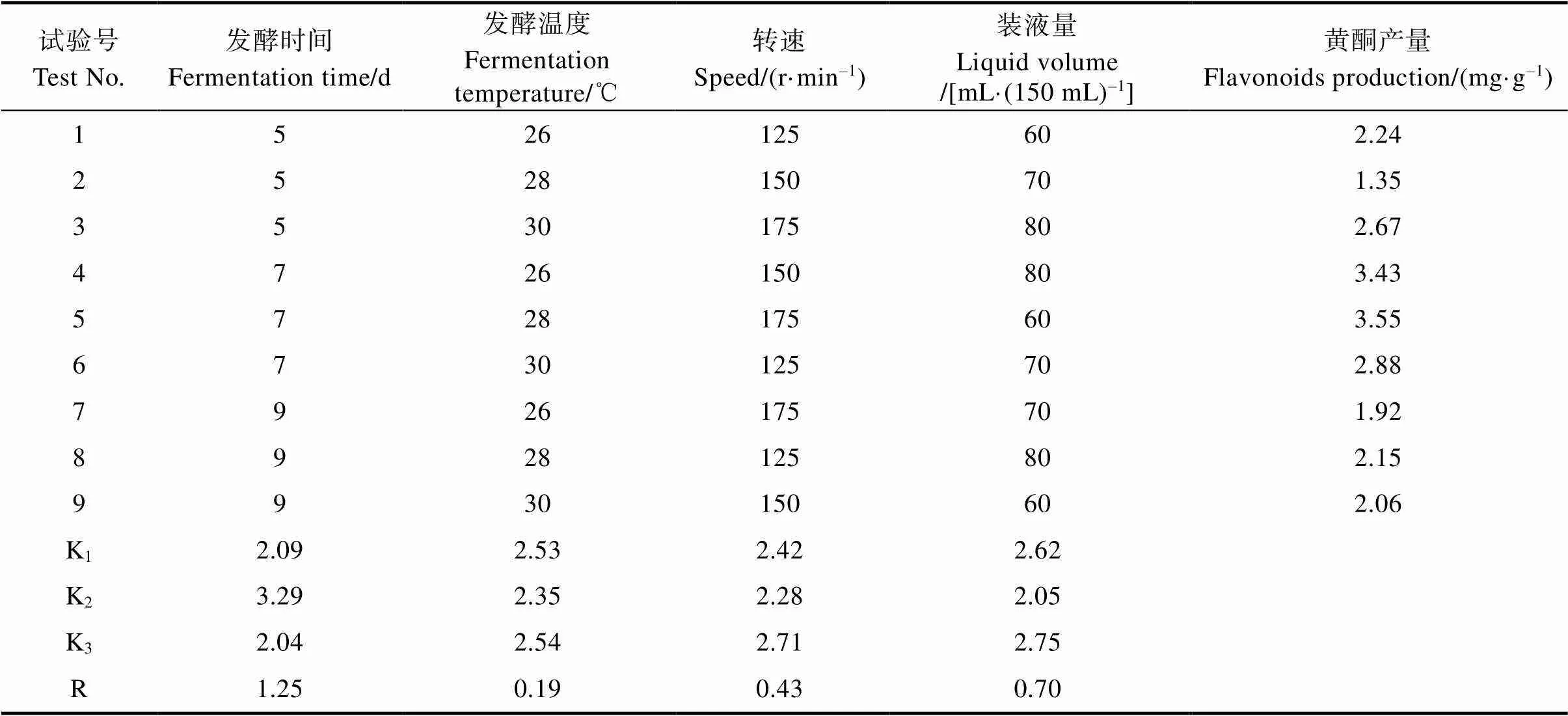
表5 菌株YZ-29的正交试验结果
3 讨论
内生真菌是影响宿主植物生存、代谢、抗逆境等方面的重要因素,是极具研究价值且尚待开发的微生物群落。为获得内生真菌作进一步分析,本研究采用传统分离培养方法首次在春季对宜宾的油樟根、茎、叶不同组织内生真菌进行分离、纯化及鉴定,共分离到62株分属于28属、54种的内生真菌,其中根部菌株鉴定为7纲11目13科16属,茎部菌株鉴定为2纲6目11科13属,叶部菌株鉴定为3纲7目8科8属,多样性指数和均匀度系数结果表明,油樟根部内生真菌种群多样性相对较丰富,群落分布相对均匀,与大多数研究根部丰富度高相似,可能由于根部与土壤接触,是抵御重金属威胁、参与修复调控、保护病害侵入等的重要部位,所以根部菌株丰度较高[23]。
已有研究表明,植物体可培养内生真菌受多种因素影响,植物类型是关键因素之一[24],如龚斌等[15]从柳树桑寄生中纯化出27株内生真菌,主要类群为sp.和sp.。赵文星等[16]从披针叶黄华分离获得29种内生真菌,主要隶属于和等。宋海燕等[17]从4个地区棉花样本中分离获得79株可培养内生真菌,其隶属于16个属,优势属为和等。本研究筛选得到的62株油樟可培养内生真菌主要隶属于和,与前人研究具有较大差异。此外,本实验室前期利用高通量测序技术对秋季油樟根、茎和叶内生真菌类群进行分析,发现油樟不同器官内生真菌绝大多数为Unclassified科属,其中根、茎和叶中的优势种属分别为Unclassified Chaetosphaeriales(91.66%)、(57.17%)和unclassified Ascomycota(58.79%),其他一些普通种属在茎中主要为unclassified Ascomycota(12.13%)、(10.38%)和(5.43%),叶部为(11.43%)和(8.58%)[25];而本研究采用平板法对相同油樟材料可培养内生真菌进行分离,发现可培养菌株主要隶属于Ascomycota和Sphaeriales,而均未被分离鉴定到,这可能与培养方法、培养基类型、培养温度的局限性和偏向性有关,亦可能与取材季节宿主独特生理特征及组织化学成分有关,但更重要的是,油樟不同器官蕴含丰富多样的内生真菌,后续还需进一步研究。此外,本研究中油樟可培养内生真菌中优势菌群Ascomycota被看作是植物内生菌群最易于在植物内部定殖的门[26],也广泛存在于植物、土壤中,如农作物、牧草花卉[27]。分离的sp.和sp.内生真菌在茎部的种类和数量上都占绝对优势,且主要寄生于茎部,提示两属可能与油樟运输营养或次生代谢产物的转化具有重要意义。
关于不同植物内生真菌产黄酮类物质的研究已有报道,赵晓璐等[19]从荷叶中筛选产黄酮的内生真菌,鉴定为棘孢曲霉(),菌丝体总黄酮含有量为8.2 mg/g。周宁[28]从甘蔗叶中分离到2株产黄酮功能内生真菌(1.21 mg/g)和(4.03 mg/g)。何福林等[29]分离到1株产黄酮银杏内生真菌,其黄酮产量为0.7 mg/g。本研究分离的10株油樟产黄酮内生真菌产黄酮量为0.73~2.48 mg/g,菌株YZ-29发酵条件优化后黄酮提高至3.73 mg/g,说明油樟内生真菌产黄酮能力中等,后续将深入进行菌株的发酵产物分析。首次筛选油樟内生真菌的产黄酮功能菌株,为开展内生真菌在油樟抗氧化成分的生物合成机制方面奠定基础。
本研究从油樟根、茎、叶分离到62株内生真菌,并对产黄酮功能菌株完成筛选,为全面挖掘油樟内生真菌代谢物研究提供了菌株资源。但从目前来看,内生真菌的研究集中在分离鉴定、抗氧化、促生长、抑菌等生理生化和生物活性研究等相对表面层次,其产生天然活性成分的机理及遗传特征仍有待研究。同时,现有内生真菌研究的分离重点定位于药用植物和区域经济作物研究上,所以内生真菌种质资源库还有很大扩充空间。另外,对于内生真菌产天然活性物质的实验现处于实验室阶段,距离大规模开发利用有一定距离。如何保证油樟产黄酮内生真菌在连续培养传代后不会出现菌种退回和特征改变等现象,均是后期待探究的。
[1] QIN S, XING K, JIANG J H, XU L H, LI W J. Biodiversity, bioactive natural products and biotechnological potential of plant-associated endophytic actinobacteria[J]. Appl Microbiol Biotechnol. 2011, 89(3): 457-473.
[2] 魏艳妮, 杨冰月, 罗 露, 雷瑞祥, 姬海月, 颜永刚, 张 岗, 胡本祥, 彭 亮. 远志内生真菌分离与鉴定研究[J]. 辽宁中医药大学学报, 2021, 23(5):35-40.
WEI Y N, YANG B Y, LUO L, LEI R X, JI H Y, YAN Y G, ZHANG G, HU B Y, PENG L. Isolation and identification of endophytic fungi from[J]. Journal of Liaoning University of Traditional, 2021, 23(5): 35-40. (in Chinese)
[3] 李秀琦. 烟草内生真菌sp.次级代谢产物分离鉴定与活性评价[D]. 北京: 中国农业科学院, 2021: 1-69.
LI X Q. Identification and activity evaluation of the secondary metabolites isolated from tobacco endophytic fungussp.[D]. Beijing, 2021: 1-69. (in Chinese)
[4] 郭顺星. 药用植物内生真菌研究现状和发展趋势[J]. 菌物学报, 2018, 37(1): 1-13.
GUO S X. The recent progress and prospects of research on endophytic fungi in medicinal plants[J]. Mycosystema, 2018, 37(1): 1-13. (in Chinese)
[5] GUPTA S, CHATURVEDI P, KULKARNI M G. A critical review on exploiting the pharmaceutical potential of plant endophytic fungi[J]. Biotechnology Advance, 2020, 39: 107462.
[6] 周成强, 练东明. 宜宾油樟产业发展现状及对策[J]. 农业与技术, 2020, 40(16): 65-68.
ZHOU C Q, LIAN D M. Development status and countermeasures ofin Yinbin[J]. Agriculture Technology, 2020, 40(16): 65-68. (in Chinese)
[7] 杜永华, 敖光辉, 魏 琴, 廖小龙, 余小霞. 油樟叶总黄酮含量测定及其抗油脂氧化活性[J]. 江苏农业科学, 2015, 43(8): 308-311.
DU Y H, AO G H, WEI Q, LIAO X L, YU X X. Determination of total flavonoids inleaves and antioxidant activity[J]. Jiangsu Agriculture Science, 2015, 43(8): 308-311. (in Chinese)
[8] 梁寒峭, 赵宇焓, 朱子冬, 陈 颖, 代晹鑫, 尹礼国, 魏 琴. 大孔树脂纯化脱油油樟叶渣中总黄酮工艺研究[J].离子交换与吸附, 2021, 37(3): 272-280.
LIANG H Q, ZHAO Y H, ZHU Z D, CHEN Y, DAI X X, YIN L G, WEI Q. Purification of total flavonoids fromdeoiled camphor leaf residue by microporous resin[J]. Ion Exchange Adsorption, 2021, 37(3): 272-280. (in Chinese)
[9] 程 贤, 毕良武, 李胜男, 陈玉湘, 赵振东, 莫开林. 春秋两季油樟叶的油细胞形态、精油成分及其抗氧化活性研究[J]. 林产化学与工业, 2021, 41(1): 38-44.
CHEGN X, BI L W, LI S N, CHEN Y X, ZHAO Z D, MO K L. Oil cell morphology, essential oil constituents and antioxidant activity ofleaves harvested in spring and autumn[J]. Chemistry and Industry for Productions, 2021, 41(1): 38-44. (in Chinese)
[10] PAPIK J, FOLKMANOVE M, SUMAN J. The invisible life inside plants: deciphering the riddles of endophytic bacterial diversity[J]. Biotechnology Advance, 2020, 44: 107614.
[11] 严 宽, 陈 放, 魏 琴, 冯瑞章, 周万海, 周 敏. 内生真菌对油樟挥发油积累及生理生化特性的影响[J]. 生物技术通报, 2017, 33(3): 138-143.
YAN K, CHEN F, WEI Q, FENG R Z, ZHOU W H, ZHOU M. Effects of endophytic fungi on volatile oil accumulation and physiological and biochemical characteristics of[J]. Biotechnology Bulletin, 2017, 33(3): 138-143. (in Chinese)
[12] 冯瑞章, 周诰均, 魏 琴, 周万海, 范轶玲, 秦 欢. 油樟内生溶磷菌的筛选及其生物学特性[J]. 广西植物, 2016, 36(11): 1396-1402.
FENG R Z, ZHOU G J, WEI Q, ZHOU W H, FAN Y L, QIN H. Screening of endogenous phosphate solubilizing bacteria inand biological characteristics[J]. Guihaia, 2016, 36(11): 1396-1402. (in Chinese)
[13] 黄金凤. 油樟同分异构松油醇抑菌活性及高产途径研究[D]. 成都: 西华大学, 2020.
HUANG J F. Antibacterial activity and high yield method of isomeric terpineol from[D]. Chengdu: Xihua University, 2020. (in Chinese)
[14] 周万海, 杨立艳, 李 苗. 天然香料植物油樟叶可培养内生细菌群落结构与多样性[J]. 食品与发酵工业, 2019, 45(20): 43-51.
ZHOU W H, YANG L Y, LI M. Community structure and diversity of cultivated endophytic bacteria in natural spice plant oilleaves[J]. Food Ferment and Industry, 2019, 45(20): 43-51. (in Chinese)
[15] 龚 斌, 巫 鑫, 韦 婷, 廖日权, 苏本伟, 宋静静, 江国焕, 朱开昕. 广西柳树桑寄生内生真菌的分离鉴定与抗肿瘤活性菌株筛选[J]. 广西植物, 2017, 37(5): 634-641.
GONG B, WU X, WEI T, LIAO R Q, SU B W, SONG J J, JIANG G H, ZHU K X. Isolation, identification and antitumor activity of endophytic fungi infromin Guangxi[J]. Guihaia, 2017, 37(5): 634-641. (in Chinese)
[16] 赵文星, 吴可欣, 郭梓豫. 披针叶黄华内生真菌的分离与鉴定[J]. 畜牧兽医学报, 2021, 52(10): 2986-2994.
ZHAO W X, WU K X, GUO Z Y. Isolation and identification of endophytic fungi in[J]. Acta Vet Zootech Sin, 2021, 52(10): 2986-2994. (in Chinese)
[17] 宋海燕, 李丽莉, 李 超, 秦华伟, 宋莹莹, 卢增斌, 于 毅, 门兴元. 棉花不同部位内生真菌群落结构及多样性分析[J]. 中国棉花, 2019, 46(1): 20-25.
SONG H Y, LI L L, LI C, QIN H W, SONG Y Y, LU Z B, YU W, MEN X Y. Analysis of community structure and diversity of endophytic fungi in different parts of cotton[J]. China Cotton, 2019, 46(1): 20-25. (in Chinese)
[18] MALHADAS C, MALHEIRO R, PEREIRA J A, DE PINHO PG, BAPTISTA P. Antimicrobial activity of endophytic fungi from olive tree leaves[J]. World Journal of Microbiology and Biotechnology, 2017, 33(3): 46.
[19] 赵晓璐, 周 宁, 谢庆武. 产黄酮荷叶内生真菌的筛选与鉴定[J]. 中成药, 2016, 38(11): 2512-2515.
ZHAO X L, ZHOU N, XIE Q W. Screening and identification of endophytic fungi producing flavonoids in lotus leaf[J]. Chinese Tradition Pat Medicine, 2016, 38(11): 2512-2515. (in Chinese)
[20] 陈艳露, 谢 玲, 刘 斌, 曾凤花, 廖仕同, 张 艳. 广西香蕉根系内生真菌的群落组成与多样性[J]. 热带作物学报, 2022, 43(2): 385-398.
CHEN Y L, XIE L, LIU B, CENG F H, LIAO S T, ZHAGN Y. Community composition and diversity of endophytic fungi in banana root in Guangxi[J]. Chinese Journal of Tropical Crops, 2022, 43(2): 385-398. (in Chinese)
[21] 王 欢, 路 浩, 郭亚洲, 冯 柯, 耿朋帅, 赵宝玉. 瑞香狼毒内生真菌的分离与鉴定[J]. 畜牧兽医学报, 2016, 47(8): 1696-1703.
WANG H, LU H, GUO Y Z, FENG K, GENG P S, ZHAO B Y. Isolation and identification of endophytic fungi from[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(8): 1696-1703. (in Chinese)
[22] 柴新义, 钟媛媛. 青檀果内生真菌菌群的组成及多样性[J]. 应用生态学报, 2017, 28(2): 636-642.
CAI X Y, ZHONG Y Y. Community composition and diversity of endophytic fungi from the fuits of[J]. Chinese Journal Application. Ecology, 2017, 28(2): 636-642. (in Chinese)
[23] 李秋桦, 夏体渊, 任 禛, 裴 妍, 尹 敏, 陈泽斌, 唐佐芯, 字学庆. 基于高通量测序技术解析三七不同部位内生细菌多样性[J]. 西南农业学报, 2021, 34(10): 2182-2190.
LI Q H, XIA T Y, REN Z, PEI Y, YIN M, CHEN Z B, TANG Z X, ZI X Q. Analysis of endophytic bacterial diversity in different parts ofg based on high throughput sequencing[J]. Southwest China Journal of Agricultural Sciences, 2021, 34(10): 2182-2190. (in Chinese)
[24] DU W, YAO Z, LI J, SUN C, XIA J, WANG B, SHI D, REN L. Diversity and antimicrobial activity of endophytic fungi isolated fromin the Yellow River Delta[J]. PLoS One. 2020, 15(3): e0229589.
[25] ZHOU W H, WEI Q, FENG R Z, LIU Y, LIANG H, LI J, YAN K. Diversity and spatial distribution of endophytic fungi inof Yibin, China[J]. Arch Microbiology. 2021, 203(6): 3361-3372.
[26] 郭顺星. 药用植物内生真菌生物学[M]. 北京: 科学出版社, 2016.
GUO S X. Endophytic mycology of medicinal plants[M]. Beijing: Science Press, 2016. (in Chinese)
[27] EDWARDS J, JOHNSON C, SANTOS-MENLLIN C. Structure variation and assembly of the root-associated microbiomes of rice[J]. PNAC, 2015, 112(8): 911.
[28] 周 宁. 甘蔗叶产黄酮内生真菌的筛选与鉴定[D]. 南宁: 广西大学, 2017.
ZHOU N. Screening and identification of flavonoid-producing endophytic fungi from sugarcane leaves[D]. Nanning: Guangxi University, 2017. (in Chinese)
[29] 何福林, 陈小明, 张 瑞. 产黄酮银杏内生真菌的分离与鉴定[J]. 天然产物研究与开发, 2017, 29(7): 1141-1147.
HE F L, CHEN X M, ZHANG R. Isolation and identification of two flavonoid-producing endophytic fungi fromLinn.[J]. Natural Product Research and Development, 2017, 29(7): 1141-1147. (in Chinese)
Diversity and Flavonoid-Producing Function of Culturable Endophytic Fungi in Natural Spice(Gamble) N. Chao in Spring
ZHOU Wanhai1,2, LIU Wenwen1,2, WEI Qin1,2, HU Lianqing1,2, FENG Ruizhang1,2*, ZHAO Shanmei1,2,REN Yuyan2
1. Sichuan Oil Camphor Engineering Technology Research Center, Yibin University, Yibin, Sichuan 644007, China; 2. Faculty of Agriculture, Forestry and Food Engineering, Yibin University, Yibin, Sichuan 644007, China
In order to develop the resources ofendophytes and discover its potential active components, this study utilized the roots, stems and leaves of healthyplants as the materials to isolate and purify culturable endophytic fungi by the tissue culture method. Combined with the ITS sequence and system, the developmental tree was used to analyze the diversity of strains, screen strains with flavonoid-producing functions, and design single-factor and orthogonal experiments to optimize the fermentation conditions of strains with the best flavonoid-producing effect. Sixty-two culturable endophytic fungi isolated from, which were divided into three phyla, seven classes, fourteen orders, twenty-two families, twenty-eight genera, and fifty-four species. Among them, the dominant phyla was Ascomycota (88.71%), the dominant class was Dothideomycetes (45.16%), the dominant order was Pleosporales (37.10%), and the dominant family was Pleosporineae (14.52%) and Didymellaceae (12.90%), the dominant genera were(12.90%) and(11.29%). Using the class as a group unit, the phylogeny of the fungi isolated from the root tissues included sixteen genera, twenty species and twelve isolates that could be divided into seven groups. The fungi isolated from the stems contained thirteen genera, twenty-four species, and thirty isolates that could be divided into two groups. The fungi isolated from the leaves contained eight genera, ten species, and eleven isolates and could be divided into three groups. The results of the diversity index and evenness coefficient showed that the endophytic fungi population diversity in the roots ofwas relatively rich, and the communal distribution was relatively even. Ten strains of endophytic fungi had the function of producing flavonoids: five from roots, five from stems, belonging to two phyla, three classes, five orders, eight families and nine genera. Among them, the YZ-29 strain had relatively strong flavonoid production capabilities. The optimal fermentation conditions for the YZ-29 strain to produce flavonoid were to be cultured at initial pH seven for 7 days at 30℃, with rotation speed of 175 r/min and liquid volume 80 mL/150 mL. The results above showed that there were differences in the number, population and composition of endophytic fungi in different tissues of. The functional strains that were screened are worthy of further excavation, development and utilization. The results would lay a foundation for the biosynthesis of antioxidant components from endophytic fungi in.
(Gamble) N. Chao; endophytic fungi; diversity analysis; flavonoids; fermentation conditions
S792.23
A
10.3969/j.issn.1000-2561.2022.10.022
2022-02-15;
2022-04-22
四川省科技厅项目(No. 2019YFSY001);香料植物资源开发与利用四川省高校重点实验室开放基金项目(No. 2015 XLZ004);2021年度宜宾市高端创新创业项目(No. 2021YGC03)。
周万海(1979—),男,博士研究生,研究方向:农业资源开发利用。*通信作者(Corresponding author):冯瑞章(FENG Ruizhang),E-mail:ruizhangfeng@126.com。
