黄连解毒汤对脑梗死合并胃损伤大鼠干细胞因子/酪氨酸激酶受体信号通路的影响
2022-11-11兰雅文王佳宁修小惠赵素君翟容乾安朋朋
兰雅文,唐 明,王佳宁,修小惠,赵素君,翟容乾,安朋朋
(1.山东中医药大学,山东 济南 250014;2.青岛市中医医院,山东 青岛 266033;3.莱阳市中医医院,山东 莱阳 265200;4.青岛市第六人民医院,山东 青岛 266700)
脑梗死是缺血性脑血管疾病,在中医学属于“中风”范畴,火毒内盛是其重要的病理基础,火热之毒损伤脑络,脑脉瘀阻,发为中风。脑梗死约占脑卒中的70%,病死率约10%,致残率可达50%以上,给患者的工作和生活带来极大的痛苦和负担[1]。脑梗死急性期易并发严重脑水肿、颅内压增高、脑疝、肺栓塞、梗死再发或继发出血等,均可明显增加不良预后风险。研究发现,脑梗死急性期还可并发胃损伤,临床多表现为胃脘胀满、疼痛、嗳气、恶心、呕吐等,甚则出现呕血、便血,可明显延长病程,降低预后[2-3]。
Cajal间质细胞作为胃部神经系统和平滑肌细胞之间的一类间质细胞,在维持胃部正常收缩功能的中发挥重要作用,酪氨酸激酶受体(C-kit)作为Cajal间质细胞的特异性标志物,与其天然配体干细胞因子(SCF)特异性结合,可以激活SCF/C-kit信号通路,该信号通路与Cajal间质细胞的发育密切相关,可影响胃部正常收缩功能。本课题组前期研究[4-5]发现,脑梗死急性期大鼠可并发胃黏膜损伤,黄连解毒汤可通过调节大鼠胃动素及血管活性肠肽的表达,发挥胃黏膜保护作用。基于本病火毒内盛的病理基础,以清热解毒为基本治疗原则,使热毒解,脑络通,诸证可愈,方选清热解毒之代表方黄连解毒汤。本实验从SCF/C-kit信号通路入手,探讨黄连解毒汤对脑梗死急性期胃损伤的影响及作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:健康SPF级10周龄雄性Wistar大鼠80只由山东大学动物实验中心提供,实验动物合格证号:0009265,体重(200±20)g。大鼠饲养于青岛市海慈医疗集团清洁级动物实验室,恒温22 ℃,湿度(50±5)%,标准颗粒饲料喂养,交替给予12 h光照与12 h黑暗,适应性饲养1周。
1.1.2 实验药物:黄连解毒汤由黄连、栀子各9 g,黄芩、黄柏各6 g组成。采用华润三九医药股份有限公司厂家同批次中药免煎颗粒剂,0.5 g颗粒剂相当于6 g生药。艾司奥美拉唑镁肠溶片(国药准字H20046380,规格:40 mg/片)。
1.1.3 主要实验试剂及仪器:二甲苯、无水乙醇(中国国药公司,批号X112051、10009218);苏木精(中国Solarbio公司,批号H8070);曙红Y、醇溶(中国Sangon公司,批号A600190);BX53显微镜、DP73显微镜拍照系统(日本Olumpus公司);RM2235石蜡切片机(德国Leica公司);NW10LVF超纯水系统(香港Heal Force公司);DH36001B电热恒温培养箱(天津斯泰特公司);H-2050R超速冷冻离心机(湖南湘仪公司);RLX-800酶标仪(美国Biotex公司)。
1.2 实验方法
1.2.1 动物分组及模型制备:将大鼠适应性饲养1周后按照随机数字表法分为模型组、黄连解毒汤组、奥美拉唑组、正常组、假手术组,以上各组根据给药时间再分设4 d组、7 d组,共10组,每组8只。除正常组和假手术组外,其余各组均采用线栓法建立大脑中动脉梗死模型(Middle cerebral artery occlusion,MCAO),假手术组仅分离大鼠颈总动脉和颈内、外动脉。正常组不作任何处理。
1.2.2 药物制备及给药方法:按人与动物等效剂量换算公式[6],计算大鼠每日给药剂量,黄连解毒汤免煎颗粒剂54 mg/d,艾司奥美拉唑27 mg/d。以上药物加蒸馏水配制药物浓度分别为黄连解毒汤27 mg/ml、奥美拉唑15 mg/ml的悬浊液,于4 ℃保存备用。大鼠造模成功后即开始给药,黄连解毒汤组给予大鼠1 ml黄连解毒汤悬浊液(27 mg/ml)灌胃,2次/d;奥美拉唑组给予大鼠1 ml奥美拉唑悬浊液(15 mg/ml)灌胃,3次/d;其余组给予每只大鼠1 ml 0.9%氯化钠溶液灌胃,2次/d;连续给药7 d。
1.2.3 标本制备与采集:4 d组连续给药4 d,7 d组连续给药7 d,采取脱颈法处死大鼠,清除胃内容物,取2~3 cm大鼠胃组织,纵行剖开清洗后,4%多聚甲醛溶液固定,以备用于后续镜下观察胃黏膜病理变化、测定胃组织中SCF、C-kit mRNA及蛋白的表达。
1.2.4 HE染色观察大鼠胃组织:将大鼠胃组织从4%多聚甲醛液内取出,石蜡包埋切片,脱蜡至水,HE染色,观察大鼠胃组织的结构和形态特征,光镜下观察胃黏膜损伤病理变化,同时予病理评分。
1.2.5 实时荧光定量检测大鼠胃组织SCF、C-kit mRNA表达水平:取出大鼠胃组织,加入1 ml TRIpure 裂解液并室温静置5 min,加入200 μl氯仿,室温静置3 min,离心后将水相置于新的离心管,加入异丙醇于-20 ℃过夜,离心后弃上清液,加入75%乙醇1 ml,离心后弃上清液,加入30 μl RNase-free ddH2O室温静置2 min,提取总RNA。采用紫外分光光度计测定各样本中RNA的浓度。将所得RNA样本于PCR仪反转录得到对应的cDNA。荧光定量分析使用荧光定量仪进行,采用2-△△Ct法进行数据分析。引物序列见表1。
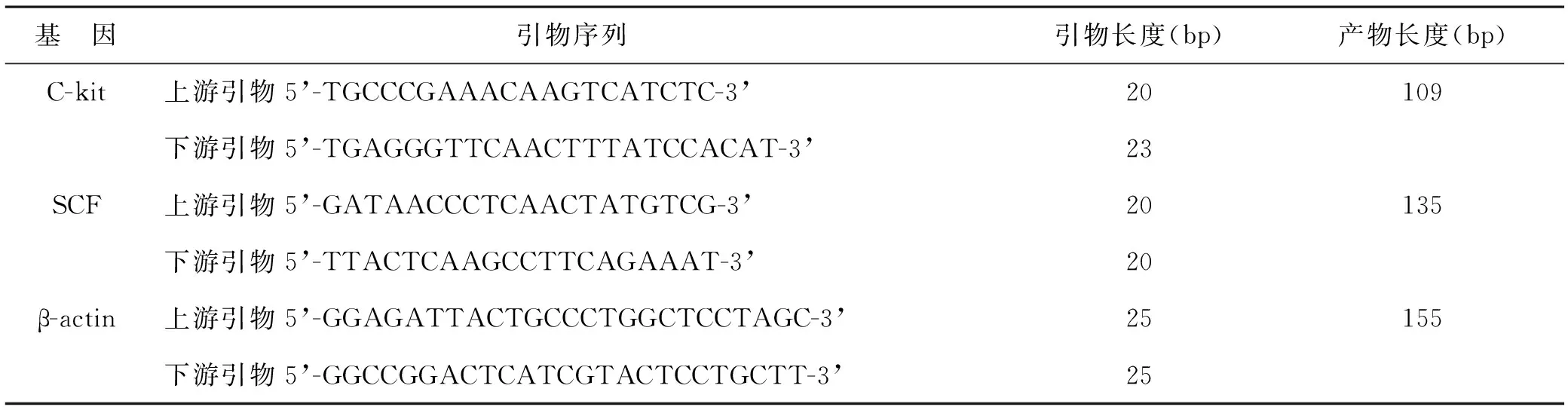
表1 SCF、C-kit引物序列
1.2.6 Western blot检测大鼠胃组织SCF、C-kit蛋白表达水平:取大鼠胃组织,加入相应体积裂解液以提取总蛋白,进行蛋白质定量,制备蛋白上样液,行SDS-PAGE凝胶电泳,转印,5%脱脂奶粉室温摇床封闭2 h,加入TRPV1一抗(1∶500),4 ℃孵育过夜。次日洗膜,再加入山羊抗兔的二抗(1∶2000),于室温孵育2 h。再次洗膜,光化学发光,显影。使用Quantity One分析软件进行灰度分析,蛋白相对含量以目的蛋白与内参灰度比值表示。
1.3 统计学方法 应用SPSS 26.0统计学软件进行数据分析。计量资料以均值±标准差表示,正态分布且方差齐时,采用单因素方差分析比较多组间差异,采用LSD-t检验比较两组间差异,非正态分布或方差不齐时,采用Kruskal-Wallis检验;P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠胃黏膜组织病理形态观察及评分比较 见图1、2。正常组和假手术组胃组织无明显充血、水肿等病变,黏膜各层结构完整,腺管排列整体,形状规则,正常组各层未见炎细胞浸润,假手术组黏膜层偶可见少量单核细胞等炎性细胞浸润;模型组大鼠胃黏膜损伤较严重,黏膜充血,上皮细胞明显水肿,黏膜层可见大量单核细胞、中性多核粒细胞等炎性细胞浸润,上皮细胞大面积坏死脱落,黏膜层不连续,呈火山口样表现,组织间隙增大,腺管疏密不均;与模型组比较,奥美拉唑组及黄连解毒汤组胃黏膜上述情况较轻,黏膜层炎性细胞数目较少,充血、水肿不明显,黏膜层及黏膜上皮见少量炎症细胞浸润,腺管排列较整齐,部分上皮脱落,未见黏膜糜烂。

图1 各组大鼠给药4 d胃黏膜组织病理改变(HE染色,×400)

图2 各组大鼠给药7 d胃黏膜组织病理改变(HE染色,×400)
与正常组、假手术组比较,模型组、黄连解毒汤组、奥美拉唑组胃黏膜病理评分均明显升高(4、7 d组均P<0.01);正常组、假手术组间比较差异无统计学意义(4、7 d组均P>0.05)。与模型组比较,黄连解毒汤组、奥美拉唑组胃黏膜病理评分均显著降低(4、7 d组均P<0.01);与奥美拉唑组比较,黄连解毒汤组胃黏膜病理评分均明显降低(4、7 d组均P<0.05),黄连解毒汤7 d组与4 d组比较,胃黏膜病理评分明显降低(P<0.05)。见表2。

表2 各组大鼠给药4、7 d胃黏膜损伤病理评分比较(分)
2.2 各组大鼠胃组织SCF、C-kit mRNA表达水平比较 见表3。与正常组、假手术组比较,模型组、黄连解毒汤组、奥美拉唑组大鼠胃组织SCF、C-kit mRNA表达水平均明显降低(P<0.01);正常组、假手术组SCF、C-kit mRNA表达水平比较,差异无统计学意义(P>0.05)。与模型组比较,黄连解毒汤组、奥美拉唑组大鼠胃组织SCF、C-kit mRNA表达水平均显著升高(P<0.01)。与奥美拉唑组比较,黄连解毒汤组胃组织SCF、C-kit mRNA表达水平均明显升高(P<0.05)。

表3 各组大鼠胃组织SCF、C-kit mRNA表达比较
2.3 各组大鼠胃组织SCF、C-kit蛋白表达水平比较 见表4(图3)。与正常组、假手术组比较,模型组、黄连解毒汤组、奥美拉唑组大鼠胃组织SCF、C-kit蛋白表达水平均明显降低(P<0.01);正常组、假手术组SCF、C-kit蛋白表达水平比较差异无统计学意义(P>0.05)。与模型组比较,黄连解毒汤组、奥美拉唑组大鼠胃组织SCF、C-kit蛋白表达水平均显著升高(P<0.01)。与奥美拉唑组比较,黄连解毒汤组胃组织SCF、C-kit蛋白表达水平均明显升高(P<0.05)。

表4 各组大鼠胃组织SCF、C-kit蛋白表达比较

A:正常组;B:模型组;C:假手术组;
3 讨 论
脑梗死在中医学属于“中风”范畴,火热之毒内盛乃中风重要的病理基础[7],基本病机为君相火旺,风火相煽,内风旋动,气血逆乱于上,直冲犯脑,火热之毒损伤脑络,导致脑脉瘀阻,发为中风[8-9]。中风发病之气血逆乱,可进一步损伤脏腑气机,其中又以胃腑气机失常最为多见。胃腑通降失常,热邪、糟粕不得泻下,腑气不通,不利于平复气血之逆乱,进而清阳不升,浊阴不降,加重脑窍之损伤[10]。故临床以清热解毒为基本治疗原则,热毒解,脑络通,疾病向愈。黄连解毒汤乃清热解毒之代表方,主治三焦火毒热盛证[11]。方中君以黄连,臣以黄芩,佐以黄柏,三黄合用,功专清热燥湿,泻火解毒,分泄上、中、下三焦火热之毒,另佐以栀子,清泄三焦之火毒,兼引热邪从小便而出。此四药合用,苦寒直折,清泄三焦上下,使火邪去,热毒解,诸症可愈。现代药理及实验研究表明,黄连解毒汤对脑梗死以及胃损伤均有较好的疗效。姜海伟[12]研究发现,黄连解毒汤可改善缺血性卒中后认知障碍患者的认知功能,并且可以通过抑制激活Notch信号通路、调节炎症因子以及改善脑梗死局部微循环来改善脑梗死模型大鼠的认知功能行为学损害。马重阳等[13]研究发现,黄连解毒汤可能通过调节以晚期糖基化终产物受体为中心的信号通路,发挥抗缺血性脑卒中疗效。刘天峰[14]研究发现,加味黄连解毒汤可明显改善热毒蕴结型胃溃疡患者临床症状,同时可能通过调节细胞增殖、凋亡平衡,改善热毒蕴结型胃溃疡模型大鼠胃黏膜损伤程度。黄婉霞[15]研究发现,加味黄连解毒汤可改善幽门螺杆菌阳性患者的胃溃疡症状,改善患者心理状态,提高治疗有效率。
正常情况下,胃部肌层组织受中枢神经系统、胃部神经系统及胃肠激素的共同调控。脑梗死发病后机体处于应激状态,神经内分泌系统失调,胃黏膜缺血缺氧,胃黏膜屏障受损,造成胃损伤。目前,脑梗死急性期并发胃损伤的具体发病机制尚未完全明确。近年来,作为维持胃部正常收缩功能的Cajal间质细胞在胃损伤机制研究中越来越受关注[16-17]。Cajal间质细胞是介于胃部神经系统和平滑肌细胞的一类间质细胞,能够产生起搏电位,控制基本电节律的传播,同时Cajal间质细胞还可加强胃部神经元与平滑肌细胞的联系,通过接受神经递质调节胃部慢波频率,从而控制平滑肌的收缩[18]。C-kit作为Cajal间质细胞的特异性标志物,与其天然配体SCF特异性结合可以激活SCF/C-kit信号通路,该通路与Cajal间质细胞的发育密切相关,当SCF、C-kit发生突变或信号通路受损,可影响Cajal间质细胞发育、分化,影响胃部正常收缩功能[19-20]。因此,SCF/C-kit信号通路的表达有可能成为探索脑梗死急性期胃损伤发病机制的突破点。
本研究显示,模型组大鼠胃黏膜病理评分较正常组、假手术组均明显升高,提示脑梗死急性期易并发胃黏膜损伤。黄连解毒汤组大鼠胃黏膜病理评分较模型组及奥美拉唑组均明显降低,提示黄连解毒汤对脑梗死急性期胃黏膜有良好的保护作用,且7 d组效果最佳,可能与黄连解毒汤应用疗程有关。与正常组、假手术组比较,模型组SCF和C-kit mRNA、蛋白表达水平明显降低,与胃黏膜损伤病理评分结果一致,说明脑梗死急性期并发胃损伤机制可能与大鼠胃组织SCF、C-kit mRNA及蛋白表达水平降低有关。与模型组、奥美拉唑组比较,黄连解毒汤组SCF、C-kit mRNA及蛋白表达水平明显升高,提示黄连解毒汤可能通过升高大鼠胃组织SCF、C-kit mRNA及蛋白表达水平对胃黏膜产生保护性作用,缓解脑梗死急性期的胃黏膜损伤,且黄连解毒汤组疗效显著优于奥美拉唑组。
综上所述,脑梗死急性期并发胃损伤机制可能与SCF/C-kit信号通路有关,黄连解毒汤可能通过上调SCF、C-kit mRNA及蛋白表达水平,起到胃黏膜保护作用。本研究侧重于胃组织的病理学改变,尚缺乏对胃动力的动态观察,同时缺少胃酸pH值的测定,难以确定SCF/C-kit信号通路是否与胃内pH值变化有关,下一步将完善SCF/C-kit信号通路与胃动力以及胃液pH值的相关性探讨,进一步明确SCF/C-kit信号通路的影响因素。
