农产品中脱氧雪腐镰刀菌烯醇的表面增强拉曼检测
2022-11-10陈明明苏毕航黄建立付凤富董永强
陈明明, 苏毕航, 黄建立, 付凤富, 董永强*
(1. 福州大学化学学院, 食品安全与生物分析教育部重点实验室, 福建省食品安全分析与检测技术重点实验室,福建 福州 350108; 2. 福建省粮油质量监测所, 福建 福州 350108)
真菌毒素是真菌的次级代谢产物。粮食在生产和储藏过程中都极易受到不同种类真菌的污染,从而产生真菌毒素。真菌毒素既可引起急性中毒,也可由于长期低剂量摄入引起慢性中毒。有些真菌毒素甚至还具有致突变性、致癌性、致畸性以及对特定系统与器官的毒性,如神经系统毒性、生殖系统毒性、肾毒性、出血性毒性、肝毒性和免疫抑制毒性[1,2]。而且大部分真菌毒素具有很强的热稳定性,即使在食物煮熟后,其中所含有的真菌毒素仍稳定存在。因此,真菌毒素已经成为国际关注的食品安全热点问题之一。
脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)是一种单端孢霉烯族毒素,主要由禾谷镰刀菌和粉红镰刀菌产生。在全世界范围内,DON是最常见的一种污染粮食、饲料和食品的霉菌毒素之一。在中国,每年超过700万公顷的小麦受镰刀菌头枯病影响,从而导致大量小麦受到DON毒素的污染。食用被DON污染的小麦籽粒及其制品的动物和人类会出现急性中毒症状,如厌食、呕吐、腹泻、发烧和造血系统受损,甚至死亡[3]。因此世界各国对粮食和饲料中的DON都有非常严格的限量标准。我国规定大麦、小麦、燕麦、青稞、玉米原粮谷物中DON限量为2 000 μg/kg。目前关于粮食中DON的检测方法以仪器分析法为主,包括液相色谱法(LC)、气相色谱-质谱法(GC-MS)和液相色谱-质谱法(LC-MS)等[4,5]。除仪器分析方法外,酶联免疫分析法、生物传感器等也可用于真菌毒素的分析[6-8]。这些方法往往都具有很好的灵敏度,可完美地实现对真菌毒素的定量检测。然而,这些方法又都存在着一定的局限性,比如仪器分析方法存在设备昂贵、对操作者的技术要求高,且容易受到杂质干扰等缺点;免疫法容易出现假阴性和假阳性问题,而且稳定性也通常较差;生物传感技术经常出现交叉反应、重现性低等问题。另外,这些方法普遍存在着耗时、过程复杂等操作层面上的问题。探索一种更为简单、迅速、灵敏的用于DON检测的传感技术对于农业与食品业发展而言具有非常重要的意义。
表面增强拉曼散射(surface-enhanced Raman scattering, SERS)是近年来迅速发展起来的一种光谱分析技术[9],具有高灵敏度、高通量、响应快速等独特优势。因此在表面科学[10,11]、材料科学[12]、生物医学[13,14]、药物分析[15-17]、食品安全[18-20]、环境检测[21]等领域显示出巨大的应用潜力。目前已经有人尝试利用SERS技术对食品中的DON进行快速检测,但从其结果来看,仍然存在灵敏度差、重现性不好、抗干扰能力弱等问题,因此不能广泛应用于实际样品的检测[22-24]。这主要是由其SERS基底自身问题所决定的。众所周知,SERS测试需要将被测分子吸附在一些特殊材料(即所谓的基底材料)的表面。在电磁增强(EM)和/或化学增强(CM)的作用下,被测分子的拉曼信号大大增强。因此,SERS测试的结果在很大程度上取决于基底的性质。然而,目前报道的SERS基底中很少能同时兼顾高灵敏度、良好的均匀性和良好的稳定性。近年来,有人提出将SERS活性材料与水凝胶结合,有望获得具有良好均匀性和稳定性的SERS基底[25]。受此启发,我们制备了具有高SERS活性的聚集态碳点包裹银纳米颗粒(a-AgNPs/CDs)和聚集态金纳米颗粒,并将其嵌入水凝胶中,制备水凝胶SERS芯片[26]。所获得的SERS芯片具有灵敏度高、稳定期长、均匀性好、抗干扰性强等优点。这一结果将大大促进SERS技术在定量分析中的应用。本工作利用本实验室开发的a-AgNPs/CDs-水凝胶SERS芯片,构建粮食中DON快速检测的SERS传感方法,并应用于实际样品。该方法具有灵敏度高、线性范围宽、重复性和回收率好、抗干扰能力强等优点。
1 实验部分
1.1 仪器、试剂与材料
高分辨透射电子显微镜(HRTEM, 2100, JEOL,日本);场发射扫描电镜(FE-SEM, 6700F, JSE,日本);紫外-可见分光光度计(UV-Vis, Lambda 750, PerkinElmer,美国);便携式拉曼光谱仪(i-Raman, BWS465-532H, BW&TEK,美国)。
硝酸银(AgNO3,纯度99.0%)、聚乙烯醇(PVA, [C2H4O]n,聚合度1 799,纯度98.0%~99.0%)购于上海阿拉丁生化科技有限公司;葡萄糖(C6H12O6,分析纯)和结晶紫(crystal violet, CV,分析纯)购于上海麦克林公司;氢氧化钠(NaOH,纯度96.0%)购于宜昌西隆化工有限公司;去离子水由Milli-Q纯水系统获得,并用于制备所有储备液和工作溶液。
1.2 实验条件
1.2.1a-AgNPs/CDs的合成
具有高SERS活性的a-AgNPs/CDs是以单层碳基点(carbon-based dots, CDs)为包裹剂[27],采用一锅自组装方法合成的[28]。将1.2 mL CD溶液(5 mg/mL)和0.6 mL AgNO3溶液(1 mol/L)分散到50 mL去离子水中,随后用NaOH(0.1 mol/L)溶液调节其pH到9。在120 ℃油浴锅中回流15 min后加入0.6 mL的葡萄糖溶液(90 mg/mL),反应20 min之后停止加热,在搅拌下将溶液自然冷却到室温。随后,将冷却后的混合物用去离子水离心洗涤3次(12 000 r/min,每次10 min)。最后,将得到的沉淀物(a-AgNPs/CDs)重新分散在10 mL去离子水中,并储存在4 ℃以备进一步使用。
1.2.2水凝胶SERS芯片的合成
水凝胶SERS芯片的制备方法按照本实验室最近发表的一项研究工作[26]进行。将1.4 g PVA和9.6 mL去离子水混合并在90 ℃下搅拌1.5 h,直到PVA完全溶解。将PVA溶液冷却到室温后加入1 mL a-AgNPs/CDs溶液(3 mg/mL),接着搅拌30 min。最后,将混合物转移到一个厚度为1 mm的玻璃模具中,通过在-24 ℃和室温下循环冷冻-解冻5次得到水凝胶SERS芯片。
1.2.3标准溶液的制备和SERS测量
用水-乙醇(1∶1, v/v)作为溶剂配制一系列的DON标准溶液(10 000、1 000、100、50、10、5和1 μg/kg)。SERS检测前将0.5 mm×0.5 mm的水凝胶SERS芯片浸泡于50 μL的DON标准溶液中一段时间,然后取出,并在每个芯片上随机选取10个点进行测量。
1.2.4样品前处理
称取2 g加标的小麦粉样品于离心管中,加入10 mL水-乙醇(1∶1, v/v),涡旋混匀。于室温下超声提取10 min后以12 000 r/min离心10 min,收集上清液并转移到另一个干净的离心管中,向残渣中再加入10 mL乙醇-水(1∶1, v/v)重复提取一次,合并上清液,得到小麦标准提取液。
1.2.5拉曼条件
便携式拉曼光谱仪拉曼激光为532 nm(BWS465-532H);激光功率为5 mW;单次积分时间为30 s;浸泡后的水凝胶SERS芯片表面无需冲洗,直接用于室温下的拉曼检测。
2 结果与讨论
2.1 材料的表征
通过TEM和FE-SEM表征a-AgNPs/CDs的形貌(见图1a和b)。所制备的AgNPs/CDs纳米颗粒粒径分布均匀,直径约为20 nm。a-AgNPs/CDs主要是由几十个AgNPs/CDs在二维方向上组成的聚集体。每个聚集体中相邻粒子之间的间隙在2 nm以下,因此,a-AgNPs/CDs具有丰富的电磁场“热点”。通过UV-Vis表征(见图1c)发现a-AgNPs/CDs呈现出两个特征的局域表面等离子体共振(localized surface plasmon resonance, LSPR)吸收峰,一个在395 nm,另一个在605 nm。

图 1 a-AgNPs/CDs的(a)透射电镜图、(b)扫描电镜图以及(c)紫外-可见吸收光谱Fig. 1 (a) TEM, (b) SEM images and (c) UV-visible absorption spectrum of a-AgNPs/CDsa-AgNPs/CDs
2.2 水凝胶SERS芯片基底的全面评估
图2a展示了实验所得的水凝胶SERS芯片。实验中以CV作为探针分子对所得水凝胶SERS芯片的性能进行评估。如图2b所示,CV的SERS强度随其浓度的增加而逐渐增加,并且在10-12~10-16mol/L的范围内,浓度的对数与其特征信号强度(1 623 cm-1)呈现良好的线性关系,其线性方程为Y=11 077 logCCV+181 041,相关系数(R2)为0.998 6。另外,所得水凝胶SERS芯片还具有非常良好的均一性。在芯片上40×40 μm2的范围内随机采集100个位点上的SERS光谱,可以清楚地发现所得的100条SERS光谱没有明显的差异(图2c)。光谱中1 623 cm-1处峰强度构建的成像很均匀,没有明显的波动(图2d),据此计算得到的RSD为1.5%,远远低于大多数已报道的SERS基底。这些结果表明,所得水凝胶SERS芯片具有出色的灵敏度、均一性,因此可用于后续SERS检测。

图 2 (a)水凝胶SERS芯片在可见光下的照片, (b)水凝胶SERS芯片对不同浓度CV的SERS响应, (c)从水凝胶SERS芯片上采集100个CV(10-13mol/L)的SERS光谱, (d)100条收集到的SERS光谱中CV在1623 cm-1处的SERS信号的拉曼映射图Fig. 2 (a) Photograph of the hydrogel SERS chip, (b) SERS response of the hydrogel chip toward different concentrations of crystal violet (CV), (c) SERS spectra of 1×10-13mol/L CV collected from 100 points on the hydrogel chip, (d) Raman mapping image targeting the CV SERS signal at 1623 cm-1 from the 100 collected SERS spectra points The inset in (b) shows the linear relationship between the peak intensity at 1623 cm-1 and the logarithmic concentration of CV.

图 3 (a)不同溶剂和(b)不同水-乙醇体积比对水凝胶SERS芯片所得DON(10000 μg/kg)拉曼光谱的影响Fig. 3 Effects of (a) different solvents and (b) different water-ethanol volume ratios on the Raman spectra of the resulting deoxynivalenol (DON) (10000 μg/kg) obtained by hydrogel SERS chip The SERS chip was soaked in the respective solvents at 40 ℃ for 4 min.
2.3 溶剂对水凝胶SERS芯片检测DON的影响
DON是一种无色针状固体,可溶于水和极性溶剂,如含水甲醇、含水乙醇或含水乙酸乙酯。本文比较了3种不同极性的溶剂水-甲醇(1∶1, v/v)、水-乙醇(1∶1, v/v)、水-乙酸乙酯(1∶1, v/v)对水凝胶SERS芯片检测DON的影响。如图3a所示,结果显示当溶剂为水-乙醇(1∶1, v/v)时,DON的SERS信号最强。随后比较了不同体积比(3∶1、1∶1和1∶3)的水-乙醇对水凝胶SERS芯片检测DON的影响。实验条件优化如图3b所示,当溶剂水-乙醇体积比为1∶1时,水凝胶SERS芯片检测DON得到了最大的增强。所以,以水-乙醇(1∶1, v/v)为最终实验条件用于后续的实验研究。
2.4 浸泡温度及浸泡时间对水凝胶SERS芯片检测DON的影响
众所周知,通过SERS技术检测实际样品中的小分子时,样品基质中各种大分子(如多肽、蛋白质、多糖、寡核苷酸等)和油脂都具有很强的干扰作用。水凝胶具有有限大小的多孔网络结构,允许流体动力学直径小于孔隙大小的分子进入[25]。因此,水凝胶SERS芯片可具有出色的抗干扰能力。然而,待测小分子进入水凝胶的核心需要一段时间,这取决于分子扩散的速度。因此,在利用水凝胶SERS芯片对DON进行检测前需对浸泡温度和浸泡时间做相应的考察优化。

图 4 (a)水凝胶SERS芯片在DON溶液(10000 μg/kg)中浸泡温度对所得拉曼光谱的影响及(b)浸泡温度对DON在1380 cm-1处峰强度的影响(n=5) Fig. 4 Effects of (a) hydrogel SERS chip soaking temperature in the DON solution (10000 μg/kg) on the resulting SERS spectra, and (b) soaking temperature on the peak intensity of DON at 1380 cm-1 (n=5) Soaking time: 4 min.

图 5 (a)不同浸泡时间下DON(10000 μg/kg)在水凝胶SERS芯片上的SERS光谱图和(b)浸泡时间对DON在1380 cm-1处峰强度的影响(n=5) Fig. 5 (a) SERS spectra for DON (10000 μg/kg) on the hydrogel SERS chip under different soaking time, and (b) effect of soaking time on the peak intensity of DON at 1380 cm-1 (n=5)
如图4a所示,不同浸泡温度下,DON的SERS光谱几乎没有区别,但是信号强度上却有明显的变化。如图4b所示,在较低温度下(40 ℃以下),小分子的扩散速度随着温度升高而变快,在40 ℃时DON的SERS信号达到最大值。在较高温度时(40 ℃以上),虽然小分子的扩散速度也会进一步加快,但是高温一定程度上破坏了水凝胶的三维结构,DON的SERS信号反而随着温度的升高而有所下降。因此,选择最佳浸泡温度为40 ℃。如图5a所示,在其他实验条件保持不变的情况下,延长水凝胶SERS芯片在DON溶液中的浸泡时间也可以明显地提高其SERS信号。从图5b可以看出,DON在1 380 cm-1处的特征信号强度在3 min之内随浸泡时间增加而迅速增加,随后增加速度逐渐变缓。当浸泡时间超过5 min时,其信号强度逐渐趋于稳定。因此,选择最佳浸泡时间为5 min。
2.5 线性范围、检出限以及定量限
根据上述实验结果,利用所得水凝胶SERS芯片在最优条件下对不同含量的DON进行SERS检测。图6a展示了不同含量DON在所用水凝胶SERS基底上的SERS光谱。从图中可以看出即使DON的含量低至1 μg/kg,其SERS光谱中的主要特征峰仍可清楚分辨。当DON的含量从1 μg/kg逐渐增加到10 000 μg/kg,其SERS光谱的形状没有发生明显的变化,主要特征峰的拉曼位移也没有发生变化。然而,所有特征峰的强度都随着DON含量的提高而明显增强。如图6b所示,DON在1 380 cm-1处的SERS强度(Y)与DON的含量(C, μg/kg)的对数成正比,其线性方程为Y=5 789 logC+1 043,R2为0.996 7。

图 6 (a)不同含量DON在水凝胶SERS芯片上的SERS光谱图和(b)DON在1380 cm-1处的特征峰强度与其含量对数的关系曲线 Fig. 6 (a)SERS spectra for different contents of DON on the hydrogel SERS chip, and (b) corresponding SERS intensity at 1380 cm-1 as a function of the logarithmic DON content
根据SERS光谱的特征峰计算检出限(LOD)和定量限(LOQ),见公式(1)和(2)。
(1)
(2)
其中Sk为空白样本光谱强度的标准差,K为拟合关系曲线的斜率。得到的结果分别为LOD 0.14 μg/kg和LOQ 0.47 μg/kg。将该方法与已有报道的DON的SERS检测方法进行比较(见表1),该方法具有更宽的线性范围和更低的检出限,说明该方法具有一定的优越性。
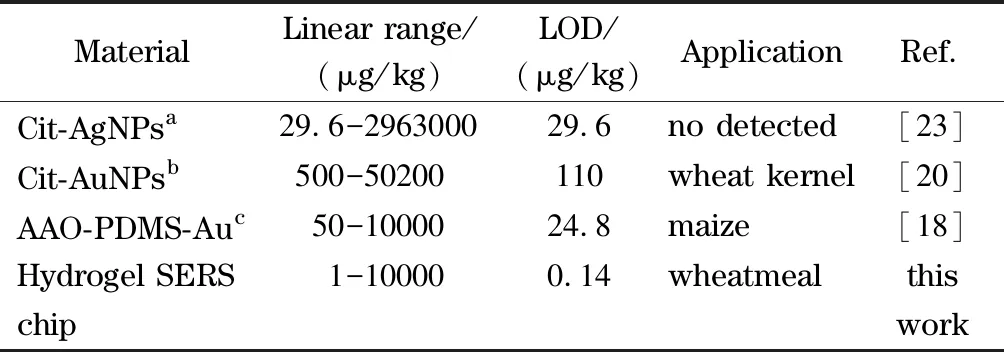
表 1 本研究方法与其他已报道SERS方法的比较
2.6 实际样品检测
为了进一步考察所构建的SERS检测方法的实用性,我们将其应用于小麦粉中DON的检测。实验结果表明,小麦粉提取液中未检测到DON的SERS信号,说明小麦粉样品中DON的含量低于该方法的检出限。因此,实验采用空白样品加标的方式对小麦粉中DON的回收率进行考察。分别于小麦粉中加入低、中、高3个水平的DON,再按照1.2.4节中所述的方法将其提取出来。用所得的水凝胶SERS芯片对提取液平行测定3次,并根据建立的标准工作曲线计算平均回收率。由于水凝胶SERS芯片具有特殊的孔径结构,在复杂样品基质检测中可以隔绝大分子(糖、色素、油脂、蛋白质等),加之SERS是一种可以检测和鉴别分子、可反映结构信息的光谱技术,因此水凝胶SERS芯片可以在高灵敏度下仍然保持高选择性。结果见表2, DON在小麦粉中的平均回收率为97.3%~103%,符合方法验证规范要求的85%~115%。RSD为4.2%~5.0%,同样符合方法验证规范≤10%的要求。

表 2 小麦粉中DON的加标回收率(n=3)
3 结论
本文利用本实验室构建的水凝胶SERS芯片以及便携式拉曼光谱仪建立了一种快速筛查和检测DON的SERS方法。该方法具有响应范围宽、灵敏度高、重复性好、响应迅速、操作简单等优点,在粮食中生物毒素的快速筛查与检测方面具有良好的应用潜力。
